小剂量电离辐射的免疫増强效应已为国内外学者所证实,但其对肿瘤影响的报道尚不多见。本文用小剂量(75mGy)X线全身照射小鼠24小时后观察其脾细胞在体内对肿瘤生长和转移的影响,并对其机制作了初步探讨,为小剂量电离辐射进一步研究及应用提供实验依据。
1 材料与方法 1.1 动物与肿瘤:C57BL/6小鼠,雌雄兼用6~8周龄,18~20克,本校实验动物中心提供。Lewis肺癌,购自上海药研所,用同系小鼠皮下传代保种。
1.2 照射条件:Sikmes深部X线治疗机,200kV,10mA,0.5mmCu+ 1 mmAl照射距离245.5mm,剂量率为12.5 Gy/min,照射6分钟。
1.3 脾细胞体内抑瘤试验:无菌条件下分别取照射组及未照射组(对照组)鼠脾脏,经200目尼龙网磨碎制成单细胞悬液,用D-Hank’s液离心(1500rpm × 5 min)洗3次,调成4 × 108个/ml活细胞悬液备用,另取LLC瘤块,用消化液(0.25%胰酶+ 0.04%EDTA)消化经200目尼龙网过滤制成单细胞悬液,用D-Hank's液离心(同前)洗3次,调成8 × 108个/ml活细胞悬液备用。分别取照射组及对照组鼠脾细胞与LLC细胞等体积混合,再分别注入两组C57 BL/6小鼠足掌(照射鼠脾细胞+ LLC细胞为受照组,未照射鼠脾细胞+ LLC细胞为对照组),按2×107个脾细胞+ 4×105个LLC细胞/0.1ml/鼠注射。每隔2天用测微仪侧足掌原发瘤长径(a表示)、短径(b表示),按0.4ab2计算瘤体积,LCC注射后26天杀鼠取瘤测量并称重,另取肺用Bouin's液固定24小时,解剖显微镜下计数自发肺转移结节。
1.4 脾细胞对ConA刺激转化率测定:用3H-TdR (7.4×1011Bq,购自北京原子能研究院同位素研究所)掺入法[1]。用cpm表示。
1.5 NK细胞活性检测:用LOH释放法[2]测定NK细胞对YAC-1 (购自上海细胞所)杀伤率来表示,效靶比为50: 1。
1.6 实验数据均用t检验。 2 结果 1.1 受照小鼠脾细胞对LLC生长的影响实验发现脾、瘤细咆混合注射后20天与26天时受照组原发病的体积明显小于对照组,26天时原发瘤重量也明显低于对照组(P < 0.05)(见表 1)。
|
|
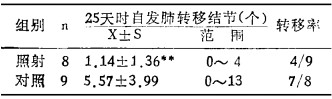
表 1 受照组脾细胞对LLC生长的影响 |
LLC注射后26天,受照组自发肺转移结节数明显低于对照组,但转移率无明显差异。(见表 2)。
|
|
表 2 受照组脾细胞对LLC自发肺转移的影响 |
小鼠受照后24小时,其脾细胞对ConA刺激转化率明显高于对照组,NK细胞活性也明显增强(P < 0.01)(见表 3)。
|
|
表 3 受照纽脾细胞NK细胞、T细胞活性的变化 |
人类生存不可避免地接受慢性小剂量电离辐射,其对人体的影响,尤其是与肿瘤的关系一直是人们重视的课题。早在1915年Murphy的实验就证实低剂觉全身照射小鼠对移植瘤表现出较大的抵抗力;Anderson[3, 4]也有同样的实验结论,我国也发现广东高本底地区肿瘤标化死亡率明显低于对照地区,且肝、肺癌发生率也较低[5]。
本室进行一系列研究发现低剂量X射线全身单次照射小鼠,对其移植瘤生长和转移有明显抑制作用(另行报道)。木研究表明小鼠接受75mGyX线照射后24小时,其脾细胞在同系小鼠体内明显抑制肿瘤生长和转移。进一步实验表明小鼠受照后其脾细胞内T细胞转化能力增强,NK细胞活性明显提高。由此,本实验中低剂量X线对小鼠脾细胞体内抑瘤功能的影响可能主要通过T细胞、NK细胞功能增强来实现的。
T淋巴细胞、NK细胞及单核巨噬细胞是机体抗肿瘤的主要细胞。国内外学者证实:小剂量电离辐射可明显提高小鼠细胞免疫功能[6, 7, 8]。本文受照小鼠24小时后的脾细胞与Lewis肺癌细胞混合注入同系C57BL/6小鼠足掌,可能脾细胞内功能増强的T细胞(尤其是溶细胞性T细胞对实体瘤杀伤能力更强[9])及NK细胞杀伤大量LLC细胞表现出LLC原发瘤生长明显受抑。
LLC自发肺转移主要与机体NK细胞活性有关[10]。本实验中两组荷瘤小鼠NK细胞活性应无明显差异,但混有受照鼠的脾细胞的LLC自发肺转移明显低于未受照鼠的脾细胞组。此可能由于受照鼠脾细胞LLC原发瘤生长较小,较少可能有很多LLC细胞通过淋巴道、血道在肺内形成自发肺转移[11, 12],表现为肺转移结节明显减少。转移率差异不显著,可能与样本量少有关,日本的坂本也证明0.1Gy照射的小鼠免疫功能有所提高,且有预防肿瘤转移的作用[13]。
总之,低剂量照射使小鼠脾细胞内T细胞、NK细胞功能增强;使脾细体内对肿瘤抵抗作用增强,从而起抑制肿瘤的生长和转移的作用。
| [1] |
孙瑛勋, 等. 用3H-TdR检闭小鼠淋巴细胞转化功能[J]. 上海实验动物学, 1987, 7(1): 35-39. |
| [2] |
Carol K, Danis MC. An Enzyme-Release Assay for Natural cytotoxicity[J]. J Imm Meth, 1983, 64: 313-320. DOI:10.1016/0022-1759(83)90438-6 |
| [3] |
Anderson RE, et al.Low Dose Irradiation permits Immunizaticn of A/J Mice with subimmunogenic Numbers of Sal cells Br J Cancer 1986; 54 (3): 505~509.
|
| [4] |
Anderson RE, et al. Effects of Low Dose Irradiation upon T cell subsets in volved in the Response of prined A/J mice to Sal cells[J]. Int J Radiat Biol, 1988, 53(1): 103-118. DOI:10.1080/09553008814550471 |
| [5] |
何伟辉, 等. 广东高本底地区居民恶性肿瘤死亡调査[J]. 中华放射医学与防护杂志, 1985, 5(2): 109-113. |
| [6] |
Bloom ET. Radiation-induced Augmention of the Immune Respose[J]. Health phys, 1987, 52: 585. DOI:10.1097/00004032-198705000-00009 |
| [7] |
鞠桂芝, 等. 低剂量辐射诱导免疫适应性的最佳时间[J]. 中华放射医学与防护杂志, 1994, 14(5): 311-314. |
| [8] |
刘树铮, 等. 低剂量X线全身照射后淋巴细胞对调节因子反应性的变化[J]. 中华放射医学与防护杂志, 1994, 14(1): 7-10. |
| [9] |
Mitchell Ms, et al. Biomodulators in Cancer Treatment[J]. J Clin Pharmacol, 1992, 32(1): 2-9. DOI:10.1002/jcph.1992.32.issue-1 |
| [10] |
谢克平, 等. 体内自然杀伤活性调变对肿瘤血源转移的影响[J]. 免疫学杂志, 1988, 4(2): 93-96. |
| [11] |
于俊阁. 肿瘤淋巴道转移的研究进展[J]. 国外医学肿瘤学分册, 1983, 2: 79-83. |
| [12] |
Grant T, et al. Tumor cell Heterogeneity and metastasis[J]. Int J Microciro Clin Exp, 1986, 3: 343. |
| [13] |
坂本澄彦, 他.低放射线全身照射  消灭.原子力工业, 1990;36(5) : 3 消灭.原子力工业, 1990;36(5) : 3
|