放射性核素内照射认为只有损害作用的传统说法是不符合实际的。当然,大剂量或中等剂量放射性核素内污染对机体无论从整体水平、细胞水平、还是亚细胞水平都呈现出明显的损伤效应[1]。但在低剂量内照射时,可产生与大剂量内污染时明显不同的效应,如在人类长期进化过程中,对天然辐射本底的辐照就可以适应,并经实验证明其对生物体的正常发育是必需的[2]。考虑到重核裂变产物147Pm为纯β辐射体核素,释放的是软β粒子,又具有适宜的物理半衰期,因而目前我国在荧光涂料工业上已采用147Pm来替代镭作为荧光涂料的激发能源而得到广泛应用[3],用于表面描绘和彩色电视屏等尤为普遍。而且147Pm在核辅助动力装置系统中也得到普遍使用[4]。因此,随之而来的147Pm作为一个环境污染物而摄入人体的可能性就大为增加,而有关147Pm对机体的影响,特别是低剂量1 7Pm内照射是否呈现对中枢和外周免疫细胞的良性刺激增殖作用,文献中未见报道,有必要加以探讨。为此,本文进行了这方面的研究。
一 实验方法对147Pm摄入机体的转运和滞留观察是在体重为125±19g的20只雄性Wistar大白鼠体中进行的。取放化纯和化学纯的147Pm硝酸盐液由尾静脉注入机体,其放射性活度为18.5kBq·g-1,于注入后2小时,5、10和91天的不同间隔阶段观察147Pm在体内的滞留动态。将各组大白鼠分别放入有机玻璃代谢装置中收集尿和粪[5]。随后按不同观察间隔,各组大白鼠分别放血处死。收集血样,取出肝、肾、肺和股骨等组织,用扭力天平秤取各器官组织样品50mg,按我们以前报道的匀相透明液制备法处理上述样品[6],并加入0.6%的PPO-甲苯闪烁液,经暗适应后,用Beckman液体闪烁仪进行放射性活度测定。观察标本并进行猝灭校正,最后计算出每克组织含放射性量与理论上平均分配量的比值[7],并用最小二乘法配线求出147Pm在体内的滞留方程。
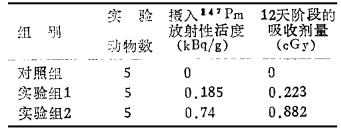
关于低剂量147Pm对中枢免疫器官骨髓和胸腺免疫细胞,以及外周免疫器宵脾脏T、B淋巴细胞增殖转化能力的观察是在BALB/c雄性小白鼠体中进行的,随机分成两个实验组和一个平行对照组,每组各5只动物。两个实验组分别由尾静脉给予0.185或0.74kBq·g-1体重的147Pm。而相应对照组则注入等量的生理盐水。至12天阶段,实验动物由颈动脉放血处死进行下列操作:
1.骨硫细胞的制备和培养:无菌操作取一侧股骨,放入小瓶中,加10mlEagle洗液,夹碎股骨,混匀,随即抽取细胞悬液移入离心管中,1000转/分离心10分钟,弃上清,再用2~3 ml Eagle洗液将细胞悬浮,取少量细胞悬液,用2%台盼茺活性染色(台盼兰:细胞悬液为1:4)10分钟,然后用白细胞稀释液作20倍稀释后,镜检计数活细胞,换算出细胞悬液中的细胞浓度。然后按500万个骨髓细胞的标准分装到每个培养瓶中,再加入RPMI1640培养液2 ml和10%小牛血清。每份样本重复培养4瓶:其中2瓶各加入3H-TdR的放射性活度为44.4kBq/瓶,另2瓶不加,放置37℃培养24小时。
2.胸腺细胞的制备和培养:无菌操作剖取出胸腺,剪碎。制备细胞悬液及培养条件都与骨髓细胞的制备和培养相同。
3.脾脏T、B淋巴细胞的制备和培养:无菌操作取出小白鼠脾脏,置于基础培养液中,用眼科弯镊梳刮脾脏制成单细胞悬液。离心去上淸。用RPMI-1640全培养液调整细胞浓度为1×107个/ml。取96孔平底培养板,每孔加入细胞悬液和丝裂源各100μl,丝裂源浓度对脾T淋巴细胞为200μg/mlPHA,而对脾B淋巴细胞为40μg/mlLPS。每份样品设自身对照,三复孔培养。在37℃、5%CO2培养器内培养72小时,终止培养前16小时加入3H-TdR18.5kBq/孔。培养终止后,用多头细胞样品收集器收获细胞于49型玻璃纤维膜上。
4.测量标本制备和液闪纸片法测量:先加蒸馏水于玻璃纤维膜上破坏残存的红细胞,再用生理盐水洗涤滤膜,并加15%三氣醋酸液固定细胞,无水乙醇脱水后,将滤膜放入红外线快速干燥器中烘干。将滤膜细胞面向上,放入预先加入5 ml的0.6%PPO和含0.06%POPOP二甲苯液的闪烁液瓶内,使滤膜紧贴瓶底,经暗适应后,用Beckman液体闪烁测量系统6800 (程序1)进行纸片法液闪放射性测量[9]。测量结果以每分钟计数率(min-1)表示,样本放射性活度取其两个重复管的平均值。
5.统计处理:摄入低剂景147Pm内照射对中枢免疫器官骨髓和胸腺免疫细胞,以及对外周免疫器官脾脏T、B淋巴细胞的效应观察,可按掺入细胞内3-HTdR的计数率,计算出各组均值加减标准误,然后对数据进行齐性检验的方差分析。
二 实验果结 1 147Pm摄入佟内滯留过程实验观察得出的147Pm在体内总的滞留过程,以相对百分比表示,如附图所示。由图可见147Pm在进入体内后,仅在开始时降低较快,以后的降低极为缓慢。估算的体内147Pm滞留方程为:

|
可见147Pm在体内的滞留过程,包括两个不同快慢组分的半滞留期:即快组分T1=4.77天,而慢组分T2 = 866.3天。
2 低剂量147Pm摄入机体的内照射吸收剂量估算根据147Pm在体内的滞留方程,用最小二乘法配线拟合的滞留方程,对147Pm内照射的吸收剂量按如下公式进行计算[10]:
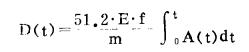
|
式中,D(t)为t时刻的体内吸收剂量,以cGy计;t为147Pm摄入体内起所经过的吋间;E为机体对每次147Pm衰变的平均有效吸收能量0.073MeV[11]; f为吸收分数;m为全身的质量,以克计;而A(t)为实测放射性活度,以kBq计。
根据上述公式,计算出机体每克体重注入0.185或0.74kBq147Pm后12天阶段的全身吸收剂量见表 1。表明其相应放射性活度的147Pm摄入机体后的吸收剂量分别为0.223和0.882cGy。
|
|
表 1 由静脉摄入机体低剂量147Pm后12天阶段的内照射吸收剂量值 |
当机体受低剂量147Pm内照射时对骨髓和胸腺免疫细胞増殖能力的变化值列于表 2中。由表 2可见,当机体摄入0.185或0.74kBq·g-1体重的147Pm内照射12天阶段,观察到中枢免疫器官骨髓细胞和胸腺细胞3H-TdR的掺入率都呈显著增升,表现出明显的放射性核素低剂量内照射的刺激效应。
|
|
表 2 由静脉摄入机体低剂量147Pm内照射12天阶段骨髄和胸腺免疫细胞增埴能力的变化 |
实验观察当低剂量的荧光涂料激发的能源l47Pm内照射对脾脏T、B淋巴细胞转化能力的变化列于表 3中。可见当机体摄入0.185kBq·g-1的147Pm后12天阶段,使脾T淋巴细胞对PHA的转化反应和使脾B淋巴细胞对LPS的转化能力显著增升,表现在能使3H-TdR的掺入率显著升高,DNA合成能力明显增长,呈现出显著的147Pm内照射的刺激效应。
|
|
表 3 由静脉摄入机体低剂量l47Pm内照射12天阶段对脾脏T、B淋巴细胞转化能力的变化 |
骨髓是极其重要的中枢免疫器官,因为骨髓不仅提供了各种免疫细胞的前体细胞,而且还是哺乳动物B-淋巴细胞成熟的场所[12, 13]。至于胸腺,是将骨髓中前T淋巴细胞进一步诱导分化为成熟T-淋巴细胞的场所[14],在这一过程中,前T-淋巴细胞由大到小,逐渐分化成熟,迁移到髓质再进入外周淋巴器官。它们都是对电离辐射敏感的组织[15]。实验中体外培养小白鼠骨髓细胞,观察其3H-TdR掺入率的程度,可以了解骨髓中各种幼稚细胞的增殖能力。同时,观察小白鼠胸腺细胞体外培养对3H-TdR的掺入率,可以掌握从前T-淋巴细胞到成熟T-淋巴细胞各个不同阶段的幼稚淋巴细胞的DNA合成能力。
值得指出的是,实验观察到中枢免疫器官骨髓和胸腺细胞在低剂量147Pm0.185~0.74kBq·g-1的作用下,对3H-TdR的掺入率都呈明显升高,DNA合成能力呈现出显著增升。由此可见,低剂量的荧光涂料激发能源内照射,可以呈现出明显的对中枢免疫器官骨髓和胸腺细胞的刺激增殖作用,且其刺激增殖作用阈值只需0.223cGy。
成熟T、B淋巴细胞是机体中对辐射最敏感的细胞之一[18]。本研究结果表明外周免疫器官脾T淋巴细胞PHA转化反应和脾B淋巴细胞的LPS转化反应在0.185kBq·g-1的147Pm低剂量内照射时,3H-TdR的掺入率显著增升,其刺激指数值呈显著加大,显示明显的刺激增殖效应。
| [1] |
朱寿彭, 等. 放射毒理学[M]. 第二版. 北京: 原子能出版社, 1992: 214.
|
| [2] |
Luckey T. D. Physiological benifits from low level of ionizing radiation[J]. Health phys., 1982, 43(4): 771. |
| [3] |
朱寿彭. 夜光涂料147Pm的放射毒理学研究[J]. 工业卫生与职业病, 1985, 11(5): 320. |
| [4] |
Mcclellen R.O. Metabolism of some SNAP radionuclides in miniature swine[J]. Aerospace Med., 1965, 36(1): 16. |
| [5] |
朱寿彭, 等. 褐藻酸钠对58Co的胃肠道阻吸收和811的早期促排[J]. 核技术, 1980, 3(4): 47. |
| [6] |
朱寿彭, 等. 用整体测量探讨75Se-蛋氨酸在体内的滯留[J]. 中国药理学报, 1984, 5(3): 214. |
| [7] |
朱寿彭, 等. 液体闪烁法探讨裂片147Pm在体内污染、转移和排除的代谢动态[J]. 环境科学, 1984, 5(5): 22. |
| [8] |
ICRP Publication 30. Part 1: Limits for intakes of radionuclides by workers[M]. ICRP Pergamon press, 1979.
|
| [9] |
朱寿彭, 张澜生. 医用同位素示踪技术[M]. 北京: 原子能出版社, 1989: 131.
|
| [10] |
Snipes M.B. Metabolism and dosimetry of 106Ru inhaled as 106RuO4 by beagle dogs[J]. Health phys., 1981, 41(2): 303. DOI:10.1097/00004032-198108000-00008 |
| [11] |
UNSCEAR. Ionizing Radiation: Sources and biological effects, UN, New York, 1982.
|
| [12] |
Osmond D.C, et al. Pre-B cell in mice bone marrow[J]. J Immunol, 1984, 133(1): 86. |
| [13] |
Durum S.K., et al. The comparative radiosensitivity of T and B lymphocytes[J]. Int J Radiat Biol., 1978, 34(1): 1. |
| [14] |
Schurman H.J., et al. T cell maturation in the human thymus[J]. Clin. Immunol. Immunopathol, 1983, 29(2): 271. DOI:10.1016/0090-1229(83)90029-6 |
| [15] |
Gerber M., et al. Radiosensitivity of murine T lymphocyte cytotoxicity[J]. RadiatRes, 1984, 100(2): 365. |
| [16] |
Kishimo T, Hirono T. Molecular regulation of B lymphocytes response[J]. Ann Rev Immunol, 1988, 36(2): 485. |