微核检测技术是七十年代初期发展起来的一种新的细胞遗传学检测体系,被认为可测定部分染色体损伤。由于操作简便,易于分析,而被推荐作为记录双着丝粒畸变的辅助手段来评价细胞的辐射效应和受损程度,特别适用于群体检_的初筛指标。它大致经历了直接涂片法、培养法和胞质分裂阻断法(CB法)三个阶段,直接涂片法检出率太低,培养法显然有了较大进步,特别是1985年Fenech和Morley[1]使用细胞松弛素B (Cytochalasin B, Cyt-B)以阻止胞浆分裂,使完成一次核分裂后形成双核细胞,从而只记录双核细胞中的微核,这样就大大提高了敏感性和准确性,而引起人们的极大兴趣和关注,但是该方法中Cyt-B加入时间,Cyt-B终浓度和培养收获时间三个实验因素的影响最受重视。
我们的工作分两部分,首先用三水平正交试验设计对影响CB法的三个因素进行综合探讨,得出最适组合方案,然后再用该方条对箱射诱发人体淋巴细胞微核的剂量效应关系作了研究。
一 方法学 1 材料与方法4例健康成人静脉血(男女各2, 年龄20~30岁),一式二份,其中一份作对照,另一份室温下137Csγ射线照射50cGy (CAMMA-CELL40,加拿大产平板源,剂量率116cGy/min), 再将每份血分装在9个含有RPMI 1640培基的培养瓶中,编号后,37℃恒温培养。
为使实验随机化,将每份血各瓶的编码按随机排列表中的数字顺序安排在L9(34)正交表中,然后按正交表中的设计进行操作。
加Cyt-B的时间分别为36、40和44小时; Cyt-B终浓度分别为3、6和9 μg/ml; 收获时间分别为50, 56和72小时。
CB法标本的制备按常规进行,盲法阅片,每份培养计数1000个转化细胞中的双核细胞数和多核细胞数,及计数500个双核细胞中的微核数,并且计数500个双核细胞时出现的多核细胞数。
统计方法:把每个献血者看作一个区组,按随机区组设计进行方差分析,检验微核率,微核细胞率和双核细胞率是否存在个体间的差异。若差异不显著,则把实验作为有重复,多指标的三因素,三水平正交试验进行下一步的统计处理。若对多个指标进行综合分析,则根据诱发微核率,微核细胞率和双核细胞率应尽可能高的原则,用公式法将每个人的各项指标值化为统一指标一式二份,然后再进行方差分析,判断各因素的作用大小并找出各因素不同水平间的最佳搭配方案。考虑到辐射可能给双核细胞率带来影响,将照射与未照射条件下双核细胞率看作两个不同的观察指标进行统计处理。
2 结果用三水平正交试验设计,对影响CB法的实验因素进行综合探讨时,可以看出随着培养时间的延长,多核细胞占的比例越来越大,最高达48%,衷明两周期以上的细胞越来越多。而在Cyt-B终浓度一致的情况下,随着培养时间的延长,双核和多核细胞呈上升趋势,最高可达69%。
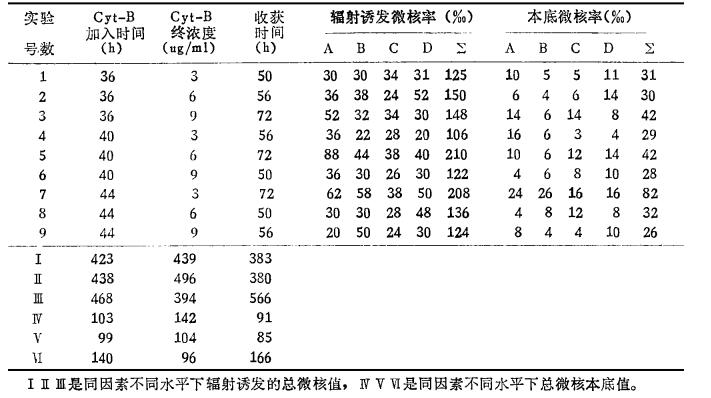
表 1列出了4个个体用50cGy γ线诱发的微核率和本底微核率。表 1中Ⅰ、Ⅱ和Ⅲ三行数字为同因素不同实验水平诱发微核率的合计值;Ⅳ、Ⅴ和Ⅵ三行数字为对应的本底微核率的合计值。为了检验个体间是否存在差异,按随机区组设计对表中数据进行方差分析,可以看出:个体间诱发微核率和本底值均无显著统计学差异(P>0.05)。因此,按照有重复的三水平正交试验进一步的统计处理,方差分析表明:收获时间是影响微核率的主要因素。72小时收获细胞,微核率明显高于50和56小时,且有非常显著的统计学意义(P < 0.01)。而50和56小时收获,微核率无明显差异。Cyt-B终浓度和加入时间对不同水平微核率合计值间无统计学差异(P>0.05),提示Cyt-B本身不诱发微核。
|
|
表 1 辐射诱发的微核车与本底微核率 |
考虑到照射可能给双核细胞率带来影响,将照射和未照射时看作两个不同的观察指标进行统计处理,经检验4个个体间无统计学差异(P>0.05),按有重复的正交试验设计进行方差分析,结果表明,Cyt-B终浓度和培养时间为影响双核细胞率的主要因素,两因素不同实验水平间的作用具有显著的统计学差异(P < 0.01)。
为了综合分析三因素在三个水平对双核细胞率、微核率和微核细胞率的影响,按照射和未照射的不同条件进行方差分析表明:Cyt-B终浓度和培养时间不同水平的影响具有显著统计学差异(P < 0.01),说明这二因素是影响CB法的主要因素。综上分析三因素三水平对所观察指标的影响,Cyt-B加入时间36—44小时,终浓度为6 ng/ml,72小时收获细胞时为最适组合方案。
3 讨论CB法是近年来发展起来的具有一定敏感性的细胞遗传学方法,所以计数一定量的双核细胞是满足分析要求的前提,而下限剂量诱导微核率与本底间统计意义上的差异是否显著,则是确定方法的灵敏程度。
自1985年Fenech和Morley[1]建立CBMN以来,为了使该方法更完善、更标准,各实验结果更便于比较,对方法学的影响因素的研究非常重要。对于Cyt-B终浓度,首先Fenech和Morley报导分离淋巴细胞培养时使用3 μg/ml获得了多量双核细胞,因此多数学者就沿用这一浓度,但对最适阻断浓度的看法仍不尽一致,Littlefield [2]和蒋本荣[3]等用全血培养时,认为6 μg/ml是最适阻断浓度,且在一定范围内继续升髙时双核比例不再增加。本实验也发现3μg/ml、6μg/ml和9μg/ml三水平时,前者双核细胞率明M低于后两者(P < 0.01),而后两者则比较接近,这可能是由于全血中红细胞和粒细胞的存在减少了淋巴细胞与Cyt-B接触机率的结果。
为记录第一次分裂后形成的双核细胞,有的作者认为44小时加入Cyt-B为时已晚,Mitchell等[4]报导在培养到30小时加入就观察到一定量的双核细胞,Soott等报道人淋巴细胞培养到44小时时,80名个体中处于第二次或更晚分裂细胞的频率已为50~65%之间,这说明部分快速分裂细胞,此时已完成第一周期,开始进入了第二或更晚的细胞周期,但是Mitchell等也发现,微核细胞率在培养30~40小时之间较低,而48~60小时则迅速増高,意味着快速分裂的细胞含有较少的微核,会导致结果偏低。从本实验加入Cyt-B时间三个水平对应的50cGy诱发微核率合计值(表 1中Ⅰ、Ⅱ、Ⅲ行第一列数字)可以看出,以44小时为最高,提示上述可能性的存在,但合计值间差异无显著统计学意义。
有关细胞收获时间,Köksal[5]认为56小时后至72小时收获,微核率没有差别,而Mitchell等则认为诱发微核细胞率随培养时间的延长而增高,至72小时时可达高峰,作者认为与细胞分裂后微核表达的延迟有关。我们的实验也证实不管是50cGy诱导的微核率还是本底微核率72小时收获,都明显高于50和56小时,而50小时和56小时收获时的微核率则没有统计学差异。
二 剂置效应关系微核技术是一种简易而快速的检测体系,被推荐为染色体因辐射所致损伤后的一种可选择手段和受照程度的评价,目前已广泛应用于很多领域,在辐射防护领域显示出独特性能,特别是CB法建立以来,又注入了新的活力,我们试图对相同个体在不同剂量水平照射条件下诱发的微核率和细胞微核率进行研究。
1 材料和方法取5例不吸烟的健康成人(男3女2, 年龄20~27岁)全血样品,等分五份,除一份作对照外,其余四份在常温下用加拿大产GAMMA CELL40平板源,137Csγ线源,剂量率为1.167Gy/min条件下分别照射0.1、0.2、0.4和0.8Gy,另取5例(男3女2,年龄20-26岁),在同上相同条件分别照射1、2、3和4 Gy。照射后放置2小时左右,然后分别加入含有RPMI 1640、小牛血清和适量PHA的综合培养基中,置37℃:恒温培养,按最适组合方案进行培养、收获细胞,常规制片,盲法镜检,每个剂量点计数1000个双核细胞。
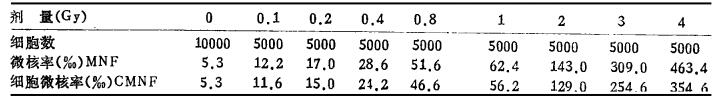
2 结果对10例志愿供血者共分析了50000个CB双核细胞,在低剂量部分(0.1~0.8Gy)和中高剂量部分(1~4 Gy)的对照点各观察5000个双核细胞屮分别看到27和26个微核,经统计学处理组间没有差异,故合并为一个组,均值为5.3%。结果如表 2。
|
|
表 2 不同剂量水平时微核率和微核细胞率与剂量之间的关系 |
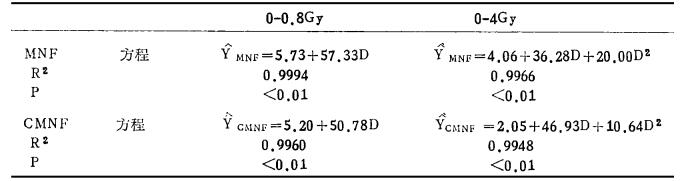
从表 2可见,微核率和微核细胞率均可见到随着剂量的増高而増加。根据表 2资料分别拟合的方程见表 3。
|
|
表 3 用微核率和细胞微核率拟合的回归方程 |
从表 3可以看出,在低剂量区段呈直线方程模式,而中高剂量部分则为线性平方模式,用最小平方和法进行拟合和拟合度检验,回归系数显著,拟合度良好。
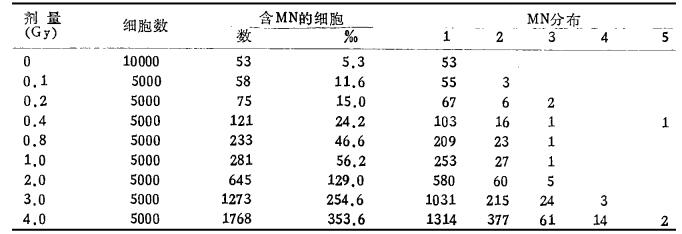
表 4给出了在不同剂量水平所诱发的淋巴细胞中微核细胞率和分布情况,可以看出随着剂量的增加,微核细胞率呈明显增加,且在同一细胞甲百多个微核的细胞数也随之増加,不尽表现在双核CB细胞中含一个微核细胞数増加,而且含多个微核的细胞也随之増加,尤以中高剂量区段増加明显,有时在一个双核细胞可出现高达4~5个微核。
|
|
表 4 不同剂量诱发淋巴细胞中细胞微核频数和分布 |
尽管从本底水平来讲,CB法比推片法和常规培养法其微核率和微核细胞率都高,但随着剂量的増高,其増长的幅度非常明显。
3 讨论到目前为止,染色体畸变(主要指双着丝粒和稳定性畸变)的分析被认为是辐射生物剂量计的最有效方法(IAEA1986), 但由于费时,技术条件要求高,在实践时遇到了一些难题,特别是对大人群检查时。CB微核检测法的出现,无疑显示出在某些领域的广阔前景。
在胞质分裂阻断微核法中,微核计数是限制在遇受胞质分裂阻断的细胞,因此在双核细胞中易于辨认,该法可行的就在于在培养过裎中加入了胞质分裂抑制剂一Cyt-B,使累积一定量的CB细胞成为可能。CB微核法作为初筛方法可以测到很低的剂量,0.1 Gy诱发的微核率与对照组比,就可以见到有显著的变化,Huber等(1984)研究结果表明低于0.3GyX-线诱发的微核,用常规检测法就很不准确,而Fenech和Morley[6]的实验结果表明,0.05Gy的X线照射用CB法就易于检出,若检出数百个细胞,在1小时内即可完成,由此认为CB法比常规法更敏感,比染色体分析更为省时。
很多学者强调,CB微核检测法作为生物剂量计的问题之一就是本底值的变化频率大,Fenech和Morley[6]对40名年龄在21~85岁受试者中,微核本底值以接近指数形式增长,而且在年龄超过40岁以上时,可见到相当大的分散度。Catena等[7]对50名健康人,其变化范围为0.006~0.05, Prosser等[8]对14人为0.01~0.018, 从我们对10例正常人,其范围为0.002~0.008, 而我们在另一篇文章[9]对54份样品分析的结果,其自发率范围为0.002~0.34。这些本底值变异如此之大,我们认为年龄组成为影响因素之外,还与生活习惯(烟、酒和咖啡嗜好与程度)、药物治疗与否,以及遗传体质等均有关系。
有关年龄效应问题,Huber等指出只有常规法才具有随年龄以每年3.4± 1.3%速度増加,而CB法是不存在年龄效应的,但Fenech和Morley [8]却发现,CB法是随年龄以每年4.3%速度増长,而在他们的另一篇报道[11]中同样证实了这一问题,小于35岁的15人的正常值为7.3±1.1,而大于65岁的33人则増加至12.3±0.97,从我们报道的10例看来,年龄范围很窄(20~27岁),用CB法其微核率为2~8 %,看不到年龄效应问题,可是在我们的另一篇报道[9]中对年龄为18~67岁54份样品分析的结果,可以明确看到、随着年龄的増长,本底值也随之增加,年龄増长率为4.67%,也说明当年龄挡次拉开后,也可看到年龄效应问题。
CB微核法尽管才出现几年,由于其双核细胞的微核易于辨认、计数第一次分裂后的细胞是准确的、剂量效应关系明显,以及检出率高等优点而被人们所认可,在急性事故受照时,在大人群初筛时,可作为一项有效指标应用。
| [1] |
Fenech M., Morler A.A. Measurement of micronuclous in lymphocytes[J]. Mutat, Res., 1985, 147: 29. DOI:10.1016/0165-1161(85)90015-9 |
| [2] |
Litterfield L.G., et al. Comparison of Dose-response parameters radiation-induced acentric fragments[J]. Mulagenesis, 1989, 4: 265. |
| [3] |
蒋本荣, 等. 人淋巴细胞胞浆分裂阻滞微核法的探讨[J]. 军事医学科学院院刊, 1990, 14: 132. |
| [4] |
Mitchell J C., Norman A. The induction of micronuclei in human lymphocytes by low doses of radiation[J]. Int. J. Radiat. Biol, 1987, 52: 527. |
| [5] |
Korsal G., et al. The dependence of the micronuclets yield in lymphocytes on culture at cytokinesis blocking times[J]. Radiat. Prot. Dosim, 1989, 20: 209. |
| [6] |
Fenech M, Morley A. A. Cytokinesis-block micronucleus method in human lymphocytes: Effect of in vivo ageing and low dose X-irradiation[J]. Mutat. Res, 1986, 161: 193. DOI:10.1016/0027-5107(86)90010-2 |
| [7] |
Catena C., et al. Inter-individual differences in radiation respone shown dy an in Vitro Micronucleus Assay: Effects of 3-aminobenzamide on X-ray treatraet[J]. Int. J. Radiat. Biol, 1992, 62(6): 687. DOI:10.1080/09553009214552641 |
| [8] |
Prosser J. S., et al. Radistion induction of micronuclei in human lymphocytes. mutat. Res[J]. Mutat. Res, 1988, 199: 37. |
| [9] |
王玉书, 等. 对影响胞质分裂阻断微核自发率因素的探讨[J]. 中国辐射卫生, 1992, 1(2): 81. |
| [10] |
Huber, et al. Screening for interindividual differences in radiobensitivetj. by means of the raicronucleus assay in human lyphocytes radiat[J]. Enriron, Biophs, 1989, 28: 113. |
| [11] |
Fenech M., Morley A.A. The Effect of donor age on spontanous and Induced micronuclei[J]. Mutat. Res, 1985, 148: 99. DOI:10.1016/0027-5107(85)90212-X |