体细胞次黄嘌呤鸟嘌呤磷酸核糖转移酶(HPRT)基因位点是一个对电离辐射比较敏感的位点,该位点的控制基因定位于X染色体长臂末端。目前研究表明某些肿瘤患者[1]接触过环境中各种诱变剂的人群[2]和电离辐射者[3]等,其突变频度都可增加,且与剂量之间有一定的依赖关系。
利用多核细胞检测法,测定HPRT基因位点突变的方法,在研究电离辐射所致人体遗传损伤的机理及损伤后的远期效应评价中,不仅可弥补染色体、微核方法的不足,而且方法简单、快速、灵敏度高,特別是在研究低剂量范围内以单基因突变为主的辐射损伤中更有其独特的意义。
现将本文所作的100cGy以下X射线诱发的HPRT基因位点突变频率的剂量效应研究结果报告如下:
一 材料和方法1.样品照射及接种培养
实验用血来自一例不吸烟的男性献血员,取20ml肝素防凝血,分装到6个无菌的园形塑料盒中(Φ4.3cm、高1.3cm),每盒3 ml, 编号照射剂量为0、5、15、25、75、100cGy,用PYM-3M深部X线治疗机照射。血样受照时间最长不超过15分钟。对照组除不接受照射外,其他条件与照射组相同。照射后,每剂量组分装6瓶,每瓶中含血0.3ml,加入到3mlPH7.2的细胞培养液中(内含80%的RPMI1640,20%小牛血清,适量的肝素及PHA),每剂量组其中3瓶加入0.1ml 1×10-8Mol浓度的6-TG, 放入37℃恒温箱中培养到36hr时,每瓶加入浓度为60μg/ml的Cyt-B工作液0.3ml,使cyt-B终浓度为6μg/ml,混匀,37℃继续培养至72hr。终止培养后,吸去大部分上清液, 加入予温至37℃的0.15MKCl 4ml,混匀,立即加入1 ml新配制的固定液,混匀,37℃放10分钟,1500转/分离心8分钟,弃上清液后,再加固定液5 ml, 反复固定两次,第一次固定30分钟,第二次为20分钟,离心、弃上清液,加入0.2ml固定液,混匀成细胞悬液,用冰片滴片,气干后,Giemsa染色。
2.阅片
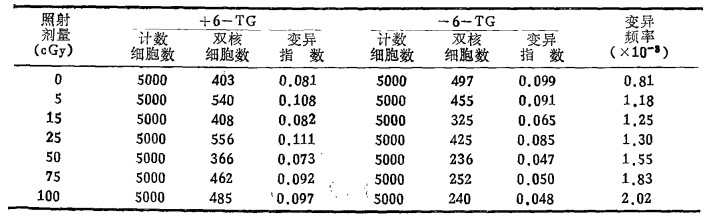
盲法阅片,每一剂量组中对加6-TG和不加6-TG的各计数转化的淋巴细胞5000个,并记录在同一胞浆内具有完整核膜的重叠、相切或分离的双核或多核淋巴细胞数。
3.统计方法
含6-TG的1000个活存淋巴细胞中双核或多核细胞数,被除以不含6-TG的1000个活存淋巴细胞中双核或多核细胞数,其得数为HPRT基因位点的变异频率与照射剂量配以直线回归方程Y=a1+b1D,并经X2检验其配合适度,并进行回归系数的显著性测验。
二 实验结果与讨论1. HPRT基因突变频率与电离辐射剂量之间的关系:见表 1、图 1。
|
|
表 1 X线诱发人外周血淋巴细胞的HPRT基因突变频率 |
|
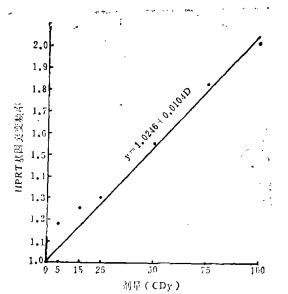
图 1 HPRT基因突变频率与X线照射剂量关系 |
用多核细胞检测法分析了经X线照射剂量在5~100cGy之间的T淋巴细胞抗6-TG的突变频率。实验结果表明,HPRT基因突变频率随照射剂量增加而増加,5cGy时其突变频率(1.18)即为对照的(0.81) 1.5倍,100cGy时达2.7倍。低剂量范围内的剂量效应关系方程式适宜配直线回归y= a1+b1D即y=1.0246 + 0.0104D,其结果与Grosovsky等[3]实验结果相似,均呈线性增加。相关系数(r)为0.9727, P < 0.01。
2.HPRT基因突变与柒色体崎变的比较:
许多实验结果表明[4],HPRT基因突变与染色体畸变之间存在着线性关系,两者的剂量效应动力学非常相似。本实验用相同的照射条件,进行了染色体畸变分析,经与HPRT基因突变频率相比,两者均与照射剂暈呈直线相关,相关系数(r)为0.9399, 见表 2,进一步证实了HPRT基因突变频率用于低LET射线,低剂量生物剂量估算的可行性。Mair等[5]认为,电离辐射引起的许多损伤在染色体上是见不到的,而检测突变体细胞的方法,可揭示染色体和微核所不能揭示的规律,深信这种方法将以它客观、准确、灵敏等优点受到人们的重视。
|
|
表 2 HPRT基因突变频率与染色体畸变的关系 |
利用多核细胞法检测了用X线照射5~ 100cGy诱发的人淋巴细胞HPRT基因突变频率。结果表明,HPRT基因位点突变频率与照射剂量呈线性増加,其直线回归方程为y=1.0246 + 0.0104D,与染色体畸变亦存在线性关系,其相关系数(r)为0.9399, 进一步证实了HPRT基因突变频率用于低LET射线、低剂量生物剂量估算的可行性。
| [1] |
Tompa A, et al. Detectiom of 6-thioguanint resistant in human peripheral blood lymphocytes of incdustrial worker and lung Cancer patients[J]. Mutat Res, 1989, 210: 345. DOI:10.1016/0027-5107(89)90096-1 |
| [2] |
Messing k, et al. In vivo mutant freguency rises among breast cancer patients after exposure to high doses of r-radiation[J]. Mutat Res, 1985, 152: 107. DOI:10.1016/0027-5107(85)90051-X |
| [3] |
Grosovsky Aj, et al. Evidnece for linear response for the induction of mutations in human cells by x-ray exposures below 10 rads[J]. Proc Natl Acad Sci USA, 1985, 82: 2092. DOI:10.1073/pnas.82.7.2092 |
| [4] |
Hakada M, et al. Increased Somatio cell matant freguency in atomic bomb survivors[J]. Mutat Res, 1988, 201-39. |
| [5] |
Mvir P, et al. karyotypic abrormality of the X chromosome is rare in mutant HPRT lymphocyte clones[J]. Mutat Res, 1988, 197: 157. DOI:10.1016/0027-5107(88)90152-2 |