染色体是遗传物质的载体, 是巨大的遗传信息储存库, 它具有高度的辐射敏感性。染色体畸变分析可察觉早期的辐射损伤, 已被用作"生物剂量计"来估算辐射剂量[1], 同时也是评价远后效应的重要指标[2]。电离辖射诱发染色体畸变的转归及其生物学意义, 引起了学者们的普遍重视, 尤其在辐射致癌和遗传效应与染色体损伤关系的研究方面已积累了一些资料, 并取得了进展。微核测定法, 不但可以作为估算生物剂量的辅助指标[3], 而且在远后效应研究中也得到了广泛的应用[4]。
本文为小剂量受照人员照后10~21年细胞遗传学随访结果。
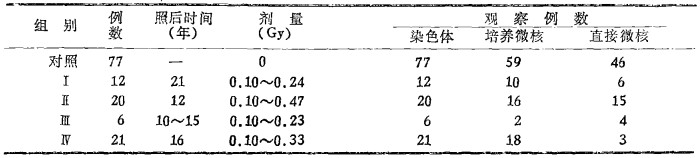
一 人员受照情况和分组本次共观察59例受超剂量照射人员, 其中38例为一次性外照射, 将其分成三组, Ⅰ组为12例, 事故发生在1966年; Ⅱ组为20例, 发生在1975年; Ⅲ组为6例, 发生在1972~977年。另21例为裂变产物的内污染, 发生在1971~1972年, 列为第Ⅳ组。Ⅰ ~Ⅲ组剂量用胶片或玻璃剂量仪测量, 第Ⅳ组用整体测量估算。本次观察设配对对照组。剂量分组见表 1。
|
|
表 1 受照人员的剂量分组 |
1.柒色体:采用微量全血培养法, 从培养开始加秋水仙素, 最终浓度为0.03μg·ml-1, 在恒温37±0.5℃条件下培养46~48小时收获。主要观察和记录染色体型畸变, 其中包括双或多着丝粒体、着丝粒环、无着丝粒环、多余断片、微小体、G组末端缺失和易位等。只计数46±1个着丝粒的细胞, 每例观察200个细胞, 一个观察者见到的畸变必由另一观察者予以审核。
2.微核:
(1) 培养法淋巴细胞微核, 除培养时间为72小时和不加秋水仙素外,其它同染色体方法。只是低渗时间短, 使细胞膨胀而胞浆保持完整。每例观察2000个转化的淋巴细胞[6], 以‰表示。
(2) 直接法淋巴细胞微核, 取0.4ml静脉血(肝素抗凝)加入0.2ml 0.5%甲基纤维素, 混匀, 在37℃恒温箱中放置20~30分钟后, 吸出上层液并将其离心(1000转/分)10分钟, 去上清, 沉降物涂片, 苏木素染色, 每例观察2000个淋巴细胞, 以‰表示。
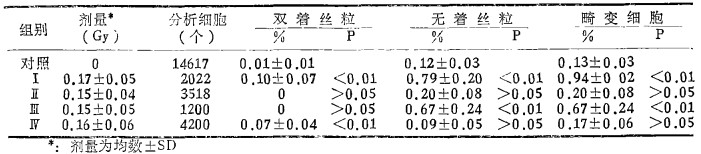
三 结果1.染色体:共观察了59例受照者的10940个淋巴细胞的中期分裂相和77例对照的14617个中期分裂细胞, 将所得结果列于表 2。从表 2可见, 在平均0.16Gy左右剂量照射后10~21年, 各组受照者平均染色体畸变率仍比对照组高, 有的差异有非常显著性意义。如Ⅰ、Ⅳ组的双着丝粒体和Ⅰ、Ⅲ组的无着丝粒畸变和畸变细胞, 只有Ⅱ组上述指标与对照差异无显著性。这可能是由于个体差和样本数较小所致。若将受照组合并后再与对照组比较(见表 3), 更易看出两个群体的差异。
|
|
表 2 各组染色体畸变率(%±SE)及其与对照组间的显著性检验 |
|
|
表 3 受照组与对照组间染色体畸变的显著性检验 |
2.微核:
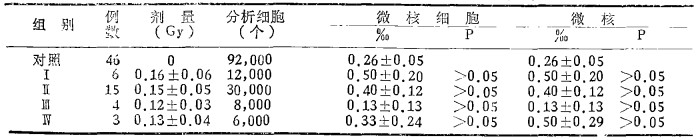
(1) 培养法, 受照组46例, 对照组59例, 共观察210, 000个转化的琳巴细胞, 除Ⅱ组外, 其余各组微核细胞率或微核率比对照组有显著牲或非常显著性增加(见表 4)。
|
|
表 4 培养法淋巴细胞微核率(‰±SE)及与对照组间的显著性检验 |
(2) 直接法, 受照28例和对照46例, 共观察148, 000个淋巴细胞, 各受照组与对照组间微核细胞率或微核率与对照组之间差异无显著性(见表 5)。
|
|
表 5 直接法淋巴细胞微核率(‰±SE)及与对照组间的显著性检验 |
1.实验方法
目前多采用FPG (荧光加姬姆萨)方法, 观察第一次有丝分裂(M1)细胞的染色体畸变。本研究用培养开始加秋水仙素法[6], 得到的中期分裂相99%以上为M1胞, 用此法代FPG法, 既经济又简便。
用培养法大大提高了微核的检出率, 结果与染色体畸变分析基本一致, 而直接法微核检出率很低, 各组与对照组之间差异无显著性。目前开始采用胞质分裂阻断法(Cy-tokinesis-block Method)[7], 培养到40小时左右加松胞素-B(Cytochalasin-B), 观察双核淋巴(M1)细胞中的微核, 大大提高了数据的可靠性。
2.剂量效应关系
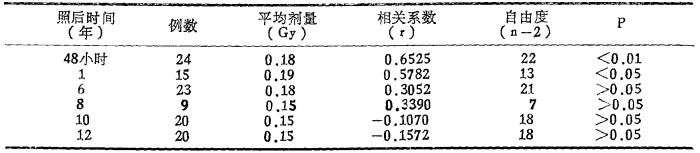
在平均0.16Gy剂量, 照后远期染色体畸变率和培养法微核仍比对照为高, 总的规律表现出随时间的推移, 非稳定性畸变不断下降, 以Ⅱ组为例, 参照先前资料[8], 将照后12年间(剂量0.10~0.24Gy)染色体畸变消长情况列于表 6。同时, 将不同时间畸变率和剂量进行了相关分析(见表 7)。
|
|
表 6 Ⅱ组照后不同时间染色体畸变率及与对照组间的显著性检验 |
|
|
表 7 Ⅱ组照后不同时间染色体畸变细胞率和剂量间的相关分析 |
从表 6可见, 照后48小时畸变细胞率明显高于对照组, 照后1~6年, 虽有所下降, 但与对照组高差异仍有非常显著性意义。8 ~12年虽高于对照, 但有的时间点差异已无显著性意义, 是由于非稳定性染色体畸变不断丢失所致。从表 7可见, 照后48小时畸变细胞率和受照剂量间相关系数有非常显著性意义。照后1年, 相关系数虽有所下降, 但仍有显著性意义。而在照后6~12年这种相关关系已不存在。因此, 在远后效应观察中应采用稳定性畸变分析, 最好用G显带技术。
第Ⅳ组内照射, 在事故后11年进行的整体测量表明137Cs在体内残留量仍明显高于正常。本次观察为事故后16年, 仍观察到双着丝粒畸变和培养法微核率明显高于对照, 可见染色体畸变分析和微核测定法可以作为小剂量内照射远期观察指标。
执笔:白玉书
| [1] |
Technical Report Series No.260, Biological dosimetry: chromosomal aberration analysis for dose assessment, IAEA, Vienna, 1986.
|
| [2] |
金璀珍, 等. 武汉钴源事故受照者照后10年染色体畸变观察[J]. 中华放射医学与防护杂志, 1985, 5(1): 14. |
| [3] |
Alinassy Zs, et al. The present state and perspectives of micronucleu sassay in radiation protection[J]. A review, Appl Radiat lsot, 1987, 38: 241. |
| [4] |
低剂量受照人员医学效应观察组. 受一次低剂量事故外照射人员4-15年细胞遗传学观察[J]. 辐射防护, 1986, 6(1): 56. |
| [5] |
白玉书, 等. 60Coγ线照射离体人血诱发的淋巴细胞微核与剂量关系[J]. 遗传, 1982, 4(3): 7. |
| [6] |
陈德清, 张朝阳. 获得离体淋巴细胞纯第一次有丝分裂(M-1)中期相方法的探索[J]. 辐射防护, 1985, 5: 457. |
| [7] |
Fench M, Morley A A. Measurement cf micronuclei in Lymphocytes[J]. Mutat Res, 1985, 147: 29. DOI:10.1016/0165-1161(85)90015-9 |
| [8] |
郭庶英.染色体畸变分析指标在小剤量辐射诊断中的应用.小剂量研究汇编军事医学科学院二所1979;71页
|