2. 美国匹兹堡大学放射卫生系
125I遗传损伤已在微生物[1]、小鼠[2]和哺乳动物细胞[3,4,5]中进行了研究。1984年Lavu等报告125I能引起小鼠高的显性致死[6]、高的精子形态异常[7]、多色性红细胞核改变[7]及生殖细胞的染色体畸变[8]等。
125I是核医学领域中使用的重要核素,它能放出低能量的俄歇电子,半衰期为60天,衰变时放出软γ射线,能量为35keV[5]。就细胞吸收能量而言,125I的潜在毒性超过3H和131I的4~5倍,125I的细胞存活曲线类似于高LET辐射。125I细胞内的高毒性是由于辐射能量高度集中在相当小的细胞核敏感体积内。
本文的研究是以检查骨髓细胞染色体断裂,多色性红细胞微核,外周血淋巴细胞微核作为观察终点。
一 材料和方法实验动物为60只BDF2雄性小鼠,年龄为9~10周,体重23~25克。
放射性125I为NaI形式,来自ICN生物化学公司,所使用的剂量范围为医学目的所使用的剂量[2]。向小鼠腹腔注入5μCi(185 kBq)、10μCi(370kBq)和15μCi(555kBq),载体为0.5ml生理盐水,对照组仅接受0.5ml生理盐水。
一组于腹腔注入后30小时杀死,注入剂量为0、185、370和555kBq,后者在杀死前6小时和30小时各注入277.5kBq。
另一组注入0、185、370和555kBq,于注入后96小时杀死。杀死动物时分离出股骨,骨髓用于分析多色性红细胞微核和染色体制备。外周血取自臂下血管,用于淋巴细胞微核培养。骨髓用马血清冲洗,涂片,姬姆萨染色,计数多色性红细胞微核,用T测验检验微核发生率的意义。骨髓细胞染色体分析用秋水仙胺(Colchemine)冲洗骨髓,37℃下培养50分钟,第二步离心以后,低渗处理,再于37℃下培养25分钟。用3:1甲醇和冰醋酸混合液固定,最后将细胞滴于冷却的玻璃片上,姬姆萨染色,以Dudcan's多项统计法处理。比较对照组和处理组之间的差别。
外周血淋巴细胞微核用含PHA的培养基内加0.5ml外周血培养3天,涂片,计数,使用变异数分析比较处理组和对照组的差别。每只动物计数2000个多色性红细胞分析其微核发生率。染色体畸变计数100个中期细胞,外周血淋巴细胞微核计数1000个淋巴细胞。
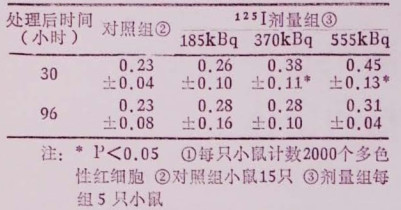
二 结果125I所致多色性红细胞微核的变化,观察结果是370kBq和555kBq剂量组显著高于对照组;各剂量组之间的发生率,仅555kBq和185kBq组之间有显著差异(见表 1)。
|
|
表 1 125I所致小鼠带髓多色性红细胞微核发生率的变化(%)① |
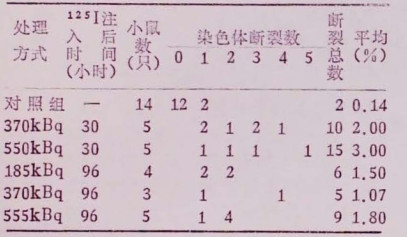
染色体断裂分析详细结果见表 2。每个剂量组染色体断裂的发生率明显高于对照组,但不同时间间隔和各剂量组之间无显著差别。
|
|
表 2 125I处理后骨髓细胞染色体断裂的发生率 |
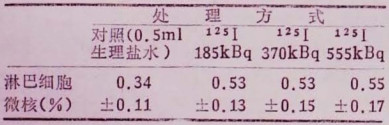
外周血淋巴细胞微核的发生率列于表 3,对照组和处理组之间无显著差异。
|
|
表 3 125I处理小鼠96小时外周血淋巴细胞微核发生率 |
微核的产生主要是由于核分裂细胞畸变时、后期或末期染色质断裂或置换的结果,一定比例置换的染色质不包含在分裂的子细胞核中,而形成微核存在于子细胞的细胞浆中。这种微核可以发生在用不同化学致突变剂[9]和125I处理的动物的骨髓细胞中[9],当原红细胞分裂周期最后引起的染色体断裂和纺锤体形成的抑制,在排出细胞核以后,多色性红细胞中出现了微核[7]。
本研究结果表明,125I有致突变作用,这和S·Lavu的结果一致。微核的发生率125I处理组(555kBg)96小时后明显高于对照组,这个结果类似于化学致突变物[8]。但本实验185KBq组与对照组无明显差异,而S·Lavu的实验结果却有差异。这或许与小鼠辐射反应的性别差异有关,因本实验使用的为雄性小鼠,而Lavu使用的为雌性小鼠。
染色体异常,所有处理组与对照组相比较,断裂都有增加,此结果同Chan PC的研究相符[4]。他报告了用125I处理中国仓鼠细胞,发现染色体和染色质异常。此结果和Lavu用125I处理后小鼠生殖细胞染色体异常的实验报告也是相符的。尽管本研究未显示染色体断裂的频率增加同剂量之间的关系,但这种倾向是明显的。
淋巴细胞微核的增加,是由于染色体断片未进入细胞核分裂时的子细胞核,而存在于细胞浆中,所以可认为这是细胞遗传学损害的间接证据。Countryman等报告[10]细胞受照以后48小时微核才开始增加,到96小时增加到最大。这大约是第一次细胞分化时间,这是本研究选择注入后96小时取样的根据。虽然,本研究结果与对照组比较无统计学意义,但此资料同样表现了倾向性,这或许由于取样时间不是反映微核增加的最佳时间,也可能由于125I主要浓集在甲状腺,受照的淋巴细胞主要是甲状腺邻近的淋巴结,或血液通过甲状腺的淋巴细胞,所以外周血淋巴细胞受损害的反应不明显。
| [1] |
Krisch RE. Lethal Effects of iodine-125 decay by electron capture in escherichia coli and bacteriophage T1[J]. Int J Radiat Biol, 1972, 21: 167-189. |
| [2] |
Reddy AR. Physical and radiobiological bases of the use of 125I in the management thyrotoxicosis[J]. Radiat Environ Biophy, 1976, 13: 205-214. DOI:10.1007/BF01330765 |
| [3] |
Boyd E, et al. Chromosome breakage in human peripheral lymphocytes after radioactive iodine(125I) treatment[J]. Radiat Res, 1974, 57: 482-487. DOI:10.2307/3573896 |
| [4] |
Chan PC, et al. The radiotoxicity of iodine-125 in mammalian cell[J]. Radiat Res, 1976, 67: 332-343. DOI:10.2307/3574422 |
| [5] |
Hofer KG, Hughes WL. Radiotoxicity of intranuclear tritium, ioline-125 and iodine-131[J]. Radiat Res, 1971, 47: 94-100. DOI:10.2307/3573291 |
| [6] |
Lavu S, et al. Dominant lethal induction and testicular uptake of iodine-125 in mice[J]. Int J Radiat Biol, 1984, 45(4): 331-343. |
| [7] |
Lavu S, et al. Iodine-125 induced micronuclei and sperm head abnormalities in mice[J]. Int J Radiat Biol, 1985, 47(3): 249-253. |
| [8] |
Lavu S, et al. Chromosome abnormalities induced by iodine-125 in mouse germ cells[J]. Int J Radiat Biol, 1984, 45(4): 331-343. |
| [9] |
Ledebur MV, Schmid W. The micronucleus test methological aspects[J]. Mutation, 1973, 19: 109-117. DOI:10.1016/0027-5107(73)90118-8 |
| [10] |
Countryman PI, Heddle JA. The production of micronuclei from chromosome aberration in irradiated cutures of human lymphocytes[J]. Mutation Res, 1976, 41: 321-332. DOI:10.1016/0027-5107(76)90105-6 |