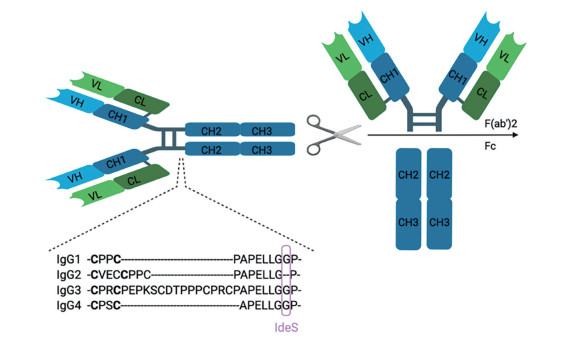
化脓性链球菌(Streptococcus pyogenes) 的免疫球蛋白G降解酶(immunoglobulin G-degrading enzyme of Streptococcus pyogenes, IdeS) 是一种高度特异性的半胱氨酸蛋白酶, 能够单位点切割人免疫球蛋白G (immunoglobulin G, IgG) 的铰链区, 使其裂解为一个F(ab')2片段和两个1/2 Fc片段。在化脓性链球菌感染的过程中, 宿主发生炎症反应并募集IgG到感染部位, 为了抵抗IgG, 链球菌分泌的IdeS对IgG进行特异性切割, 不仅降解了IgG, 还抑制了下游由Fc调节的反应, 使链球菌得以继续存活在这种炎症环境中[1-3]。
与化脓性链球菌分泌的典型的半胱氨酸蛋白SpeB不同, IdeS的作用底物仅限于人IgG类的抗体[4, 5], 具有高度的特异性, 产物均一。IdeS作用于下铰链区的第236位和237位的两个甘氨酸之间, 如图 1所示。虽然缺乏与其他半胱氨酸蛋白酶的序列同源性, 但IdeS蛋白序列第94位的半胱氨酸和第224位的组氨酸之间的距离与其他半胱氨酸蛋白酶相似[6]。与经典的半胱氨酸蛋白酶不同的是, IdeS没有二硫键, 并且是在没有前肽的情况下合成的。
随着越来越多的治疗性抗体的研发与应用以及基因工程技术的发展, 对其结构和翻译后修饰(post translational modifications, PTMs) 的分析方法要求也越来越高。质谱分析是蛋白质分析最广泛使用的方法, 能够提供主要氨基酸序列、转化后修饰、糖基化水平等其他结构特征信息, 在随后的评估与质量控制中发挥着重要作用。对于大分子的治疗性抗体而言, IdeS的出现无疑为由于分子质量过大, 结构复杂而带来的繁琐质量控制工作减轻了负担, 可以分区域的根据不同目的来选择合适的方法进行结构表征与质量评估。作为已经商业化的IgG降解酶, IdeS将抗体产品的快速和高通量分析与有限的样品制备相结合, 应用于抗体的关键质量属性的特征分析如糖基化、氧化、翻译后修饰等基本属性[7-12]。
尽管IgG在抗击入侵微生物方面起着至关重要的作用, 但它也参与各种自身免疫性疾病。IdeS对IgG的特异性降解, 使其成为生物治疗自身免疫疾病相关致病抗体的候选药物, 目前该酶正在临床前模型和临床试验中被评估为一种生物药物。2020年8月, 汉莎生物制药研发的静脉注射IdeS (imlifidase) 在欧盟获得了首次全球批准, 作为孤儿药用于对高度致敏的成人肾移植患者进行脱敏治疗, 展现出良好的预后与安全性[13-15]。由于存在超急性排斥的风险, 传统上在肾移植前数周内需要提前进行血浆或静脉免疫球蛋白的脱敏治疗, 但这对于没有活体捐献者的患者而言是十分困难的。IdeS减少了供体特异性抗体, 使得器官的异体移植成为可能。Imlifidase目前正在美国、澳大利亚、法国和奥地利进行预防肾移植排斥反应的临床评估, 并且正在法国、英国和荷兰进行抗肾小球基底膜疾病吉兰-巴雷综合征的临床开发[16, 17]。除此之外, IdeS也被探索用于基因治疗以改善腺病毒载体的转基因表达情况[18, 19]。
IdeS既可作为免疫抑制剂用于治疗器官移植引起的排斥反应等与自身免疫相关的疾病, 也可作为工具酶应用于IgG的结构表征、功能分析和亚单位制备。然而, 从宿主菌中提取IdeS无法满足如此庞大的需求, 购买进口的IdeS价格也十分高昂。本研究选择冷休克诱导表达系统, 通过Shuffle T7宿主菌异源表达, 以增加蛋白的可溶性, 促进蛋白正确折叠。在低温环境中, 大肠杆菌蛋白质从头合成受到抑制, 此时冷休克载体CspA启动子应激启动异源蛋白的特异性过表达, 同时, 低温也是提高异源蛋白在大肠杆菌宿主细胞中表达时的溶解度及表达水平的有效手段之一[20]。考虑到IdeS属于半胱氨酸蛋白酶家族, 选择Shuffle T7宿主菌可以在胞质中提供还原性微环境以促进IdeS的正确折叠[21]。其次, 通过在IdeS蛋白N-端添加His6-标签进行纯化。除了常规的镍离子亲和色谱纯化, 硅胶作为一种高活性吸附材料, 价格低廉易得, 尝试将硅胶亲和标签[22] (silica-binding peptide, SiBP) 融合在IdeS蛋白的C-端, 并考察其对IdeS产量及活性的影响。最后, 通过酶切IgG抗体对IdeS进行酶活分析, 对其今后应用于抗体药物质量控制、抗体修饰或融合蛋白生产均有重要的意义。
材料与方法材料 冷休克载体pCold购于TaKaRa公司; 所用的克隆大肠杆菌(Escherichia coli) DH10b感受态细胞购于北京庄盟国际生物基因科技有限公司; 大肠杆菌Shuffle T7购于纽英伦生物技术(北京) 有限公司; 大肠杆菌培养基为LB (1% yeast extract, 0.5% tryptone, 1% NaCl) 培养基购于英国OXOID公司; 异丙基-β-D-硫代半乳糖苷(IPTG) 购于北京兰博利德生物科技公司; 0.22 µm滤膜购于默克公司。
|
Figure 1 Schematic diagram of immunoglobulin G-degrading enzyme of Streptococcus pyogenes (IdeS) digestion sites on immunoglobulin G (IgG) |
试剂 质粒小量提取试剂盒购于威格拉斯生物技术有限公司; 凝胶DNA小量回收试剂盒购于广州美基生物科技公司; 限制性内切酶购于纽英伦生物技术(北京) 有限公司; KAPA热启动HiFi高保真酶购于罗氏诊断公司; ClonExpress® Ⅱ One Step Cloning Kit连接试剂盒购于南京诺唯赞生物科技股份有限公司; 基因测序由北京睿博兴科生物技术有限公司完成; SDS-PAGE染色液购于北京兰博利德生物科技公司。
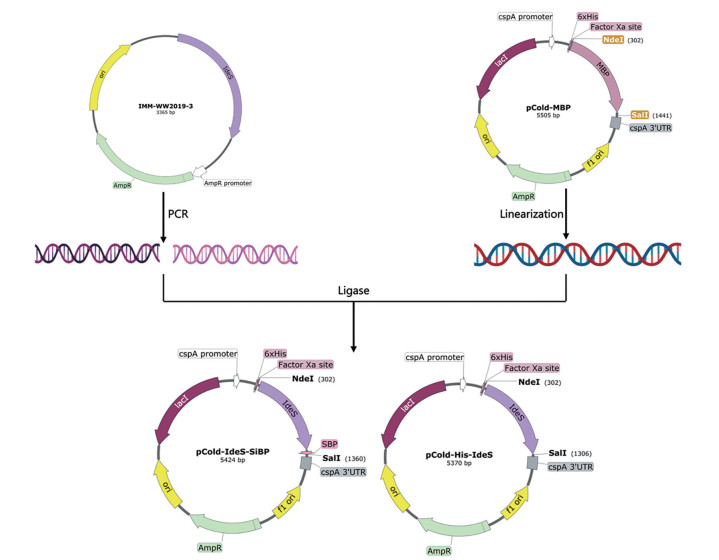
IdeS重组蛋白表达载体的构建 构建流程如图 2所示, 根据化脓性链球菌(S. pyogenes) 基因组序列(GenBank No. CP013838) 委托上海捷瑞生物工程有限公司合成IdeS编码基因, 以含有IdeS编码框的质粒IMM-WW2019-3为模板, 用引物对IdeS-F/IdeS-R (表 1) 扩增IdeS序列(编码第15~339 aa), 用引物对IdeS-F/IdeS-SBP-R1和IdeS-F/IdeS-SBP-R2连续两轮扩增C-端含有SiBP-标签的IdeS序列, 分别使用ClonExpress® Ⅱ One Step Cloning Kit试剂盒, 利用Nde Ⅰ和Sal Ⅰ位点亚克隆到pCold载体上, 获得N-端含有His6-标签的IdeS重组蛋白表达载体pCold-His-IdeS, 以及N-端含有His6-标签且C-端还有SiBP-标签的IdeS重组蛋白表达载体pCold-IdeS-SiBP。连接产物转化大肠杆菌DH10b, 挑取转化子菌落PCR鉴定后提取质粒测序验证。
|
Figure 2 Construction of the recombinant vectors of pCold-His-IdeS and pCold-IdeS-SiBP |
| Table 1 Primers used for PCR in this study |
IdeS重组蛋白的诱导表达及纯化 将IdeS重组蛋白表达载体转化大肠杆菌Shuffle T7, 挑取单克隆至25 mL LB培养基中37 ℃培养4~6 h, 按1% (v/v) 转接至400 mL LB培养基中继续培养, 待A600值为0.4~0.6后, 15 ℃静置预冷30 min, 加入终浓度0.2 mmol·L-1 IPTG, 15 ℃低温诱导16~18 h。离心收集菌体, 并用PBS (pH = 7.4) 重悬, 高压匀浆破碎菌体(800 bar, 5 min)。离心收集上清, 将上清经0.22 µm滤膜过滤后进行Ni2+亲和柱色谱纯化, 用咪唑梯度浓度洗脱并收集目的蛋白, 并利用SDS-PAGE分析纯化蛋白。
IdeS重组蛋白的活性检测 取纯化后的IdeS酶切人抗体IgG1, 37 ℃, PBS (pH = 7.4) 缓冲盐50 µL体系下, 酶与抗体质量比分别为1∶500、1∶200、1∶100、1∶20, 反应30 min, 以不添加蛋白酶的样品为对照, 利用SDS-PAGE分析酶切反应。
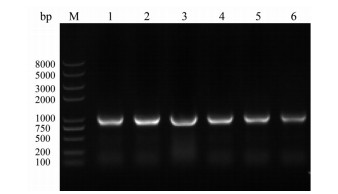
结果与分析 1 IdeS重组蛋白表达载体的构建如图 3所示, 把PCR扩增获得的目的基因片段与限制性内切酶Nde Ⅰ和Sal Ⅰ酶切的pCold载体进行连接, 然后转化克隆宿主菌DH10b; 再利用PCR方法进行阳性克隆的鉴定, 即PCR扩增得到长度约为1 000 bp的特异性条带, 提取质粒并测序验证该序列与IdeS基因一致, 表明重组质粒pCold-His-IdeS和pCold-IdeS-SiBP构建正确。
|
Figure 3 PCR verification of IdeS transformants. M: Marker; Lanes 1-3: pCold-His-IdeS; Lanes 4-6: pCold-IdeS-SiBP |
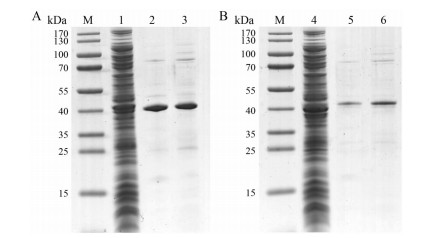
把测序正确的表达质粒pCold-His-IdeS和pCold-IdeS-SiBP转化到表达宿主中, 挑取单克隆进行种子液培养, 然后按1% (v/v) 转接到诱导培养基中培养至A600为0.5左右, 加入IPTG并低温诱导培养16 h, 经SDS-PAGE电泳分析结果如图 4所示, IdeS重组蛋白分子质量约为40 kDa, 与理论值相符。将重组蛋白进行Ni2+离子亲和色谱纯化, 在100和300 mmol·L-1咪唑梯度洗脱时可以获得纯度较高的重组蛋白IdeS。但C-端含有硅胶亲和标签的重组IdeS蛋白产量为1.5 mg·L-1, 并低于仅N-端含有His6-标签的重组IdeS蛋白4 mg·L-1的产量。
|
Figure 4 Expression and purification of recombinant proteinase IdeS. M: Marker; Lane 1: Intracellular proteins of His-IdeS; Lanes 2, 3: Elution of His-IdeS with imidazole; Lane 4: Intracellular proteins of His-IdeS-SiBP; Lanes 5, 6: Elution of His-IdeS-SiBP with imidazole |
重组蛋白IdeS与人IgG1反应30 min后, SDS-PAGE检测发现, 人IgG1能够被切割成为F(ab')2片段和1/2 Fc片段, 大小为25~30 kDa, 如图 5所示。N-端含有His6-标签的重组IdeS蛋白在酶与抗体质量比1∶200时, 就能有较高的酶切效率。而C-端含有硅胶亲和标签的重组IdeS蛋白则是在酶与抗体质量比1∶20时, 才能有较高的酶切效率。
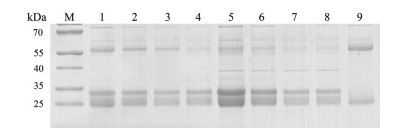
|
Figure 5 IdeS reacts with human IgG1 in 30 minutes. M: Marker; Lanes 1-4: His-IdeS reacts with human IgG1 in variety of mass ratio; Lanes 5-8: His-IdeS-SiBP reacts with human IgG1 in variety of mass ratio; Lane 9: Human IgG1 |
随着治疗性抗体的研发与应用, 基于安全性、特异性、生物物理性质和疗效的整体考虑, 治疗性抗体一方面形式更加简化; 另一方面也有可能出现更加复杂的抗体工程化修饰方式。IdeS作为抗体产品的指纹分析和质量控制的重要工具酶[7-12], 为今后的治疗性抗体类药物质量控制提供了一条十分有竞争力的分析技术。
IdeS已经作为治疗性蛋白被应用于肾移植[13-15], 虽然IdeS与宿主和免疫细胞之间的相互作用已被证实会影响免疫细胞的功能和调节免疫反应, 但其中的分子机制与相互作用仍然需要进一步的阐明。尤其是IdeS独特于其他典型半胱氨酸蛋白酶之处, 包括结构上的差异、抑制剂的差异和特异性的差异等。这些机制的阐明将会为IdeS的应用提供更多的提示, 以在将来被更广泛地用于其他与自身免疫相关的疾病的治疗[16, 17]。此外, IdeS也可以用于抗体蛋白质工程研究, 制备高纯度F(ab')2片段[23, 24], 促进新型抗体药物的发现和工程化应用。
无论是作为工具酶, 还是治疗性蛋白, 后续研发都离不开高效的异源表达和生产高活性的重组IdeS。本研究利用冷休克载体pCold在大肠杆菌中成功表达了高特异性、高活性的目的蛋白酶IdeS, N-端融合His6-标签的重组IdeS与人抗体IgG1以1∶200 (m/m) 的比例在37 ℃反应30 min, 即可酶切完全。而相同条件下, C-端融合了SiBP-标签的重组IdeS活性降低了约90%, 推测IdeS的C-端融合肽段会影响蛋白的表达与活性, 这给进一步简化和蛋白质工程改造IdeS提供了实验依据。因此, 本研究所表达的重组IdeS既可以作为抗体药物的分析表征工具酶, 也可在未来为IdeS成为适应症范围更广的治疗性蛋白提供支持。
作者贡献: 周思含参与本文的主要实验工作和论文的撰写; 刘忞之参与实验设计工作; 杨燕参与数据分析和稿件修改; 王伟作为通讯作者负责研究工作的实验设计和论文修改。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Su Y, Chuang W, Wang S, et al. The deficient cleavage of M protein-bound IgG by IdeS: insight into the escape of Streptococcus pyogenes from antibody-mediated immunity[J]. Mol Immunol, 2011, 49: 134-142. DOI:10.1016/j.molimm.2011.08.002 |
| [2] |
Happonen L, Hauri S, Svensson G, et al. A quantitative Streptococcus pyogenes-human protein-protein interaction map reveals localization of opsonizing antibodies[J]. Nat Commun, 2019, 10: 1-15. DOI:10.1038/s41467-018-07882-8 |
| [3] |
Söderberg J, von Pawel-Rammingen U. The streptococcal protease IdeS modulates bacterial IgG Fc binding and generates 1/2Fc fragments with the ability to prime polymorphonuclear leucocytes[J]. Mol Immunol, 2008, 45: 3347-3353. DOI:10.1016/j.molimm.2008.04.013 |
| [4] |
Collin M, Olsén A. Effect of SpeB and EndoS from Streptococcus pyogenes on human immunoglobulins[J]. Infect Immun, 2001, 69: 7187-7189. DOI:10.1128/IAI.69.11.7187-7189.2001 |
| [5] |
von Pawel-Rammingen U, Björck L. IdeS and SpeB: immunoglobulin-degrading cysteine proteinases of Streptococcus pyogenes[J]. Curr Opon Microbiol, 2003, 6: 50-55. DOI:10.1016/S1369-5274(03)00003-1 |
| [6] |
von Pawel-Rammingen U, Johansson BP, Björck L. IdeS, a novel streptococcal cysteine proteinase with unique specificity for immunoglobulin G[J]. EMBO J, 2002, 21: 1607-1615. DOI:10.1093/emboj/21.7.1607 |
| [7] |
Boztzanowski T, Hernandez-Alba O, Malissard M, et al. Middle level IM-MS and CIU experiments for improved therapeutic immunoglobulin subclass fingerprinting[J]. Anal Chem, 2020, 92: 8827-8835. DOI:10.1021/acs.analchem.0c00293 |
| [8] |
Sénard T, Gargano A, Falck D, et al. MS-based allotype-specific analysis of polyclonal IgG-Fc N-glycosylation[J]. Front Immunol, 2020, 11: 1-13. DOI:10.3389/fimmu.2020.00001 |
| [9] |
Zhao PY, Gunawardena HP, Zhong XQ, et al. Microdroplet ultrafast reactions speed antibody characterization[J]. Anal Chem, 2021, 93: 3997-4005. DOI:10.1021/acs.analchem.0c04974 |
| [10] |
Faid V, Leblanc Y, Bihoreau N, et al. Middle-up analysis of monoclonal antibodies after combined IgdE and IdeS hinge proteolysis: investigation of free sulfhydryls[J]. J Pharm Biomed Anal, 2018, 149: 541-546. DOI:10.1016/j.jpba.2017.11.046 |
| [11] |
Giorgetti J, Beck A, Leize-Wagner E, et al. Combination of intact, middle-up and bottom-up levels to characterize 7 therapeutic monoclonal antibodies by capillary electrophoresis-mass spectrometry[J]. J Pharm Biomed Anal, 2020, 182: 113107. DOI:10.1016/j.jpba.2020.113107 |
| [12] |
van der Burgt YEM, Kilgour DPA, Tsybin YO, et al. Structural analysis of monoclonal antibodies by ultrahigh resolution MALDI in-source decay FT-ICR mass spectrometry[J]. Anal Chem, 2019, 91: 2079-2085. DOI:10.1021/acs.analchem.8b04515 |
| [13] |
Lorant T, Bengtsson M, Eich T, et al. Safety, immunogenicity, pharmacokinetics, and efficacy of degradation of anti-HLA antibodies by IdeS (imlifidase) in chronic kidney disease patients[J]. Am J Transplant, 2018, 18: 2752-2762. DOI:10.1111/ajt.14733 |
| [14] |
Jordan SC, Lorant T, Jus C, et al. IgG endopeptidase in highly sensitized patients undergoing transplantation[J]. N Engl J Med, 2017, 377: 442-453. DOI:10.1056/NEJMoa1612567 |
| [15] |
Lonze BE, Tatapudi VS, Weldon EP, et al. IdeS (imlifidase): a novel agent that cleaves human IgG and permits successful kidney transplantation across high-strength donor-specific antibody[J]. Ann Surg, 2018, 268: 488-496. DOI:10.1097/SLA.0000000000002924 |
| [16] |
Al-Salama ZT. Imlifidase: first approval[J]. Drugs, 2020, 80: 1859-1864. DOI:10.1007/s40265-020-01418-5 |
| [17] |
Wang Y, Shi Q, Lv H, et al. IgG-degrading enzyme of Streptococcus pyogenes (IdeS) prevents disease progression and facilitates improvement in a rabbit model of Guillain-Barré syndrome[J]. Exp Neurol, 2017, 291: 134-140. DOI:10.1016/j.expneurol.2017.02.010 |
| [18] |
Leborgne C, Barbon E, Alexander JM, et al. IgG-cleaving endopeptidase enables in vivo gene therapy in the presence of anti-AAV neutralizing antibodies[J]. Nat Med, 2020, 26: 1096-1101. DOI:10.1038/s41591-020-0911-7 |
| [19] |
Irene RG, Mirja H, Laia TM, et al. Optimising the IgG-degrading enzyme treatment regimen for enhanced adeno-associated virus transduction in the presence of neutralising antibodies[J]. Clin Transl Immunol, 2022, 11: e1375. |
| [20] |
Sugiki T, Fujiwara T, Kojima C. Latest approaches for efficient protein production in drug discovery[J]. Expert Opin Drug Discov, 2014, 9: 1-16. |
| [21] |
Lobstein J, Emrich CA, Jeans C, et al. SHuffle, a novel Escherichia coli protein expression strain capable of correctly folding disulfide bonded proteins in its cytoplasm[J]. Microb Cell Fact, 2012, 11: 56. |
| [22] |
Coyle BL, Baneyx F. A cleavable silica-bingding affinity tag for rapid and inexpensive protein purification[J]. Biotechnol Bioeng, 2014, 111: 2019-2026. DOI:10.1002/bit.25257 |
| [23] |
Sjögren J, Andersson L, Mejàre M, et al. Generating and purifying Fab fragments from human and mouse IgG using the bacterial enzymes IdeS, SpeB and Kgp[J]. Methods Mol Biol, 2017, 1535: 319-329. |
| [24] |
Rosenstein S, Vaisman-Mentesh A, Levy L, et al. Production of F(ab')2 from monoclonal and polyclonal antibodies[J]. Curr Protoc Mol Biol, 2020, 131: e119. |
 2022, Vol. 57
2022, Vol. 57


