2. 山西省道地药材资源开发工程技术研究中心, 山西 太原 030001
2. Shanxi Province Daodi Medicinal Material Resources Development Engineering Technology Research Center, Taiyuan 030001, China
党参为桔梗科植物党参Codonopsis pilosula (Franch.) Nannf.、素花党参C. pilosula Nannf. var. modesta (Nannf.) L.T.Shen或川党参C. tangshen Oliv.的干燥根[1], 具有补中益气, 养血生津的功效, 是我国传统的补气药, 主产于山西、甘肃、陕西等地[2]。党参中主要药效成分包括党参多糖、党参苷Ⅰ、党参炔苷、苍术内酯Ⅲ、紫丁香苷等, 其中, 党参多糖具有抗肿瘤、抗氧化、免疫增强、抗腐蚀和改善记忆等活性, 党参苷Ⅰ、苍术内酯Ⅲ等具有抗炎、抑制血小板活化及凝血状态等活性[3, 4]。化学结构分析发现, 党参多糖包括两大类: 杂多糖和均一多糖[5]。党参苷Ⅰ、党参炔苷、紫丁香苷均属于苯丙素类化合物, 均含有葡萄糖基。苍术内酯Ⅲ属于萜类物质。在植物中, 糖基转移酶是很多含有糖基的化合物拥有生物活性的关键酶, 可以参与苯丙素类、萜类及类黄酮的生物合成途径[6], 由此可推测糖基转移酶在党参主要成分生物合成中起着重要的作用。然而, 迄今为止, 尚未有党参糖基转移酶相关研究报道。
潞党参基原为党参(C. pilosula), 为山西道地药材, 《本草从新》言“按古木草云: 参须上党者佳”, 甘肃所产白条党则引种于潞党参。由于生长环境的不同, 潞党参与白条党在多个方面存在显著差异, 例如: 潞党参的党参多糖及党参苷Ⅰ含量显著高于白条党[7]。本研究以不同产地的潞党参、白条党为实验材料, 对党参糖基转移酶进行系统研究, 以期探索党参多糖等活性成分生物合成机制, 进而分析糖基转移酶在潞党参道地性形成中的关键作用, 为其分子辅助育种奠定理论基础。
材料与方法材料 本研究所用实验材料为2年生潞党参和白条党, 由课题组成员于2020年10月份自山西省长治市平顺县青阳镇、山西省长治市平顺县龙溪镇、山西省长治市壶关县、甘肃省定西市岷县、甘肃省定西市渭源县及甘肃省定西市陇西县采集, 共采集6个不同产地的党参(表 1)。实验材料经山西医科大学高建平教授鉴定为桔梗科植物党参C. pilosula的干燥根。本实验随机选取每个产地10根党参植株混合作为一组, 从芦头下1 cm处的部位开始取样, 取2~3 cm立即放入液氮速冻, 之后存放于-80 ℃冰箱保存, 用于转录组测序及基因表达分析。再取10 cm党参样品经低温(50 ℃) 干燥后, 打粉备用。剩余样品存于山西医科大学生药学研究室标本库。
| Table 1 Information of Codonopsis pilosula sample |
HPLC指纹图谱建立 色谱条件、对照品溶液及供试品溶液的制备参照本课题组前期研究方法[7]。制备党参苷Ⅰ、党参炔苷、紫丁香苷及苍术内酯Ⅲ的对照品溶液。采用中药色谱指纹图谱相似度评价系统(2012)、GraphPad Prism7.00统计软件做图, 进行t检验方差分析。
RNA提取以及转录组测序 采用试剂mirVana™ miRNA ISOlation Kit (Ambion-1561) 分别提取6个不同产地党参组织的总RNA, 琼脂糖凝胶电泳后, 运用凝胶成像系统Tanon 2500 (天能公司) 检测总RNA完整性。用紫外分光光度计NanoDrop 2000 (Thermo) 测定总RNA浓度, 转录组测序由上海欧易生物医学科技有限公司进行。
党参Unigene注释及糖基转移酶的筛选 使用Blastx[8]、Diamond[9]软件进行比对, 取e < 1e-5的注释, 筛选具有最高序列相似性的蛋白。在NR数据库(https://www.ncbi.nlm.nih.gov/) 中进行比对, 从而得到功能注释信息, 建立党参Unigene基因数据库。自数据库中筛选出糖基转移酶Unigene序列, 在NCBI网站搜索其开放阅读框, 将其翻译为氨基酸序列, 在蛋白数据库中进行Blast比对。
党参糖基转移酶家族分类及功能分析 将筛选得到的全部糖基转移酶在GO数据库与KEGG数据库(KEGG: Kyoto Encyclopedia of Genes and Genomes) 中比对注释。然后通过基迪奥生信云工具(https://www.omicshare.com/tools/) 进行GO功能富集和KEGG通路分析。
党参糖基转移酶Unigene分类 在碳水化合物活性酶数据库中(CAZy-Home), 根据Blast比对结果将党参糖基转移酶进行分类。
党参GT1家族蛋白质保守结构域(motif) 分析 在上述党参糖基转移酶分类的基础上, 选取GT1家族作为研究对象, 运用软件MEME [Introduction-MEME Suite (meme-suite.org)] 对党参糖基转移酶的GT1家族的结构域进行分析。
党参糖基转移酶基因系统进化树的构建 在MEGA5软件中, 通过ClustalW功能对拟南芥糖基转移酶蛋白质序列与预测的党参糖基转移酶进行序列比对, 删除多余碱基序列。运用邻接法(neighbor-joining), 进行系统进化树的构建, 设置bootstrap值为1 000。
党参糖基转移酶基因的表达模式分析和验证 不同产地糖基转移酶基因FPKM值通过Z-Score均一化处理, 进行表达模式分析。选取在不同产地中表达差异显著的糖基转移酶基因进行RT-qPCR验证。以党参不同产地、不同组织及不同胁迫处理党参根系为材料, 进行GTs表达模式分析, 以蛋白磷酸酶2基因(PP2A) 作为内参基因, 引物序列见表 2扩增体系及反应程序参照TaKaRa公司的TB Green® Premix Ex TaqTM Ⅱ (Tli RNaseH Plus) 说明书。每个样品3个生物学重复, 采用Ct (2-ΔΔCt) 法计算党参糖基转移酶基因的相对表达量。采用GraphPad Prism7.00统计软件做图, 进行单因素方差分析。
| Table 2 Primer sequences |
本课题组前期研究发现, 潞党参的党参多糖含量显著高于白条党, 为了分析本研究中潞党参与白条党其他活性成分的差异, 根据课题组前期研究方法, 对潞党参与白条党进行HPLC指纹图谱分析。由图 1A可知, 党参炔苷对应峰面积相对较大, 重复性好, 故作为参照峰。由图 1B可知, 潞党参中党参苷Ⅰ、苍术内酯Ⅲ的相对峰面积显著高于白条党, 而紫丁香苷相对峰面积在潞党参与白条党之间无显著性差异。
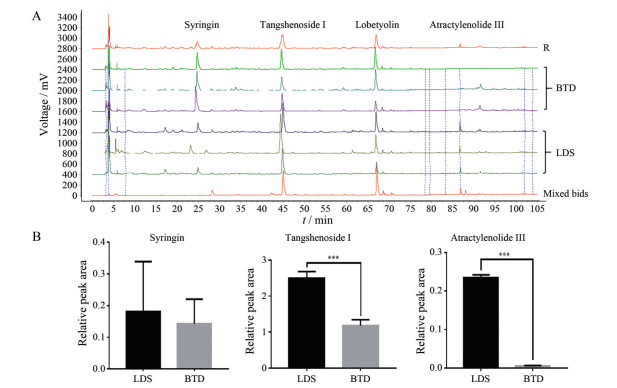
|
Figure 1 HPLC characteristic spectra (A) and relative peak areas (B) of components of syringin, tangshenoside Ⅰ, atractylenolide Ⅲ in Lu Dangshen (LDS) and Baitiaodang (BTD). n = 3, ***P < 0.001 |
由化合物结构可知, 党参多糖、党参苷Ⅰ、苍术内酯Ⅲ均含有糖基[4], 为了探讨党参中糖基转移酶基因是否调控党参多糖等活性成分的合成, 根据NR注释, 自不同产地党参转录组数据库中筛选GTs Unigenes进行分析。
共筛选到98条糖基转移酶Unigenes, 将其命名为GT1-GT98。基于GO数据库, 注释到84条Unigenes, 涉及449个GO terms (图 2)。其中分子功能(molecular function) 中注释最多的为催化活性(catalytic activity), Unigenes数量为72条。生物过程(biological process) 中注释到参与代谢过程(metabolic process) 的序列35条, 表明筛选得到的糖基转移酶主要参与催化次生代谢产物的合成。在生物过程中注释到对刺激的反应(response to stimulus) Unigenes数量为18个, 其中在潞党参中上调表达的基因数为10个, 下调表达的基因数为8个, 说明潞党参道地性的形成受到道地产区特殊生态环境的影响。在免疫系统过程(immune system process)、生物过程的正调控(positive regulation of biological process) 都只涉及到1条Unigene, 且该基因在潞党参中下调表达。而排毒(detoxification) 涉及到1条Unigene, 在潞党参中为上调表达基因。
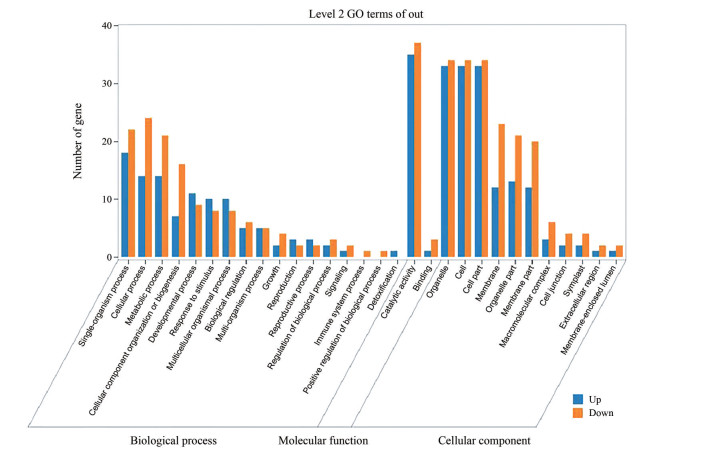
|
Figure 2 GO categorization and annotation of glycosyltransferase. Lu Dangshen was used as the experimental group, while Baitiaodang as the control group. Blue indicated the up-regulated gene, and orange indicated the down-regulated gene |
筛选到的98条糖基转移酶Unigenes, 基于KEGG数据库, 共有22条被注释(图 3), 主要参与聚糖生物合成与代谢(glycan biosynthesis and metabolism) (10条)、萜类化合物和聚酮类化合物的代谢(metabolism of terpenoids and polyketides) (6条)、碳水化合物代谢(carbohydrate metabolism) (4条)。参与聚糖生物合成与代谢的糖基转移酶除GT32、GT62外, 同时参与蛋白质折叠、分类和降解(folding, sorting and degradation), 表明党参糖基转移酶基因参与的次生代谢主要包括聚糖生物、萜类和聚酮类化合物, 以及碳水化合物的代谢。
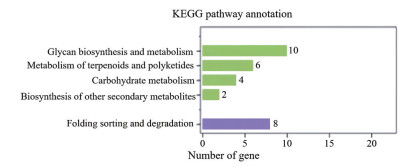
|
Figure 3 KEGG categorizations and annotation of glycosyltransferase |
将实验得到的98条Unigenes根据碳水化合物活性酶数据库(carbohydrate-active enzymes database, CAZy) 进行分类, 分别属于糖基转移酶家族1、2、4、8、21、35、64、90及92, 其中属于糖基转移酶家族1的GTs Unigenes数量最多, 达41条(图 4)。糖基转移酶家族1供体分子为尿苷二磷酸葡萄糖, 糖基转移酶家族2与糖基转移酶家族21具有相似性, 注释到的Unigenes均以木聚糖为供体; 糖基转移酶家族35主要以糖原或淀粉为供体; 糖基转移酶家族4与家族64主要以乙酰己糖胺为供体; 糖基转移酶家族90主要以木糖作为供体; 糖基转移酶家族8与家族92主要以半乳糖作为供体。党参多糖、党参苷Ⅰ等活性成分均含有葡萄糖基, 因此推测党参中糖基转移酶家族1中的糖基转移酶基因参与调控党参主要活性成分的生物合成。因此, 后续将对糖基转移酶家族1进行更深入的研究。
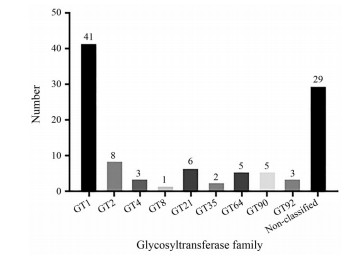
|
Figure 4 Glycosyltransferase family classification |
糖基转移酶家族1中48.3%的糖基转移酶C末端有PSPG盒(plant secondary product glycosyltransferase box) 或特征基序(signature motif)[10]。由图 5可知, 党参糖基转移酶家族1保守结构域基序为[X]-W-[2X]-Q-[3X]-[LH]-[5X]-[FLTHCGWNS]-[2X]-E-[4X]-[GVP]-[4X]-P-[4X]-Q-[2X]-[NAK]。第2位和第23位的色氨酸(W, Tyr)、第5位和第45位的谷氨酰胺(Q, Gln)、第11位和第20位的组氨酸(H, His)、22位的甘氨酸(G, Gly)、25位的丝氨酸(S, Ser)、28位的谷氨酸(E, Glu) 及35位的脯氨酸(P, Pro) 与其他氨基酸相比更加保守。与第35位的脯氨酸相比, 40位的脯氨酸更容易被苏氨酸(T, Thr) 代替。在17位到25位这个区间氨基酸残基相对集中而且保守。第6、7位, 第30、31位, 第41、42、43位及第46、47位的氨基酸残基的保守性差, 可以被任意的氨基酸残基代替。

|
Figure 5 The conservative motif of GT1 of Codonopsis pilosula |
模式植物拟南芥糖基转移酶分类及功能注释研究透彻, 故选取25条拟南芥的糖基转移酶家族1的基因与党参糖基转移酶家族1基因共41条序列进行多序列比对, 构建系统进化树, 进行功能注释(图 6)。结果发现, 位于糖基转移酶家族1的UGT 73分支中的党参UGT数量最多, 共计10条, 包括GT16、GT95、GT25、GT26、GT5、GT2、GT42、GT68、GT8、GT49。位于拟南芥UGT 72分支中的有6条, 有4条Unigenes位于拟南芥UGT 85分支, 有2条Unigenes位于在拟南芥UGT 74分支, 各有1条Unigene分别分布在拟南芥UGT 76和拟南芥UGT 84分支中, 无党参糖基转移酶分布于拟南芥UGT 71分支中。
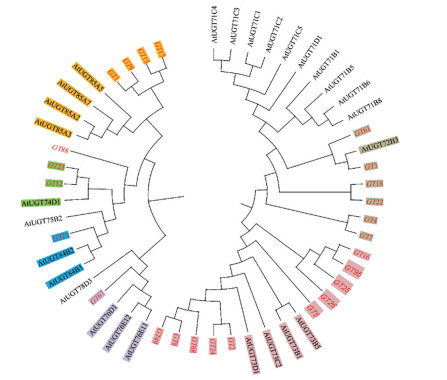
|
Figure 6 Phylogenetic tree analysis of glycosyltransferase between Codonopsis pilosula and Arabidopsis thaliana |
根据FPKM值, 对不同产地党参中糖基转移酶家族1基因的表达量进行分层聚类分析, 发现潞党参植株中糖基转移酶家族1上调表达的基因数目显著高于白条党。有22个GTs基因在壶关县(HGX) 潞党参植株中的表达量显著高于其他5个产地, 基因GT1、GT2、GT12、GT24、GT26、GT49、GT61在岷县禾驮乡(HTX) 白条党植株中表达量显著高于其他5个产地。基因GT14、GT16在3个产地的潞党参植株中表达量均显著高于不同产地的白条党(图 7)。
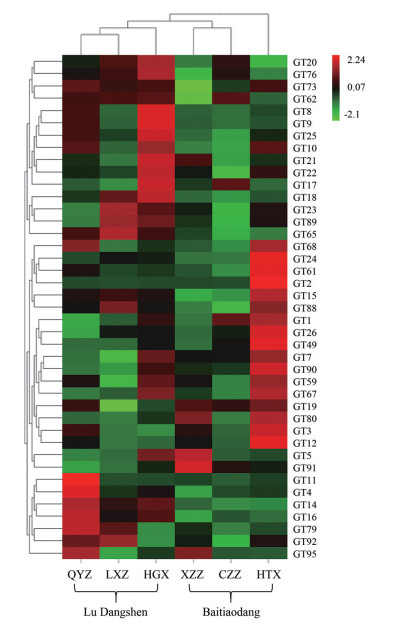
|
Figure 7 Expression of glycosyltransferase genes in Codonopsis pilosula of six different regions (QYZ, LXZ, HGX, HTX, XZZ, CZZ) |
KEGG功能注释分析发现, GT16主要参与萜类和聚酮类化合物代谢。通过NCBI进行Blast比对发现, 党参GT16基因与积雪草UDP-葡萄糖基转移酶基因UGT73AH2同源性最高, 系统进化树分析发现GT16与拟南芥AtUGT73亲缘关系最近, 因此将该基因命名为CpUGT73AH2。而GT14在转录组数据库中的基因序列长度仅有338 bp, 序列过短, 未能进行系统进化树分析, 也未比对到相似基因, 因此下文主要针对GT16基因进行分析。通过RT-qPCR对糖基转移酶基因CpUGT73AH2进行表达模式分析验证, 由图 8A可知, 该基因在潞党参植株中表达量显著高于白条党, 与转录组测序结果一致。在潞党参中党参多糖、党参苷Ⅰ、苍术内酯Ⅲ含量均显著高于白条党, Pearson相关性分析发现, 不同产地CpUGT73AH2基因表达与党参苷Ⅰ、苍术内酯Ⅲ、党参多糖含量均呈显著正相关, 推测该基因可能参与上述化合物的合成。对不同组织的CpUGT73AH2表达量进行分析, 发现该基因在茎中表达量最高, 显著高于其他组织, 在根与花中的表达量最低, 二者之间差异不显著。12% PEG胁迫处理后, CpUGT73AH2表达量在4 h时急剧下降, 在8 h时急剧上升, 而对照组CK (control check) 该基因的表达量呈下降趋势。4 ℃冷胁迫处理下, CK组与处理组CpUGT73AH2基因均呈现先下降后上升的变化趋势, 但在处理48 h时, 处理组CpUGT73AH2基因表达量显著增加, 而CK组相较处理12和24 h, 无显著变化。两组胁迫处理结果表明CpUGT73AH2基因表达可以响应环境因子诱导。
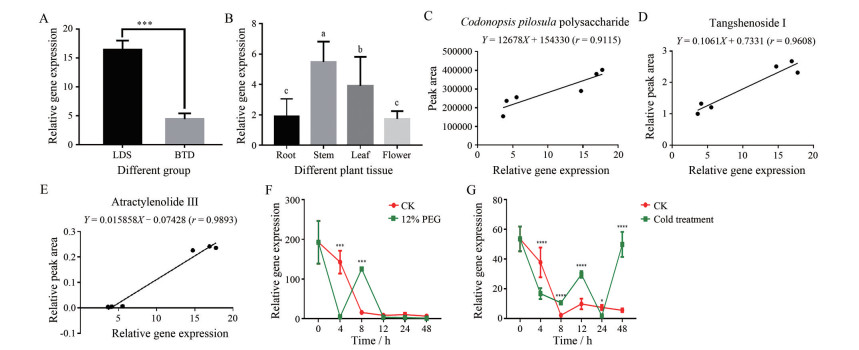
|
Figure 8 RT-qPCR analysis of CpUGT73AH2 gene in roots of LDS and BTD (A, P < 0.001), different tissues (B); correlation analysis between CpUGT73AH2 gene expression and components of Codonopsis pilosula CPP (C), tangshenoside Ⅰ (D), atractylenolide Ⅲ (E); 12% PEG drought treatment (F) and 4 ℃ cold treatment (G) of Codonopsis pilosula. Different letters represent significant differences, ***P < 0.001; ****P < 0.000 1 vs control group (CK) |
党参为我国传统补益类中药, 既可以作为食物原材料用以茶饮、煲汤等, 还可以与其他中药配伍组成方剂, 如: 四君子汤、补肺汤、生脉散等[2]。党参主要产区为山西省、甘肃省, 甘肃定西等产地。党参在1964年引种于山西, 在甘肃进行大面积种植后, 因其采用熏硫工艺, 使得党参色泽光白被称为白条党[11]。由于种植环境及后续加工方式的不同, 潞党参与白条党在表观性状、化学成分等方面存在差异。本研究对不同产地的党参通过指纹图谱分析其化学成分含量, 发现潞党参中党参苷Ⅰ与苍术内酯Ⅲ相对峰面积显著高于白条党。同时, 课题组前期实验也证实潞党参中党参多糖含量显著高于白条党[6]。而据文献[12]报道, 党参多糖、党参苷Ⅰ、党参炔苷及苍术内酯Ⅲ等成分则作为党参质量标志物的选择对象。因此, 党参多糖、党参苷Ⅰ及苍术内酯Ⅲ应当作为潞党参道地品质的特征性成分, 其中, 党参苷Ⅰ属于苯丙素类, 苍术内酯Ⅲ属于萜类成分。
文献[5]报道, 糖类、苯丙素类、萜类等物质的生物合成途径中, 糖基转移酶是糖基化机制的关键酶, 起到催化糖苷键形成的作用, 促进物质的合成。本文通过以山西的潞党参植株与甘肃的白条党植株为实验材料建立的转录组数据库, 共筛选到98条糖基转移酶基因, 其中41条属于糖基转移酶家族1。功能注释分析发现糖基转移酶在参与党参次生代谢产物合成途径中起着至关重要的作用。拟南芥中的糖基转移酶研究较为透彻, 通过与拟南芥中糖基转移酶的序列进行系统进化树的构建, 能够对党参中的糖基转移酶功能进行推测。GT12以及GT23与拟南芥中UGT 74基因家族在同一进化支中, 推测其功能相似。UGT74C被证明是葡萄糖苷生物合成中的辅助酶, 其在植物适应环境挑战期间具有潜在功能[13, 14]。党参中党参多糖与党参苷Ⅰ含葡萄糖基, 推测GT12、GT23基因可能参与党参多糖与党参苷Ⅰ生物合成途径。GT3、GT61与拟南芥UGT72系列为同一进化支, 拟南芥中UGT72通过糖化松柏醇和芥子醇, 影响木质素的合成途径[15]。党参中党参苷Ⅰ为木质素类化合物, 推测GT3、GT61同样参与党参苷Ⅰ的合成途径, 但其参与方式与GT12、GT23基因不同。
CpUGT73AH2在KEGG注释到萜类化合物和聚酮类化合物的代谢途径中, 在GO主要注释到不同构型葡萄糖基转移酶催化活性。拟南芥UGT73参与萜类化合物中如常春藤皂苷、齐墩果酸以及大豆皂苷的葡萄糖糖基化过程[16, 17], UGT73C6同样催化葡萄糖从UDP葡萄糖进行转移[18], UGT73C5催化芸苔甾内酯-23-O-葡萄糖糖基化[19], UGT73AM3则是通过催化3-O-β-D-吡喃葡萄糖, 调控黄瓜苦三萜糖基化[20]。同时UGT73B6底物宽泛, 可糖基化多种天然化合物, 催化合成酚苷类天然化合物[21]。CpUGT73AH2与上述拟南芥中的催化不同种类的葡萄糖进行糖基化的基因位于同一家族, 遗传进化功能相近, 所以推测CpUGT73AH2也具有通过催化葡萄糖糖基化进而调控多种天然化合物的功能。本研究发现不同产地CpUGT73AH2基因表达与党参多糖、党参苷Ⅰ、苍术内酯Ⅲ含量呈显著正相关, 结合上述文献报道, 推测CpUGT73AH2基因可能是通过催化葡萄糖糖基化, 促进党参中萜类化合物苍术内酯Ⅲ与含有葡萄糖基党参苷Ⅰ的合成。
而通过对不同组织CpUGT73AH2基因表达与2021年8月党参多糖含量进行相关性分析, 发现呈显著负相关, CpUGT73AH2基因在源器官中高表达, 而党参多糖积累主要发生在库器官[22]。对不同产地党参多糖含量与CpUGT73AH2基因表达进行相关性分析, 发现呈显著正相关。由于CpUGT73AH2不仅参与党参杂多糖的积累, 还可能参与党参中其他次生代谢产物的糖基化。因此, 推测8月CpUGT73AH2基因在茎、叶中的高表达可能是由于参与党参多糖外其他次生代谢产物的合成。未来, 可通过茎和根代谢组学差异分析进行验证。
山西道地药材潞党参生长在年平均气温8.6~10.5 ℃, 年降水量530~650 mm, 海拔1 000~1 700 m的山区; 白条党则生长在年平均气温5.7~7.7 ℃, 年总降水量400~600 mm, 海拔2 000 m以上的山区。道地药材道地性的形成具有逆境效应[23], 受道地产区特殊生态环境的影响。因此可通过环境胁迫进一步验证基因CpUGT73AH2的功能。前期研究发现道地药材潞党参的党参多糖、党参苷Ⅰ含量等均显著高于白条党[7], 表明潞党参有效成分的积累受道地产区特殊生态环境的影响。本研究发现CpUGT73AH2基因表达响应干旱胁迫与冷胁迫诱导。综上所述, CpUGT73AH2基因可能响应环境胁迫诱导, 从而参与调控萜类物质与苷类物质的合成, 促进其积累。然而, CpUGT73AH2在党参中具体的调控机制尚不明确, 后续需要进行更深入的基因功能验证。
近年来, 随着基因测序和分析技术的进步, 越来越多的植物进行基因组和转录组测序, 如: 人参、天麻、雷公藤等[24]。本研究基于党参转录组数据, 从糖基转移酶的分类、功能注释、保守结构域、表达模式以及进化树等方面进行了系统分析, 探讨糖基转移酶在党参主要活性成分合成中的作用, 发现CpUGT73AH2基因参与潞党参道地性品质特征成分合成, 为分析潞党参道地性形成机制提供理论依据。
作者贡献: 田星锐主要负责进行液相色谱实验、转录组数据分析及论文撰写; 吉姣姣主要负责指导整个实验及整篇论文的修改; 李建宽主要负责设计液相色谱实验; 姜峰和刘喆宇负责样品的采集及样品信息的统计; 高建平主要负责整篇论文的修改及提供基金支持。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. Part 1. 2020 Ed. Beijing: China Medical Science Press, 2020: 280-281.
|
| [2] |
Gao SM, Liu JS, Wang M, et al. Traditional uses, phytochemistry, pharmacology and toxicology of Codonopsis: a review[J]. J Ethnopharmacol, 2018, 219: 50-70. DOI:10.1016/j.jep.2018.02.039 |
| [3] |
Zou YF, Zhang YY, Paulsen BS, et al. Prospects of Codonopsis pilosula polysaccharides: structural features and bioactivities diversity[J]. Trends Food Sci Technol, 2020, 103: 1-11. DOI:10.1016/j.tifs.2020.06.012 |
| [4] |
Xie Q, Cheng XM, Hu FD, et al. Research advance on chemical constituents, pharmacological action and quality control of Radix Codonopsis[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2020, 54: 11. |
| [5] |
Li JK, Zhang X, Cao LY, et al. Three inulin-type fructans from Codonopsis pilosula (Franch.) Nannf. roots and their prebiotic activity on Bifidobacterium longum[J]. Molecules, 2018, 23: 3123. DOI:10.3390/molecules23123123 |
| [6] |
Brown DM, Goubet F, Wong VW, et al. Comparison of five xylan synthesis mutants reveals new insight into the mechanisms of xylan synthesis[J]. Plant J, 2010, 52: 1154-1168. |
| [7] |
Zhang SS. Research on Commodity Specification Grade and Quality Standard of Codonopsis Radix (Lu Dangshen) (潞党参药材商品等级及质量标准研究) [D]. Taiyuan: Shanxi Medical University, 2019.
|
| [8] |
Altschul S, Gish W, Miller W, et al. Basic local alignment search tool[J]. J Mol Biol, 1990, 215: 403-410. DOI:10.1016/S0022-2836(05)80360-2 |
| [9] |
Buchfink B, Xie C, Huson DH. Fast and sensitive protein alignment using DIAMOND[J]. Nat Methods, 2015, 12: 59-60. DOI:10.1038/nmeth.3176 |
| [10] |
Zhang LZ, Lin JS, Li YJ. Research progress on glycosylation modification of plant hormones[J]. Chin Bull Bot (植物学报), 2014, 49: 515-523. DOI:10.3724/SP.J.1259.2014.00515 |
| [11] |
Song PP, Cui F, Zhang YJ, et al. Analysis of the functional factor of root-head, taproot and tail root of Codonopsis pilosula[J]. Food Sci (食品科学), 2021. DOI:10.7506/spkx1002-6630-20210908-098 |
| [12] |
Qi JL, Liang J, Hu J, et al. Quality control status and predictive analysis of quality markers of Codonopsis pilosula [J/OL]. Chin Arch Tradit Chin Med (中华中医药学刊), 2021 [2022-02-28]. http://kns.cnki.net/kcms/detail/21.1546.R.20211104.1314.028.html.
|
| [13] |
Wang T, Li P, Mu T, et al. Overexpression of UGT74E2, an Arabidopsis IBA glycosyltransferase, enhances seed germination and modulates stress tolerance via ABA signaling in rice[J]. Int J Mol Sci, 2020, 21: 7239. DOI:10.3390/ijms21197239 |
| [14] |
Grubb CD, Zipp BJ, Kopycki J, et al. Comparative analysis of Arabidopsis UGT74 glucosyltransferases reveals a special role of UGT74C1 in glucosinolate biosynthesis[J]. Plant J Cell Mol Biol, 2014, 79: 92-105. DOI:10.1111/tpj.12541 |
| [15] |
Lim EK, Li Y, Parr A, et al. Identification of glucosyltransferase genes involved in sinapate metabolism and lignin synthesis in Arabidopsis[J]. J Biol Chem, 2001, 276: 4344-4349. DOI:10.1074/jbc.M007263200 |
| [16] |
Achnine L, Huhman DV, Farag MA, et al. Genomics-based selection and functional characterization of triterpene glycosyltransferases from the model legume Medicago truncatula[J]. Plant J, 2005, 41: 875-887. DOI:10.1111/j.1365-313X.2005.02344.x |
| [17] |
Naoumkina MA, Modolo LV, Huhman DV. Genomic and coexpression analyses predict multiple genes involved in triterpene saponin biosynthesis in Medicago truncatula[J]. Plant Cell, 2010, 22: 850-866. DOI:10.1105/tpc.109.073270 |
| [18] |
Ones P, Messner B, Nakajima JI, et al. UGT73C6 and UGT78D1, glycosyltransferases involved in flavonol glycoside biosynthesis in Arabidopsis thaliana[J]. J Biol Chem, 2003, 278: 43910-43918. DOI:10.1074/jbc.M303523200 |
| [19] |
Poppenberger B, Fujioka S, Soeno K, et al. The UGT73C5 of Arabidopsis thaliana glucosylates brassinosteroids[J]. Proc Natl Acad Sci U S A, 2005, 102: 15253-15258. DOI:10.1073/pnas.0504279102 |
| [20] |
Zhong Y, Xue X, Liu Z, et al. Developmentally regulated glucosylation of bitter triterpenoid in cucumber by the UDP-glucosyltransferase UGT73AM3[J]. Mol Plant, 2017, 10: 1000-1003. DOI:10.1016/j.molp.2017.02.005 |
| [21] |
He QL, Bai YF, Zhou W, et al. Biocatalysis of phenolic glycosides natural products in Escherichia coli strain using UGT73B6[J]. Biotechnol Bull (生物技术通报), 2017, 33: 136-142. |
| [22] |
Zheng QH, Li J, Ji JJ. Cloning and expression analysis of the full-length CpSUC4 gene of Codonopsis pilosula[J]. J Shanxi Univ (Nat Sci Ed) (山西大学学报自然科学版), 2018, 41: 831-838. |
| [23] |
Guo LP, Huang LQ. Ecological research on traditional Chinese medicine resources[J]. China J Chin Mater Med (中国中药杂志), 2004, 29: 9-12. |
| [24] |
Chen SL, Sun Y, Wang HH, et al. Highlights on the progress of traditional Chinese medicine and natural drugs during 2015-2020[J]. Acta Pharm Sin (药学学报), 2020, 55: 2751-2776. |
 2022, Vol. 57
2022, Vol. 57


