2. 军事科学院军事医学研究院毒物药物研究所, 北京 100850
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China
大多数早或中期局部原发性肿瘤首选的治疗方法是手术切除[1], 但由于传统手术中原发肿瘤的完全切除困难, 残留肿瘤细胞/组织可能进一步发展, 导致肿瘤复发和/或远处转移[2, 3]。为阻止肿瘤切除的术后复发, 患者术后通常会接受辅助化疗, 这种化疗是全身性治疗, 化疗药物杀死癌细胞的同时患者身体也经历药物带来的不良反应, 对患者身体健康造成伤害[4]。近年局部药物递送成为防止癌症术后复发的新策略, 与全身治疗相比, 局部药物传递更具优势, 增加了给药部位的药物浓度, 全身不良反应较小且易于给药[5]。温敏凝胶是一种能随环境温度变化而产生溶胶-凝胶相变的制剂, 当温度较低时, 是流动性的溶胶状, 人体温度时变为半固体凝胶状[6], 且有一定黏附性, 能延长药物在局部的滞留时间, 在给药部位形成高浓度的药物储库, 持续释放药物[7]。相对于肿瘤术后全身给药治疗, 温敏凝胶负载药物在肿瘤切除后的肿瘤腔内直接给药, 既减小了全身给药带来的不良反应, 也减少了药物浪费[8]。
紫杉醇是从红豆杉中提取的天然抗肿瘤药物, 已在乳腺癌、卵巢癌和部分头颈癌和肺癌的临床治疗中发挥作用[9]。上市制剂主要有紫杉醇注射液和白蛋白结合型注射用紫杉醇[10], 由于紫杉醇是水不溶性药物, 前者将紫杉醇溶于聚氧乙烯蓖麻油和无水乙醇混合制得[11], 但聚氧乙烯蓖麻油易引起严重过敏反应, 需在给药前进行抗过敏预处理, 使患者被动接受大剂量激素而带来不良反应; 后者虽不需进行抗过敏处理, 但在治疗乳腺癌的临床试验中发现了较高的感觉神经病变率, 且整体价格比紫杉醇注射液贵, 增加了患者经济负担。因此, 拟将紫杉醇制备成局部给药制剂以用于肿瘤疾病术后复发的治疗, 但紫杉醇水溶性差[12]的特点限制了其在局部的药物浓度的提高, 拟通过减小粒径、增大比表面积增加难溶性药物的溶解度[13]。
本研究利用介质研磨法和高压均质法获得了粒径为350、800 nm的紫杉醇混悬液[14-16], 通过气流粉碎和筛分法获得了3、9 μm的紫杉醇, 将其与泊洛沙姆407、泊洛沙姆188和卡波姆结合构建含不同粒径的紫杉醇温敏凝胶系统, 考察了紫杉醇温敏凝胶的形貌、黏度变化、流变学性质及体外释放, 并通过药代动力学研究考察了其在大鼠体内的吸收与代谢。
材料与方法仪器 高速剪切机(德国布鲁克公司)、球磨机(华尔宝机械有限公司)、液滴性状分析仪(德国KRÜSS公司)、Nano-ZS90粒度仪(英国Malvern公司)、程控型恒温浴槽(德国Julabo公司)、磁力搅拌器(德国Chemtron公司)、高压均质机(ATS Engineering公司)、超微粉气流粉碎机[诺泽流体科技(上海) 有限公司]、自动溶出仪(天津天大天发科技公司)、JSM-7900F场发射扫描电子显微镜(scanning electron microscope, SEM; 日本电子株式会社)、透射电镜(transmission electron microscope, TEM; 日本Hitachi公司)、旋转黏度计(德国Brookfield公司)、流变仪(美国Thermo公司)、质构仪(上海保圣科技有限公司)、恒温振荡器(天津欧诺仪器股份有限公司)、涡旋仪(美国Scientific industries公司)、Aglilent 1200液相色谱-Agilent G6460质谱联用仪(美国安捷伦公司)、高速冷冻离心机(美国Sigma公司)。
试剂 紫杉醇(批号20200401, 纯度: 98%, 无锡紫衫药业); 羟丙基纤维素[hydroxypropyl methyl cellulose, HPMC; 批号NPE-0013, 亚什兰化学贸易(上海) 有限公司]、聚维酮(polyvinyl pyrrolidone k 30, PVP k 30; 批号G91897PT0)、泊洛沙姆407 (批号GND02121B)、泊洛沙姆188 (批号GND17221B) (德国BASF公司); 羟丙纤维素(hydroxypropyl cellulose, HPC-SL; 批号NOC0211, 日本曹达株式会社); 羧甲基纤维素钠(carboxymethylcellulose sodium, CMC-Na; 批号TF78200401, 湖南九典宏阳制药有限公司); Tween-80 (TW-80; 批号20190402)、Tween-20 (TW-20; 批号20190402)、乙酸(分析纯, 批号20200921) (国药集团化学试剂有限公司); 十二烷基硫酸钠(sodium dodecyl sulfate, SDS; 批号WXBC1167V, 上海麦克林生化科技有限公司)、卡波姆(批号0102177011, 美国Lubrizol公司)、乙腈(色谱纯, 批号193730, Fisher Chemical公司)、地西泮(批号140708, 山东信谊制药有限公司)。
实验动物 SD (Sprague-Dawley) 大鼠, 雄性, SPF级, 体重200~220 g, 北京维通利华实验动物技术有限公司, 许可证号SCXK (京) 2016-0011。
制备不同粒径紫杉醇
介质研磨法 称取处方量的紫杉醇、稳定剂(PVP k 30、SDS) 加入蒸馏水中, 高速剪切机剪切1 min, 所得含药混合液加入到球磨机进料斗中, 研磨腔中填充65%的氧化锆珠作为研磨介质循环研磨40 min, 制得紫杉醇粒径约为350 nm的紫杉醇纳米晶混悬液。
高压均质法 称取处方量的紫杉醇、稳定剂(PVP k 30、SDS) 于蒸馏水中, 高速剪切机剪切1 min, 所得含药混合液在200 bar的压力下在高压均质机中循环20 min, 制得紫杉醇粒径约为800 nm的紫杉醇纳米晶混悬液。
气流粉碎 利用气流粉碎机将紫杉醇原料药粉碎成粒径为3 μm的颗粒。
筛分 将紫杉醇原料药过60目筛, 粒径约为9 μm。
接触角和表面张力测定药物系统中常用的空间稳定剂包括非离子型聚合物, 如HPMC、PVP k 30、HPC-SL、CMC-Na、TW-80、TW-20; 电荷稳定剂主要是离子型表面活性剂如SDS、多库酯钠(DOSS)[17]。稳定剂的主要功能之一是疏水性药物的润湿剂, 可通过稳定剂与药物表面的润湿性初步筛选稳定剂种类, 润湿性可通过接触角和表面张力来评价。紫杉醇是疏水性药物, 可通过测量稳定剂与药物间的接触角和表面张力来选择润湿性较好的稳定剂。
将紫杉醇药物粉末置于样品池, 铺平表面, 使表面均匀平滑。在接触角仪中选择座滴法, 将上述稳定剂溶液分别滴下, 在液滴与紫杉醇粉体接触的瞬间拍照并记录接触角。将稳定剂溶液置于接触角仪注射器中, 选择悬滴法, 液体滴下, 记录表面张力数据。
粒径大小及稳定性考察 紫杉醇混悬液50 μL加水稀释300倍, 马尔文粒径仪设置折射率为1.560, 吸光度为0.010, 测量温度为25 ℃, 平行测量3次取平均值, 记录粒径及多分散系数(polydisperse index, PDI), 分别考察0、5、10、15天的粒径变化。
紫杉醇颗粒形态观察 取10 μL不同粒径的紫杉醇混悬液滴于TEM专用铜网上, 室温下自然晾干, 滴加10 μL的3%磷钨酸负染2 min, 用滤纸吸去多余的染液, TEM在加速电压为80.0 kV下观察纳米晶体的形态。
冷法制备空白凝胶 称取处方量的卡波姆于蒸馏水中, 4 ℃放置过夜, 加入处方量的泊洛沙姆407和188, 轻轻搅拌, 使固体粉末分散在蒸馏水中, 4 ℃放置12 h, 使其完全溶胀。
胶凝温度和胶凝时间的测定 将10 mL凝胶溶液倒入西林瓶中, 放入搅拌子, 设置水浴温度程序, 10 ℃上升到40 ℃, 升温速率为1 ℃·min-1, 30 ℃后每个温度点设置平衡时间2 min, 150 r·min-1磁力搅拌, 观察搅拌子转动情况。当搅拌子停止转动时记录温度, 即为胶凝温度。将装有凝胶溶液的西林瓶放入37 ℃水浴槽中, 150 r·min-1磁力搅拌, 观察搅拌子转动情况, 记录西林瓶放入水浴中到搅拌子停止转动的时间, 即为胶凝时间。
Box-Behnen Design优化空白凝胶 在单因素试验基础上, 采用Box-Behnen Design优化空白凝胶, 选择泊洛沙姆407、泊洛沙姆188、卡波姆的浓度作为考察因素, 胶凝温度和时间作为响应值, Design-Expert软件设计试验。设置泊洛沙姆407、泊洛沙姆188、卡波姆的浓度范围分别为17%~21%、1%~5%、0.1%~0.3%, 并对结果进行多元回归拟合。以胶凝温度33~35 ℃、胶凝时间60~90 s为拟合范围得到最优处方。根据模型拟合出的最优处方量制备紫杉醇温敏凝胶, 确定最终的泊洛沙姆407、泊洛沙姆188和卡波姆浓度。
不同粒径紫杉醇温敏凝胶的制备 按照冷法制备空白凝胶方法, 将350 nm、800 nm、3 μm、9 μm的紫杉醇混悬液加入空白凝胶中制成含药温敏凝胶, 并调整最终紫杉醇的含药量为10 mg·g-1。
紫杉醇温敏凝胶的表征
观察凝胶形貌 取适量冻干凝胶粉末, 喷金处理, 利用SEM观察凝胶孔径和形貌。
温度-黏度变化 利用旋转黏度计测定4种粒径紫杉醇温敏凝胶在10~40 ℃的黏度变化。选择29#转子, 转速100 r·min-1, 升温速度1 ℃·min-1, 每10 s测量1个数据, 测定黏度发生突变时的温度。
流变学性质 温敏凝胶具有黏性液体和弹性固体两种流变学性质, 黏性液体性质用流变学参数损耗模量G″表示, 弹性固体性质用流变学参数储能模量G'表示。G'又称为弹性模量, 指材料在发生形变时, 由于弹性形变而储存能量的大小, 反映材料弹性; G″又称黏性模量, 指材料在发生形变时, 由于黏性形变而损耗的能量大小, 反映材料黏性[18]。当G'和G″相等时, 发生相变, 此时温度即为胶凝温度[19]。使用赛默飞Mars 40流变仪, 测量模具: 25 mm平行板。在固定应变幅度1%、频率1 Hz、升温速度1 ℃·s-1条件下, 考察不同粒径紫杉醇温敏凝胶在10~40 ℃时随温度升高的G″和G'变化。
黏附性及凝胶强度 质构仪测得的质构曲线最大峰值为凝胶的破断力, 达到破断力所产生的形变量为破断距离。按照公式计算凝胶强度: X =
紫杉醇混悬液的体外释放 采用2020版《中国药典》溶出度与释放度测定法中第二法桨法测定, 以0.5% SDS-磷酸盐缓冲液(PBS, pH 7.4) 为溶出介质, 溶出介质体积为900 mL, 转速100 r·min-1, 温度(37 ± 0.5) ℃。取1 mL紫杉醇混悬液(约15 mg·mL-1), 分别在5、10、15、20、25、30、40、50、60、90、120、150、180 min取样5 mL, 同时补充5 mL空白释放介质。样品用0.25 μm微孔滤膜过滤, 取续滤液, 稀释后HPLC测定。计算紫杉醇的累积释放百分率。
紫杉醇温敏凝胶的溶蚀与释放 采用重量损失法测紫杉醇温敏凝胶的溶蚀与释放, 称取1 g紫杉醇温敏凝胶(mg) 于10 mL西林瓶中, 称量空瓶重量和加入凝胶后瓶与凝胶的总重(m0); 将装有凝胶的西林瓶置于恒温振荡器中, 37 ℃平衡20 min, 使其完全成胶; 再加入5 mL已预热至37 ℃的PBS (pH 7.4) 溶液作为释放介质; 转速为100 r·min-1, 每隔30 min将全部介质取出, 称量西林瓶与剩余凝胶的总重(mt), 再加入5 mL释放介质; 样品用0.22 μm滤膜过滤, 取续滤液, HPLC法测定紫杉醇含量并计算累积溶蚀率和累积释放率, 绘制凝胶释放曲线和溶蚀曲线, 并考察其相关性。
累积溶蚀率= (m0 - mt)/mg × 100% (m0为瓶与凝胶的总重, mt为各时间剩余凝胶与瓶的总重, mg为加入的凝胶的实际重量)
累积释放率=
紫杉醇含量测定HPLC方法条件色谱条件: 色谱柱: Waters Symmetry C8 (4.6 mm × 250 mm, 5 μm); 流动相: 乙腈-水(60∶40); 检测波长: 228 nm; 流速: 1.0 mL·min-1; 进样量: 20 μL; 柱温: 30 ℃。
紫杉醇温敏凝胶药代动力学研究
动物实验过程 30只雄性大鼠随机分为5组, 每组6只, 分别是350 nm、800 nm、3 μm、9 μm紫杉醇温敏凝胶组以及空白组, 给药前禁食12 h, 自由饮水; 每只大鼠背部皮下注射温敏凝胶各0.2 mL, 空白组注射0.2 mL生理盐水, 注射完成后, 分别在1、2、3、4、5、6、8、10、12、24、36、48、72、96、120、144、168、192、216 h于眼底静脉丛取血0.5 mL, 置于肝素钠预处理的离心管中, 振摇使血样与抗凝剂充分接触, 再将血样在冷冻离心机中4 ℃下14 000 r·min-1离心10 min, 取上层血浆在-20 ℃下冷冻保存; 采用液相色谱-质谱联用(LC-MS) 测量血浆中紫杉醇的含量。动物福利和实验过程均遵循军事医学研究院动物伦理委员会的规定。
LC-MS色谱条件[20] 色谱柱: CAPCELL PAK C18 2.1 mm × 100 mm, 5 μm; 流动相: A: 0.1%乙酸-乙腈= 70∶30; B: 0.1%乙酸-乙腈= 10∶90; 进样量: 5 μL; 柱温: 25 ℃; 内标: 地西泮。
质谱条件 离子极性: 正离子; 离子化方式: 气动辅助电喷雾离子化(ESI); 离子检测。方式: 多反应监测(MRM); 检测对象: 紫杉醇([M+Na]十, m/z 876.3→307.9, 内标([M+Na]十, m/z 285.2→193.1); 碎裂电压分别为: 190和28 V; 碰撞能量: 紫杉醇28 V、内标55 V, 干燥气流速: 9 L·min-1; 雾化室压力: 25 psi; 干燥气温度: 350 ℃, 毛细管电压: 4 000 V。
对照品及内标溶液配制 ①对照品溶液配制: 精密称取PTX (paclitaxel) 对照品15 mg, 置于100 mL容量瓶中, 加入90%乙腈溶解并定容, 量取1 mL上述溶液于100 mL容量瓶中, 加90%乙腈溶解并定容; 制成1 500 ng·mL-1对照品溶液。②内标溶液配制: 精密称取地西泮10 mg于100 mL容量瓶中, 加90%乙腈溶解并定容, 量取1 mL上述溶液于100 mL容量瓶中, 加90%乙腈溶解并定容; 量取10 mL于100 mL容量瓶中, 加90%乙腈溶解并定容, 制成100 ng·mL-1地西泮溶液作为内标。
样品处理方法 取血浆样品50 μL置于1.5 mL离心管中, 加入10 μL地西泮溶液(100 ng·mL-1), 再加入190 μL乙腈, 混合涡旋1 min, 于4 ℃、14 000 r·min-1离心10 min, 取90 μL上清液于样品管中, 按照LC-MS色谱条件进样分析。
专属性考察 取40 μL空白血浆, 加入10 μL紫杉醇溶液(500 ng·mL-1) 和10 μL内标地西泮溶液(100 ng·mL-1), 经上述“样品处理方法”处理, 得到模拟大鼠血浆样品; 样品按照LC-MS条件进行测定, 观察内源性杂质和代谢产物对紫杉醇含量测定的影响。
标准曲线绘制 取空白血浆40 μL置于1.5 mL离心管中, 加入10 μL紫杉醇系列标准溶液, 浓度分别为10、50、150、200、300、450、600、1 000、1 500 ng·mL-1, 再加入10 μL地西泮溶液(100 ng·mL-1), 加入190 μL乙腈, 混合涡旋1 min, 于4 ℃、14 000 r·min-1离心10 min, 取上清液于样品管中, 按照LC-MS色谱条件进样分析。
药动学参数计算方法 将获得的不同时间点血药浓度数据利用DAS 3.0软件处理, 分别计算各组温敏凝胶中紫杉醇的最大血药浓度(Cmax)、达峰时间(Tmax)、药-时曲线下面积(AUC0-t), 采用SPSS 22.0软件进行t检验分析。
统计学分析 数据以
空间稳定剂和电荷稳定剂可充分润湿药物粒子, 通过形成静电斥力和产生高能屏障, 抑制结晶生长, 从而抑制具有高表面自由能的纳米级药物粒子发生聚集[21]。不同种类稳定剂与紫杉醇的接触角和表面张力如表 1所示, 当接触角小于90°时说明稳定剂与紫杉醇间有较好润湿性[22], 其中SDS的接触角为72°且表面张力为(33.38 ± 1.27) mN·m-1, 是所有考察稳定剂中表面张力最小的, 所以选择SDS作为电荷稳定剂, HPC SL、PVP k 30、TW-80作为空间稳定剂; 在后续实验中, 需通过粒径的稳定性来考察稳定剂或组合是否适合与紫杉醇通过介质研磨获得紫杉醇混悬液。
| Table 1 Contact angle and surface tension of different stabilizers. HPMC: Hydroxypropyl methyl cellulose; HPC SL: Hydroxypropyl cellulose; PVP k 30: Polyvinyl pyrrolidone k 30; CMC-Na: Carboxymethylcellulose sodium; TW-80: Tween-80; TW-20: Tween-20; SDS: Sodium dodecyl sulfate; DOSS: Docusate sodium |
固定空间稳定剂含量为1%, 电荷稳定剂含量为0.5%, 紫杉醇含量为5%, 介质研磨法进行研磨, 制备紫杉醇纳米晶混悬液, 将混悬液放置在室温下, 以粒径和PDI为指标考察纳米晶在15天内的粒径稳定性, 筛选稳定剂。结果显示, PVP k 30/SDS的组合在0、5、10、15天的粒径分别为348.9、346.1、349.5、347.9 nm, 粒径无明显变化, PDI为0.153 ± 0.05, 分散性较好。HPC SL/SDS、TW-80/SDS作为稳定剂制备的混悬液较0天相比, 粒径分别增加了235和151.6 nm, 粒径不能保持相对稳定。综上, PVP k 30、SDS分别作为空间稳定剂和电荷稳定剂可有效阻止纳米药物颗粒的聚集, 使得纳米晶粒径保持相对稳定的状态。
3 不同粒径紫杉醇的形貌及大小结果显示, 紫杉醇纳米晶颗粒表现不同形态(图 1), 350 nm组为棒状粒子, 且表面较为光滑, 分布较为均匀; 800 nm组为细长杆状粒子, 但大小和均一性较差; 3 μm组也是细长杆状粒子, 且表面较为光滑, 分布较为均匀; 9 μm组是杆状粒子, 但分布较为无序。

|
Figure 1 Transmission electron microscope (TEM) images of paclitaxel nanocrystals. The results of paclitaxel of 350 nm (A), 800 nm (B), 3 μm (C), and 9 μm (D) were shown. Scale bar: 500 nm (A), 1 μm (B), 2 μm (C, D) |
不同紫杉醇混悬液(350 nm、800 nm、3 μm、9 μm) 测得的粒径大小、PDI和电位值如表 2所示。
| Table 2 Data on particle size, polydisperse index (PDI) and potential of paclitaxel suspension with different particle sizes |
通过Box-Behnen Design设计三因素三水平试验。因素X1 (泊洛沙姆407) 分别为17%、19%、21%; 因素X2 (泊洛沙姆188) 分别为1%、3%、5%; 因素X3 (卡波姆) 分别为0.1%、0.2%、0.3%。
采用Design-Expert 8.06软件对因变量与各响应值的关系进行多元线性回归拟合, 得多元线性回归方程Y = 85.97 - 2.94 X1 + 1.03 X2 - 0.75 X3, 多元线性回归拟合模型进行方差分析见表 3、4。模型拟合, P < 0.05表示具有统计学显著性意义, 模型拟合较好, 且失拟项(lack of fit) P > 0.05即失拟项不显著。考虑到患者给药的时间及夏季室温下的储存条件, 因此确定胶凝温度在33~35 ℃, 胶凝时间在60~90 s, 得出最优处方预测: X1 (泊洛沙姆407): 19%, X2 (泊洛沙姆188): 4%, X3 (卡波姆): 0.1%。
| Table 3 Design and results of Box-Behnen Design |
| Table 4 Analysis of variance and response surface regression model. **P < 0.01, ***P < 0.001 (statistically significant values at a 95% confidence level) |
采用场发射SEM观察凝胶形貌(图 2), 凝胶内部有大量三维多孔网状结构, 该结果为药物在体内的贮存和输送提供了结构基础。

|
Figure 2 TEM of paclitaxel thermosensitive gel (PTG). The results of PTG of 350 nm (A), 800 nm (B), 3 μm (C), and 9 μm (D) were shown. Scale bar: 100 μm (A, C), 10 μm (B, D) |
四种粒径的紫杉醇温敏凝胶黏度均在30~35 ℃范围内发生较大改变, 凝胶发生相变, 由溶液状变为半固体状, 直接表现为黏度上升。350 nm、800 nm、3 μm、9 μm紫杉醇温敏凝胶出现黏度突跃时的温度分别为33.9、33.0、32.4、32.1 ℃, 也反映了Box-Behnen Design模型拟合出的最优处方量满足紫杉醇温敏凝胶制备的需求。
5.3 流变学性质从流变学曲线可看出(图 3), 随温度升高, 储能模量G'和损耗模量G″都逐渐升高, 且G'变化速度明显大于G″, 说明随温度升高, 凝胶溶液逐渐从液体溶胶状态变为半固体水凝胶状态。当G'和G″相等时, 可知胶凝温度。350 nm、800 nm、3 μm、9 μm紫杉醇温敏凝胶的胶凝温度分别为32.31、32.32、32.29、32.26 ℃。当温度升至35 ℃, G'和G″均逐渐趋于稳定, 且G'大于G″, 凝胶可以半固体状态黏附在给药部位, 增加在局部的滞留时间。
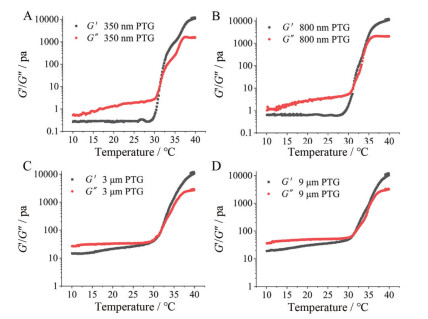
|
Figure 3 Rheological properties of PTG with different particle sizes. The results of PTG of 350 nm (A), 800 nm (B), 3 μm (C), and 9 μm (D) were shown |
质构仪测得的350 nm、800 nm、3 μm、9 μm紫杉醇温敏凝胶的黏附力分别为(456.34 ± 3.38)、(476.5 ± 7.08)、(647.04 ± 2.09)、(763.2 ± 0.46) gf·sec, 凝胶强度分别为(124.23 ± 10.15)、(127.84 ± 15.19)、(134.36 ± 10.89)、(141.65 ± 7.63) g·cm。随粒径的增大, 黏附性逐渐增大且凝胶强度也随之增大。
5.5 紫杉醇混悬液的体外释放不同粒径的紫杉醇混悬液体外释放行为(累积释放率) 如图 4所示, 350 nm组在30 min可达到88.86%, 800 nm组在60 min达到84.75%, 3 μm和9 μm组在180 min分别达到21.57%和16.80%。结果表明, 减小粒径可显著提高紫杉醇的释放速率。
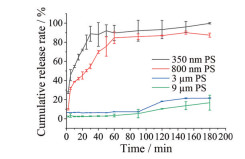
|
Figure 4 Cumulative release of paclitaxel suspension (PS) with different particle sizes (n = 3, |
紫杉醇温敏凝胶的释放和溶蚀行为如图 5所示, 350 nm组的释放速率最快, 4 h可达92.68%累积释放率; 800 nm组在4.5 h累积释放率为92.72%; 3 μm、9 μm组在5.5和7 h内的累积释放率分别为6.46%和4.01%, 凝胶完全溶蚀但药物未在介质中完全溶解。
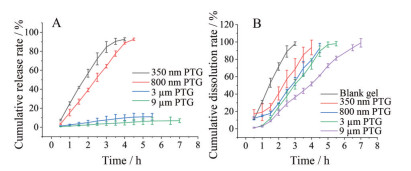
|
Figure 5 Cumulative release rate (A) and dissolution rate (B) of PTG with different particle sizes. n = 3, |
空白凝胶基质的溶蚀时长为3 h, 含药凝胶的溶蚀时间均大于空白凝胶。9 μm紫杉醇温敏凝胶的溶蚀时间最长, 7 h才能溶蚀完全; 350 nm组的温敏凝胶溶蚀时间最短, 为4 h; 800 nm、3 μm组的溶蚀时间介于两者之间。溶蚀时间的差异表明药物的加入显著影响凝胶的溶蚀过程, 且粒径大小会影响溶蚀速度。
350 nm、800 nm、3 μm、9 μm紫杉醇温敏凝胶溶蚀和紫杉醇释放的相关系数R2分别为0.912 9、0.967 5、0.974 8、0.972 4, 存在良好线性关系, 凝胶在溶蚀的同时也伴随着紫杉醇的释放。
6 紫杉醇温敏凝胶药代动力学研究 6.1 标准曲线用加权最小二乘法(W = 1/C2) 进行回归计算, 以紫杉醇浓度为横坐标, 紫杉醇峰面积与内标地西泮峰面积之比为纵坐标, 所得直线回归方程即为标准曲线: y = 0.000 2x - 0.002 (R2 = 0.998 2)。结果表明血浆在10~1 500 ng·mL-1有良好线性关系, 相关系数R2大于0.99。
6.2 专属性紫杉醇和内标地西泮溶液分析结果可知紫杉醇和地西泮的保留时间分别约为1.109和1.209 min。分别提取紫杉醇和内标的离子峰后进行分析, 内源性杂质和代谢产物不干扰测定。
6.3 紫杉醇温敏凝胶体内药动学紫杉醇温敏凝胶药代动力学研究结果如图 6, 达到最大吸收浓度的时间分别为: 350 nm组, (34.00 ± 4.90) h; 800 nm组, 96 h; 3 μm和9 μm组, (132.00 ± 20.08) 和(164.00 ± 23.60) h。达峰时间随粒径增大而延长, AUC0-t的变化也与粒径有明显相关性: 350 nm > 800 nm > 3 μm > 9 μm (表 5)。
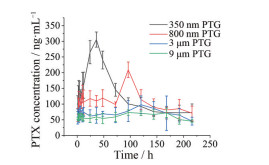
|
Figure 6 Concentration-time curve of PTG injected into the back of rats (n = 6, |
|
Table 5 Pharmacokinetic parameters of PTG injected into the back of rats. n = 6, |
温敏凝胶可随环境温度改变而使自身状态发生改变, 这种特殊优势可延长药物在体内的停留时间, 使局部的药物浓度增高, 提高生物利用度, 实现在疾病发生部位直接给药, 拓展了药物的应用范围, 具有很好临床应用前景。本研究分别获得了350 nm、800 nm、3 μm、9 μm的紫杉醇, 体外释放实验结果表明粒径是影响药物释放行为的关键因素, 350 nm和800 nm紫杉醇在介质中的释放速度显著快于3 μm和9 μm组。药物粒径越小其暴露于介质中的比表面积越大, 因而加速了溶解, 也说明通过介质研磨和高压均质得到的紫杉醇混悬液显著提高了紫杉醇在介质中的释放速率。紫杉醇温敏凝胶的溶蚀与释放也存在良好线性关系, 温敏凝胶中紫杉醇的释放主要是通过凝胶的溶蚀来实现, 高含水量的凝胶基质在介质中逐渐溶蚀, 同时束缚在凝胶三维网状结构中的药物随之释放到介质中, 而紫杉醇的释放速率主要是由粒径决定。在相同时间内, 随粒径增大, 凝胶的溶蚀率逐渐减小, 结合凝胶强度结果也可看出这是由于小粒径的紫杉醇温敏凝胶的凝胶强度较小, 在同一时间受到释放介质的侵蚀加快; 另一方面, 紫杉醇粒径越大, 越能形成更为牢固的立体网状结构。随凝胶的溶蚀, 小粒径紫杉醇扩散到介质中完全溶解释放, 而大粒径紫杉醇由于自身溶解度的限制, 在凝胶溶蚀的同时, 只将紫杉醇扩散到介质中而无法完全溶解。
由于粒径大小不同而引起的释放速度差异在体内药代动力学实验中也有类似的结果, 紫杉醇在大鼠体内达到Cmax的时间由快到慢分别是350 nm、800 nm、3 μm、9 μm, 350 nm紫杉醇温敏凝胶达到最大血药浓度的时间为(34.00 ± 4.90) h, 而市售紫杉醇注射达到最大血药浓度的时间仅为10 min[21]。紫杉醇注射液进入大鼠体内后血浆中的紫杉醇浓度呈快速下降趋势, 在体内的消除半衰期较短, 只有3.7 h, 相较而言, 350 nm紫杉醇温敏凝胶可在局部滞留更长时间, 形成药物储库缓慢释放药物。结果显示AUC0-t也呈同样变化趋势, 更进一步佐证粒径越小释放得越快。一方面是由于350 nm紫杉醇和9 μm紫杉醇相比, 粒径减小增大了药物颗粒的表面积, 使溶出速率加快, 达到最大吸收浓度的时间加快; 另一方面是由于9 μm紫杉醇温敏凝胶药物颗粒较大, 形成了更牢固的三维网状结构, 黏度更大, 所以在局部的滞留时间更长, 达峰时间也越长。此外, 由于粒径的减小, 释放速率加快, 紫杉醇以纳米晶颗粒存在进入血液循环的量也相应增加。
黏度和流变学性质的结果也证明了紫杉醇温敏凝胶在30~35 ℃时可发生相变, 既能使紫杉醇温敏凝胶在室温下是流动状态, 方便给药, 也有利于药物的储存和运输。良好的黏附性和凝胶强度使得紫杉醇温敏凝胶可滞留在肿瘤切除后的手术腔内, 通过局部给药达到杀死残留癌细胞的目的, 进一步提高乳腺癌、卵巢癌等术后辅助治疗疗效, 从而降低癌症复发率和病死率。
作者贡献: 范冉冉是本研究的实验设计者和实验研究的执行人, 完成数据分析、论文初稿的写作; 王增明参与实验设计和结果分析; 张慧、李见春、郑爱萍是项目构思者及负责人, 指导实验设计、数据分析、论文写作与修改。全体作者都阅读并同意最终的文本。
利益冲突: 所有作者均声明不存在任何利益冲突。
| [1] |
Chen Q, Wang C, Zhang X, et al. In situ sprayed bioresponsive immunotherapeutic gel for post-surgical cancer treatment[J]. Nat Nanotechnol, 2019, 14: 89-97. DOI:10.1038/s41565-018-0319-4 |
| [2] |
Fan YY, Yu DJ, Li D, et al. Prevention of local tumor recurrence after surgery by thermosensitive gel‐based chemo photothermal therapy in mice[J]. Lasers Surg Med, 2020, 2: 682-691. |
| [3] |
Kong X, Cheng R, Wang J, et al. Nanomedicines inhibiting tumor metastasis and recurrence and their clinical applications[J]. Nano Today, 2021, 36: 101004. DOI:10.1016/j.nantod.2020.101004 |
| [4] |
Tellini R, Antonelli A, Tardanico R, et al. Positive surgical margins predict progression-free survival after nephron-sparing surgery for renal cell carcinoma: results from a single center cohort of 459 cases with a minimum follow-up of 5 years[J]. Clin Genitourin Cancer, 2018, 17: e26-e31. |
| [5] |
Omtvedt LA, Kristiansen KA, Strand WI, et al. Alginate hydrogels functionalized with β-cyclodextrin as a local paclitaxel delivery system[J]. J Biomed Mater Res A, 2021, 109: 2625-2639. DOI:10.1002/jbm.a.37255 |
| [6] |
Bialik M, Kuras M, Sobczak M, et al. Achievements in thermosensitive gelling systems for rectal administration[J]. Int J Mol Sci, 2021, 22: 5500. DOI:10.3390/ijms22115500 |
| [7] |
Rosseto HC, de Toledo LAS, Said dos Santos R, et al. Design of propolis-loaded film forming systems for topical administration: the effect of acrylic acid derivative polymers[J]. J Mol Liq, 2021, 322: 114514. DOI:10.1016/j.molliq.2020.114514 |
| [8] |
Wu J, Qu Y, Shi K, et al. Camptothecin @HMSNs/thermosensitive hydrogel composite for applications in preventing local breast cancer recurrence[J]. Chin Chem Lett, 2018, 29: 1819-1823. DOI:10.1016/j.cclet.2018.10.004 |
| [9] |
Karpuz M, Dogan A, Nemutlu E, et al. Simultaneous quantification of paclitaxel and vinorelbine encapsulated in the ranostic nanosized liposomes[J]. J Anal Chem, 2021, 76: 742-748. DOI:10.1134/S1061934821060034 |
| [10] |
Xu J, Meng LH, Qing C. The clinical application and development of traditional antitumor drugs[J]. Acta Pharm Sin (药学学报), 2021, 56: 1551-1561. |
| [11] |
Wolinsky JB, Colson YL, Grinstaff MW. Local drug delivery strategies for cancer treatment: gels, nanoparticles, polymeric films, rods, and wafers[J]. J Control Release, 2012, 159: 14-26. DOI:10.1016/j.jconrel.2011.11.031 |
| [12] |
Park J, Sun B, Yeo Y. Albumin-coated nanocrystals for carrier-free delivery of paclitaxel[J]. J Control Release, 2017, 263: 90-101. DOI:10.1016/j.jconrel.2016.12.040 |
| [13] |
Liu J, Da L, Ha F. Understanding the structure and stability of paclitaxel nanocrystals[J]. Int J Pharm, 2010, 390: 242-249. DOI:10.1016/j.ijpharm.2010.02.013 |
| [14] |
Kawano Y, Shimizu Y, Hanawa T. Testing a benchtop wet-milling method for preparing nanoparticles and suspensions as hospital formulations[J]. Pharmaceutics, 2021, 13: 482. DOI:10.3390/pharmaceutics13040482 |
| [15] |
Tanaka Y, Inkyo M, Yumoto R, et al. Nanoparticulation of poorly water soluble drugs using a wet-mill process and physicochemical properties of the nanopowders[J]. Chem Pharm Bull (Tokyo), 2009, 57: 1050-1057. DOI:10.1248/cpb.57.1050 |
| [16] |
Merisko-Liversidge E, Liversidge GG. Nanosizing for oral and parenteral drug delivery: a perspective on formulating poorly-water soluble compounds using wet media milling technology[J]. Adv Drug Deliv Rev, 2011, 63: 427-440. DOI:10.1016/j.addr.2010.12.007 |
| [17] |
Van Eerdenbrugh B, Van den Mooter G, Augustijns P. Top-down production of drug nanocrystals: nanosuspension stabilization, miniaturization and transformation into solid products[J]. Int J Pharm, 2008, 364: 64-75. DOI:10.1016/j.ijpharm.2008.07.023 |
| [18] |
Al Sabbagh C, Seguin J, Agapova E, et al. Thermosensitive hydrogels for local delivery of 5-fluorouracil as neoadjuvant or adjuvant therapy in colorectal cancer[J]. Eur J Pharm Biopharm, 2020, 157: 154-164. DOI:10.1016/j.ejpb.2020.10.011 |
| [19] |
Liu ZX, Liu XW, Luo MY, et al. Preparation of 5-aminosalicylic acid thermosensitive gel and its properties in vivo and in vitro[J]. Mil Med J South China (华南国防医学杂志), 2019, 33: 663-668. |
| [20] |
Wei LS. Preparation and Antitumor Study of Paclitaxel Nanocrystals (紫杉醇纳米晶体的制备及抗肿瘤研究) [D]. Beijing: Academy of Military Medical Sciences, 2014.
|
| [21] |
Li F, Li L, Wang S, et al. Improved dissolution and oral absorption by co-grinding active drug probucol and ternary stabilizers mixtures with planetary beads-milling method[J]. Asian J Pharm Sci, 2019, 14: 649-657. DOI:10.1016/j.ajps.2018.12.001 |
| [22] |
Liu H, Han X, Li H, et al. Wettability and contact angle affect precorneal retention and pharmacodynamics behavior of microspheres[J]. Drug Deliv, 2021, 28: 2011-2023. DOI:10.1080/10717544.2021.1981493 |
 2022, Vol. 57
2022, Vol. 57


