2. 军事科学院军事医学研究院毒物药物研究所, 北京 100850
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China
黄体酮(progesterone) 是一种由肾上腺皮质、性腺、中枢神经系统和外周神经系统分泌的类固醇激素[1], 为黄体支持的首选药物, 结构见图 1。目前黄体酮在临床上常用的给药方式为肌肉注射, 注射液的溶媒为注射用油。根据适应症的不同, 患者每日需给药1~2次, 用药周期长达几周甚至数月。频繁的给药及相应的肌肉刺激给患者带来一定的痛苦, 大大降低了患者的顺应性。
|
Figure 1 Chemical structure of progesterone |
瑞士Ferring公司研发了一种新颖的混悬型黄体酮缓释注射剂Prosphere, 首次在墨西哥上市。该制剂的溶媒为水性基质, 颗粒为球形纯药微晶, 粒径分布均一, 给药周期为7天, 具有良好的缓释效果[2]。与一般黄体酮注射剂相比, 该制剂有着延长药物作用时间、降低给药频率、减少药物不良反应及提高患者依从性等特点。目前, 该产品尚未进口中国, 国内亦无仿制产品。
药代动力学是评价和筛选药物剂型的有效指标, 它贯穿于药物研发的全过程, 为临床合理用药提供科学依据, 保证用药的安全性[3]。高效液相色谱串联质谱法(LC-MS/MS) 作为一种特异性强、灵敏度高、分析速度快的生物样品分析方法[4], 已成为近年来生物样品定量分析的金标准。
因此, 为全面深入了解Prosphere的用药效果及体内释药行为, 本研究选用Beagle犬进行其药代动力学研究, 并建立了一种可靠、快速和灵敏的LC-MS/MS方法, 测定Beagle犬血浆中黄体酮浓度。将该方法应用于黄体酮缓释注射剂在Beagle犬体内的药代动力学研究, 为黄体酮缓释制剂的后续研究提供参考。
材料与方法药品与试剂 黄体酮标准品(纯度99.6%, 批号100027-201810)、醋酸甲地孕酮标准品(内标, 纯度99.0%, 批号100171-202105) (中国食品药品检定研究院); 黄体酮缓释微球注射液(Prosphere, 批号I 1801158, 规格200 mg·mL-1, 瑞士Ferring公司); 乙腈(HPLC级, Fisher Chemical公司); 甲酸铵(分析纯)、甲酸(HPLC级) (国药集团化学试剂有限公司)。
实验动物 Beagle犬, 3只, 雄性, 体重(8 ± 1) kg, 年龄约1.0~2.0岁, 购自北京玛斯生物技术有限公司, 许可证号SCXK (京) 2016-0001, 由军事医学研究院动物中心一级动物房饲养。本研究动物实验方案已获得军事医学研究院动物伦理委员会的批准。
仪器 Agilent 1200型高效液相色谱仪、Agilent G6460型三重四极杆液质联用仪、Agilent LC/MS QQQ质谱工作站(美国安捷伦公司); Sigma 1-14高速离心机(美国Sigma公司); VORTEX genie-2涡旋仪(美国Scientific Industries公司); BP211D型电子天平(德国Sartorius公司); WinNonlin 8.1统计计算软件(美国Pharsight公司)。
色谱条件 色谱柱: CAPCELL PAK C18 column (2.7 μm × 2.0 mm × 50 mm); 流动相为乙腈溶液A (含0.1%甲酸)-10 mmol·L-1甲酸铵水溶液B (含0.1%甲酸), 梯度洗脱, 洗脱程序见表 1; 柱温为30 ℃; 流速为0.35 mL·min-1; 进样量为5 μL。
| Table 1 Mobile phase gradient elution conditions. A: Acetonitrile solution (containing 0.1% formic acid); B: Ammonium formate solution (10 mmol·L-1, containing 0.1% formic acid) |
质谱条件 离子源为ESI; 多反应监测(MRM) 模式; 离子极性: 正离子; 离子反应: 黄体酮m/z 315.2→97.0, 碎裂电压145 V, 碰撞能量25 V; 内标醋酸甲地孕酮m/z 385.2→267.1, 碎裂电压120 V, 碰撞能量16 V; 干燥气流速: 10 L·min-1; 干燥气温度: 350 ℃; 雾化室压力40 psi; 毛细管电压: 4 000 V。
标准溶液、质控溶液和内标溶液配制 精密称取2份黄体酮标准品和1份醋酸甲地孕酮标准品, 分别加乙腈溶解并稀释成10 mg·mL-1的储备液, 分别用于配制黄体酮标准系列溶液、质控溶液和内标工作液。用乙腈稀释黄体酮储备液, 配制浓度为0.1、1、5、10、20、50、100、200、500 ng·mL-1的标准系列溶液以及0.1、0.2、80、400 ng·mL-1的定量下限、质控溶液。用乙腈稀释内标储备液, 配制浓度为300 ng·mL-1的内标溶液, 备用。
血浆样品处理 取50 μL血浆样品, 加入50 μL内标溶液(300 ng·mL-1), 再加入400 μL乙腈, 涡旋1 min混匀, 13 000 r·min-1离心15 min后取300 μL上清液于离心管内, 相同离心条件进行2次离心, 取上清液待检测分析。
方法学考察专属性 取不同Beagle犬空白血浆作为基质, 按“血浆样品处理”项下操作, 制备空白血浆混内标、空白血浆混标准溶液样品。同样按“血浆样品处理”项下操作, 制备Beagle犬肌注给药后的血浆样品。将各样品进行LC-MS/MS分析, 记录图谱。
基质效应 取Beagle犬的空白血浆50 μL, 按“血浆样品处理”项下操作, 在二次离心前, 分别加入50 μL的低、高浓度的质控溶液及内标溶液, 涡旋混匀后, 进行二次离心, 取上清进行LC-MS/MS分析。每个浓度配制6份样品(不同来源Beagle犬血浆), 计算黄体酮与内标物的峰面积比A。以乙腈代替空白血浆, 配制上述相同浓度的含有黄体酮及内标物的纯溶液样品, 进行LC-MS/MS分析, 每个浓度配制6份样品, 计算黄体酮与内标物的峰面积比B。两者峰面积比的比值即为基质效应值。
标准曲线与定量下限 取空白血浆50 μL, 分别加入标准系列溶液及内标溶液50 μL, 按“血浆样品处理”项下操作, 进行LC-MS/MS分析。以黄体酮的浓度为横坐标, 黄体酮与内标物峰面积比值为纵坐标, 使用最小二乘法进行线性回归运算, 得到标准曲线, 标准曲线的最低点即为定量下限。
准确度与精密度 按“血浆样品处理”项下操作, 分别制备定量下限和低、中、高浓度质控样品, 每个浓度配制5份样品, 共3批, 连续3 d进行分析检测, 并随行测定标准曲线。由标准曲线计算出各样品浓度, 考察方法的准确度与精密度。
样品稳定性考察 考察低、高浓度质控样品在各条件下的稳定性, 包括室温放置12 h、-20 ℃反复冻融3次、-20 ℃放置60 d。计算测得浓度与标示浓度的偏差。
提取回收率 按“血浆样品处理”项下操作, 分别制备低、中、高浓度质控样品, 每个浓度配制6份样品, 计算黄体酮与内标物的峰面积比C。另取空白血浆50 μL, 预处理后, 在二次离心前, 分别加入50 μL的低、中、高浓度的质控溶液及内标溶液, 涡旋混匀后, 进行二次离心, 取上清进行LC-MS/MS分析, 每个浓度配制6份样品, 计算黄体酮与内标物的峰面积比D。两者峰面积比的比值即为提取回收率。
稀释可靠性 制备定量上限(500 ng·mL-1) 血浆样品, 用空白血浆稀释10倍后, 按“血浆样品处理”项下操作, 进行LC-MS/MS分析, 平行测定5份, 考察稀释的可靠性。
黄体酮缓释制剂的药代动力学试验设计及样品采集 选择体重相近的Beagle犬(n = 3) 在标准实验环境下, 给药前一晚禁食, 自由进水。在犬大腿右侧肌肉注射Prosphere 1 mL (约含黄体酮100 mg), 分别于给药后15 min、30 min、1 h、2 h、4 h、6 h、8 h、12 h、24 h、2 d、3 d、5 d、7 d、9 d、12 d、15 d, 于四肢静脉交替采血1 mL于抗凝管中, 6 000 r·min-1离心10 min, 提取血浆, 于-20 ℃存放待检测。
样品检测及数据处理 将采集好的血样按“血浆样品处理”项下操作, 进行LC-MS/MS分析, 记录结果, 计算各取样时间点的血药浓度。
统计学分析 采用WinNonlin 8.1软件以非房室模型对数据进行处理和统计学分析, 数据以
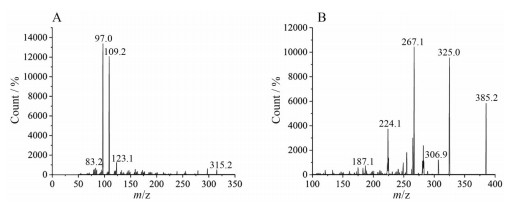
以上述质谱条件分析得到待测物黄体酮及内标醋酸甲地孕酮的产物离子扫描图见图 2。
|
Figure 2 Production mass spectra of progesterone (A) and megestrol acetate (internal standard, IS) (B) |
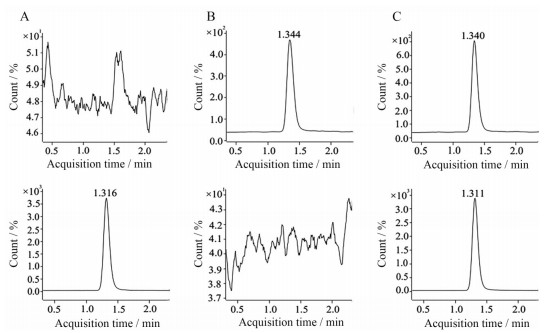
结果显示, 在该测定条件下, 黄体酮和内标物的保留时间分别为1.344 min和1.311 min左右, 在测定时间内, 血浆中药物及内标物之间无相互干扰, 相应图谱见图 3。
|
Figure 3 Representative multiple-reaction monitoring (MRM) chromatograms of progesterone (1.344 min), megestrol acetate (IS) (1.311 min). A: Blank plasma mixed IS sample; B: Blank plasma mixed standard solution sample; C: Plasma sample collected at 6 h after administration |
结果表明, 低、高质控样品的基质效应在93.03%~95.81%之间, RSD在2.94%~6.23%之间, 黄体酮和内标在Beagle犬血浆中不存在离子抑制或增强现象, 符合有关生物样品分析方法验证的要求[5, 6]。
2.3 标准曲线与定量下限在0.1~500.0 ng·mL-1内, 黄体酮的线性关系良好, 标准曲线的线性回归方程为y = 0.001 1 x + 0.015 9 (r2 = 0.998 9), 定量下限为0.1 ng·mL-1。
2.4 准确度与精密度结果见表 2。定量下限样品的批内、批间精密度(RSD) 分别为7.30%、13.25%, 准确度(RE) 为8.92%; 低、中、高质控样品的批内、批间精密度(RSD) 分别在4.95%~6.08%、0.12%~8.28%之间, 准确度(RE) 在0.83%~4.85%之间, 符合生物样品分析有关要求。
| Table 2 Precision and accuracy for the analysis of progesterone in dog plasma. RSD: Relative standard deviation; RE: Relative error |
结果见表 3, 低、高浓度质控样品在室温放置12 h、-20 ℃反复冻融3次、-20 ℃放置60 d的储存条件下, 稳定性良好。
| Table 3 Stability of progesterone in dog plasma |
结果表明, 低、中、高3种质控样品的提取回收率分别为71.43%、77.97%和72.08%, 各浓度血浆样品的提取回收率之间差异较小。
2.7 稀释可靠性稀释10倍后的血样样品的准确度(RE) 在-3.91%~2.51%之间, 精密度(RSD) 为2.66%。结果表明, 血浆样品稀释后进行分析, 不影响样品测定结果的准确度和精密度。
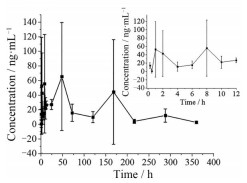
3 药代动力学研究以建立好的分析方法对肌注黄体酮缓释微球的Beagle犬的血样进行检测, 其平均血药浓度-时间曲线见图 4。用WinNonlin 8.1软件进行非房室模型分析, 相应的药代动力学参数见表 4。结果表明, 黄体酮缓释微球在Beagle犬体内可缓慢释放, Cmax为137.72 ± 11.59 ng·mL-1, t1/2为83.83 ± 26.43 h, tmax为19.00 ± 25.36 h。
|
Figure 4 Mean plasma concentration-time profile of progesterone after intramuscular injection of progesterone sustained release microspheres in Beagle dogs |
| Table 4 The pharmacokinetic parameters of progesterone after intramuscular injection of progesterone sustained release microspheres in Beagle dogs |
黄体酮为弱碱性药物, 甲酸的加入可酸化黄体酮, 促进其离子化[7], 在增强其响应、提高灵敏度的同时, 可一定程度地减少基质效应的影响[8]; 由于甲酸易挥发, 甲酸铵缓冲液的加入可防止因流动相中酸的挥发所引起的色谱行为的改变, 有效改善待测物的峰形。因此, 本方法采用乙腈溶液(含0.1%甲酸)-10 mmol·L-1甲酸铵水溶液(含0.1%甲酸) 为流动相。以梯度洗脱的方式, 有效改善了峰的拖尾现象, 且使每个样品在3 min内即可完成分析, 大大减少了分析测定时间, 适用于大批量血浆样品的测定。正离子的检测模式适用于碱性样品的检测, 因此, 本方法采用正离子检测模式对血浆样品中的黄体酮进行测定。
在进行体内药代动力学研究的过程中, 样品处理是必不可少的步骤, 其影响方法的分析速度、准确性及灵敏度[9]。本研究以乙腈为蛋白沉淀剂, 体积比为1∶9, 对血浆进行蛋白沉淀。结果显示该方法可有效去除血浆中的大部分蛋白, 减少基质效应的产生, 且该处理方式操作简便快速、成本低廉, 适合批量操作。对蛋白沉淀且离心后的上清溶液进行二次离心, 可最大程度减少样品对仪器的污染。
黄体酮的适用人群主要为女性, 原则上应选择雌性Beagle犬进行药物体内药代动力学的研究, 但作为内源性药物, 雌性Beagle犬体内黄体酮浓度随生理周期和时辰做周期性波动, 变化幅度大, 且雌性Beagle犬体内黄体酮个体间差异也较大。为准确了解黄体酮缓释微球在体内的释药行为, 本研究选择黄体酮本底更低的雄性Beagle犬进行研究, 以减少重要的非实验因素对结果的影响。
本研究中所用制剂为黄体酮缓释制剂, 给药周期为7天, 规格为每支200 mg。考虑到Beagle犬与人体对药物吸收的差异性, 以及考察制剂给药后在体内吸收的全过程, 给予每只犬半支制剂(1 mL, 100 mg), 并以15天为1个采血周期, 进行黄体酮缓释微球的Beagle犬体内药动学研究。
应用LC-MS/MS法对Beagle犬肌注黄体酮缓释微球制剂后的血药浓度进行测定, 结果表明, 在取样的15天中, 注射入Beagle犬体内的黄体酮缓释微球持续释放药物, 维持体内黄体酮血药浓度在一定水平。平均血药浓度-时间曲线(图 4) 显示, 药物呈多峰谷波动, 表明该制剂在Beagle犬体内具有多次连续吸收的过程, 其波动趋势与黄体酮相关文献[10-12]中所报道的相似, 与该制剂专利[13]中所列出的药时曲线的波动趋势相吻合。微球在注射入肌肉组织后, 小粒径微球迅速被肌肉组织中丰富的血流溶解并吸收[14], 而粒径较大的微球则在注射部位形成药物储库, 缓慢溶解、扩散、吸收, 维持血液中黄体酮的浓度在较高水平, 从而达到缓释效果。
以非房室模型计算得出该缓释制剂的Cmax为137.72 ± 11.59 ng·mL-1、tmax为19.00 ± 25.36 h, 但由于该药时曲线波动趋势较为特殊, 推算出的数值仅能作为部分参考[10]。从图 3中, 可估算出该制剂tmax为48 h, Cmax为65.55 ng·mL-1。据文献[15, 16]报道, 部分动物的黄体酮的有效治疗血药浓度为2~5 ng·mL-1。在本研究中, 微球在注射入组织后, 黄体酮血药浓度迅速达到5 ng·mL-1以上, 且在后续释药过程中, 浓度水平也基本波动在该有效范围之上, 表明该微球制剂在缓释的同时也可保证药物的有效性。
本研究使用3只雄性Beagle犬, 结果显示, 血药浓度存在较大的个体差异性。当某一药物的个体内变异系数CV ≥ 30%时即为高变异药物, 黄体酮属于常见的高变异药物。因此, 对于该类药物的个体差异性结果在不影响临床药效和安全性影响不大的情况下, 可适当放宽接受范围[17, 18]。由于雄性Beagle犬自身存在一定浓度的内源性黄体酮, 因此, 血药浓度在达到最大值之后, 虽在缓慢降低, 但也并未能达到完全消除。为客观评价药物体内浓度, 应设立空白对照组, 与给药犬在同时间进行血样的采集, 来评估由于外源性即制剂引起的体内黄体酮药物浓度的变化。
随着我国生育政策的逐步放开, 高龄产妇显著增加, 黄体酮是治疗先兆流产及体外受精-胚胎着床的必备药物, 通常, 这些适应症需要高剂量和长期服用黄体酮进行治疗。因此, 研发高效缓释的黄体酮制剂尤为重要。本研究对墨西哥上市的黄体酮缓释微球注射液Prosphere进行了Beagle犬药代动力学研究, 深入了解该制剂的体内释药行为, 并成功开发一种专属性强、灵敏度高、准确性好的LC-MS/MS分析方法, 可有效检测Beagle犬体内黄体酮的血药浓度, 为今后黄体酮相关缓释制剂的研发提供了新的方法及评价依据。
作者贡献: 王玥负责设计实验、实验操作、数据分析、文章撰写和返修; 程艺负责动物实验血浆样品采集; 张慧和郑爱萍提供了实验平台、文章选题设计和文章质量的把关和校审。
利益冲突: 所有作者声明无任何利益冲突。
| [1] |
Goletiani NV, Keith DR, Gorsky SJ. Progesterone: review of safety for clinical studies[J]. Exp Clin Psychopharmacol, 2007, 15: 427-444. DOI:10.1037/1064-1297.15.5.427 |
| [2] |
Roberto BE, Manuel CB, Rosalba AC, et al. Observational study of the local tolerability of injectable progesterone microspheres[J]. Gynecol Obstet Invest, 2012, 73: 124-129. DOI:10.1159/000330711 |
| [3] |
Li JL, Cui MX, Zhang ZQ, et al. The significance and role of pharmacokinetics in drug development[J]. Pharm J Chin PLA (解放军药学学报), 2010, 26: 258-261. |
| [4] |
Koal T, Schmiederer D, Hai PT, et al. Standardized LC-MS/MS based steroid hormone profile-analysis[J]. J Steroid Biochem Mol Biol, 2012, 129: 129-138. DOI:10.1016/j.jsbmb.2011.12.001 |
| [5] |
National Food and Drug Administration. Technical Guide-lines for Nonpharmacologic Pharmacokinetics of Drugs (药物非临床药代动力学研究技术指导原则) [S]. CFDA, 2014 [2020-05-21]. https://wenku.baidu.com/view/3314aaadcad376eeaeaad1f34693daef5ef71320.html.
|
| [6] |
Chinese Pharmacopoeia Commission. Guiding Principles for Quantitative Analysis of Biological Samples (生物样品定量分析方法验证指导原则) [S]//Chinese Pharmacopoeia (中国药典), 2020 Ed. Beijing: China Medical Science and Technology Press, 2020.
|
| [7] |
Gu TT, Zhao WH, Gao XL. LC-MS/MS determination of progesterone in Beagle plasma and its Pharmacokinetics[J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 6-12. |
| [8] |
Yao MK, Ma BL, Ma YM. Overview of the matrix effects in quantitative liquid chromatography/mass spectrometry analysis of biological samples[J]. Chin J Pharm Anal (药物分析杂志), 2010, 30: 2436-2440. |
| [9] |
Dong JC, Zeng LL, Wang X, et al. Progress on application of biological sample pretreatment technology in pharmacokinetic research[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2018, 29: 110-117. |
| [10] |
Tuleu C, Newton M, Rose J, et al. Comparative bioavailability study in dogs of a self-emulsifying formulation of progesterone presented in a pellet and liquid form compared with an aqueous suspension of progesterone[J]. J Pharm Sci, 2004, 93: 1495-1502. DOI:10.1002/jps.20068 |
| [11] |
Salem HF. Sustained-release progesterone nanosuspension following intramuscular injection in ovariectomized rats[J]. Int J Nanomedicine, 2010, 5: 943-954. |
| [12] |
Li L, Li W, Sun J, et al. Preparation and evaluation of progesterone nanocrystals to decrease muscle irritation and improve bioavailability[J]. AAPS PharmSciTech, 2018, 19: 1254-1263. DOI:10.1208/s12249-017-0938-3 |
| [13] |
Jones GF, Lola LS, Jones GP, et al. Preparation method of pharmaceutical composition for parenteral injection: CN, 91104859.6 [P]. 2000-07-28.
|
| [14] |
Pu C, Qiao W, Zhang H, et al. In vitro-in vivo relationship of amorphous insoluble API (progesterone) in PLGA microspheres[J]. Pharm Res, 2017, 34: 2787-2797. DOI:10.1007/s11095-017-2258-4 |
| [15] |
Jameela SR, Kumary TV, Lal AV, et al. Progesterone-loaded chitosan microspheres: a long acting biodegradable controlled delivery system[J]. J Control Release, 1998, 52: 17-24. DOI:10.1016/S0168-3659(97)00187-9 |
| [16] |
Deluca PP, Mehta RC, Hausberger AG, et al. Biodegradable Polyesters for Drug and Polypeptide Delivery[M]. Washington, DC: ACS Symposium Series American Chemical Society, 1993: 53-79.
|
| [17] |
He CY, Sun H, Xie HT. Bioequivalence test and quantitative evaluation of highly variable drugs[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2016, 21: 721-730. |
| [18] |
Zhu FC, Wang AG, Han F, et al. Investigation of FDA issued guidance for Bioequivalence Recommendations for Specific Products related with high variable drugs[J]. Chin J Drug Eval (中国药物评价), 2016, 33: 397-401. |
 2022, Vol. 57
2022, Vol. 57


