2. 福建农林大学动物科学学院, 福建 福州 350000;
3. 上海中医药大学教学实验中心, 上海 200120
2. College of Animal Sciences, Fujian Agriculture and Forestry University, Fuzhou 350000, China;
3. Teaching Experiment Center of Shanghai University of Traditional Chinese Medicine, Shanghai 200120, China
间歇性禁食(intermittent fasting, IF) 是一种交替进行禁食和摄食的方式, 它被证明可以有效减轻体重[1], 促进新陈代谢、改善身体健康及延长寿命[2]。在2020年, 根据国际食品信息理事会的调查发现, IF是18~80岁美国人中最常被提及的饮食模式。它可以以各种不同的形式进行, 常见的禁食方式包括隔天禁食(24 h)、每周禁食2天或者限时禁食等[3]。目前已有许多研究一致表明, IF在动物模型上对一系列慢性疾病(肥胖[1]、心血管疾病[4]、癌症[5]和神经退行性疾病[6]等) 具有强大的改善作用。目前IF发挥功能的原因尚不清楚, 但有研究报道它可以显著影响对机体的代谢。IF造成的饮食变化会第一时间改变机体自身肠道微生物的组成[7, 8], 而肠道是哺乳动物体内重要的代谢“器官”, 影响着宿主的整体代谢[9]。Li等[1]通过对盲肠内容物进行代谢组学研究发现间歇性禁食可以通过改变肠道微生物来源的代谢物诱导白色脂肪褐变, 从而改善小鼠的代谢紊乱; Liu等[10]发现间歇性禁食可以重建肠道中微生物和代谢物稳态, 调节与认知功能相关代谢物(如3-吲哚乙酸、短链脂肪酸、牛磺熊去氧胆酸等) 的含量, 从而改善2型糖尿病引起的认知功能障碍; Shi等[4]发现间歇性禁食通过调节肠道微生物稳态, 影响肠道及血液中胆汁酸水平, 从而改善高血压。因此, IF引起的代谢水平改变可能会是其发挥功效的关键因素之一, 但是目前主流的研究没有将目光聚焦在正常情况下禁食带来的影响。IF作为一种饮食方式, 对于正常人的影响也是非常值得关注的。本研究将聚焦于IF对正常小鼠代谢的影响。
代谢组学是研究生物体中所有代谢产物变化规律的一门科学。它是一个从微观到宏观的传声工具, 揭示生物体不同状态下的代谢产物变化规律, 对于发现疾病的生物标志物、研究疾病机制、药物毒理学、药效机制等是一种有效且科学的手段。目前代谢组学技术已经广泛地应用于间歇性禁食的相关研究中, 并且与肠道微生物和相关代谢产物密切相关[1, 4, 10]。本研究将以代谢组学技术为基础, 通过检测小鼠粪便代谢物探讨在正常生理情况下不同的间歇性禁食时间对小鼠代谢的影响, 为临床IF的治疗相关疾病提供实验基础和理论依据。
材料与方法试剂与材料 实验采用的甲醇、乙腈、异丙醇、甲酸和醋酸均为色谱级, 购自Thermo Fisher公司; 三氯甲烷为分析级, 购自中国国药化学试剂有限公司; 去离子水通过Milli-Q Academic System制备获得。
动物实验 实验方案经上海中医药大学实验动物中心福利与伦理委员会审查(批准号: PZSHUTCM200731016), 符合实验动物福利与伦理相关规范。研究采用C57BL/6J小鼠(雄性, 8周龄, 北京维通利华实验动物技术有限公司), 在上海中医药大学实验动物中心饲养, 自由饮食饮水。实验条件稳定, 温度22 ± 1 ℃, 湿度55% ± 5%, 光/暗周期12 h/12 h。
小鼠适应性喂养3天后, 随机分为空白组(control, CON) 和间歇性禁食组(control + IF, CF), 每组8只。实验采用隔日禁食法进行间歇性禁食, 即小鼠每隔一天剥夺食物24 h, 并在接下来的24 h进行随意饮食, 实验共持续10周。实验过程中每周记录小鼠体重、食物摄入量和饮水量, 并在实验进行至第5周和第10周时测定小鼠空腹血糖并收集粪便。第10周实验结束后, 将小鼠麻醉处死。
粪便样本预处理方法 称取0.04 g粪便样本, 加入50%乙腈(含内标200 μg·mL-1) 1 mL, 涡旋混匀, 4 ℃静置2 h以便更好地提取小分子代谢物。样本在4 ℃下以12 000 ×g离心15 min, 取上清液于离心管中用N2吹干, 加入200 μL 50%乙腈复溶, 涡旋30 s, 样本在4 ℃下12 000 ×g离心15 min, 取上清液100 μL至液相小瓶中进行分析。所有样品另取上清液20 μL混合成质量控制样品(quality control, QC), 用于后续上机检测。
粪便代谢组学色谱质谱条件 使用液相色谱-飞行时间质谱仪(Shimadzu Nexera System HPLC & SCIEX TripleTOF 6600) (美国SCIEX公司) 通过信息依赖型扫描(information-dependent acquisition, IDA) 模式进行高分辨质谱数据采集。数据采集软件Analyst TF 1.8依据一级质谱数据和预先设定的标准, 自动选择离子并采集其二级质谱数据。每个循环选取强度前8的母离子进行二级质谱扫描, 碎片碰撞能为40 V, 循环时间为0.05 s。离子源参数如下: GS1: 0.38 MPa, GS2: 0.38 MPa, CUR: 0.24 MPa, TEM: 500 ℃, DP: 80 V, ISVF: 正离子5 500 V、负离子-4 500 V。一级母离子扫描范围为80~1 200 m/z, 二级子离子扫描范围为50~1 200 m/z。色谱柱采用Waters Acquity UPLC HSST 3 column (100 mm × 2.1 mm, 1.8 μm), 柱温45 ℃, 流速0.4 mL·min-1, 进样量2 μL。流动相A (5 mmol·L-1醋酸铵-0.1%甲酸-水), 流动相B (乙腈)。粪便代谢物梯度洗脱条件: 0~0.5 min, 2% B; 0.5~13 min, 2%~98% B; 13~13.1 min, 98%~2% B; 13.1~18 min, 2% B。
数据预处理与分析 数据采集后, 将原始数据转换为mzXML格式, 并使用XC-MS软件(XC-MS plus, CA, USA) 进行数据预处理, 内容包括峰去卷积、峰对齐和峰匹配。主要参数如下: 峰宽= 50; 带宽= 0.1; m/z重叠区宽度= 0.1; 一个特征峰应在一组里大于80%的样本中出现。然后将包括m/z、保留时间和峰强度在内的三维原始数据集输出到Microsoft Excel 2020 (Microsoft Corp., Redmond, WA) 中。在本次研究中, 选择峰强度高于1 000的峰进一步分析。采用Microsoft Excel 2020计算变异系数(CV, 标准差/ 平均强度× 100%) 来表示数据的重复性, 质量控制样本CV% > 30%的峰被定义为高变异峰, 不纳入下一步分析。
实验基于准确的m/z值和MS/MS特征碎片, 并通过MetDNA2 (http://metdna.zhulab.cn/)、One-MAP (http://www.5omics.com/) 和MS-DIAL 4.8等数据库来鉴定代谢物。进一步采用HMDB 4.0 (https://hmdb.ca/) 验证这些代谢物。
LC-MS原始数据采用log10变换和Pareto标度进行归一化, 并用于后续的多变量分析。通过SIMCA-P软件(v14.0, Umetrics, Umea, Sweden) 进行多元分析, 其中包括主成分分析(principal components analysis, PCA) 和正交偏最小二乘判别分析(orthogonal projection to latent structures-discriminant analysis, OPLS-DA)。PCA是一种无监督模式, 用于检查CON组和CF组小鼠之间代谢模式变化的概况。OPLS-DA模式则用于进一步评估CON组和CF组小鼠粪便的代谢差异, 并筛选重要的差异代谢物。采用10次交叉验证来评估OPLS-DA的性能, 其中R2和Q2分别计算得到模型的拟合优度和预测指标, 越接近1表示模型合格。接着通过OPLS-DA的差异权重贡献值(variable importance in the projection, VIP) 评分来识别负责分类的重要代谢物。火山图是通过网站(https://www.omicshare.com/) 绘制的, 随后用于分析VIP > 1的代谢物, 其中P < 0.05和|log2(FC)| > 1则表示潜在的差异代谢物。韦恩图是通过在线网站(http://bioinformatics.psb.ugent.be/webtools/Venn/index.html) 绘制的, 代谢途径分析是用MetaboAnalyst 5.0 (https://www.metaboanalyst.ca/) 软件进行绘制。
统计学分析 实验结果以均数±标准差(mean ± SD) 表示, 采用Graphpad Prism 8.0软件进行分析。两组数据比较采用学生t检验(Student t test); P < 0.05表明差异具有统计学意义。
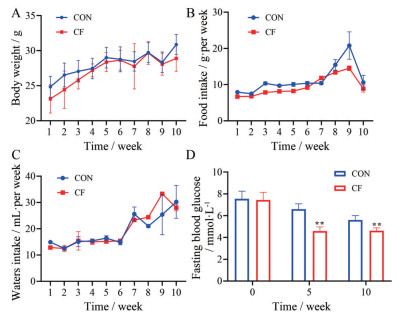
结果 1 间歇性禁食对正常小鼠生长状况的影响由图 1A中所示, 间歇性禁食在开始阶段会导致小鼠出现轻微的体重下降, 但没有显著性差异。随着实验的推进, 间歇性禁食对体重的影响逐渐消失, CF组与CON组小鼠体重从第4周起, 没有明显的差异。通过分析小鼠饮食饮水量, 发现间歇性禁食对小鼠饮食饮水量没有显著性影响(图 1B、C)。检测小鼠5周和10周时的空腹血糖, 发现小鼠血糖都处在正常范围内, 但较CON组而言, 间歇性禁食小鼠在第5周和第10周时的空腹血糖出现显著下降的情况(图 1D)。
|
Figure 1 The physiological situation of intermittent fasting (IF)-treated mice. Changes in (A) body weight, (B) food intake per week, (C) water intake per week, and (D) fasting blood glucose. **P < 0.01 vs CON. CON: Control; CF: Control + IF |
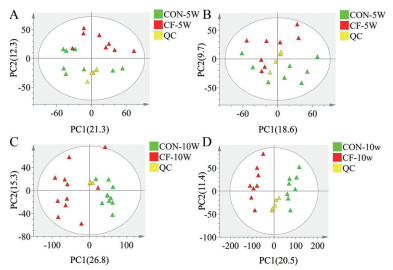
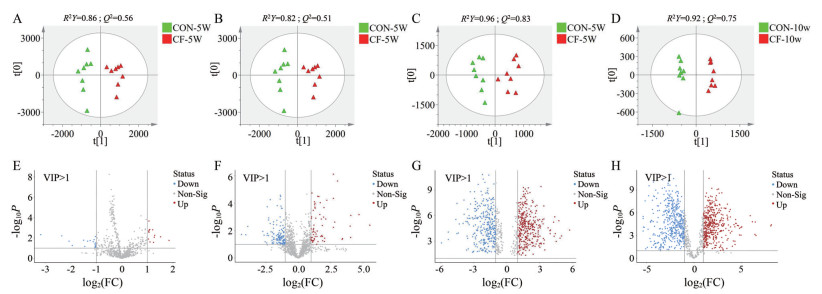
首先, QC样本在PCA图中均呈现中心聚集, 表明样本在分析过程中具有良好的仪器重复性(图 2)。此外, 在正负离子模式下, 基于粪便代谢组学数据的PCA图显示无论间歇性禁食5周还是10周时间, CON组和CF组小鼠都出现了明显的分离, 但10周时分离更加明显(图 2)。该结果表明间歇性禁食在5周时就能够影响小鼠体内代谢情况, 并且这种影响会随着禁食时间的增加而变得更加明显。接着, 通过使用多变量的OPLS-DA和单变量的t检验分析的方式, 筛选CON组和CF组小鼠之间重要的差异代谢物, 并进行鉴定。选择VIP值> 1.0、P < 0.05和|log2(FC)| > 1的代谢物进行下一步研究(图 3)。
|
Figure 2 Fecal metabolome analysis of intermittent fasting-treated mice. Fecal metabolic pattern changes in intermittent fasting-treated (A: Positive; B: Negative) 5 weeks and (C: Positive; D: Negative) 10 weeks were analyzed by PCA based on positive and negative modes, respectively |
|
Figure 3 Fecal metabolic pattern analysis. The differences in metabolic patterns of intermittent fasting-treated (A: Positive; B: Negative) 5 weeks and (C: Positive; D: Negative) 10 weeks analyzed by OPLS-DA under positive mode and negative mode. Subsequently, metabolites with VIP > 1.0 were selected and volcano plot analysis was used to identify important metabolites (P < 0.05, |log2(FC)| > 1), as highlighted in E-H |
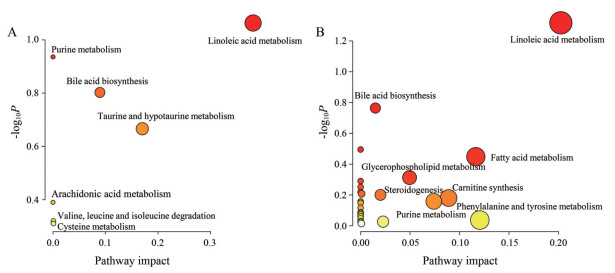
通过上述代谢物筛选标准, 从间歇性禁食5周时间点筛选并鉴定到18个差异代谢物(表 1), 而在禁食10周情况下得到108个差异代谢物(选取其中48个重要代谢物展示于表 2中)。这些差异代谢物种类复杂, 主要包括氨基酸、胆汁酸、类固醇及其衍生物、脂肪酸、甘油磷酸类、嘌呤核苷类、二羟酸及其衍生物、己糖类、吲哚及其衍生物、β-羟基酸及其衍生物和胆红素等。对以上差异代谢物综合分析发现无论禁食5周还是10周, 影响最明显的代谢物是脂肪酸, 其次是胆汁酸和氨基酸。进一步对以上差异代谢物进行KEGG通路富集(图 4A、B), 结果表明亚油酸代谢和胆汁酸生物合成在两个时间点上都表现出显著的影响力。此外, 在禁食5周时, 仅有牛磺酸代谢较为重要; 而在禁食10周时, 脂肪酸代谢、类固醇激素、肉毒碱合成和甘油磷脂代谢等多个方面都有显著影响。由此推测随着禁食时间的延长, 对小鼠体内代谢的影响也更为显著。
| Table 1 List of differentiated compounds in the 5-week IF mice compared with CON mice. RT: Retention time; CV: Coefficient of variation of QC sample; VIP: Variable importance in projection; FC: Fold change |
| Table 2 List of differentiated compounds in the 10-week IF mice compared with CON mice |
|
Figure 4 Changes of fecal metabolites in intermittent fasting-treated mice. Metabolic pathway analysis of metabolites changed in intermittent fasting-treated (A) 5 weeks and (B) 10 weeks. Node color based on P value and node radius determined based on pathway impact values |
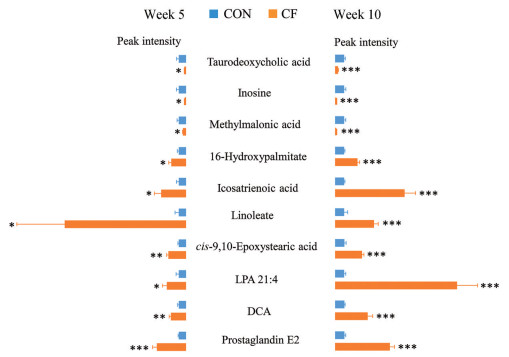
通过对两个时间点粪便代谢物的分析发现, 存在10种差异代谢物在5周和10周时均出现同样显著的影响, 初步猜测这10种代谢物在间歇性禁食过程中可能起着较为重要的作用。图 5展示了这10种代谢物在两个时间点时的相对峰强度变化结果, 该结果显示牛磺脱氧胆酸、甲基丙二酸和肌苷三种代谢物在间歇性禁食后都是呈现显著下降的趋势; 而3α-二羟基-5β-胆-6-烯酸酯、16-羟基棕榈酸酯、亚油酸、顺-9, 10-环氧硬脂酸、二十碳三烯酸、前列腺素E2和LPA 21∶4七种代谢物在禁食后出现显著升高的趋势。上调的7种代谢物中大部分属于脂肪酸, 其可由脂质分解产生, 并经过β氧化释放出大量能量供机体利用, 故推测小鼠在间歇禁食后会消耗机体的脂质并提供能量。
|
Figure 5 Fecal metabolic changes in intermittent fasting-treated mice. Butterfly diagram showing changes in 10 common features between intermittent fasting-treated 5 weeks and 10 weeks. DCA: 3α, 12α-Dihydroxy-5β-chol-6-enoate. *P < 0.05, ** P < 0.01, *** P < 0.001 vs CON |
在过去的几十年里, 能量限制饮食作为改善代谢状况, 尤其是在治疗各种疾病方面的潜力受到越来越多的关注。而间歇性禁食作为其中最流行的一种饮食方式, 已经有许多研究提出了其发挥功效的分子机制猜想。而最新的研究发现, 禁食可以改善健康状况甚至延长寿命, 但其原因可能并不是饮食成分的改变或是卡路里的摄入变化[2]。这些研究表明全身性的代谢重组可能会是间歇性禁食发挥作用的主要因素。本研究证明了随着小鼠IF时间的延长, 粪便代谢物结构组成的变化的影响也在不断加深。
在许多限制性饮食的方式中, IF是最受欢迎的一种, 其中也包括24 h交替禁食和摄入的方式[3]。通过统计小鼠在间歇性禁食过程中的体重变化, 发现IF前期会对正常小鼠的体重产生一定的影响, 但与正常饮食小鼠并没有显著性差异。这种影响也在随着IF时间的延长而减轻。通过摄食量和饮水量监测的结果, 发现体重的稳定可能与摄食量的稳定有关, 进一步说明禁食10周时间对正常小鼠自身的基础状态不会产生较大的影响。而后发现血糖检测的结果也与前期研究一致[11], IF能够在一定程度上降低血糖, 这可能也是其用于干预糖尿病的潜在原因之一。
IF与肠道微生物之间的联系已经在多项研究中得到验证, 研究发现IF可以通过肠道微生物降低血压[12]、促进白色脂肪的褐变[1]、改善糖尿病引起的认知功能障碍[10]及调节中枢神经系统的自身免疫[13]等。而肠道代谢物的变化又是肠道微生物发挥功能的重要介质之一。因此, 实验进一步采用代谢组学技术对小鼠粪便代谢物进行了检测。研究证明IF在第5周就能够影响小鼠代谢情况, 并随着时间的延长而变得更加显著。在预设条件下, 对分析鉴定出的代谢物进行通路富集, 发现亚油酸代谢、胆汁酸生物合成及脂肪酸代谢等代谢通路在IF过程中可能发挥重要作用。亚油酸是公认的一种必须脂肪酸。它是花生四烯酸、二十碳五烯酸以及二十二碳六烯酸的前体, 是人体不可或缺的重要代谢物。研究发现亚油酸能降低血液胆固醇, 胆固醇必须与亚油酸结合后, 才能在体内进行正常的运转和代谢[14]。如果亚油酸代谢异常则会导致胆固醇代谢紊乱, 并在血管壁上沉积下来, 进而引发动脉粥样硬化等心脑血管疾病[15]。胆汁酸是由胆固醇在肝脏合成的一系列胆甾烷类内源性物质。胆汁酸在肝肠循环的过程中, 95%的胆汁酸在回肠末端被重吸收进入门静脉, 再回到肝脏被重新利用。而仅有5%的胆汁酸可以作为肠道菌群在结肠中生物转化的底物[16]。在正常情况下, 胆汁酸代谢处于平衡状态。若由于胆汁酸代谢或排泄出现异常, 则会引起胆汁淤积, 并进一步引起肝细胞线粒体损伤, 导致肝细胞的凋亡和衰竭等[17]。此外, 胆汁酸代谢还会涉及到肠道炎症[18, 19]和心脏功能异常[20]等方面, 甚至在阿尔茨海默病引起的认知功能障碍中也发挥着重要作用[21, 22]。脂肪酸是指一端含有一个羧基的长的脂肪族碳氢链, 是机体主要能量来源之一。而脂肪酸代谢则包括能量动态平衡所需的合成代谢和分解代谢过程, 以及维持细胞膜结构和功能、储存能量和细胞信号传导所需的代谢中间产物的形成。目前研究发现神经系统性疾病[23-25]、心血管疾病[26]及癌症[27, 28]等多种疾病都与脂肪酸代谢异常密切相关。此外, IF还涉及牛磺酸代谢、肉毒碱代谢等多个方面, 由此推测长期并合理地进行IF会在一定程度上改变机体代谢模式, 而这种代谢重组可能也是IF在治疗各种疾病过程中发挥极其重要作用的原因。
在此基础上进一步筛选在两个时间点下具有相同变化趋势的代谢物。该10种代谢物在IF过程中可能发挥着关键作用。目前这些代谢物已经被许多研究证明具有一系列的生物活性, 如甲基丙二酸会加快癌细胞侵袭和转移[29], 促进肿瘤发展[30], 并且也与糖尿病引起的神经病变有关[31]; 肌苷则能够影响早期帕金森的发生发展[32]并参与机体的免疫调节[33]; 亚油酸已被报道能够通过减少肠道炎症改善中枢神经系统疾病[34]; 二十碳三烯酸具有促进内脏血管舒张降低门静脉高压的作用[35]; 前列腺素E2能够影响慢性皮肤炎症[36], 并且可通过介导感觉神经控制骨稳态[37]。因此, 这些差异代谢物可能是IF发挥功效的关键中间介质之一, 这也为后续探讨IF可能的分子机制提供可靠的理论基础。
然而仅分析小鼠粪便中代谢物的变化情况并不能全方面的阐明IF对小鼠全身代谢的影响; 同时, 两个时间点的选择也不能概括小鼠在IF过程中代谢物及代谢模式的变化规律。因此, 以本研究为基础, 在后续工作中将进一步深入开展多时间点、多组织的代谢组学研究, 一方面探究IF对小鼠全身代谢的系统性影响; 另一方面进一步为IF预防或治疗疾病的潜在分子机制提供新的思路。
作者贡献: 鞠政财设计实验方案; 熊星、熊微和陈岩进行实验数据采集与分析; 熊星和鞠政财撰写、修改论文。
利益冲突: 无利益冲突。
| [1] |
Li GL, Xie C, Lu SY, et al. Intermittent fasting promotes white adipose browning and decreases obesity by shaping the gut microbiota[J]. Cell Metab, 2017, 26: 672-685. DOI:10.1016/j.cmet.2017.08.019 |
| [2] |
Mitchell SJ, Bernier M, Mattison JA, et al. Daily dasting improves health and survival in male mice independent of diet composition and calories[J]. Cell Metab, 2019, 29: 221-228. DOI:10.1016/j.cmet.2018.08.011 |
| [3] |
Clifton KK, Ma CX, Fontana L, et al. Intermittent fasting in the prevention and treatment of cancer[J]. CA Cancer J Clin, 2021, 71: 527-546. DOI:10.3322/caac.21694 |
| [4] |
Shi HA, Zhang BJ, Abo-Hamzy T, et al. Restructuring the gut microbiota by intermittent fasting lowers blood pressure[J]. Circ Res, 2021, 128: 1240-1254. DOI:10.1161/CIRCRESAHA.120.318155 |
| [5] |
Tang XL, Li G, Shi L, et al. Combined intermittent fasting and ERK inhibition enhance the anti-tumor effects of chemotherapy via the GSK3β-SIRT7 axis[J]. Nat Commun, 2021, 12: 5058. DOI:10.1038/s41467-021-25274-3 |
| [6] |
Liu Y, Cheng A, Li YJ, et al. SIRT3 mediates hippocampal synaptic adaptations to intermittent fasting and ameliorates deficits in APP mutant mice[J]. Nat Commun, 2019, 10: 1886. DOI:10.1038/s41467-019-09897-1 |
| [7] |
Chen XY. Effect of Intermittent Fasting on Metabolic Health and Gut Microbiota of Normal Chow-fed and High Fat Diet-fed Mice (间歇性禁食对普通饮食和高脂饮食小鼠代谢健康和肠道菌群的影响) [D]. Shanghai: Shanghai Jiaotong University, 2019.
|
| [8] |
Li S, Li Q, Yu HW, et al. Research progress on the relationship between intestinal microorganisms, human health and diet[J]. Intern Med (内科), 2021, 16: 479-484. |
| [9] |
Zheng XJ. Development of Metabolomics Platforms for Gut Mircrobial-host Co-metabolism (肠道菌—宿主代谢物组的分析平台的建立及应用) [D]. Shanghai: Shanghai Jiaotong University, 2013.
|
| [10] |
Liu ZG, Dai XH, Zhang HB, et al. Gut microbiota mediates intermittent-fasting alleviation of diabetes-induced cognitive impairment[J]. Nat Commun, 2020, 11: 855. DOI:10.1038/s41467-020-14676-4 |
| [11] |
Wang X, Lv W, Xu J, et al. Hepatic suppression of mitochondrial complex II assembly drives systemic metabolic benefits[J]. Adv Sci (Weinh), 2022, 9: e2105587. DOI:10.1002/advs.202105587 |
| [12] |
Maifeld A, Bartolomaeus H, Lober U, et al. Fasting alters the gut microbiome reducing blood pressure and body weight in metabolic syndrome patients[J]. Nat Commun, 2021, 12: 1970. DOI:10.1038/s41467-021-22097-0 |
| [13] |
Cignarella F, Cantoni C, Ghezzi L, et al. Intermittent fasting confers protection in CNS autoimmunity by altering the gut microbiota[J]. Cell Metab, 2018, 27: 1222-1235. DOI:10.1016/j.cmet.2018.05.006 |
| [14] |
Zhou H, Sugiyama K. Effect of dietary linoleic acid on plasma cholesterol concentrations and lipid molecular species in rats[J]. Jiangxi Sci (江西科学), 2002, 20: 6-11. |
| [15] |
Dan Y, Lin XZ, Shen JH, et al. Effect of conjugated linoleic acid in lowering blood lipids and anti-atherosclerosis[J]. Prog Mod Biomed (现代生物医学进展), 2011, 11: 1228-1230. |
| [16] |
Tan WH, Wang LN. Research progress of interaction between bile acid metabolism and intestinal microflora[J]. Feed Res (饲料研究), 2021, 44: 129-132. |
| [17] |
Xu Y, Chen CC, Yang L, et al. Evaluation on hepatotoxicity caused by dioscorea bulbifera base on analysis of bile acids[J]. Acta Pharma Sin (药学学报), 2011, 46: 39-44. |
| [18] |
Mohammed AD, Mohammed Z, Roland MM, et al. Defective humoral immunity disrupts bile acid homeostasis which promotes inflammatory disease of the small bowel[J]. Nat Commun, 2022, 13: 525. DOI:10.1038/s41467-022-28126-w |
| [19] |
Yu HC, Hou SC, Cui B, et al. Research progress on the role of bile acids in regulating glycolipid metabolism[J]. Acta Pharma Sin (药学学报), 2020, 55: 1419-1430. |
| [20] |
Vasavan T, Deepak S, Jayawardane IA, et al. Fetal cardiac dysfunction in intrahepatic cholestasis of pregnancy is associated with elevated serum bile acid concentrations[J]. J Hepatol, 2021, 74: 1087-1096. DOI:10.1016/j.jhep.2020.11.038 |
| [21] |
MahmoudianDehkordi S, Arnold M, Hho K, et al. Altered bile acid profile associates with cognitive impairment in Alzheimer's disease-an emerging role for gut microbiome[J]. Alzheimer′s Dement, 2019, 15: 76-92. DOI:10.1016/j.jalz.2018.07.217 |
| [22] |
Jia W, Rajani C, Kaddurah‐Daouk R, et al. Expert insights: the potential role of the gut microbiome‐bile acid‐brain axis in the development and progression of Alzheimer's disease and hepatic encephalopathy[J]. Med Res Rev, 2020, 40: 1496-1507. DOI:10.1002/med.21653 |
| [23] |
Esposito G, Giovacchini G, Liow JS, et al. Imaging neuroinflammation in Alzheimer′s disease with radiolabeled arachidonic acid and PET[J]. J Nucl Med, 2008, 49: 1414-1421. DOI:10.2967/jnumed.107.049619 |
| [24] |
Kim HW, Rapoport SI, Rao JS. Altered arachidonic acid cascade enzymes in postmortem brain from bipolar disorder patients[J]. Mol Psychiatry, 2011, 16: 419-428. DOI:10.1038/mp.2009.137 |
| [25] |
Zhang NN, Wang ZZ, Chen NH. Association of depression with dietary fatty acids and the progress of mechanism research[J]. Acta Pharma Sin (药学学报), 2021, 56: 906-912. |
| [26] |
Fang H, Chen J, Lin S, et al. CD36-mediated hematoma absorption following intracerebral hemorrhage: negative regulation by TLR4 signaling[J]. J Immunol, 2014, 192: 5984-5992. DOI:10.4049/jimmunol.1400054 |
| [27] |
Maan M, Peters JM, Dutta M, et al. Lipid metabolism and lipophagy in cancer[J]. Biochem Biophys Res Commun, 2018, 504: 582-589. DOI:10.1016/j.bbrc.2018.02.097 |
| [28] |
Liu YC, Du TT, Wang QH, et al. Lipid metabolism and hematological malignancies[J]. Acta Pharma Sin (药学学报), 2021, 56: 2456-2463. |
| [29] |
Gomes AP, Ilter D, Low V, et al. Age-induced accumulation of methylmalonic acid promotes tumour progression[J]. Nature, 2020, 585: 283-287. DOI:10.1038/s41586-020-2630-0 |
| [30] |
Kay EJ, Zanivan S. Methylmalonic acid: an age-related metabolite that drives tumour aggressiveness[J]. Nat Metab, 2022, 4: 412-413. DOI:10.1038/s42255-022-00540-w |
| [31] |
Wile DJ, Toth C. Association of metformin, elevated homocysteine, and methylmalonic acid levels and clinically worsened diabetic peripheral neuropathy[J]. Diabetes Care, 2010, 33: 156-161. DOI:10.2337/dc09-0606 |
| [32] |
The Parkinson study group SURE-PD investigators. Inosine to increase serum and CSF urate in Parkinson disease: a randomized, placebo-controlled trial[J]. JAMA Neurol, 2014, 71: 141-150. DOI:10.1001/jamaneurol.2013.5528 |
| [33] |
Kroemer G, Zitvogel L. Inosine: novel microbiota-derived immunostimulatory metabolite[J]. Cell Res, 2020, 30: 942-943. DOI:10.1038/s41422-020-00417-1 |
| [34] |
Fleck AK, Hucke S, Teipel F, et al. Dietary conjugated linoleic acid links reduced intestinal inflammation to amelioration of CNS autoimmunity[J]. Brain, 2021, 144: 1152-1166. DOI:10.1093/brain/awab040 |
| [35] |
Pascoli MD, Zampieri F, Verardo A, et al. Inhibition of EETs production in cirrhotic rats has beneficial effects on portal hypertension by reducing splanchnic vasodilation[J]. J Hepatol, 2016, 64: S449. |
| [36] |
Sawada Y, Honda T, Nakamizo S, et al. Prostaglandin E2 (PGE2)-EP2 signaling negatively regulates murine atopic dermatitis-like skin inflammation by suppressing thymic stromal lymphopoietin expression[J]. J Allergy Clin Immunol, 2019, 144: 1265-1273. DOI:10.1016/j.jaci.2019.06.036 |
| [37] |
Chen H, Hu B, Lv X, et al. Prostaglandin E2 mediates sensory nerve regulation of bone homeostasis[J]. Nat Commun, 2019, 10: 181. DOI:10.1038/s41467-018-08097-7 |
 2022, Vol. 57
2022, Vol. 57


