2. 安徽贝克生物制药有限公司, 安徽 合肥 230088;
3. 安徽万邦医药科技股份有限公司, 安徽 合肥 230601
2. Anhui Bio-Pharmaceutical Co., Ltd., Hefei 230088, China;
3. Anhui Wanbang Pharmaceutical Technology Co., Ltd., Hefei 230601, China
依非韦伦是人免疫缺陷病毒-1型(HIV-1) 的选择性非核苷反转录酶抑制剂, 通过非竞争性结合并抑制HIV-1逆转录酶活性, 主要作用于模版、引物或三磷酸核苷, 兼有小部分竞争性的抑制作用, 主要用于艾滋病患者的抗病毒治疗。依非韦伦相关单方制剂最早由美国Bristol-Myers Squibb及Merck Sharp & Dohme Pty. Ltd.等公司联合研发, 原研药物以片剂及口服溶液为主。实际临床应用过程中, 远远超过临床治疗剂量的依非韦伦对HIV-2反转录酶和人细胞DNA多聚酶α、β、γ和δ无抑制作用[1, 2]。目前国内依非韦伦制剂是由Merck Sharp & Dohme (Australia) Pty. Ltd.进口注册上市, 2016年实现本品原研国产化。
本品国内临床用药过程中, 主要以600 mg产品为主, 但临床专家多次指出国内HIV患者应用依非韦伦日剂量600 mg过大[3, 4], 容易产生耐药性, 同时增加本品不良反应发生率, 建议本品最佳临床使用日剂量应在200~400 mg之间, 因此国内市场急需研制出依非韦伦片小规格制剂产品, 供国内临床HIV患者使用。
材料与方法药品与仪器 受试制剂: 依非韦伦片(规格: 200 mg, 批号: 210701), 由安徽贝克生物制药有限公司生产; 参比制剂: 依非韦伦片(商品名: 施多宁, 规格: 200 mg, 批号: T023612), 由MSD K.K株式会社生产; 依非韦伦对照品(批号: 101441-202001, 含量: 99.9%), 中国食品药品检定研究院; 依非韦伦同位素内标(rac-efavirenz-d5, 批号: 1866-041A4, 化学纯度: 94.6%, 同位素纯度: 99.0%), 加拿大TLC Pharmaceutical Standards。主要仪器: Dionex Ultimate 3000 UHPLC液相色谱仪(美国Thermo Scientific公司); AB API 4000质谱仪(美国AB公司); G-16C/4-16KS台式高速冷冻离心机(德国Sartorius公司); XP6百万分之一电子分析天平(梅特勒-托利多仪器(上海) 有限公司) 等。
受试者选择 本次人体生物等效性临床研究经安徽医科大学第二附属医院药物临床试验伦理委员会核准(伦理批件号: YW2021-110) 后, 依据核准临床试验方案开展。所有受试者入组前均需签署知情同意书, 并严格按试验方案入/排标准进行筛选。
主要入选标准: ①年龄在18~60周岁的男性或女性志愿受试者; ②男性体重不低于50.0 kg、女性体重不低于45.0 kg, 体重指数(BMI) 在19.0 ~26.0 kg·m-2范围内; ③受试者愿意自筛选前2周至研究药物最后一次给药后6个月内无生育计划; ④志愿受试者试验前签署知情同意书, 并对试验内容、过程及可能出现的不良反应充分了解, 自愿参加且能够按照试验要求完成研究。
主要排除标准: ①在筛选期间存在系统疾病者; ②曾有过癫痫病史者; ③临床上有食物、药物等过敏史, 尤其已知对依非韦伦及其辅料中任何成分过敏者; ④在筛选前3个月内接受过手术或者计划在研究期间进行手术者; ⑤筛选前3个月内献血包括成分血或大量失血(≥ 400 mL); ⑥在筛选前28天内使用过任何抑制或诱导肝脏对药物代谢的药物; ⑦筛选前2周内使用过任何处方药、非处方药、中草药和维生素者; ⑧筛选前3个月内参加过其他的药物临床试验或非本人来参加临床试验者; ⑨其他研究者认为不适宜参加临床试验者。
试验设计 依据美国FDA《Guidance on Efavirenz》相关信息[5]及原研产品说明书信息[2], 明确本品与食物同时服用会增加其暴露, 并增加不良反应的发生, 因此本品仅需开展单剂量空腹生物等效性试验。参考2020版中国药典中《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》等法规及相关文献[6]要求, 本次试验拟采用: 空腹、随机、开放、单剂量、两序列、两周期、双交叉生物等效性试验设计, 计划入组36例健康受试者, 男女比例适中。受试者入组后随机分为两组, 每组18人, 每周期给药一次, 给药剂量200 mg, 试验清洗期为35天。
血样采集及预处理 入组受试者在给药前2天入住规定GCP病房, 进行饮食控制管理, 并于次日早晨按照试验随机表, 在空腹给药条件下用240 mL水送服受试制剂1片或参比制剂1片(剂量200 mg)。分别于给药前(给药前1.00 h内) 及给药后0.50、1.00、1.33、1.67、2.00、2.33、2.67、3.00、3.33、3.67、4.00、4.50、5.00、5.50、6.00、7.00、8.00、10.00、12.00、24.00、48.00和72.00 h采集静脉血约4 mL, 分别注入含K2EDTA抗凝剂的真空采血管置于冰水浴中。采集后的受试者全血样本要求1 h内置于低温离心机(设置: 温度4 ℃, 离心力2 500 ×g) 离心10 min, 冰水浴条件下, 取离心后的上清血浆加入到检测管中。2 h内需要将血浆样本置于-90 ℃~-60 ℃超低温冰箱保存, 直至生物样本检测使用。
色谱条件 色谱柱: Welch Ultimate XB-C18 (100 mm × 2.1 mm, 5 μm); 流动相A: 10 mmol·L-1乙酸铵; 流动相B: 乙腈, 总流速为0.400 mL·min-1; 柱温: 40 ℃, 进样器温度为4 ℃; 进样量: 5 μL。
质谱条件 ESI离子源, 多反应监测(MRM) 扫描模式。
血浆样品处理 在96孔板的孔中加入50 μL室温下解冻的样品或新配制的样品(标准曲线, 质控样品, 系统适用性样品或待测生物样品, 对于双空白样品或者零点样品, 加入空白基质样品50 μL); 对于双空白样品或ULOQ Without IS样品, 加入50%甲醇溶液50 μL, 对于其他样品加入内标工作液(500.000 ng·mL-1) 50 μL, 涡旋混匀。每一个样品孔中加入乙腈200 μL, 封板, 混匀10 min, 样品在4 ℃, 2 623 ×g离心10 min。取离心后上清液100 μL至另一96孔收集板中, 加入50%甲醇溶液200 μL, 封板, 混匀, 样品在4 ℃, 2 623 ×g离心10 min, 进样检测[7-10]。
统计学处理 待测物(依非韦伦) 和内标物(依非韦伦-d5) 的色谱图采集和色谱峰面积由Analyst 1.6.3软件进行采集并处理, 再将其峰面积导入Watson LIMS 7.6 SP1进行回归计算, 以待测物与内标物的峰面积比对标准曲线中待测物的理论浓度进行最小二乘法线性回归计算, 以所得回归方程y = ax + b计算样品中待测物的实测浓度。
结果 1 方法学验证 1.1 选择性分别精密移取6个不同来源的空白正常基质、1个来源的空白高脂基质、1个来源的空白溶血基质, 按“血浆样品处理”项下方法进行样品处理, 结果显示, 依非韦伦和依非韦伦-d5色谱峰形均良好, 不同来源的空白基质对分析物和内标的检测无明显干扰, 不影响定量分析, 内标与分析物之间也互相不干扰。其典型色谱图如图 1所示。
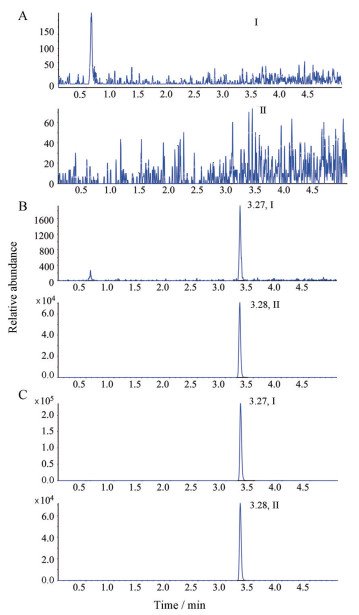
|
Figure 1 Typical LC-MS/MS chromatograms of efavirenz, efavirenz-d5 (IS). A: Human blank plasma; B: LLOQ (400 ng·mL-1) sample spiked with IS (500 ng·mL-1); C: 2 h human plasma sample spiked with IS (500 ng·mL-1) after an oral administration at dose of 200 mg efavirenz. Peaks I and II refer to efavirenz, efavirenz-d5 respectively |
按“血浆样品处理”项下方法处理进样分析, 依非韦伦标准曲线血浆样品中质量浓度分别为20.0、40.0、120、300、600、1 200、2 400和3 000 ng·mL-1, 得到依非韦伦的回归方程为y = 0.001 30x - 0.002 65 (r = 0.997 5)。最终得出依非韦伦在20.0~3 000 ng·mL-1内标准曲线较好, 其定量下限为20.0 ng·mL-1。
1.3 精密度和准确度配制定量下限(LLOQ)、低(LQC)、中1 (M1QC)、中2 (M2QC) 和高(HQC) 五个质量浓度水平的质量控制(QC) 样品, 依非韦伦的质量浓度分别为20.0、60.0、200、1 000和2 250 ng·mL-1, 按血浆样品处理项下方法处理进样分析。结果显示依非韦伦LQC、M1QC、M2QC和HQC样品的准确度均在95.7%~105.1%内, 依非韦伦LLOQ样品批间准确度为105.0%, 批内、批间精密度(CV%) 均小于5.2%, 说明该方法重复性较好。
1.4 提取回收率和基质效应使用6个不同来源的空白正常基质、1个来源的空白高脂基质、1个来源的空白溶血基质, 按“血浆样品处理”项下方法进行基质样品处理, 然后分别加入低、中、高相同质量浓度水平分析物和内标混合工作液, 配制成基质效应考察的基质样品。结果显示, 所有不同来源的基质样品中依非韦伦的内标归一化基质效应因子的相对标准偏差均不超过4.0%, 说明不影响准确测定。
用混合空白正常基质配制成低、中、高质量浓度水平样品, 按“血浆样品处理”项下方法进行处理。结果显示依非韦伦LQC浓度水平的提取回收率平均值为99.3%, MQC浓度水平的提取回收率平均值为105.1%, HQC浓度水平的提取回收率平均值为101.4%, 内标(EFV-d5) 提取回收率平均值为101.6%。依非韦伦及EFV-d5在基质样品中的提取回收率均满足生物样品分析要求。
1.5 基质中稳定性配制LQC、HQC两个质量浓度水平的稳定性QC样品考察血浆中依非韦伦的稳定性, 分别在零时和不同考察条件下放置后进行评价。结果表明, 依非韦伦每一浓度水平稳定性QC样品的均值均在标示浓度的±15.0%范围内, CV%均小于10.0%, 在各种考察环境下稳定性均较好。
1.6 其他另外考察了交叉干扰、残留效应、溶血效应、高脂效应、稀释可靠性、分析批最大进样针数, 其结果均符合2020版中国药典中《生物样品定量分析方法验证指导原则》的相关要求。
综上可知, 拟定液相色谱串联质谱法测定健康人K2EDTA血浆中依非韦伦的分析方法符合2020版中国药典中《生物样品定量分析方法验证指导原则》的相关要求, 可用于本次临床试验血浆样品的分析。
2 生物样本检测本次试验共随机化入组36例受试者, 最终有35例受试者分别单次完成了口服依非韦伦受试药物或参比药物, 纳入本次试验药代动力学参数集(pharmacokinetics parameter set, PKPS) 及生物等效性集(bioequivalence set, BES) 进行统计分析。
35例健康受试者空腹状态下, 单次口服依非韦伦受试药物或参比药物后, 平均血药浓度-时间曲线结果见图 2。
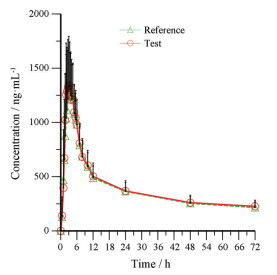
|
Figure 2 Curve of average plasma concentration-time of efavirenz in 35 subjects after oral administration of reference preparation and test preparation under fasting conditions |
35例健康受试者空腹状态下单次口服依非韦伦片受试药物及参比药物后, 药动学参数统计分析结果见表 1所示。
|
Table 1 The main pharmacokinetic parameters. n = 35, |
结果显示, 受试药物与参比药物主要药动学参数基本一致, 且与原研产品说明书[2]药动学参数信息基本一致。
4 生物等效性评价35例健康受试者空腹状态下单次口服依非韦伦片受试药物及参比药物后, 生物等效性分析结果如下表 2所示。
| Table 2 Statistical results of bioequivalence (n = 35) |
结果显示, 受试药物与参比药物在本次空腹给药条件下具有生物等效性。
讨论试验实施过程中, 为确保试验科学性及合理性, 考虑到依非韦伦属于低溶解性低渗透性的化合物, 食物会增加其机体暴露量, 并增加不良反应的发生率[2], 为有效降低受试者机体基线代谢水平对药物代谢影响, 确保受试者两周期药物代谢机能基本一致, 与其他同类药物生物等效性研究比较[11], 本试验采用了服药前2天入住GCP病房, 进行统一饮食控制管理, 确保了试验结果的真实性与准确性。
本次试验最终入选36例男女健康志愿受试者, 试验过程中共有12例受试者发生19例次不良事件, 不良事件严重程度均为I级轻度, 无严重不良事件发生, 经统计分析确认: 受试者在空腹给药条件下, 单次口服受试制剂或参比制剂200 mg后, 其临床安全性良好, 表明受试制剂与参比制剂临床用药安全性相近。
从依非韦伦90%置信区间结果可以看出, 空腹给药条件下依非韦伦Cmax、AUC0-72 h的90%置信区间和几何均值比值(受试制剂/参比制剂) 的统计结果均在80.00%~125.00%内[12]。Cmax的90%置信区间为95.62%~107.15%, 几何均值比为101.22%; AUC0-72 h的90%置信区间为100.43%~104.38%, 几何均值比为102.38%, 经双单侧t检验分析后P值均小于0.05, 则拒绝H0接受H1, 即两制剂在本次空腹条件下依非韦伦具有生物等效性, 故受试制剂和参比制剂在空腹给药条件下具有生物等效性。
致谢: 安徽医科大学第二附属医院对本次试验给予的支持。
作者贡献: 夏玉明主要参与项目试验设计等各项工作, 是本次临床研究项目负责人, 对本文各项试验结果进行审核确认; 许杨主要负责试验生物样本分析, 并参与本文数据审核与确认; 马陶陶对本次试验技术和本文撰写进行技术指导。
利益冲突: 本次临床试验内容与任何机构和个人均无利益冲突。
| [1] |
Li YQ, Shang DW, Wen YG, et al. Population pharmacokinetics of efavirenz in Chinese acquired immune deficiency syndrome patients[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2020, 36: 833-837. |
| [2] |
U. S. Food and Drug Administration. SUSTIVA (efavirenz) tablets for oral use [DB/OL]. Drugs@FDA: FDA-Approved Drugs. 2019-10-29. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/020972s057,021360s045lbl.pdf.
|
| [3] |
Li H, Cao YQ, Cheng YG, et al. Overview on current development of the dose of efavirenz (400 mg) in treating HIV[J]. Chin J Aids STD (中国艾滋病性病), 2021, 8: 903-906. |
| [4] |
Peng WX, Fu Q, Du XL, et al. Effects of HBV and HCV co-infection on plasma concentration, efficacy and hepatotoxicity of efavirenz in HIV/AIDS patients[J]. Chin Pharm J (中国药学杂志), 2019, 14: 1162-1168. |
| [5] |
U. S. Food and Drug Administration. Guidance on efavirenz [S]. Product-Specific Guidances for Generic Drug Development: 2008-05. https://www.accessdata.fda.gov/drugsatfda_docs/psg/Efavirenz_tab_21360_RC11-06.pdf.
|
| [6] |
National Medical Products Administration. Guidelines for general considerations in clinical trials of medicines [EB/OL]. Annex to Announcement No. 11, 2017-01-20. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/qtggtg/20170120160701190.html.
|
| [7] |
Kumar VR, Reddy BP, Kumar BR, et al. High throughput LC-MS/MS method for simultaneous determination of zidovudine, lamivudine and nevirapine in human plasma[J]. J Chromatogr B, 2013, 921-922: 9-14. DOI:10.1016/j.jchromb.2012.12.042 |
| [8] |
Bedor DCG, Souza Filho JHD, Ramos VLS, et al. A sensitive and robust LC-MS/MS method with monolithic column and electrospray ionization for the quantitation of efavirenz in human plasma: application to a bioequivalence study[J]. Quim Nova, 2011, 34: 950-955. DOI:10.1590/S0100-40422011000600007 |
| [9] |
Li Z, Ding CG, Zhou Q, et al. Determination of efavirenz in human plasma by LC-MS/MS and bioequivalence in human body[J]. Chin J Pharm (中国医药工业杂志), 2015, 46: 1323-1326. |
| [10] |
Yu SD. Preclinical Pharmacokinetics Study of a Novel Anti-HIV Drug Combination Using HPLC-MS/MS Method (基于高效能LC-MS/MS分析的新型抗艾滋病复方药物的临床前药代动力学研究) [D]. Shanghai: Naval Medical University, 2018.
|
| [11] |
Zhang XQ, Zhang JD, Zhao P, et al. Bioequivalence of tenofovir disoproxil fumarate tablets in human under fasting and fed conditions[J]. Chin J Pharm (中国医药工业杂志), 2015, 46: 180-185. |
| [12] |
National Medical Products Administration. Statistical guidelines for bioequivalence studies [EB/OL]. Annex 1 to Announcement No. 103, 2018-10-17.https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20181029173101911.html.
|
 2022, Vol. 57
2022, Vol. 57


