荆芥穗为唇形科植物荆芥Schizonepeta tenuisfolia Briq. 的干燥花穗, 始载于《神农本草经》, 被列为中品, 原名假苏。性辛, 微温, 入肝、肺经, 主治寒热鼠瘘、瘰疬生疮、破结聚气、下瘀血、除湿痹[1]。中医学多视荆芥穗为荆芥的优选药用部位, 历代本草如《仁术便览》[2]、《本草纲目》[3]、《要药分剂》[4]中均有佐证。荆芥穗为生境主导型道地药材, 产地生态环境是影响药材品质的主要因素。其道地主产区为河北, 所产“祁荆芥”质量较高, 其他产地如河南等均有分布。由于来源广泛, 药材的生态环境适应性导致各地荆芥穗质量良莠不齐, 给药材质量控制带来很大的困难。《中华人民共和国药典》 (2020版) 以及中国台湾中药典第二版仅以胡薄荷酮作为荆芥穗质量控制指标成分[5, 6], 是否与药效相关未见报道。随着国家药品监督管理局药品审评中心网站于2020年11月4日发布的《中药新药研究各阶段药学研究技术指导原则(试行)》, 国家开始对中药材质量和安全性加大监管。中药因多成分、多靶点、多通路的特点, 单一指标难以全面反映药材质量。
中药指纹图谱以其独特的优势, 广泛应用于中药质量控制、真伪鉴别和谱效关系研究, 能系统地反映出各组分的信息情况。但中药指纹图谱具有数据量大, 人工辨别耗时且不客观等缺点, 无法反映出不同产地药材的共同差异性标志物。因此需要结合化学模式识别方法进行科学全面的分析, 从而筛选出指标性成分。对此, 本研究采用HPLC建立了25批不同产地荆芥穗指纹图谱, 标定了22个共有色谱峰, 指认了7个化学成分, 对其进行了多指标成分含量测定。并通过相似度评价联合聚类分析(cluster analysis, CA)、主成分分析(principal component analysis, PCA)、正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA) 等化学模式识别技术筛选了5个标志性成分, 较为全面地对荆芥穗药材进行质量控制, 旨在为荆芥穗药材质量标准的研究提供参考。
材料与方法仪器 Agilent 1260Ⅱ型高效液相色谱仪(美国Agilent公司); CPA225D型电子分析天平(北京赛多利斯科学仪器有限公司); KQ-5200DE型数控超声波清洗器(昆山市超声仪器有限公司); DHG-9030A型电热恒温鼓风干燥箱(上海一恒科技有限公司); RE-2000A型旋转蒸发仪(巩义市予华仪器有限公司)。
试药 胡薄荷酮(批号111706-201703)、橙皮苷(批号110721-201617)、咖啡酸(批号110885-201703), 以上对照品纯度≥ 95%, 均购于中国食品药品检定研究院; 迷迭香酸(批号wkq19030403)、金合欢素-7-O-葡萄糖(批号wkq21071504)、槲皮素(批号wkq16063005), 以上对照品纯度≥ 98%, 均购于四川省维克奇生物科技有限公司; 芦丁对照品(批号Y22S6S3719) 纯度≥ 98%, 购于上海源叶生物科技有限公司; 水为超纯水; 乙腈为色谱纯(美国SIGMA公司); 其他试剂均为分析纯。本实验所用荆芥穗药材及饮片分别购于河南、河北、四川, 经西南交通大学宋良科副教授鉴定为唇形科植物荆芥Schizonepeta tenusfolia Briq.的干燥花穗。25批药材信息见表 1。
| Table 1 Origin information of 25 batches of medicinal materials |
荆芥穗药材质量评价 根据2020版《中华人民共和国药典》[5]标准规定, 对25批次荆芥穗药材及饮片进行水分、总灰分、酸不溶性灰分及浸出物等检查项、胡薄荷酮及挥发油含量测定。
色谱条件 色谱柱为InertSustain C18 (250 mm × 4.6 mm, 5 μm), 流动相为乙腈(A)-0.1%磷酸水溶液(B), 梯度洗脱(0~10 min, 10%→22% A; 10~13 min, 22%→23% A; 13~15 min, 23%→26% A; 15~21 min, 26%→26% A; 21~25 min, 26%→36% A; 25~30 min, 36%→50% A; 30~35 min, 50%→85% A; 35~40 min, 85%→85% A), 柱温35 ℃, 流速为1.0 mL·min-1, 检测波长235 nm, 进样量10 μL。
混合对照品溶液的制备 分别精密称取胡薄荷酮、橙皮苷、迷迭香酸、金合欢素7-O-葡萄糖、槲皮素、咖啡酸、芦丁7种对照品适量, 精密称定, 加入甲醇配制成质量浓度分别为42.196 0、64.256 3、86.845 4、102.323 4、88.342 3、26.795 8和45.657 3 μg·mL-1的混合对照品溶液。
供试品溶液的制备 取本品粉末(过二号筛) 约1 g, 精密称定, 置具塞锥形瓶中, 加甲醇20 mL, 超声处理(功率250 W, 频率50 kHz) 20 min, 滤过, 滤渣和滤纸再加甲醇20 mL, 同法超声处理1次, 滤过, 加甲醇适量洗涤2次, 合并滤液和洗液, 转移至50 mL量瓶中, 加甲醇至刻度, 摇匀, 用0.45 μm微孔滤膜滤过, 取续滤液, 即得。
方法学考察
精密度 精密吸取同一批次荆芥穗药材(编号为S13) 的供试品溶液, 按色谱条件连续进样6次后测定, 以7种成分的峰面积计算RSD值。
线性关系考察 分别精密称取胡薄荷酮、橙皮苷、迷迭香酸、金合欢素7-O-葡萄糖、槲皮素、咖啡酸、芦丁7种对照品适量, 用甲醇配成质量浓度分别为16.878 4、33.756 8、67.513 6、84.392 0、101.270 4 μg·mL-1的胡薄荷酮对照品溶液; 质量浓度分别为25.702 5、51.405 0、64.256 3、77.107 6、102.810 1 μg·mL-1的橙皮苷对照品溶液; 质量浓度分别为25.138 2、50.276 3、62.845 4、75.414 5、87.983 6 μg·mL-1的迷迭香酸对照品溶液; 质量浓度分别为32.312 3、48.783 2、65.635 4、78.452 1、91.657 6 μg·mL-1的金合欢素7-O-葡萄糖溶液; 质量浓度分别为28.767 3、50.513 2、71.673 1、84.231 4、98.455 7 μg·mL-1的槲皮素对照品溶液; 质量浓度分别为3.215 5、6.431 0、8.038 7、9.646 5、12.862 0 μg·mL-1的咖啡酸对照品溶液; 质量浓度分别为2.122 1、3.898 7、5.023 4、7.354 3、9.787 6 μg·mL-1的芦丁对照品溶液。按色谱条件进样测定, 以峰面积为纵坐标(Y), 质量浓度为横坐标(X), 得回归方程。
重复性 平行制备6份同一批次荆芥穗药材(编号为S13) 的供试品溶液, 按色谱条件测定7种成分的含量, 计算RSD值。
稳定性 精密吸取同一荆芥穗药材(编号为S13) 的供试品溶液, 分别于供试品制备0、2、4、8、12、24 h后按色谱条件进样后测定, 以7种成分的峰面积计算RSD值。
加样回收率 取已知含量的荆芥穗药材约1 g, 精密称定, 共6份, 分别按样品-对照品(1∶1) 的比例加入一定量的各对照品, 按“供试品溶液的制备”项下方法制备, 摇匀, 按色谱条件测定各成分的峰面积, 并计算回收率。
结果 1 方法学考察在上述色谱条件下, 各特征峰可达到较好分离, 混合对照品与供试品溶液HPLC色谱图见图 1。
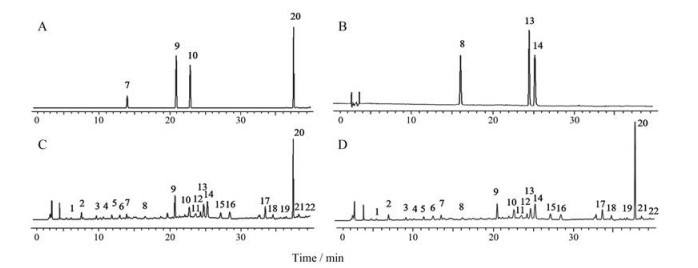
|
Figure 1 The HPLC chromatograms of mixed standard solution (A, B) and sample solution (C, D). 7: Caffeic acid; 8: Rutinum; 9: Hesperidin; 10: Rosmarinic acid; 13: Tilianin; 14: Quercetin; 20: Pulegone; 1-6, 11, 12, 15-19, 21, 22: Unkonwn |
结果22个共有峰的相对峰面积RSD值均小于2%, 其中胡薄荷酮、橙皮苷、迷迭香酸、金合欢素7-O-葡萄糖、槲皮素、咖啡酸、芦丁的相对峰面积RSD分别为0.51%、0.49%、0.70%、0.35%、0.21%、0.02%和0.12%, 表明仪器精密度良好。
1.2 线性关系7个成分的线性回归方程及相关系数见表 2。说明各成分在线性范围内呈良好的线性关系。
| Table 2 Linear analysis of seven components in Schizonepeta tenuifolia panicle |
胡薄荷酮、橙皮苷、迷迭香酸、金合欢素7-O-葡萄糖、槲皮素、咖啡酸、芦丁的相对峰面积RSD分别为1.10%、0.85%、1.29%、1.02%、0.98%、1.61%、1.72%, 均小于2%, 表明该方法的重复性良好。
1.4 稳定性胡薄荷酮、橙皮苷、迷迭香酸、金合欢素7-O-葡萄糖、槲皮素、咖啡酸、芦丁的相对峰面积RSD分别为0.83%、1.05%、1.52%、1.24%、1.32%、1.05%、1.12%, 均小于2%, 表明该供试品溶液在制备后24 h内稳定。
1.5 加样回收率胡薄荷酮、橙皮苷、迷迭香酸、金合欢素7-O-葡萄糖、槲皮素、咖啡酸、芦丁的平均加样回收率分别为102.76%、103.81%、98.84%、97.34%、98.12%、96.54%、96.34%, RSD依次为0.69%、0.98%、1.20%、1.32%、1.28%、1.01%、1.87%, 均小于2%, 表明该方法准确可靠。
2 荆芥穗药材指纹图谱相似度分析将25批荆芥穗供试品色谱图依次导入中药色谱指纹图谱相似度评价系统(2012A版), 以S1色谱图为参照, 采用中位数法, 时间窗宽度设置为0.1 min, 计算相似度。25批次荆芥穗药材的相似度依次为0.927、0.922、0.944、0.922、0.940、0.957、0.910、0.951、0.953、0.951、0.903、0.912、0.951、0.944、0.940、0.931、0.931、0.942、0.932、0.913、0.900、0.909、0.941、0.929、0.935, 相似度均大于0.900。再将25批次荆芥穗样品的相似度值进行箱式图分析, 结果显示该组数据分布均匀, 表明该样品之间具有良好的一致性。本次中药指纹图谱共确定22个共有峰, 其共有峰峰面积占总峰面积的51%~70%, 指认出其中7个共有峰, 分别是咖啡酸(7号峰), 芦丁(8号峰), 橙皮苷(9号峰), 迷迭香酸(10号峰), 金合欢素7-O-葡萄糖(13号峰), 槲皮素(14号峰), 胡薄荷酮(20号峰)。以胡薄荷酮作为参照峰, 计算各共有峰相对保留时间和相对峰面积, 其中相对保留时间RSD < 0.4%, 相对峰面积差异较大, RSD介于8.56%~61.78%。
3 荆芥穗药材中多指标成分含量测定取混合对照品溶液和25批荆芥穗样品供试品溶液, 按上述色谱条件进样分析, 按外标法以峰面积计算含量, 结果见表 3。
| Table 3 Determination results of 7 components in 25 batches of samples |
CA常应用于评价中药指纹图谱相似性, 是目前常用的数据分析方法之一。采用SPSS 25.0软件, 以22个共有峰的峰面积为变量, 选择平方欧式距离作为测度进行聚类分析, 探讨不同批次之间样本数据的一致性。结果见图 2, 当选择平方欧式距离为25作为测度时, 可聚为2类, 其中来自河北安国的S11~S15、来自四川新荷花饮片公司的S21~S25聚为一类。其余来自河北新乐的S16~S20以及来自河南洛阳S1~S10聚为另外一类。当选择平方欧氏距离为5作为测度时, 可聚为3类, S11~S15、S21~S25聚为第1类, S16~S20聚为第2类, S1~S10聚为第3类。说明同一省份的不同产地、不同批次的荆芥穗药材在化学成分组成及含量上具有相似性, 但又具有一定差异性, 且四川新荷花的荆芥穗饮片质量与河北安国的荆芥穗药材质量相似, 提示可能为其道地产区。同时运用多元变量统计软件SIMCA 14.1得到PCA得分图, 见图 3, 结果将其分为3类, S11~S15、S21~S25分为第1类, S1~S5、S6~S10分为第2类、S16~S20分为第3类, 对比CA与PCA结果, 发现两者分类结果一致, 进一步证明了聚类分析的合理性。

|
Figure 2 Cluster analysis of 25 batches of Schizonepeta tenuifolia panicle samples |
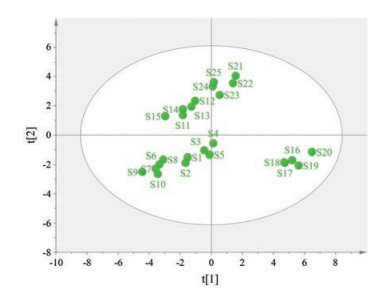
|
Figure 3 Principal component analysis scores of 25 batches of Schizonepeta tenuifolia samples |
PCA是一种掌握主要矛盾的统计方法。采用SPSS 25.0软件, 对25批荆芥穗药材指纹图谱的22个共有峰的峰面积首先进行标准化数据处理, 再进行运算, 按照主成分个数的提取原则, 提取出特征值大于1的主成分对应的前4个主成分, 其中第1主成分贡献值为8.924、第2主成分贡献值为6.255、第3主成分贡献值为2.117、第4主成分贡献值为1.324, 4个主成分的累计方差贡献率可达84.639%, 几乎囊括了指纹图谱大部分信息, 说明在荆芥穗药材中, 这4个主要成分反映了22个成分与不同样品之间的关系。进而得到主成分分析碎石图, 结果显示, 提取出来的4个主成分的坡度较陡, 其他成分坡度较为平缓, 表明这4个主成分可能是评价荆芥穗药材具有代表性的变量。以主成分为变量, 得到主成分矩阵, 见表 4, 可知共有色谱峰1~4、7~12、14、22代表了第1主成分的信息, 共有色谱峰6、13、15~17、19、20代表了第2主成分的信息, 共有色谱峰5、18、21代表了第3主成分的信息, 共有色谱峰19代表了第4主成分的信息。综上, 通过主成分分析降维处理后所提取的4个主成分可以作为代表荆芥穗药材指纹图谱中22个共有峰的主要信息。
| Table 4 Principal component analysis of 25 batches of Schizonepeta tenuifolia |
OPLS-DA是一种基于特征变量的回归方法, 被广泛应用于多元校正。通过CA与PCA, 可将荆芥穗样品分为3类。进一步进行OPLS-DA分析, 通过OPLS-DA得分图, 结果发现累积解释能力参数(R2X、R2Y) 分别为0.952、0.920, 预测能力参数(Q2) 为0.849, 均大于0.5。表明所建立的模型稳定可靠、预测能力强, 可以用于区分不同产地的荆芥穗药材。由图 4结果可得, 荆芥穗样品聚类良好, 分离显著, 与CA、PCA分类结果一致, 从而进一步验证了分析的合理性。图 5代表了25批样品里22个共有色谱峰的载荷图, 主要说明样品中22个共有色谱峰的离散程度、样本与整体的关系。结果显示, 其中偏离中心较大的5个共有色谱峰分别为9、10、13、14和20号色谱峰, 可以明显反映出样品的整体信息。经前面指纹图谱鉴定, 共有色谱峰9、10、13、14、20分别为橙皮苷、迷迭香酸、金合欢素7-O-葡萄糖、槲皮素、胡薄荷酮。
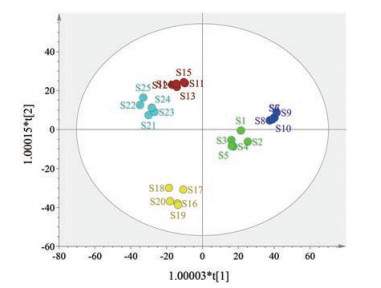
|
Figure 4 Orthogonal partial least squares-discriminant analysis scores of 25 batches of Schizonepeta tenuifolia spike samples |
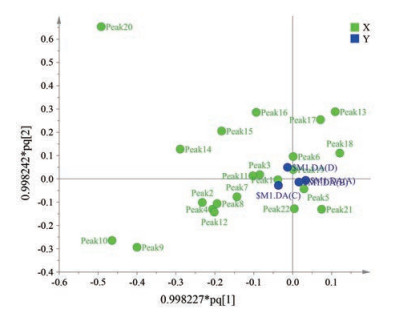
|
Figure 5 Loading diagram of 25 batches of Schizonepeta tenuifolia panicles |
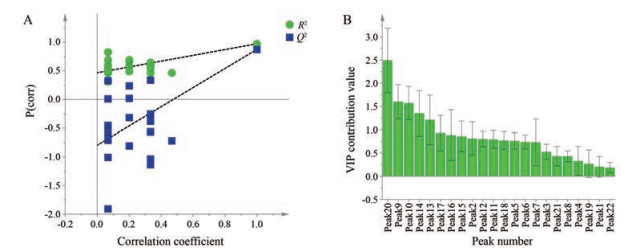
对建立的OPLS-DA模型进行200次置换检验, 图 6A中Q2与R2分别代表累积交叉有效性与累积方差值, 结果显示, R2和Q2的截距值分别为0.487 8和-0.759 4, 右边的R2和Q2值均大于0.9, 位于左边的R2和Q2值均小于其最右边的值, 并且Q2回归线截距为负值, 说明建立的OPLS-DA模型没有拟合现象, 具有较好的预测能力, 从而进一步证明了上述分析的合理性, 可以用来判别分析不同产地及批次的荆芥穗。结合变量重要性投影VIP法, 如图 6B, 在95%置信区间内, 以VIP贡献值大于1作为筛选标准, 结果筛选出5个标志性差异物, 其中20号峰的VIP贡献值为2.49、9号峰的VIP贡献值为1.60、10号峰的VIP贡献值为1.57、14号峰的VIP贡献值为1.35、13号峰的VIP贡献值为1.21, 其VIP贡献值均大于1, 说明这5类成分影响荆芥穗药材的质量, 可以作为荆芥穗药材的潜在质量标志物。
|
Figure 6 OPLS-DA replacement test chart (A) and VIP chart of each component of 25 batches of samples (B) |
本实验在确定液相色谱条件方法时, 由于荆芥穗化学成分较多, 等度洗脱无法表示所有成分, 故选择梯度洗脱方式。流动相的选择分别考察了乙腈-0.02%甲酸水、乙腈-0.2%磷酸水、乙腈-0.1%磷酸水三种体系, 其中乙腈-0.1%磷酸水分离效果最好, 则确定乙腈-0.1%磷酸水作为流动相。色谱柱的选择考察了三根不同品牌、不同型号的色谱柱, 最终确定使用InertSustain C18柱。此外还对检测波长、流速、柱温等进行了考察, 最终确定了色谱条件。在共有峰的确定上, 本研究建立的HPLC方法共确定了22个共有峰, 对其中7个成分进行了含量测定。结果表明, 胡薄荷酮与橙皮苷、迷迭香酸含量较高。其中单萜类成分胡薄荷酮和薄荷酮约占挥发油总量的70%以上[7], 具有抗炎镇痛[8, 9]、抗过敏[10]及抗病毒[11]等活性。黄酮类物质橙皮苷可抑制流感病毒唾液酸酶的活性和抑制膜融合, 具有抗病毒的作用[12]。酚酸类物质迷迭香酸具有抗过敏、免疫抑制及抗氧化等药理活性[13]。
由于中药本身具有规范性较差的特点, 其质量易受多种因素的影响, 因此需要通过化学模式识别等方式进行评价。聚类分析结合PCA结果显示, 河北安国可能为其道地产区。后使用主成分分析以及偏最小二乘判别进一步分析, 筛选出5个具有统计学意义的差异标志物, 分别为橙皮苷、迷迭香酸、金合欢素7-O-葡萄糖、槲皮素、胡薄荷酮。从分析结果来看, 不同批次药材在成分含量上存在差异, 反映了产地和环境对药材品质的影响, 表明建立全面质量控制条件的必要性。
综上所述, 本研究首次采用HPLC结合多指标成分含量测定的方法, 指认了7个主要成分, 之后采用化学模式识别分析方法中的CA、PCA及OPLS-DA, 筛选出了5个影响荆芥穗药材质量的差异成分, 为荆芥穗药材质量可控制提供参考。
作者贡献: 张群主要进行了本文的撰写工作、实验设计和论文修改等。罗沙主要进行了本文的选题设计、实验思路、方法建立、实验数据处理等。李洁、李贝、牛文意对本文的选题设计、实验思路以及文章写作及修改提供了宝贵的意见, 以及实验帮助。谭睿从选题设计、实验思路、文章修改等方面进行了专业指导。
利益冲突: 所有作者声明本文不存在任何利益冲突。
| [1] |
Gu GG. Shennong Herbal Classic (神农本草经)[M]. Beijing: Academy Press, 2007: 202.
|
| [2] |
Ding ZP, Jiang XB, Ding MS, et al. Experience of treating abortion and pregnancy obstruction with Schizonepeta tenuifolia[J]. Shandong J Tradit Chin Med (山东中医杂志), 2020, 39: 1115-1119. |
| [3] |
Li SZ. Compendium of Materia Medica. Volume Ⅰ (本草纲目·上册)[M]. Liu HR, Ed. Beijing: People's Health Publishing House, 1982: 913.
|
| [4] |
Sheng JA. Definition of Essential Drugs (要药分剂释义)[M]. Taiyuan: Shanxi Science and Technology Press, 2011: 65.
|
| [5] |
Chinese Pharmacopeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020: 244.
|
| [6] |
Taiwan Chinese Pharmacopoeia Editing Group of the Department of Health of the Executive Yuan. Taiwan Chinese Pharmacopoeia (台湾中药典)[M]. 2nd Ed. Taiwan: Committee on Traditional Chinese Medicine, 2013: 290-291.
|
| [7] |
Wang F, Wen TQ, Sang WT, et al. Research status of chemical constituents and pharmacological effects of volatile oil from Schizonepeta tenuifolia[J]. Cent South Pharm (中南药学), 2017, 15: 312-318. |
| [8] |
Wen TQ. Anti-inflammatory Effects of Schizonepeta tenuifolia Volatile Oil and Pulegone on LPS Poisoning Model Mice and the Mechanism of NLRP3 Pathway (荆芥挥发油与胡薄荷酮对LPS中毒模型小鼠的抗炎效应及NLRP3通路机制研究)[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2017.
|
| [9] |
Xue ZB. Preparation, Quality Analysis and Activity Evaluation of Huoluo oil, an Anti-inflammatory and Analgesic Traditional Chinese Medicine (一种抗炎镇痛中药活络油的制备、质量分析和活性评价)[D]. Shanghai: East China University of Technology, 2014.
|
| [10] |
Ren HK, Liu YH, Meng H, et al. Study on anti allergic effect of compound extract of Schizonepeta tenuifolia[J]. J Light Ind (轻工学报), 2016, 31: 44-48. |
| [11] |
Zhang X, Wang WY, Zhang MQ, et al. Effects of 15 Chinese herbal extracts on spore germination and growth of three edible fungi[J]. Shaanxi Agric Sci (陕西农业科学), 2017, 63: 11-14. |
| [12] |
Li XF, Jiang H. Pharmacological mechanism and research progress of hesperidin[J]. Hainan Med (海南医学), 2016, 27: 2337-2340. |
| [13] |
Hu JH, Liu LL, Zhang YH, et al. Simultaneous determination of caffeic acid and rosmarinic acid in Perilla leaves and Schizonepeta tenuifolia from different habitats by HPLC[J]. Chin Herb Med (中草药), 2015, 46: 2155-2159. |
 2022, Vol. 57
2022, Vol. 57


