氧气是人类生存不可缺少的气体, 氧气进入机体后一般以氧分子的形式存在。但当机体发生病理反应时, 氧被还原成超氧阴离子、过氧化氢和羟自由基, 这些活性氧簇(ROS) 诱发机体的氧化应激状态后, 破坏机体内的氧化还原平衡, 使得过量的ROS堆积从而引起体内的脂质、DNA等细胞成分的损伤, 导致神经退行性疾病例如阿尔茨海默症, 或是由内分泌紊乱引起的2型糖尿病, 以及骨密度、骨质量下降引发的骨质疏松症等疾病[1-4]。而持续的氧化应激状态还将造成细胞内信息转导的紊乱进而导致细胞凋亡, 使得机体趋老化、趋弱化[5-8]。因此, 开发出新天然抗氧化药物十分重要。
海洋真菌种类繁多, 由于其自身代谢生长途径独特、遗传背景复杂, 其代谢产生的化合物类型多、活性强[9], 其结构类型包括聚酮、生物碱、环肽、大环内酯、萜类等, 大多具有抗肿瘤、抗菌、抗病毒、抗氧化等[10-12]活性, 是近年来潜力巨大的新型资源, 成为了人们寻找高效低毒药物前体的新来源。链格孢属(Alternaria sp. F49) 是世界经济上最重要的真菌之一, 它在自然界分布广泛, 是多种活性物质的产生菌, 是紫杉烷类、麦角甾酮等天然产物的重要来源, 并且链格孢菌系的天然产物还具有抗癌、抗肿瘤、阻断病毒入侵细胞等[13, 14]活性, 具有较高的研究价值和潜在的开发应用前景。
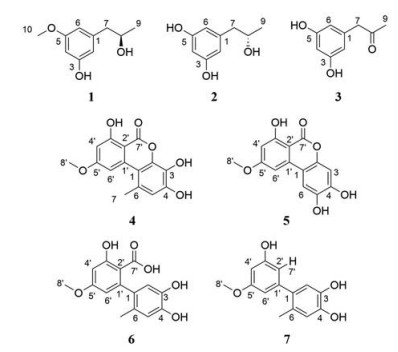
本课题组前期实验已从Alternaria sp. F49的大米发酵产物中分离得到14个化合物, 其中2个新化合物[15]。随后进一步对该菌的PDB次级代谢产物进行了提取纯化, 从中分离得到1个新苯酚类化合物和6个已知化合物(图 1)。
|
Figure 1 The chemical structures of compounds 1-7 |
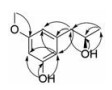
化合物1 无色透明油状物, 由高分辨质谱HR-ESI-MS得到准分子量为m/z 181.086 6 [M-H]-, 并结合核磁谱推测得出该化合物分子式为C10H14O3, 以此计算出其不饱和度为4。紫外最大吸收波长λmax (logε) 分别为204 (4.92)、275 (3.62)、281 (3.66) nm。氢谱显示9个信号: 2个活泼氢信号δH 4.51 (d, J = 5.0 Hz, 8-OH)、9.23 (s, 3-OH), 3个芳香氢信号δH 6.14 (t, J = 2.0 Hz, H-4)、6.19 (t, J = 2.0 Hz, H2-2, 6), 1个连氧的次甲基信号δH 3.76 (m, H-8), 1个亚甲基信号δH 2.39 (dd, J = 13.5, 6.5 Hz, H-7a)、2.58 (dd, J = 13.5, 6.5 Hz, H-7b), 1个甲氧基信号δH 3.65 (s, H3-10), 1个甲基信号δH 1.01 (d, J = 6.0 Hz, H3-9)。碳谱显示10个信号: 1个甲基信号δc 23.1 (CH3, C-9), 1个甲氧基信号δc 54.7 (CH3, C-10), 1个亚甲基信号δc 45.7 (CH2, C-7), 1个连氧的次甲基信号δc 67.1 (CH, C-8), 3个sp2杂化的次甲基信号δc 98.7 (CH, C-4)、105.8 (CH, C-6)、108.8 (CH, C-2), 3个sp2杂化的季碳信号δc 141.6 (C, C-1)、158.1 (C, C-3)、160.1 (C, C-5)。这些数据(表 1) 都与已知化合物orcinotriol基本一致[16], 唯一不同的是化合物1 (图 2) C-5上是一个甲氧基。并且通过比对化合物1与orcinotriol中各自C-8位上的旋光性, 发现orcinotriol的旋光度值为[α]
| Table 1 The 1H and 13C NMR data for compound 1 (500/125 MHz, DMSO-d6, J in Hz) |
|
Figure 2 Selected HMBC correlations of compound 1 |
化合物2 浅黄色油状物, 分子式C9H12O3, HR-ESI-MS m/z 167.078 7 [M-H]-, 不饱和度为4; 1H NMR (DMSO-d6, 500 MHz): δH 9.01 (1H, s, 3-OH), 6.03 (1H, t, J = 2.0 Hz, H-2), 6.03 (1H, t, J = 2.0 Hz, H-6), 6.01 (1H, t, J = 2.0 Hz, H-4), 4.49 (1H, d, J = 4.5 Hz, 8-OH), 3.72 (1H, m, H-8), 2.52 (2H, dd, J = 13.5, 6.5 Hz, H-7b), 2.29 (2H, dd, J = 13.5, 6.5 Hz, H-7), 0.99 (3H, d, J = 6.0 Hz, H-9); 13C NMR (DMSO-d6, 125 MHz): δC 158.0 (C, C-3), 158.0 (C, C-5), 141.3 (C, C-1), 107.3 (CH, C-2), 107.2 (CH, C-6), 100.1 (CH, C-4), 67.2 (CH, C-8), 45.7 (CH2, C-7), 23.0 (CH3, C-9)。这些数据都与文献数据[16]基本一致, 因此将该化合物2的结构定为orcinotriol。
化合物3 无色透明油状物, 分子式C9H10O3, ESI-MS m/z: 167.07 [M+H]+, 不饱和度为5; 1H NMR (DMSO-d6, 500 MHz): δH 9.17 (1H, s, 3-OH), 6.09 (1H, t, J = 2.0 Hz, H-4), 6.04 (1H, t, J = 2.0 Hz, H-2), 6.04 (1H, t, J = 2.0 Hz, H-6), 3.50 (2H, s, H-7), 2.06 (3H, s, H-9); 13C NMR (DMSO-d6, 125 MHz): δC 206.1 (C, C-8), 158.4 (C, C-3), 158.4 (C, C-5), 136.5 (C, C-1), 107.5 (CH, C-2), 107.5 (CH, C-6), 100.9 (CH, C-4), 51.1 (CH2, C-7), 29.1 (CH3, C-9)。这些数据都与文献数据[16, 17]基本一致, 因此将该化合物3的结构定为α-acetylorcinol。
化合物4 淡橘黄色粉末, 分子式C15H12O5, ESI-MS m/z: 273.07 [M+H]+, 不饱和度为10; 1H NMR (DMSO-d6, 500 MHz): δH 7.30 (1H, d, J = 1.8 Hz, H-6'), 6.82 (1H, s, H-5), 6.63 (3H, d, J = 1.8 Hz, H-4'), 3.99 (13H, s, H-8'), 2.74 (3H, s, H-7); 13C NMR (DMSO-d6, 125 MHz): δC 167.3 (C, C-5'), 165.8 (C, C-7'), 165.4 (C, C-3'), 148.2 (C, C-4), 142.3 (C, C-2), 139.5 (C, C-1'), 132.4 (C, C-3), 127.3 (C, C-6), 117.7 (CH, C-5), 110.1 (C, C-1), 104.2 (CH, C-6'), 99.7 (CH, C-4'), 99.2 (C, C-2'), 56.3 (CH3, C-8'), 24.9 (CH3, C-7)。这些数据都与文献数据[18]基本一致, 因此将该化合物4的结构定为3'-hydroxyalternariol 5-O-methyl ether。
化合物5 橘黄色粉末, 分子式C14H10O6, ESI-MS m/z: 275.05 [M+H]+, 不饱和度为10; 1H NMR (DMSO-d6, 500 MHz) δH 11.50 (1H, s, 3'-OH), 7.51 (1H, s, H-6), 7.02 (1H, d, J = 2.4 Hz, H-6'), 6.79 (1H, s, H-3), 6.54 (1H, d, J = 2.4 Hz, H-4'), 3.92 (3H, s, 5'-OMe); 13C NMR (DMSO-d6, 125 MHz) δC 166.4 (C, C-5'), 164.6 (C, C-7'), 163.3 (C, C-3'), 148.8 (C, C-2), 143.8 (C, C-4), 143.6 (C, C-5), 130.2 (C, C-1'), 108.7 (CH, C-6), 108.6 (C, C-1), 103.2 (CH, C-3), 99.8 (CH, C-4'), 98.5 (CH, C-2'), 97.8 (CH, C-6'), 55.9 (CH3, 5'-OMe)。这些数据都与文献数据[19]基本一致, 因此将该化合物5的结构定为altenusiol。
化合物6 淡黄色固体, 分子式C15H14O6, ESI-MS m/z: 291.08 [M+H]+, 不饱和度为9; 1H NMR (DMSO-d6, 500 MHz) δH 9.33 (1H, br s, 3'-OH), 8.70 (1H, br s, 4-OH), 8.65 (1H, br s, 3-OH), 6.52 (1H, s, H-5), 6.43 (1H, s, H-2), 6.37 (1H, d, J = 2.7 Hz, H-4'), 6.11 (1H, d, J = 2.7 Hz, H-6'), 3.80 (3H, s, 5'-OCH3), 1.90 (3H, s, 6-CH3); 13C NMR (DMSO-d6, 125 MHz) δC 175.0 (C, 2'-COOH), 165.9 (C, C-3'), 165.0 (C, C-5'), 148.0 (C, C-1'), 145.0 (C, C-3), 143.0 (C, C-4), 135.5 (C, C-1), 127.5 (C, C-6), 118.0 (CH, C-5), 117.0 (CH, C-2), 111.0 (CH, C-6'), 107.0 (C, C-2'), 101.0 (CH, C-4'), 56.0 (CH3, 5'-OCH3), 19.5 (CH3, 6-CH3)。这些数据都与文献数据[20]基本一致, 因此将该化合物6的结构定为altenusin。
化合物7 浅黄色油状物, 分子式C14H14O4, ESI-MS m/z: 247.09 [M+H]+, 不饱和度为8; 1H NMR (DMSO-d6, 500 MHz) δH 9.42 (1H, br s, 3'-OH), 8.78 (1H, br s, 4-OH), 8.72 (1H, br s, 3-OH), 6.60 (1H, s, H-5), 6.54 (1H, s, H-2), 6.25 (1H, br s, H-4'), 6.21 (1H, br s, H-2'), 6.20 (1H, br s, H-6'), 3.69 (3H, s, 5'-OCH3), 2.05 (3H, s, 6-CH3); 13C NMR (DMSO-d6, 125 MHz) δC 160.4 (C, C-5'), 158.5 (C, C-3'), 144.8 (C, C-1'), 144.5 (C, C-3), 143.5 (C, C-4), 132.7 (C, C-1), 125.3 (C, C-6), 118.0 (CH, C-5), 117.1 (CH, C-2), 109.3 (CH, C-2'), 106.2 (CH, C-6'), 99.7 (CH, C-4'), 55.4 (CH3, 5'-OCH3), 19.8 (CH3, 6-CH3)。这些数据都与文献数据[21]基本一致, 因此将该化合物7的结构定为5'-methoxy-6-methyl-biphenyl-3, 4, 3'-triol。
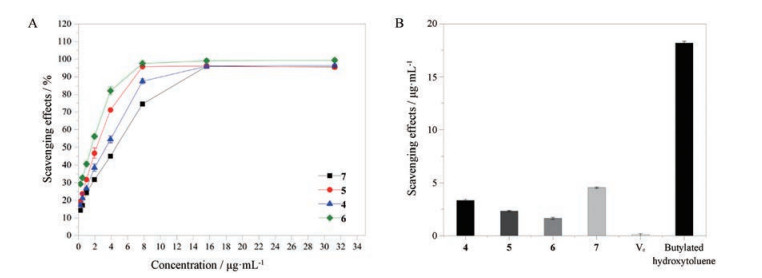
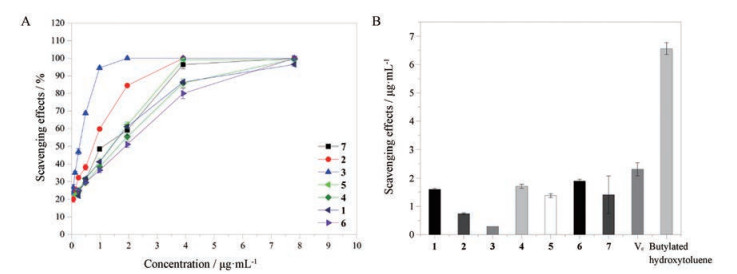
2 化合物自由基清除活性采用DPPH自由基清除能力以及ABTS自由基清除能力的方法对化合物的抗氧化活性进行评估, 结果表明(图 3) 化合物4~7都显示出非常强的DPPH自由基清除活性, 并且IC50值明显低于阳性对照二丁基羟基甲苯(BHT) (IC50 = 18.20 ± 0.16 μg·mL-1), 高于抗坏血酸Vc (IC50 = 0.08 ± 0.01 μg·mL-1), 其IC50值分别为3.34 ± 0.10、2.33 ± 0.06、1.64 ± 0.10和4.54 ± 0.07 μg·mL-1; 化合物1~7都显示出非常强的ABTS自由基清除活性(图 4), IC50值分别为1.60 ± 0.04、0.74 ± 0.03、0.29、1.71 ± 0.07、1.38 ± 0.07、1.89 ± 0.07和1.41 ± 0.06 μg·mL-1, 都显著低于BHT (IC50 = 6.56 ± 0.21 μg·mL-1), 低于Vc (IC50 = 2.13 ± 0.16 μg·mL-1)。
|
Figure 3 A: DPPH free radical scavenging rate of different compounds (BHT used as positive control); B: The IC50 value of DPPH radical scavenging assay |
|
Figure 4 A: ABTS free radical scavenging rate of different compounds (BHT used as positive control); B: The IC50 value of ABTS radical scavenging assay |
本文对海绵共附生真菌Alternaria sp. F49次级代谢产物进行了系统的化学成分研究, 共分离出7个单体化合物, 其中化合物1为首次分离得到的新化合物。采用DPPH、ABTS法, 以BHT及Vc为阳性对照, 对化合物抗氧化活性进行评价, 结果表明, 化合物4~7对DPPH以及ABTS均有非常强的自由基清除能力; 化合物1~3有非常强的ABTS自由基清除能力。
实验部分核磁共振波谱仪(德国Bruker公司): Bruker Avance DRX500型(500/125 MHz, TMS为内标)。HR-ESI-MS (德国Bruker公司): Bruker micro TOF-QII mass spectrometer (Bruker, Fällanden, Switzerland)。EYELAN-1000型旋转蒸发仪(日本Eyela公司)。高效液相色谱仪(美国Agilent公司): Agilent 1200 (泵型号: G1212C, 紫外检测器型号: G1315D), YMC-Pack (C8 250 mm × 10 mm I.D. S-5 μm, 12 nm)。TLC: 高效薄层色谱板(HPTLC) 为德国Merck公司产品和烟台江友硅胶开发有限公司产品。显色剂: 10%硫酸香兰素溶液。常用有机试剂均为上海阿拉丁的分析纯产品。
1 发酵培养与提取分离海绵共附生真菌Alternaria sp. F49在25 ℃的PDA培养基上培养7天。将其接种到液体PDB培养基中(马铃薯: 200 g, 海盐: 2.5 g, 蒸馏水: 1 000 mL, pH 7.4~7.8), 并在25 ℃的摇床中摇72 h (170 r·min-1)。将1 mL种子悬浮液接种到300 mL的PDB培养基中, 培养30天, 进行放大发酵。
2 提取分离发酵物用丙酮浸泡, 然后用乙酸乙酯提取3次。之后分别用石油醚进行萃取(去除油脂) 得到粗浸膏。粗浸膏用硅胶柱、LH-20凝胶柱和高效液相得到化合物1~7。具体过程为: 发酵物捣碎, 浸泡到丙酮中超声提取20 min后过滤蒸干(A), 滤渣用乙酸乙酯提取3次(B)。将A、B合并后分别用石油醚、乙酸乙酯萃取, 最后得到乙酸乙酯相(16.43 g)。粗浸膏首先用中压硅胶柱进行分离, 流动相为石油醚(petroleum ether)/乙酸乙酯(EtOAc)、梯度洗脱(V/V, 50∶1, 30∶1, 20∶1, 10∶1, 5∶1, 1∶1, 0∶1), 再用乙酸乙酯(EtOAc)/甲醇(methanol) 梯度洗脱(V/V, 20∶1, 10∶1, 0∶1)。洗脱下来的流分用TLC检测并合并为12个流分。利用高效液相色谱(HPLC) 法对粗组分Fraction 6~Fraction 10做进一步分离纯化。Fraction 6 (0.485 6 g) 经HPLC分离(5%~100% MeOH/H2O) 出6个流分(Fr.6.1~Fr.6.6); Fr.6.1流分经HPLC纯化(30% MeOH/H2O) 得到化合物3 (6.7 mg); Fr.6.2流分经HPLC纯化(40% MeOH/H2O) 得到化合物1 (3.7 mg); Fraction 7 (0.240 4 g) 经HPLC分离(5%~100% MeOH/H2O) 出5个流分(Fr.7.1~Fr.7.5); Fr.7.1流分经HPLC纯化(25% MeOH/H2O) 得到2 (4.5 mg); Fr.7.3流分经HPLC (55% MeOH/H2O) 分离出2个流分(Fr.7.3.1和Fr.7.3.2); Fr.7.3.1流分经HPLC纯化(35% CH3CN/H2O) 得到化合物6 (1.0 mg)、7 (1.6 mg)。Fraction 10 (0.536 9 g) 经HPLC分离(5%~100% MeOH/H2O) 出4个流分(Fr.10.1~Fr.10.4); Fr.10.4流分经HPLC纯化(80% MeOH/H2O) 得到化合物5 (10.8 mg)、4 (6.4 mg)。
3 体外抗氧化活性测定 3.1 清除DPPH自由基活力测定参考文献[22]的方法, 首先, 选择最大样品终浓度(250 μg·mL-1) 对化合物进行体外抗氧化初筛, 表明只有化合物4~7清除DPPH自由基活力较好, 因此针对这4个样品进行浓度细筛。其次, 用甲醇溶剂将待测样品按二倍稀释法配成一系列不同样品浓度, 取不同浓度的样品溶液100 μL和DPPH自由基溶液(0.1 mmol·L-1, 无水乙醇配制) 100 μL于96孔板中, 每个浓度设定3个重复。样品加入后于快速混匀机上充分振荡混匀, 25 ℃避光静置反应30 min, 用酶标仪在517 nm处测定所得吸光度值为A1。同时用100 μL无水乙醇代替100 μL DPPH自由基溶液, 作为样品参比组, 其测定所得吸光度值为A2; 用样品100 μL甲醇代替100 μL不同浓度样液, 作为空白组, 其测定所得吸光度值为A0。用甲醇进行校正凋零, 阳性对照为BHT。按公式(1) 计算:
| $ {\rm{DPPH}}自由基清除率 (\%) = (1 - \frac{{A}_{1}-{A}_{2}}{{A}_{0}} ) × 100 $ | (1) |
参照文献[23]的方法, 配制ABTS贮存母液(7 mmol·L-1, 蒸馏水配制) 和过硫酸钾水溶液(2.45 mmol·L-1), 临用之前按1∶1比例进行混合, 室温避光静置反应16 h后, 用甲醇进行稀释, 使得734 nm处所测的吸光值为0.70 ± 0.02, 即ABTS自由基溶液。用甲醇溶剂将待测样品按二倍稀释法配成一系列不同样品浓度。取不同浓度样液100 μL和ABTS自由基溶液100 μL于96孔板中, 每个浓度设定3个重复。样品加入后于快速混匀机上充分振荡混匀, 25 ℃避光反应10 min, 734 nm处测定吸光度值Ap。同时用100 μL甲醇代替100 μL ABTS自由基溶液, 作为样品参比组, 其测定所得吸光度值为Ac; 用样品100 μL甲醇代替100 μL不同浓度样液, 作为空白组, 其测定所得吸光度值为Amax。用甲醇进行校正凋零, 阳性对照为BHT。按公式(2) 计算:
| $ {\rm{ABTS}}自由基清除率 (\%) = (1 - \frac{{A}_{\mathrm{p}}-{A}_{\mathrm{c}}}{{A}_{\mathrm{m}\mathrm{a}\mathrm{x}}} ) × 100 $ | (2) |
作者贡献: 林舒婷进行实验研究并分析数据; 陈雨实、冷佳荣负责数据补充、论文撰写及排版; 田永奇对整篇文章进行设计并做了主要修改; 汪少芸对文章进行了审查和指导。
利益冲突: 本研究内容无任何冲突。
| [1] |
Burgos E, Abad J, Maranon A, et al. Relationship between oxidative stress, ER stress, and inflammation in type 2 diabetes: the battle continues[J]. J Clin Med, 2019, 8: 22. |
| [2] |
Chrysostomou V, Rezania F, Trounce I, et al. Oxidative stress and mitochondrial dysfunction in glaucoma[J]. Curr Opin Pharmacol, 2013, 13: 12-15. DOI:10.1016/j.coph.2012.09.008 |
| [3] |
Hua R, Zhang J, Riquelme M, et al. Connexin gap junctions and hemichannels link oxidative stress to skeletal physiology and pathology[J]. Curr Osteopor Rep, 2021, 19: 66-74. DOI:10.1007/s11914-020-00645-9 |
| [4] |
Li M, Zhou Y, Du G, et al. Research progress about the anti-aging effect and mechanism of flavonoids from traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2019, 54: 1382-1391. |
| [5] |
Kovacic P, Pozos R, Somanathan R, et al. Mechanism of mitochondrial uncouplers, inhibitors, and toxins: focus on electron transfer, free radicals, and structure-activity relationships[J]. Curr Med Chem, 2005, 12: 2601-2623. DOI:10.2174/092986705774370646 |
| [6] |
Zhao J. Evaluation of Antioxidative Abilites of Lactobacillus plantarum and the Antioxidative Mechanisms (植物乳杆菌抗氧化评价及抗氧化机制研究)[D]. Zhenjiang: Jiangnan University, 2018.
|
| [7] |
Xie J, Su T, Wei Y, et al. Research progress of antioxidant drugs in myocardial ischemiareperfusion injury[J]. Acta Pharm Sin (药学学报), 2021, 56: 1845-1855. |
| [8] |
Zhuo H. Molecular and Cellular Analysis of the Effects of Cyclohexanol and Cyclohexanone on the Antioxidant System of Earthworm (分子和细胞水平上解析环己醇与环己酮对蚯蚓抗氧化系统的影响及作用机理)[D]. Jinan: Shandong University, 2020.
|
| [9] |
Newman D, Cragg GM. Natural products as sources of new drugs from 1981 to 2014[J]. J Nat Prod, 2016, 79: 629-661. DOI:10.1021/acs.jnatprod.5b01055 |
| [10] |
Ding L, Gu B, Jiao W, et al. New furan and cyclopentenone derivatives from the sponge-associated fungus Hypocrea koningii PF04[J]. Mar Drugs, 2015, 13: 5579-5592. DOI:10.3390/md13095579 |
| [11] |
Jeon J, Julianti E, Oh H, et al. Stereochemistry of hydroxy-bearing benzolactones: isolation and structural determination of chrysoarticulins A-C from a marine-derived fungus Chrysosporium articulatum[J]. Tetrahedron Lett, 2013, 54: 3111-3115. DOI:10.1016/j.tetlet.2013.04.006 |
| [12] |
Peng J, Jiao J, Jing L, et al. Pyronepolyene C-glucosides with NF-κB inhibitory and anti-influenza A viral (H1N1) activities from the sponge-associated fungus Epicoccum sp. JJY40[J]. Bioorg Med Chem Lett, 2012, 22: 3188-3190. DOI:10.1016/j.bmcl.2012.03.044 |
| [13] |
Liang X, Gao J, Pan R. Study on isolation of active components of secondary metabolites of a mangrove endophytic fungus by bioassay-guided method[J]. Chem Bioeng (化学生物工程), 2009, 28: 48-52. |
| [14] |
Liao Y. Studies on the Secondary Metabolites and Bioactivities an Ocean-derived fungi Alternaria sp. 114-1a (一株大洋来源链格孢菌114-1G次级代谢产物及生物活性研究)[D]. Fuzhou: Fujian Agriculture and Forestry University, 2020.
|
| [15] |
Tian Y, Lin S, Liu Y. A new polyketide from a sponge-derived fungus[J]. Acta Pharm Sin (药学学报), 2018, 53: 1134-1138. |
| [16] |
Shigemori H, Tenma M, Shimazaki K, et al. Three new metabolites from the marine yeast aureobasidium pullulans[J]. J Nat Prod, 1998, 61: 696-698. DOI:10.1021/np980011u |
| [17] |
Nukina M, Marumo S. α-Acetylorcinol from Cochliobolus lunata[J]. Agric Biol Chem, 1977, 41: 717-717. DOI:10.1080/00021369.1977.10862571 |
| [18] |
Aly A, Edradaebel R, Indriani ID, et al. Cytotoxic metabolites from the fungal endophyte Alternaria sp. and their subsequent detection in its host plant Polygonum senegalense[J]. Planta Med, 2007, 71: 972-980. |
| [19] |
Kim N, Sohn M, Koshino H, et al. Verrulactone C with an unprecedented dispiro skeleton, a new inhibitor of Staphylococcus aureus enoyl-ACP reductase, from Penicillium verruculosum F375[J]. Bioorg Med Chem Lett, 2014, 24: 83-86. DOI:10.1016/j.bmcl.2013.11.071 |
| [20] |
Phaopongthai J, Wiyakrutta S, Meksuriyen D, et al. Azole-synergistic anti-candidal activity of altenusin, a biphenyl metabolite of the endophytic fungus Alternaria alternata isolated from Terminalia chebula Retz[J]. J Microbiol, 2013, 51: 821-828. DOI:10.1007/s12275-013-3189-3 |
| [21] |
Wang Q, Li B, Yang X, et al. Polyketides with antimicrobial activity from the solid culture of an endolichenic fungus Ulocladium sp.[J]. Fitoterapia, 2012, 83: 209-214. DOI:10.1016/j.fitote.2011.10.013 |
| [22] |
Chen F, Wu A, Shieh P, et al. Evaluation of the antioxidant activity of Ruellia tuberosa[J]. Food Chem, 2006, 94: 14-18. DOI:10.1016/j.foodchem.2004.09.046 |
| [23] |
Re R. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radic Biol Med, 1999, 26: 1231-1237. DOI:10.1016/S0891-5849(98)00315-3 |
 2022, Vol. 57
2022, Vol. 57


