卵巢储备功能下降(decreasing ovarian reserve, DOR) 指女性35岁之前出现卵母细胞数量及质量的下降, 生育能力降低及体内性激素水平紊乱, 出现一系列围绝经期综合征表现如月经稀发、量少、闭经、不孕、潮热、失眠、抑郁等症状, 严重影响其生活质量。对于癌症幸存者中处于育龄期的女性来说, 化疗可通过诱导原始卵泡增殖、诱导生长卵泡闭锁及加速活化而引起卵巢功能衰退, 其细胞毒性机制更可引发炎症反应和氧化损伤, 产生大量活性氧, 造成DOR[1]。
西曲瑞克(cetrorelix) 具有较强的性腺抑制作用, 可有效保护卵巢而不被化疗药物的毒性作用所破坏[2]。而左归丸治真阴肾水不足之证, 在方药配伍方面适合化疗所致的DOR的病证特点。故本次实验选择西曲瑞克联合左归丸作为观察药物, 探讨其对化疗诱导的DOR的防治作用。
材料与方法动物 SPF级雌性ICR小鼠55只, 5周龄, 购于济南朋悦实验动物繁育有限公司[合格证号: SCXK (鲁) 20170174], 体质量30 ± 3 g, 动物进入暨南大学动物实验中心进行实验, 实验前适应性饲养10天以熟悉环境, 室内温度22.5~24.5 ℃, 相对湿度52%~64%, 昼夜明暗交替时间10 h/14 h。本研究中所有动物处理程序均按照实验室动物护理评估与认可协会指导方针和暨南大学实验动物伦理委员会的监督与审查中执行。
药物及配制 化疗药物环磷酰胺(cyclophosphamide, CTX) 购于暨南大学附属第一医院西药房, 厂家: Baxter, 规格: 每瓶0.2 g, 批次: 1B454A。西曲瑞克: 上海迈瑞尔化学技术有限公司生产, 批次: F21267/1 mg。左归丸颗粒剂购于暨南大学附属第一医院中药房, 华润三九医药股份有限公司生产, 组方: 熟地黄颗粒24 g、菟丝子颗粒12 g、山药颗粒12 g、山茱萸颗粒12 g、川牛膝颗粒9 g、龟甲胶12 g、鹿角胶12 g。环磷酰胺溶液配制: 按照50 mg·kg-1给药浓度, 用生理盐水混合配制; 西曲瑞克溶液配制: 成人临床最低给药量为0.22 mg, 换算出实验给药浓度2 mg·kg-1, 用生理盐水混合配制; 左归丸悬液配制: 将颗粒剂倒入研钵中, 研磨成细粉末状, 将纯水加热至沸腾, 按照灌胃浓度1 g·mL-1的浓度来配制; 所有药物现用现配; 每只小鼠每次灌胃0.3 mL。
主要试剂 生长分化因子9 (growth differentiation factor 9, GDF-9)、脑源性神经营养因子(brain derived neurotrophic factor, BDNF)、白血病抑制因子(leukemia inhibitory factor, LIF)、活性氧(reactive oxygen species, ROS)、一氧化氮合酶(nitric oxide synthase, NOS)、卵泡刺激素(follicle-stimulating hormone, FSH)、雌二醇(estradiol, E2) ELISA试剂盒均购自江苏酶免实业有限公司; P53 (1C12) mouse mAb、P21 Waf1/Cip1 (DCS60) mAb、沉默信息调节因子2相关酶类1 (SIRT1) (1F3) mouse mAb抗体均购自美国Cell Signaling Technology公司; Rabbit anti-mouse IgG抗体购自成都正能生物技术有限责任公司; GAPDH抗体购自英国Abcam公司。
分组及给药 55只小鼠共分为对照组、模型组、西曲瑞克组、左归丸组、联合用药组(左归丸+西曲瑞克组), 每组11只。第1~5天给予西曲瑞克组和联合用药组腹腔注射西曲瑞克混悬液2 mg·kg-1, 每天0.2 mL, 其余3组每天予腹腔注射生理盐水0.2 mL; 第6~10天给予对照组腹腔注射生理盐水, 每只0.2 mL, 其余各组每天给予CTX腹腔注射50 mg·kg-1, 每只0.2 mL; 第11~38天给予左归丸组和联合用药组左归丸颗粒剂混悬液灌胃, 浓度为1 g·mL-1, 每只0.3 mL, 其余3组给予纯水灌胃, 每只0.3 mL。
实验结束后取各组小鼠摘眼球取血, 室温静置1 h待血清析出, 随后室温3 000 r·min-1离心15 min, 取上层血清分装, -80 ℃保存备用; 各组小鼠取双侧卵巢称重, 将一侧卵巢用0.2 mL EP管分装好, 放置于-80 ℃冰箱备用; 另一侧卵巢则放入4%多聚甲醛固定液中固定, 常温备用。
动情一般情况观察 观察小鼠动情周期变化, 每天以生理盐水进行阴道分泌物涂片, 于显微镜下观察小鼠阴道脱落细胞变化情况, 区分动情周期, 记录天数。
生长生化因子及氧化应激相关指标检测 ELISA法检测卵巢匀浆中GDF-9、BDNF、LIF、NO、NOS、ROS水平。将小鼠取样所得卵巢组织样本与钢珠放入EP管中, 按100∶1的比例加入裂解液与蛋白酶抑制剂, 置于匀浆机中打磨, 12 000 r·min-1、4 ℃离心30 min, 吸取上清, 操作严格按照ELISA检测按试剂盒的说明进行。
卵巢功能检测 ELISA法检测外周血中FSH、E2水平。将小鼠取样所得血液样本室温下静置1 h, 3 000 r·min-1、4 ℃离心20 min, 分装上层血清, 操作严格按照ELISA检测按试剂盒的说明进行。
SIRT1/P53/P21相关指标检测 免疫组化法检测P53、P21、SIRT1蛋白在卵巢中的表达。将固定于4%多聚甲醛固定液的小鼠卵巢组织送样至武汉塞维尔生物科技公司进行石蜡切片制备, 对石蜡切片依次进行脱蜡、抗原修复、淬灭、封闭、孵育抗体、显色、苏木素复染及封片, 最终晾干切片后在CX43正置显微镜下观察。
统计学方法 采用SPSS26.0统计学软件进行分析, 计量资料以均数±标准差(
为了观察各组小鼠治疗后动情期、动情间期和动情周期变化水平, 通过镜下观察治疗后各组小鼠阴道涂片细胞。结果发现, 与对照组对比, 模型组的动情期(图 1A) 平均减少7.14天, 具有显著性差异(P < 0.01); 与模型组对比, 左归丸组和联合用药组的动情期分别平均增加7.81和6.27天, 具有显著性差异(P < 0.01)。与对照组对比, 模型组的动情间期(图 1B) 平均增加6.94天, 具有显著性差异(P < 0.01); 与模型组对比, 左归丸组和联合用药组的动情间期分别平均下降7.81和6.26天, 具有显著性差异(P < 0.01)。与对照组对比, 模型组的动情周期长度(图 1C) 平均比对照组延长5.20天, 联合用药组在动情周期长度改善上最明显, 较模型组平均缩短4.63天, 具有显著性差异(P < 0.01)。
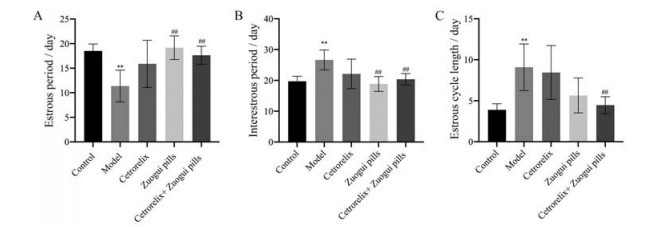
|
Figure 1 In terms of estrous cycle modifications, the Zuogui pills group, cetrorelix group, and cetrorelix+Zuogui pills group can all effectively improve CTX-induced DOR and restore a normal estrous cycle. n = 6, |
用环磷酰胺干预后, 卵巢功能受到损伤的信号反馈到垂体并刺激其分泌更多的FSH以促进卵泡的功能维持, 血清FSH水平显著上升; 给予西曲瑞克、左归丸及联合用药治疗后各组小鼠血清FSH水平(图 2A) 下降, 联合用药组下降水平最为显著(P < 0.01); 与模型组比较, 给药组的血清E2上升水平(图 2B) 均有显著差异(P < 0.05)。
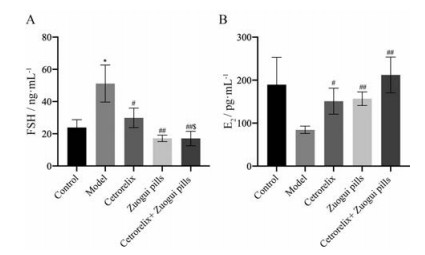
|
Figure 2 According to hormone levels in mice, Zuogui pills group, cetrorelix group, and cetrorelix+Zuogui pills group can reduce follicle-stimulating hormone (FSH) and restore estradiol (E2). n = 4 or 6, |
NOS主要存在卵巢健康的未成熟卵泡的颗粒细胞中, 而在健康的成熟卵泡和即将闭锁卵泡的颗粒细胞中表达很少, NO是由NOS催化合成, 对卵泡的发育与凋亡都起着重要的调节作用, NOS和NO浓度对于卵母细胞的成熟及减数分裂的恢复都有着重要作用, 高浓度NOS、NO可能诱导细胞凋亡并损伤卵巢。通过ELISA法检测治疗后各组卵巢匀浆NOS和NO浓度, 模型组NOS浓度(图 3A) 上升(P < 0.05), 经治疗后, 西曲瑞克组NOS浓度反而上升(P < 0.01), 联合用药组比模型组明显下降(P < 0.01); 与对照组比较, 模型组NO浓度(图 3B) 明显上升(P < 0.01), 3个治疗组的NO浓度均明显下降(P < 0.01), 3个治疗组之间比较, 联合用药组NO浓度下降更明显(P < 0.01)。氧化应激介导损伤的机制与卵母细胞的凋亡有关, 氧化应激会破坏DNA修复过程, 诱导细胞凋亡和自噬, 造成机体功能的衰老与凋亡, 体内产生了过量的氧化应激反应后会产生ROS, ELISA法检测治疗后各组卵巢匀浆ROS浓度(图 3C), 与对照组比较, 模型组ROS浓度明显上升(P < 0.01); 与模型组比较, 3个治疗组的ROS浓度均明显下降(P < 0.05)。
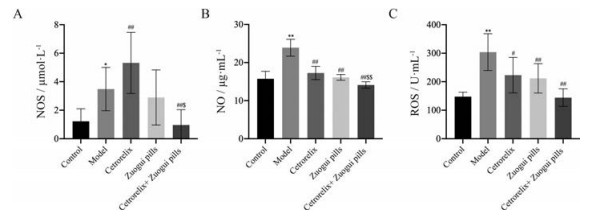
|
Figure 3 In terms of oxidative stress-related factor levels, the Zuogui pills group, cetrorelix group, and cetrorelix+Zuogui pills group can reduce oxidative stress product production in vivo and negatively regulate oxidative stress response related signaling pathways. In terms of nitric oxide (NO) index, the cetrorelix+Zuogui pills group outperforms the Zuogui pills group. n = 8, |
GDF-9在促进卵泡发育、卵母细胞成熟及受精过程中发挥重要作用, 卵泡发育过程中, GDF-9的缺失容易在单层颗粒细胞的初级卵泡阶段发育停止。BDNF可以通过调节卵丘细胞的基因表达来提高卵母细胞成熟的效率。本实验使用ELISA法检测各组卵巢匀浆中生长发育相关因子浓度变化, 研究发现模型组BDNF、GDF-9浓度均显著下降(P < 0.01), 3个治疗组的BDNF及GDF-9浓度均明显上升(P < 0.01), 联合用药组的BDNF浓度上升(P < 0.05) 高于西曲瑞克组和左归丸组(图 4A、B)。LIF广泛参与细胞的增生和分化等环节, 促进胚胎着床, 通过调节卵巢功能参与排卵、早期胚胎发育和胚泡植入, 通过检测发现(图 4C), CXT诱导的DOR模型组的LIF水平降低, 治疗后3个治疗组的LIF浓度上升。
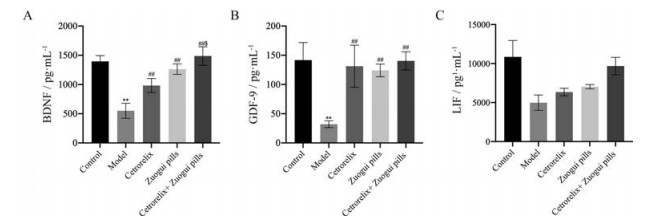
|
Figure 4 Based on changes in the levels of growth biochemical factors, the Zuogui pills group, cetrorelix group, and cetrorelix+Zuogui pills group could stimulate the increase of growth biochemical factors, thereby promoting ovarian cell growth. According to the brain derived neurotrophic factor (BDNF) index, the cetrorelix+Zuogui pills group outperformed the Zuogui pills group alone or the cetrorelix group alone. n = 3 or 6 or 8, |
SIRT1在调节卵子发生和细胞应激反应过程中起关键作用, SIRT1的氧化还原相关靶分子主要是P53, SIRT1使P53去乙酰化来抑制P53依赖性转录和凋亡, 进而修复因应激而引起的DNA损伤, 减少细胞凋亡; 同时在SIRT1启动子区域中存在P53结合位点, 活化的P53可以抑制SIRT1的翻译。P21是P53下游基因中执行激活细胞衰老的靶基因。在本研究中, 使用免疫组化法检测各组小鼠卵巢组织中SIRT1、P53、P21蛋白表达(图 5), 结果发现, 与对照组相比, 模型组SIRT1蛋白表达明显减少, P53蛋白表达明显增多; 与模型组对比, 3个治疗组的SIRT1蛋白表达增加, 其中左归丸组和联合用药组较为显著; 3个治疗组P53蛋白表达均减少, 西曲瑞克组减少较显著。与对照组相比, 模型组P21蛋白表达明显增多; 与模型组对比, 3个治疗组P21蛋白表达均减少, 其中联合用药组的P21蛋白表达减少最显著, 接近对照组水平。
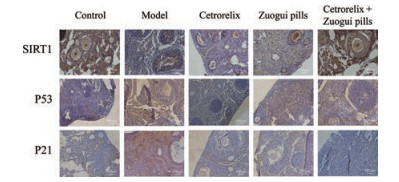
|
Figure 5 Immunohistochemistry was used to detect the protein expression levels of SIRT1, P53, and P21 in the ovarian tissues of mice in each group. In the model group, SIRT1 protein expression was lower than that in the control group, while P53 and P21 protein expression was higher. SIRT1 protein expression increased significantly in the three treatment groups compared to the model group, while P53 and P21 protein expression decreased significantly. Scale bar: 100 μm |
近年来, 关于对促性腺激素释放激素拮抗剂(GnRH-a) 保护卵巢功能的研究很多, 第三代GnRH-a代表药物西曲瑞克可以快速降低FSH和LH[3], 可高效抑制下丘脑-垂体-卵巢轴。化疗药物损害处于分裂增殖期的细胞和生长中的卵泡[4]。故在化疗前使用GnRH-a可通过下调性腺轴, 抑制卵巢内小卵泡的有丝分裂, 短暂抑制卵巢生长发育, 保存原始卵泡, 保护卵巢功能。
中医自古以来并无“卵巢储备下降”的病名, 根据DOR患者表现出月经失调甚至闭经、不孕等围绝经期综合征的症状, 将本病归纳为中医学中“经水早断”、“闭经”、“血枯”等范畴。清·傅山谓之“经水出诸肾”, 《素问·六节脏象论》认为“肾者, 主蛰, 封藏之本, 精之处也”, 精为先天之精、生殖之精。故可以看出肾虚是DOR发生的基本病机。本病的一系列临床症状均指向肾阴虚, 故治疗上应采取补肾养阴法。《景岳全书》中提到的左归丸可填补真阴不足, 治疗“虚热往来, 自汗, 盗汗, 或神不守舍, 血不归原, 或虚损伤阴, 或遗淋不禁, 或气虚昏运, 或眼花耳聋, 或口燥舌干, 或腰酸腿软, 凡精髓内亏, 津液枯涸等证”。左归丸方用熟地黄为君药, 补肾益阴, 补养精血冲任; 山药健脾养阴; 山茱萸收涩补肝为臣药; 配以枸杞、川牛膝补益肝肾; 加上鹿角胶和龟甲胶二药以参合阴阳, 调督任之元, 故能大补肾阴。另外菟丝子补肾阳, 乃“阴中求阳”之意, 促成水火交济, 在方药配伍方面适合化疗所致的DOR的病证特点。故本研究选择西曲瑞克联合左归丸作为观察药物, 探讨其对化疗诱导的DOR的防治作用。
从动情周期和性激素指标分析, 联合用药组动情期延长, 动情间期缩短, 动情周期可恢复到正常4~5天一个周期的规律, 效果最显著。模型组FSH较对照组显著升高, 说明DOR模型制备成功。治疗后各组小鼠血清FSH水平下降, E2浓度上升, 其中联合用药组效果最明显, 说明联合用药的方法可有效改善DOR小鼠体内激素紊乱的情况, 从而恢复小鼠正常的动情周期。
GDF-9于卵泡膜细胞、卵母细胞及里面的颗粒细胞中以自分泌及旁分泌的形式, 发挥着促进卵泡发育、卵母细胞成熟及受精过程的重要作用[5, 6]; BDNF的作用是营养神经元, 可以通过调节卵丘细胞的基因表达来提高卵母细胞成熟的效率[7, 8]; LIF广泛参与细胞的增生和分化等环节, 可调节子宫内膜容受性, 从而促进胚胎着床, 对卵细胞的发育和成熟起重要作用, 并通过调节卵巢功能参与排卵、早期胚胎发育和胚泡植入[9, 10]。故本课题观察在DOR发生过程中上述3个指标的变化情况。结果显示, 模型组BDNF、GDF-9、LIF浓度均显著下降, 说明化疗可影响卵巢局部生长因子的表达, 进而影响卵泡发育, 导致DOR。治疗后3个治疗组BDNF、GDF-9的浓度上升, 联合用药组效果优于单用西曲瑞克或左归丸, 说明西曲瑞克联合左归丸的治疗方法有利于通过诱导生长生化相关因子的增加来改善CTX所致的DOR。
氧化应激(oxidative stress, OS) 是指体内氧化与抗氧化作用的平衡状态被打破, 在偏强的氧化作用下, 中性粒细胞集中发生炎性浸润, 体内蛋白酶分泌增加, 进而产生大量氧化中间产物如ROS、NOS、NO等, 这些产物可诱导凋亡程序启动[11, 12]。CTX是一种临床常用的抗肿瘤药物, 属于强效烷化剂, 其在体内经过肝微粒体酶催化分解, 会释放出磷酰胺氮芥, 产生损害细胞的毒性作用[13]。线粒体是卵母细胞中主要的能量产生细胞器, 不仅是产生ROS的主要场所, 更是ROS最敏感的部分, 其活性与卵母细胞的质量密切相关[14]。在CTX药物作用下, ROS因氧化应激作用大量产生, 线粒体膜和细胞膜的完整性被破坏, 引起卵巢内颗粒细胞凋亡[15]。实验结果显示: 模型组中多种氧化应激产物如ROS、NO、NOS浓度显著上升, 显示CTX可能通过诱导机体氧化应激反应, 影响线粒体功能, 从而负面影响女性的生育能力。治疗后, 3个治疗组的ROS、NO、NOS浓度均有下降, 说明治疗组药物可改善CTX引起的氧化应激状态, 从而达到防护卵巢功能的目的, 其中以联合用药组效果最为显著。
近年来, 大量研究发现SIRT1是调节细胞应激反应关键过程的重要参与者, 可通过调控卵母细胞数量、改善卵母细胞质量、抑制氧化应激、调节线粒体功能抑制卵母细胞衰老, 提高卵巢储备功能, 延长卵巢寿命[16, 17]。SIRT1使P53去乙酰化来抑制P53依赖性转录和凋亡, 进而修复因应激而引起的DNA损伤, 减少细胞凋亡; 同时在SIRT1启动子区域中存在P53结合位点, 活化的P53可以抑制SIRT1的翻译。随着P53的表达增多, P21的表达也会上调, 这与细胞分裂周期、衰老和凋亡有关[18]。本研究结果显示, 模型组卵巢局部SIRT1蛋白表达比对照组明显减少, 而P53、P21蛋白表达明显增多, 说明由CTX导致的DOR可能是通过机体过量的氧化应激产物堆积, 抑制了SIRT1蛋白表达, 从而激活P53表达, 进一步激活下游P21表达, 加速卵巢衰老。治疗后, 与模型组对比, 3个治疗组的P53、P21蛋白表达明显减少, 而SIRT1蛋白表达增加, 进一步说明治疗药物可增加SIRT1在卵巢中的表达, 从而下调P53和P21表达, 其中左归丸组和联合用药组疗效较为明显。
综合上述实验结果, 可见西曲瑞克、左归丸能不同程度地改善CTX所致的DOR小鼠的动情周期及体内激素水平紊乱的情况, 并通过调控SIRT1/P53/P21通路, 降低体内氧化产物的产生及堆积, 诱导生长发育相关因子的产生来改善CTX所致的卵巢功能损伤, 其中西曲瑞克与左归丸联合对DOR进行治疗比单用其中一种药物的效果显著。
作者贡献: 李清瑜负责实验设计和实施; 李清瑜、高晶晶、付延津负责撰写和修改论文; 龙孟莎、蒙祖玉、林少姿、章依垚负责数据处理; 秦佳佳负责对本课题研究思路的提出、实验设计及修订论文。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Ayres LS, Berger M, Durli I, et al. Kallikrein-kinin system and oxidative stress in cisplatin-induced ovarian toxicity[J]. Reprod Toxicol, 2020, 93: 1-9. DOI:10.1016/j.reprotox.2019.12.002 |
| [2] |
Kanda A, Nobukiyo A, Sotomaru Y. Effect of cetrorelix administration on ovarian stimulation in aged mice[J]. Exp Anim, 2021, 70: 31-36. DOI:10.1538/expanim.20-0058 |
| [3] |
Tomao F, Miele E, Spinelli GP, et al. Anticancer treatment and fertility effects. Literature review[J]. J Exp Clin Cancer Res, 2006, 25: 475-481. |
| [4] |
Spears N, Lopes F, Stefansdottir A, et al. Ovarian damage from chemotherapy and current approaches to its protection[J]. Hum Reprod Update, 2019, 25: 673-693. DOI:10.1093/humupd/dmz027 |
| [5] |
Castro FCD, Cruz MHC, Leal CLV. Role of growth differentiation factor 9 and bone morphogenetic protein 15 in ovarian function and their importance in mammalian female fertility-a review[J]. Asian-Australas J Anim Sci, 2016, 29: 1065-1074. |
| [6] |
Monte A, Bezerra MS, Menezes VG, et al. Involvement of phosphorylated Akt and FOXO3a in the effects of growth and differentiation factor-9(GDF-9) on inhibition of follicular apoptosis and induction of granulosa cell proliferation after in vitro culture of sheep ovarian tissue[J]. Reprod Sci, 2021, 28: 2174-2185. DOI:10.1007/s43032-020-00409-x |
| [7] |
Zhao X, Du F, Liu X, et al. Brain-derived neurotrophic factor (BDNF) is expressed in buffalo (Bubalus Bubalis) ovarian follicles and promotes oocyte maturation and early embryonic development[J]. Theriogenology, 2019, 130: 79-88. DOI:10.1016/j.theriogenology.2019.02.020 |
| [8] |
Chang HM, Wu HC, Sun ZG, et al. Neurotrophins and glial cell line-derived neurotrophic factor in the ovary: physiological and pathophysiological implications[J]. Hum Reprod Update, 2019, 2: 224-242. |
| [9] |
Mo X, Wu G, Yuan D, et al. Leukemia inhibitory factor enhances bovine oocyte maturation and early embryo development[J]. Mol Reprod Dev, 2014, 81: 608-618. DOI:10.1002/mrd.22327 |
| [10] |
Guo C, Dong J, Ma Y, et al. LIF and bFGF enhanced chicken primordial follicle activation by Wnt/β-catenin pathway[J]. Theriogenology, 2021, 176: 1-11. DOI:10.1016/j.theriogenology.2021.09.008 |
| [11] |
Rani V, Deep U, Singh RK, et al. Oxidative stress and metabolic disorder; pathogenesis and therapeutic strategies[J]. Life Sci, 2016, 148: 183-193. DOI:10.1016/j.lfs.2016.02.002 |
| [12] |
El Assar M, Angulo J, Rodríguez-Mañas L. Oxidative stress and vascular inflammation in aging[J]. Free Radic Biol Med, 2013, 65: 380-401. DOI:10.1016/j.freeradbiomed.2013.07.003 |
| [13] |
Huang C, He FJ, Yang X, et al. Dynamic changes of cyclophosphamide-induced liver injury in mice[J]. Acta Pharm Sin (药学学报), 2019, 54: 1062-1068. |
| [14] |
Wang L, Tang J, Wang L, et al. Oxidative stress in oocyte aging and female reproduction[J]. J Cell Physiol, 2021, 236: 7966-7983. DOI:10.1002/jcp.30468 |
| [15] |
Ding C, Zhu L, Shen H, et al. Exosomal miRNA-17-5p derived from human umbilical cord mesenchymal stem cells improves ovarian function in premature ovarian insufficiency by regulating SIRT7[J]. Stem Cells, 2020, 38: 1137-1148. DOI:10.1002/stem.3204 |
| [16] |
Grabowska W, Suszek M, Wnuk M, et al. Curcumin elevates sirtuin level but does not postpone in vitro senescence of human cells building the vasculature[J]. Oncotarget, 2016, 7: 19201-19213. DOI:10.18632/oncotarget.8450 |
| [17] |
Lee YH, Bae YS. Phospholipase D2 downregulation induces cellular senescence through a reactive oxygen species-p53-p21Cip1/WAF1 pathway[J]. FEBS Lett, 2014, 588: 3251-3258. DOI:10.1016/j.febslet.2014.07.009 |
| [18] |
Ong ALC, Ramasamy TS. Role of sirtuin 1-p53 regulatory axis in aging, cancer and cellular reprogramming[J]. Ageing Res Rev, 2018, 43: 64-80. DOI:10.1016/j.arr.2018.02.004 |
 2022, Vol. 57
2022, Vol. 57


