2. 广州医科大学药学院, 广东省分子靶标与临床药理学重点实验室, 广东 广州 511436
2. Guangdong Key Laboratory of Molecular Target and Clinical Pharmacology, School of Pharmacy, Guangzhou Medical University, Guangzhou 511436, China
肝癌是常见的恶性肿瘤之一, 严重危及人类的生命安全。根据2020全球癌症数据报告, 在全球所有恶性肿瘤中, 每年约有90万肝癌新增病例, 其发病率(4.7%) 排名第6, 每年约有83万肝癌死亡病例, 其病死率(8.3%) 排名第3[1]。乙型肝炎病毒与丙型肝炎病毒是原发性肝癌发生的重要原因之一。肝癌的治疗方法主要包括手术切除、介入治疗、微波消融治疗、肝细胞移植治疗、放射治疗、化学治疗和免疫治疗等[2-4]。由于大多数患者就诊时间较晚, 肝功能受损严重, 且合并癌细胞转移, 错过了手术治疗的最佳时机[5]。因此, 迫切需要对肝癌发生和发展机制深入研究, 以便寻找和开发新的诊疗方法和治疗药物。
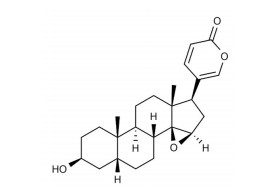
天然产物为抗肿瘤药物的发现提供了独特的来源和分子支架[6]。蟾酥是从蟾蜍科动物中华大蟾蜍或黑眶蟾蜍的耳后腺和皮肤腺的分泌物经干燥而成的中药, 具有包括镇痛、消炎、麻醉、强心、抗癌等多种生物活性[7]。酯蟾毒配基(resibufogenin) 是蟾酥的主要活性成分, 属于蟾蜍二烯内酯类化合物[8], 其化学结构如图 1所示。研究表明, 酯蟾毒配基呈现出显著的抗肿瘤活性, 可能通过不同的机制抑制肿瘤生长, 包括诱导细胞凋亡和自噬、阻滞细胞周期、抑制细胞迁移、逆转肿瘤耐药等[9]。Xie等[10]发现华蟾素提取液中的蟾蜍硫堇对肝癌细胞SMMC-7721和BEL-7402的增殖有明显的抑制作用, 可能与诱导G2/M期细胞周期阻滞有关。然而, 目前关于酯蟾毒配基的抗肝癌细胞活性和机制研究较少。因此, 本研究通过MTT、划痕、Transwell、Western blot实验探索了酯蟾毒配基在体外的抗肿瘤活性和相关分子机制, 为开发肝癌化疗药物提供重要的科学依据。
|
Figure 1 Chemical structure of resibufogenin |
细胞与主要试剂 人肝癌细胞系MHCC-97H、HepG2、SK-Hep-1、Huh-7均购自赛百慷(上海) 生物技术股份有限公司; 酯蟾毒配基标准品购自四川省维克奇生物科技有限公司; 索拉非尼(sorafenib) 标准品购自上海迈瑞尔化学技术有限公司; 胎牛血清、DMEM高糖培养基购自美国Gibco公司; 0.25%胰酶和青霉素-链霉素(双抗) 溶液购自吉诺生物医药技术有限公司; 四甲基偶氮唑盐(MTT) 粉末、二甲基亚砜(dimethyl sulfoxide, DMSO) 溶液购自美国MP Biomedicals公司; Transwell小室、Matrigel基质胶购自美国Corning公司; BCA蛋白定量试剂盒购自Thermo Fisher Technology公司; 内参抗体β-肌动蛋白(β-actin, AF7018)、内参基因GAPDH (AF7021)、目的抗体整合素α2 (integrin α2, DF2540)、磷酸肌醇3-激酶(phosphoinositide 3-kinase, PI3K, AF6242)、磷酸化磷酸肌醇3-激酶(phospho-phosphoinositide 3-kinase, p-PI3K, AF3242) 购自Affinity公司; 目的抗体整合素α6 (integrin α6, 3750S)、整合素β1 (integrin β1, 9699S)、N-钙黏蛋白(N-cadherin, 13116S)、E-钙黏蛋白(E-cadherin, 3195S)、基质金属蛋白酶2 (matrix metalloproteinase 2, MMP2, 40994S)、转录因子Twist (69366S)、蛋白激酶B (protein kinase B, AKT, 4685S)、磷酸化蛋白激酶B (phospho-protein kinase B, p-AKT, 4060S) 购自Cell Signaling Technology公司。
细胞培养 人肝癌细胞系MHCC-97H、HepG2、SK-Hep-1、Huh-7复苏后重悬至含10%胎牛血清和1%双抗的DMEM高糖培养基, 于37 ℃、5%恒温培养箱培养。
MTT比色法 取对数生长期的MHCC-97H细胞用胰酶消化计数, 按每孔4 000个细胞接种于96孔板内, 待细胞贴壁后加入不同浓度的酯蟾毒配基或肝癌治疗阳性药物索拉非尼, 作用72 h后每孔中添加5 mg·mL-1 MTT溶液20 μL, 继续培养4 h, 弃去上清液, 每孔中加入DMSO溶液100 μL, 37 ℃振荡10 min, 用酶标仪检测波长540和650 nm处的吸光度值[11]。
划痕实验 在6孔板后面用黑色马克笔沿直尺均匀地画5条黑线, 取对数生长期的MHCC-97H细胞用胰酶消化计数, 按每孔4×105个细胞接种于6孔板内, 待细胞生长至约90%的融合率时, 用200 μL枪头垂直于黑线划3道划痕, 用PBS洗去漂浮的细胞, 于显微镜下选取视野观察并拍照作为0 h的取样点, 随后加入不同浓度的酯蟾毒配基, 作用12、24 h后拍照, 使用Image J软件对空白区域愈合速度进行评估[12]。
Transwell实验 对于Transwell侵袭实验, 将Matrigel基质胶置于4 ℃冰箱中使其融化, 基质胶和无血清培养基按l∶8比例稀释并取45 μL铺到Transwell小室, 将对数生长期的MHCC-97H细胞用胰酶消化计数, 取5×104细胞接种至小室, 并加入不同浓度的酯蟾毒配基, 下室中加入600 μL含10%胎牛血清的DMEM高糖培养基。培养24 h后, 甲醇固定30 min, 0.1%结晶紫染色1 h, 洗涤, 用棉签轻轻擦去小室上层未迁移的细胞, 晾干后于显微镜下随机选取视野观察并拍照, 使用Image J软件对穿过基底膜的细胞进行计数。对于Transwell迁移实验, Transwell小室内不铺基质胶, 其余操作及计数方法同上[13]。
Western blot实验 取不同浓度酯蟾毒配基作用24或48 h后的MHCC-97H细胞, 用RIPA裂解液和PMSF蛋白酶抑制剂处理细胞, 冰上裂解30 min后高速离心20 min, 取上清用BCA定量试剂盒测定总蛋白浓度。采用SDS-PAGE电泳法分离细胞蛋白, 用湿转移法将蛋白条带转移到PVDF膜上。用5%脱脂牛奶室温封闭1 h, 用一抗溶液4 ℃孵育过夜。TBST溶液洗涤3次, 每次5 min, 用二抗溶液室温孵育1 h, TBST溶液洗涤3次, 每次5 min。采用ECL发光液对膜进行显影, 使用Image J软件分析蛋白条带灰度值。蛋白相对表达量=目的蛋白条带灰度值/内参蛋白条带灰度值[14]。
统计学处理 采用SPSS 20.0统计软件进行分析, 计量资料以
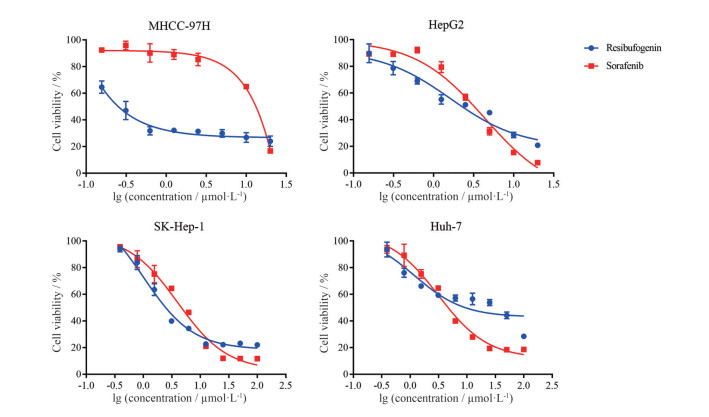
MTT比色法结果表明, 不同浓度的酯蟾毒配基作用于4种肝癌细胞(MHCC-97H、HepG2、SK-Hep-1、Huh-7) 72 h后, 发现该化合物对上述肝癌细胞均具有明显的生长抑制作用, 其半数抑制浓度(half maximal inhibitory concentration, IC50) 分别为0.55 ± 0.06、2.83 ± 0.24、5.25 ± 0.49、14.89 ± 2.28 μmol·L-1 (图 2), 因此本研究选择MHCC-97H细胞完成后续的抗肿瘤活性实验研究, 且将浓度分组设置为0、0.25、0.50、1.00 μmol·L-1。此外, 本研究采用肝癌治疗阳性药物索拉非尼作为对照, 对上述4种肝癌细胞检测作用72 h后的细胞存活率, 其IC50值分别为6.43 ± 0.74、2.30 ± 0.28、5.61 ± 0.20、6.80 ± 0.76 μmol·L-1。
|
Figure 2 Effects of different concentrations of resibufogenin and sorafenib on in vitro proliferation of human hepatocellular carcinoma cell |
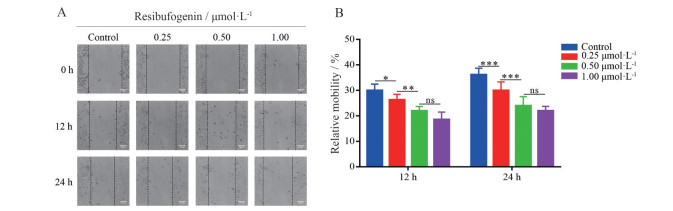
划痕实验结果显示, 0、0.25、0.50、1.00 μmol·L-1酯蟾毒配基作用于MHCC-97H细胞12 h后, 其迁移愈合率分别为30.03% ± 2.43%、26.35% ± 2.11%、21.97% ± 1.71%、18.51% ± 2.96%; 当药物作用24 h后, 迁移愈合率分别为36.19% ± 2.56%、30.01% ± 3.35%、23.99% ± 3.57%、21.95% ± 1.77% (图 3)。MHCC-97H细胞的迁移愈合率随着酯蟾毒配基浓度的增加而显著降低, 这表明酯蟾毒配基能够以剂量依赖性的方式显著抑制MHCC-97H细胞的平面迁移能力。
|
Figure 3 Effects of different concentrations of resibufogenin on horizontal migration of MHCC-97H cells. A: The result of wound healing assay revealed that resibufogenin inhibited the horizontal migration of MHCC-97H cells in a concentration-dependent manner. Scale bar: 50 μm; B: The statistical results of A. *P < 0.05, **P < 0.01, ***P < 0.001. ns: No significance |
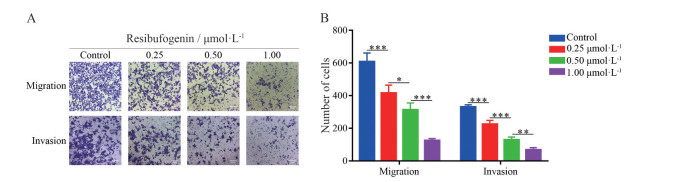
Transwell实验结果显示, 小室未铺基质胶时, 0、0.25、0.50、1.00 μmol·L-1酯蟾毒配基组穿过基底膜的侵袭细胞数分别为608 ± 53、416 ± 48、312 ± 43、125 ± 12个; 小室铺上基质胶时, 0、0.25、0.50、1.00 μmol·L-1酯蟾毒配基给药组穿过基底膜的侵袭细胞数分别为330 ± 13、225 ± 24、129 ± 17、67 ± 13个(图 4)。与对照组相比, 不同浓度酯蟾毒配基组穿过基底膜的侵袭细胞数均显著减少, 且呈现浓度依赖效应, 这表明酯蟾毒配基能够随着浓度增加而显著抑制MHCC-97H细胞的空间迁移能力和侵袭能力。
|
Figure 4 Effects of different concentrations of resibufogenin on spatial migration and invasion of MHCC-97H cells. A: The result of Transwell assay revealed that resibufogenin inhibited the spatial migration and invasion of MHCC-97H cells in a concentration-dependent manner. Scale bar: 50 μm; B: The statistical results of A. *P < 0.05, **P < 0.01, ***P < 0.001 |
Western blot实验结果表明, 与对照组相比, 不同浓度(0.25、0.50、1.00 μmol·L-1) 酯蟾毒配基组的integrin α2、integrin α6、integrin β1、N-cadherin、MMP2、Twist的蛋白表达水平下调, 而E-cadherin的蛋白表达水平上调(图 5), 这说明酯蟾毒配基可能通过调控MHCC-97H细胞内迁移侵袭相关蛋白的表达, 进而抑制肝癌的发生和发展。
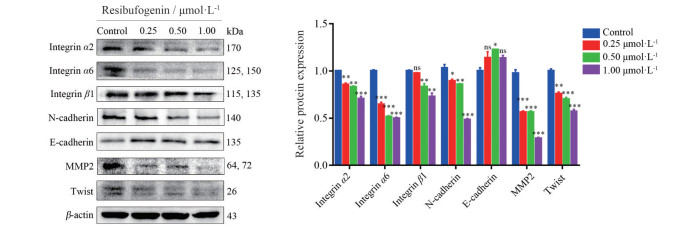
|
Figure 5 Effects of different concentrations of resibufogenin on the expression of proteins related to migration and invasion in MHCC-97H cells. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group. MMP2: Matrix metalloproteinase 2 |
结果表明, 与对照组相比, 不同浓度(0.25、0.50、1.00 μmol·L-1) 酯蟾毒配基组的p-PI3K/PI3K和p-AKT/AKT比值显著降低(图 6), 说明酯蟾毒配基可能通过调控PI3K/AKT信号通路进而影响肝癌MHCC-97H细胞的体外增殖、迁移和侵袭能力。
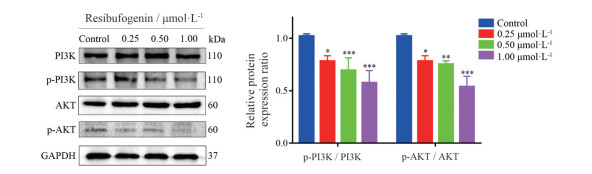
|
Figure 6 Effects of different concentrations of resibufogenin on the expression of PI3K/AKT signaling pathway proteins in MHCC-97H cells. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group. PI3K: Phosphoinositide 3-kinase; AKT: Protein kinase B |
近年来, 从中国传统中药中寻找天然产物已经成为一种很有前景的新药开发途径。在中国, 蟾酥及其二烯内酯化合物在临床上经常被用作强心剂、止痛剂、麻醉剂、中枢神经系统兴奋剂等。作为蟾酥的活性成分之一, 酯蟾毒配基可以抑制心肌细胞膜上的Na+-K+-ATP酶, 使心肌细胞内Na+浓度和Ca2+浓度升高, 心肌收缩力增强, 但仍需注意高剂量的酯蟾毒配基可能表现出心脏毒性[15]。研究表明, 酯蟾毒配基是从蟾酥中分离出来的抗癌有效单体, 在体内和体外均显示出显著的抗肿瘤活性。Han等[16]报道了酯蟾毒配基通过上调受体相互作用蛋白3 (receptor-interacting protein 3, RIP3) 和磷酸化混合谱系激酶结构域样蛋白Ser358诱导体内坏死, 诱导活性氧的积累发挥细胞毒性作用, 进而抑制结直肠癌的生长和转移。Zhou等[17]对172种中草药进行筛选, 发现酯蟾毒配基可以显著抑制卵巢透明细胞癌细胞的体外增殖、迁移和侵袭, 并诱导其凋亡, 这可能与PI3K/AKT和肌动蛋白细胞骨架信号通路的调控有关。Yang等[18]发现酯蟾毒配基可通过与腺苷三磷酸(adenosine triphosphate, ATP) 竞争性结合血管内皮细胞生长因子受体2 (vascular endothelial growth factor receptor 2, VEGFR2) 激酶结构域, 影响VEGFR2的磷酸化, 进而阻断VEGFR2介导的信号通路, 抑制三阴性乳腺癌的血管生成。然而, 关于酯蟾毒配基在抑制肝癌迁移侵袭的研究鲜少报道。
本研究表明, 酯蟾毒配基在体外对肝癌细胞有显著的抗肿瘤活性; 采用MHCC-97H细胞探讨酯蟾毒配基对肝癌迁移侵袭的影响, 结果表明酯蟾毒配基可以显著抑制MHCC-97H细胞的迁移和侵袭能力。此外, 本研究发现integrin α2、integrin α6、integrin β1、N-cadherin、MMP2、Twist的蛋白表达下调, E-cadherin的蛋白表达上调。因此, 推测酯蟾毒配基在体外抑制肝癌细胞的增殖、迁移和侵袭可能与调控上皮间充质转化(epithelial-mesenchymal transition, EMT) 相关通路有关。
EMT是指上皮细胞向间充质表型转化的生物学过程, 在肿瘤进展、转移和耐药中发挥重要作用。首先上皮细胞逐渐丧失顶端-基底端极性, 形态由鹅卵石样形态逐渐成为纺锤体样, 伴随着黏附连接蛋白的溶解和紧密连接的破坏, 从而导致上皮细胞的分离[19]。EMT可通过影响转录因子(如Twist、Snail、ZEB等) 的调控, 进而下调上皮标志物(如E-cadherin、cytokeratin等) 的表达, 诱导间充质标记蛋白(如N-cadherin、vimentin、fibronectin等) 的表达, 并促进上皮细胞附着到细胞外基质(extracellular matrix, ECM), 最终使细胞获得通过基底膜和血液/淋巴管壁迁移和侵袭的能力[20]。接着, 发生EMT的细胞以循环肿瘤细胞(circulating tumor cell, CTC) 的形式在血液中存活, 并最终迁移到远处的器官, 形成继发性肿瘤。除了表现出更强的侵袭性表型, 肿瘤细胞发生EMT后还可获得肿瘤干细胞(cancer stem cell, CSC) 样特征、免疫逃避、化疗耐药、代谢改变等功能[21]。然而, 大多数肿瘤细胞并没有完全丧失上皮形态和完全获得间充质形态, 在获得部分EMT (partial EMT, pEMT) 后, 肿瘤细胞可以通过保留一定程度的上皮表型维持细胞间的附着, 也可通过转化成间充质表型赋予细胞迁移的潜能, 更可能实现成群肿瘤细胞的侵袭[22]。MMPs是一个Zn2+依赖性的金属内切蛋白酶家族, 不仅能够降解ECM成分, 还可通过蛋白水解参与调节细胞内和细胞间信号通路。基底膜和细胞外基质的降解对肿瘤的侵袭和转移至关重要, MMPs为恶性肿瘤细胞提供侵袭和转移特征, 有利于其在EMT过程中浸润[23]。整合素(integrins) 是由α和β两种亚单位形成的异源二聚体, 用于介导细胞间的黏附作用和ECM相互作用, 在诱导肿瘤细胞EMT过程中涉及到多种信号通路[24, 25]。在肿瘤微环境中, 整合素连接激酶(integrin-linked kinase, ILK) 与整合素β1和β3胞质结构域相互作用连接整合素和肌动蛋白细胞骨架, 可以通过介导E-cadherin的下调导致EMT发生[26]。此外, 整合素参与了Src激酶和局灶黏附激酶(focal adhesion kinase, FAK) 的激活, 促进细胞膜上的动态肌动蛋白的变化, 进而影响下游通路包括黏附、迁移、增殖和存活等关键功能[27]。因此, 针对EMT过程中关键的调控机制寻找对应的靶标分子和治疗肿瘤转移策略显得尤为重要。
在PI3K/AKT信号通路中, 酶家族通过将多种生长因子和细胞因子与受体结合而被激活, 接着PI3K将磷脂酰肌醇4, 5-二磷酸(phosphatidylinositol 4, 5-biphosphate, PIP2) 磷酸化为磷脂酰肌醇3, 4, 5-三磷酸(phosphatidylinositol 3, 4, 5-triphosphate, PIP3), PIP3作为第二信使促进AKT的激活。AKT是PI3K信号通路的一个重要下游效应, 活化的AKT可以通过抑制凋亡、调节细胞生长和代谢等多种途径影响肿瘤的生长与发展[28, 29]。本研究表明, 酯蟾毒配基作用后p-PI3K/PI3K和p-AKT/AKT比值显著降低, 推测PI3K/AKT信号通路和肝癌发展之间存在一定的关联, 抑制该通路可能成为一种有效的肝癌治疗策略。
综上所述, 活性化合物酯蟾毒配基通过调控细胞内迁移侵袭相关蛋白表达, 通过影响EMT和PI3K/AKT信号通路显著抑制肝癌MHCC-97H细胞的增殖、迁移和侵袭过程, 且呈现浓度依赖效应。以上研究提示, 酯蟾毒配基在抗肝癌转移治疗中具有良好的应用前景, 但关于其对迁移侵袭涉及的信号靶点和具体分子机制还有待于进一步研究。
作者贡献: 张建业负责课题的实验设计与经费支持; 乔桐杉负责文章撰写和稿件修改; 周雯敏负责数据分析和MTT实验; 范欣悦和张雨荃负责文献查阅; 谢婷和林晓琪负责划痕和Transwell实验; 乔山、郝利恒和王猛负责Western blot实验。
利益冲突: 本文所有作者均声明无利益冲突。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71: 209-249. DOI:10.3322/caac.21660 |
| [2] |
Anwanwan D, Singh SK, Singh S, et al. Challenges in liver cancer and possible treatment approaches[J]. Biochim Biophys Acta Rev Cancer, 2020, 1873: 188314. DOI:10.1016/j.bbcan.2019.188314 |
| [3] |
Fu J, Wang HY. Precision diagnosis and treatment of liver cancer in China[J]. Cancer Lett, 2018, 412: 283-288. DOI:10.1016/j.canlet.2017.10.008 |
| [4] |
Yan SJ, Liu XY, Wan GH. Review on clinical research progress of immunotherapy in liver cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 1749-1754. |
| [5] |
Han TS, Ban HS, Hur K, et al. The epigenetic regulation of HCC metastasis[J]. Int J Mol Sci, 2018, 19: 3978. DOI:10.3390/ijms19123978 |
| [6] |
Chen Y, Kirchmair J. Cheminformatics in natural product-based drug discovery[J]. Mol Inform, 2020, 39: e2000171. DOI:10.1002/minf.202000171 |
| [7] |
Wei WL, Hou JJ, Wang X, et al. Venenum bufonis: an overview of its traditional use, natural product chemistry, pharmacology, pharmacokinetics and toxicology[J]. J Ethnopharmacol, 2019, 237: 215-235. DOI:10.1016/j.jep.2019.03.042 |
| [8] |
Qi FH, Li AY, Inagaki Y, et al. Antitumor activity of extracts and compounds from the skin of the toad Bufo bufo gargarizans Cantor[J]. Int Immunopharmacol, 2011, 11: 342-349. DOI:10.1016/j.intimp.2010.12.007 |
| [9] |
Li FJ, Hu JH, Ren X, et al. Toad venom: a comprehensive review of chemical constituents, anticancer activities, and mechanisms[J]. Arch Pharm (Weinheim), 2021, 354: 2100060. DOI:10.1002/ardp.202100060 |
| [10] |
Xie RF, Li ZC, Gao B, et al. Bufothionine, a possible effective component in cinobufocini injection for hepatocellular carcinoma[J]. J Ethnopharmacol, 2012, 141: 692-700. DOI:10.1016/j.jep.2011.12.018 |
| [11] |
Li L, Dong Z, Shi PF, et al. Bruceine D inhibits cell proliferation through downregulating LINC01667/microRNA-138-5p/cyclin E1 axis in gastric cancer[J]. Front Pharmacol, 2020, 11: 584960. DOI:10.3389/fphar.2020.584960 |
| [12] |
Huang WJ, Yan YY, Liu Y, et al. Exosomes with low miR-34c-3p expression promote invasion and migration of non-small cell lung cancer by upregulating integrin α2β1[J]. Signal Transduct Target Ther, 2020, 5: 39. DOI:10.1038/s41392-020-0133-y |
| [13] |
Wei MY, Li JJ, Qiu JH, et al. Costunolide induces apoptosis and inhibits migration and invasion in H1299 lung cancer cells[J]. Oncol Rep, 2020, 43: 1986-1994. |
| [14] |
Li JJ, Guo QR, Lei XP, et al. Pristimerin induces apoptosis and inhibits proliferation, migration in H1299 lung cancer cells[J]. J Cancer, 2020, 11: 6348-6355. DOI:10.7150/jca.44431 |
| [15] |
Puschett JB, Agunanne E, Uddin MN. Emerging role of the bufadienolides in cardiovascular and kidney diseases[J]. Am J Kidney Dis, 2010, 56: 359-370. DOI:10.1053/j.ajkd.2010.01.023 |
| [16] |
Han QR, Ma Y, Wang H, et al. Resibufogenin suppresses colorectal cancer growth and metastasis through RIP3-mediated necroptosis[J]. J Transl Med, 2018, 16: 201. DOI:10.1186/s12967-018-1580-x |
| [17] |
Zhou GN, Zhu ZY, Li LH, et al. Resibufogenin inhibits ovarian clear cell carcinoma (OCCC) growth in vivo, and migration of OCCC cells in vitro, by down-regulating the PI3K/AKT and actin cytoskeleton signaling pathways[J]. Am J Transl Res, 2019, 11: 6290-6303. |
| [18] |
Yang T, Jiang YX, Wu Y, et al. Resibufogenin suppresses triple-negative breast cancer angiogenesis by blocking VEGFR2-mediated signaling pathway[J]. Front Pharmacol, 2021, 12: 938. |
| [19] |
Pastushenko I, Blanpain C. EMT transition states during tumor progression and metastasis[J]. Trends Cell Biol, 2019, 29: 212-226. DOI:10.1016/j.tcb.2018.12.001 |
| [20] |
Aiello NM, Kang Y. Context-dependent EMT programs in cancer metastasis[J]. J Exp Med, 2019, 216: 1016-1026. DOI:10.1084/jem.20181827 |
| [21] |
Bakir B, Chiarella AM, Pitarresi JR, et al. EMT, MET, plasticity, and tumor metastasis[J]. Trends Cell Biol, 2020, 30: 764-776. DOI:10.1016/j.tcb.2020.07.003 |
| [22] |
Saitoh M. Involvement of partial EMT in cancer progression[J]. J Biochem, 2018, 164: 257-264. DOI:10.1093/jb/mvy047 |
| [23] |
Scheau C, Badarau IA, Costache R, et al. The role of matrix metalloproteinases in the epithelial-mesenchymal transition of hepatocellular carcinoma[J]. Anal Cell Pathol (Amst), 2019, 2019: 9423907. |
| [24] |
Cooper J, Giancotti FG. Integrin signaling in cancer: mechanotransduction, stemness, epithelial plasticity, and therapeutic resistance[J]. Cancer Cell, 2019, 35: 347-367. DOI:10.1016/j.ccell.2019.01.007 |
| [25] |
Yan YY, Guo QR, Fan XY, et al. Bruceantin inhibits proliferation, migration and invasion of non-small cell lung cancer H1299 cells by up-regulating miR-29a-3p[J]. Acta Pharm Sin (药学学报), 2021, 56: 520-527. |
| [26] |
Hamidi H, Ivaska J. Every step of the way: integrins in cancer progression and metastasis[J]. Nat Rev Cancer, 2018, 18: 533-548. DOI:10.1038/s41568-018-0038-z |
| [27] |
Canel M, Serrels A, Frame MC, et al. E-cadherin-integrin crosstalk in cancer invasion and metastasis[J]. J Cell Sci, 2013, 126: 393-401. DOI:10.1242/jcs.100115 |
| [28] |
Dimri M, Satyanarayana A. Molecular signaling pathways and therapeutic targets in hepatocellular carcinoma[J]. Cancers (Basel), 2020, 12: 491. DOI:10.3390/cancers12020491 |
| [29] |
Liu R, Chen Y, Liu G, et al. PI3K/AKT pathway as a key link modulates the multidrug resistance of cancers[J]. Cell Death Dis, 2020, 11: 797. DOI:10.1038/s41419-020-02998-6 |
 2022, Vol. 57
2022, Vol. 57


