2. 甘肃中医药大学药学院, 甘肃 兰州 730000;
3. 甘肃中医药大学, 敦煌医学与转化教育部重点实验室, 甘肃 兰州 730000
2. College of Pharmacy, Gansu University of Chinese Medicine, Lanzhou 730000, China;
3. Key Laboratory of Dun Huang Medical and Transformation, Ministry of Education, Gansu University of Chinese Medicine, Lanzhou 730000, China
胃癌是常见的消化道恶性肿瘤, 在我国居恶性肿瘤死因第3位[1], 胃癌5年生存率不足50%[2]。目前, 针对胃癌临床上主要的治疗方法为手术和化疗, 对正常组织细胞有明显的物理和化学损伤, 且治疗效果仍不理想[3]。胃癌病机复杂多变, 主要以脾胃虚弱为本, 气滞、血瘀、痰凝、毒结为标, 由于气血津液生化乏源或过用克伐津液之化疗药物, 导致正气亏虚、升降失职, 阴津亏损、燥热内生, 因此治则当以健脾温中, 益气养阴。
敦煌医学是敦煌学的一个分支, 所包含的敦煌医方和诊疗技术独具特色。敦煌医方大补脾汤由具有温中功效的干姜, 有益气功效的人参、甘草、白术, 具有养阴功效的麦冬、五味子和具有降逆功效的旋覆花组成。该方源自《辅行诀五脏用药法要》“治脾气大疲, 饮食不消, 时自吐利, 其人枯瘦如柴, 立不可动转, 口中苦干渴, 汗出, 气急, 脉微而时结者方[4]”。有文献[5, 6]报道, 大补脾汤能够防护放射性肺损伤和顺铂诱导的肝肾毒性。基于敦煌医学“辅行诀”理论体系配伍的大补脾汤既注重温中健脾, 也强调滋养胃阴, 既能补中益气, 也配以降逆止呕。因此, 大补脾汤具有恢复胃癌手术或化疗患者脾胃虚衰症状的对应功效, 存在辅助胃癌治疗的理论基础, 具有进一步挖掘的潜在价值。
目前, 仍然缺乏大补脾汤防治胃癌物质基础和作用机制的系统性挖掘研究, 并且对于大补脾汤的组方规律尚不清楚。本研究拟通过计算机辅助药物设计结合复杂网络分析的研究体系, 探究大补脾汤基于“益气养阴、温中健脾”防治胃癌的活性成分、潜在作用靶点及作用机制, 即其起效的化学信息和生物信息, 初步尝试利用现代科学语言解释敦煌医方大补脾汤组方规律的科学内涵。
材料与方法细胞来源及培养 人胃癌AGS细胞株购自上海中乔新舟生物科技有限公司。细胞培养液用含有10%胎牛血清的1640培养基。细胞置于37 ℃、5% CO2, 饱和湿度细胞培养箱内培养。取P4代对数生长期内细胞进行实验。
药物与试剂 1640培养基(Hyclone公司, AF29520450), 胎牛血清(BI公司, 1919555), 周期试剂盒(联科生物公司, A00114), CCK8细胞增殖检测试剂盒(MCE公司, HY-K0301), JC-10细胞线粒体膜电位(MMP) 活细胞荧光染料(美国AAT公司, 2191362)。
大补脾汤冻干粉溶液的制备: 人参15 g, 炙甘草15 g, 干姜15 g, 白术5 g, 麦门冬5 g, 五味子5 g, 旋覆花5 g, 共65 g, 购自甘肃中医药大学附属医院。用0.5 L蒸馏水煮沸至少1 h, 提取水煎液, 然后用滤纸过滤, 将滤液放入冷冻干燥机内冻干。大补脾汤冻干提取物的提取率约为30%。冻干粉在使用前溶于蒸馏水, 然后用0.22 µm注射器过滤器过滤。
主要仪器 光学显微镜(日本Olympus, IX51), 激光共聚焦显微镜(Olympus, IX81), 流式细胞仪(美国BD公司, FACS CelestaTM), 二氧化碳培养箱(美国Thermo, SKYJH-1112), 酶标仪(美国BioTek公司, Epoch), 冷冻干燥机(EYELA公司, PD-551)。
显微镜观察细胞形态变化 取对数生长期细胞, 用完全培养基将细胞浓度调整为每毫升1×105个加入6孔板中, 在待细胞融合度达到60%~70%时, 分别以0、100、200、300 μg·mL-1浓度的大补脾汤冻干粉溶液对AGS胃癌细胞进行干预, 并于24 h后在倒置显微镜下观察细胞形态的变化。
CCK8法检测细胞增殖能力 取对数生长期细胞, 用完全培养基将细胞浓度调整为每毫升5×103个接种于96孔板常规培养, 待细胞贴壁后, 分别以0、100、200、300 μg·mL-1浓度的大补脾汤冻干粉溶液对细胞进行干预, 每组5个复孔, 于24 h进行细胞增殖能力检测。在24 h终止培养, 每孔加入10 μL CCK8溶液, 在培养箱中避光孵育1 h, 在450 nm处用全波长酶标仪检测各组细胞的吸光度值, 并比较各组细胞的吸光度值变化。
流式细胞术检测细胞周期 各组细胞完成24 h干预后, 用胰酶消化成细胞悬液, 用PBS清洗, 1 500 r·min-1离心5 min, 弃上清后, 再次加入PBS混匀清洗后离心, 将清洗后的细胞混匀液转入流式上样管, 同时加入破膜剂和PI染液, 避光15 min后通过流式细胞仪检测细胞周期。
激光共聚焦显微镜观察细胞线粒体活性 以每毫升1×104个浓度的细胞悬液接种于共聚焦专用小皿中, 分别以0、100、200、300 μg·mL-1浓度的大补脾汤冻干粉溶液对细胞进行干预。24 h后用PBS清洗, 并加入JC-10线粒体膜电位荧光染料, 37 ℃避光孵育30 min后, 于激光共聚焦显微镜下以488和594 nm波长观察细胞并拍照。
大补脾汤组方理论与功效组的划分 配伍研究是中药方剂研究的重要环节, 大补脾汤可治疗脾气大衰之证, 方中人参微温大补元气, 健脾益肺, 生津, 为君药; 甘草补脾益气, 助君药大补元气之功, 干姜温中散寒, 为臣药; 麦门冬、五味子养阴生津, 旋覆花下气化痰, 降逆复平, 三者共用为佐药; 白术性温归脾、胃经, 健脾益气, 引药力直达中焦, 助君药益气健脾, 为使药。诸药合用, 共奏益气养阴、温中回阳之功。其治疗要点除温中回阳之外, 还治其阳损及阴, 补阴以益阳。围绕该方核心功效, 将大补脾汤药味分为益气组(人参、甘草、白术)、温中组(干姜)、养阴组(麦冬、五味子) 和降逆组(旋覆花) 4个功效组。
大补脾汤的性味归经网络 构建“中药-归经、中药-四气、中药-五味”网络图, 在《中国药典》中收集大补脾汤所含药味的性味归经信息, 在Cytoscape3.7.2中构建网络交互图。
大补脾汤潜在活性成分收集与候选靶标预测 利用中药系统药理学分析平台TCMSP (http://tcmspw.com/tcmsp.php), 以“白术”、“甘草”、“干姜”、“人参”、“北五味子”、“旋覆花”为关键词检索大补脾汤各药味化合物成分, 设置筛选标准OB ≥ 30%和DL ≥ 0.18的化学成分作为有效成分。对于TCMSP数据库未收录的麦冬, 利用TCMID数据库(http://www.megabionet.org/tcmid/) 收集化合物成分, 并用Lipinski规则进行筛选。利用Swiss Target Prediction (http://www.swisstargetprediction.ch/) 预测大泻脾汤中有效成分的作用靶点, 设置属性为“Homo sapiens”, 收集probability > 0的靶点。
胃癌相关靶标获取 以“gastric cancer”为关键词, 在TTD (http://db.idrblab.net/ttd/)、DrugBank (https://www.drugbank.ca/)、GeneCards (https://www.genecards.org/) 及DisGeNET (https://www.disgenet.org/) 数据库检索相关靶点信息, 其中GeneCards数据库以relevance score ≥ 20为筛选标准, DisGeNET数据库以score值> 0.1为筛选标准, 整合4个数据库检索结果并删除重复靶点, 获得胃癌疾病相关靶点。
蛋白质-蛋白质相互作用 (PPI) 网络构建 分别将益气组、温中组、养阴组和降逆组及全方的化合物候选靶点与胃癌相关基因集导入Venny 2.1.0进行韦恩分析, 获得二者的共有基因, 并利用STRING数据库进行PPI分析, 物种选择“Homo sapiens”, 设置蛋白互作综合得分(interaction score) > 0.9。利用Cytoscape3.7.2软件进行可视化分析, 对网络中节点的拓扑特征值(连接度、介度、紧密度) 进行计算, 筛选三者均大于相应中位数的节点作为大补脾汤各功效组及全方为PPI网络中大补脾汤防治胃癌的关键靶点, 用于后续KEGG富集分析研究。
大补脾汤防治胃癌关键靶点KEGG通路富集分析 利用生物学信息注释数据库(DAVID) 分别对将PPI分析获得的益气组、温中组、养阴组和降逆组及全方的关键靶点进行基因组百科全书(KEGG) 信号通路分析(P < 0.05)。
“药味-潜在作用成分-关键靶点”网络构建 采用Cytoscape 3.7.2软件分别构建大补脾汤各功效组及全方“药味-潜在作用成分-关键靶点”网络, 建立可视化网络图。针对全方拓扑网络筛选连接度、介度、紧密度均大于其中位数的化合物成分与靶点为大补脾汤防治胃癌的核心成分和核心靶点, 用于分子对接验证。
分子对接 本研究选择“药味-潜在作用成分-关键靶点”网络度值排名前10的核心靶点与前20个核心成分进行了分子对接, 包括雌激素受体1 (ESR1, PDB ID: 5ACC)、雄激素受体(AR, PDB ID: 4OLM)、表皮生长因子受体(EGFR, PDB ID: 6DUK)、细胞周期蛋白依赖性激酶2 (CDK2, PDB ID: 3PY0)、细胞周期蛋白依赖性激酶1 (CDK1, PDB ID: 4Y72)、细胞周期蛋白依赖性激酶4 (CDK4, PDB ID: 2W96)、ATP结合盒转运蛋白亚家族G2 (ABCG2, PDB ID: 6FFC)、糖原合酶激酶3β (GSK3B, PDB ID: 3L1S)、激酶插入域受体(KDR, PDB ID: 3VNT)、雌激素受体2 (ESR2, PDB ID: 2GIU)。使用Schrödinger软件的PrepWiz模块对受体进行预处理。使用Glide的标准精度方法(standard precision, SP) 进行分子对接。将化合物小分子结构用LigPrep进行处理, 运用OPLS_2005力场得到相应的低能构象。Epik28以pH值为7.0 ± 2.0为条件分配电离状态并进行对接计算。
MM/GBSA结合自由能计算 结合自由能常被用于表示受体和配体之间的结合强度。计算受体-配体之间的结合自由能对于评价分子的活性有重要的意义。本研究在网络药理学及分子对接的基础上, 对核心靶点与其对应成分进行结合自由能计算, 深层次地探究核心靶点与对应的核心成分之间结合亲和力的差异。本研究采用Prime程序中MM-GBSA方法进行结合自由能估算。公式: DG bind = E_complex (minimized) -E_ligand (minimized) - E_receptor (minimized)。
分子动力学模拟 使用Schrödinger软件中的Desmond模块进行分子动力学模拟, 从动力学角度分析蛋白与潜在化合物的相互结合模式。将蛋白-配体复合物周围建立边长为10 Å的TIP3P周期性显性水模型的立方体水盒子。体系中加入抗衡离子中和蛋白质所带电荷, 得到电中性的环境。采用OPLS_2005力场进行能量计算。使用Desmond默认参数设置程序实现体系能量最小化和体系弛豫过程。采用NPT系统对复合物结构进行动力学模拟。温度耦合方法为Nose-Hoover, 模拟温度弛豫时间为1 ps。压力耦合方法为Martyna-Tobias-Klein, 弛豫时间为2 ps, 模拟压力为1.013 25 bar。模拟时间为50 ns, 轨迹间隔为10 ps。
统计学分析 应用SPSS 21.0统计软件分析。结果采用均数±标准差(
以AGS人胃癌细胞作为研究对象, 为观察大补脾汤对胃癌细胞形态是否具有影响作用, 各组细胞在不同浓度的大补脾汤冻干粉溶液干预24 h后于倒置显微镜下进行形态观察, 与对照组相比, 300 μg·mL-1组有少量细胞出现变圆、变亮变化, 其余各组细胞无明显形态差异(图 1A)。
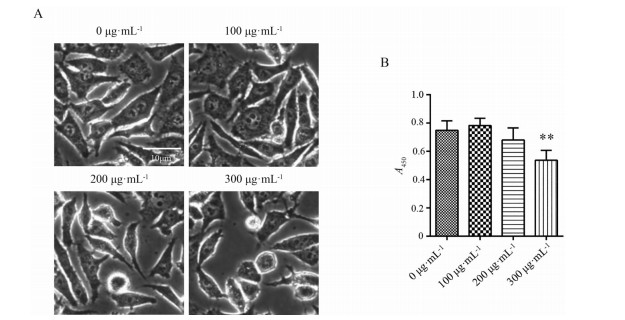
|
Figure 1 The effect of Dabupi Decoction (Dbp D) freeze-dried powder solution on the morphology and proliferation of AGS cells. A: The effect of Dbp D freeze-dried powder solution on the morphology of AGS cells. Scale bar = 10 μm; B: The effect of Dbp D freeze-dried powder solution on the proliferation of AGS cells. n = 3, |
快速增殖是肿瘤细胞的关键特征, 本研究欲进一步检测大补脾汤是否具有抑制胃癌细胞快速增殖的能力。通过CCK8法检测大补脾汤冻干粉溶液干预AGS细胞24 h后增殖能力, 与对照组相比, 仅300 μg·mL-1浓度大补脾汤冻干粉溶液干预后细胞增殖减慢, 差异有统计学意义(P < 0.01, 图 1B)。以上结果提示, 大补脾汤具有抑制AGS细胞增殖的作用, 300 μg·mL-1浓度是大补脾汤冻干粉溶液抑制AGS细胞增殖的有效浓度。
1.3 大补脾汤对AGS胃癌细胞周期的影响为验证大补脾汤对胃癌细胞增殖的抑制作用, 本研究进一步检测了大补脾汤冻干粉溶液对AGS胃癌细胞周期的影响。与对照组相比, 200和300 μg·mL-1浓度大补脾汤冻干粉溶液干预后细胞G0/G1期细胞比例升高, 而S期细胞比例降低, 差异有统计学意义(P < 0.05), 以上结果证实, 大补脾汤冻干粉溶液能够通过使AGS细胞阻滞在G0/G1期, 进而抑制其增殖(图 2)。
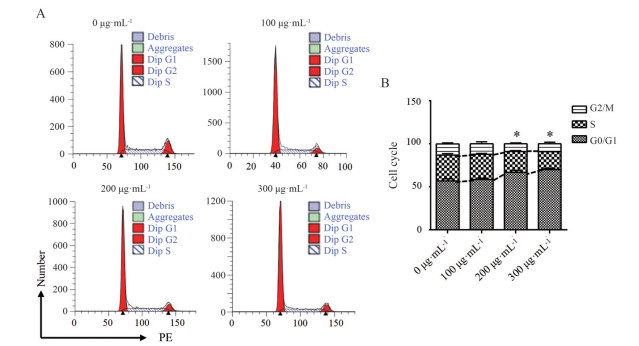
|
Figure 2 The effect of Dbp D freeze-dried powder solution on AGS cell cycle. n = 3, |
线粒体是维持细胞增殖活力和周期的最主要细胞器, 线粒体膜电位是判断线粒体活性的重要指标, 线粒体膜电位的下降是细胞线粒体活性减弱的标志。本研究通过JC-10线粒体膜电位荧光染料观察线粒体膜电位变化, 即在线粒体膜电位较高时, JC-10聚集在线粒体的基质中, 形成聚合物, 产生橙红色荧光(检测波长为594 nm), 在线粒体膜电位较低时, JC-10不能聚集在线粒体的基质中, 为单体, 产生绿色荧光(检测波长为488 nm)。与对照组相比, 200和300 μg·mL-1浓度的大补脾汤冻干粉溶液干预后细胞线粒体膜电位明显降低(图 3)。以上结果均提示, 大补脾汤可以降低胃癌细胞线粒体活性, 起到抑制胃癌细胞增殖的作用。
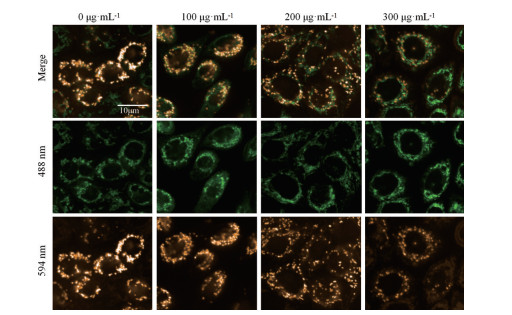
|
Figure 3 The effect of Dbp D freeze-dried powder solution on the mitochondrial membrane potential of AGS cells. Scale bar = 10 μm |
本研究通过上述研究验证其能够抑制AGS胃癌细胞增殖, 但鉴于大补脾汤由多药味组成而具有不同的功效特点, 本研究进一步基于中医理论对方中各药物的四气、五味和归经的特点进行总结, 归纳出其在性、味、归经方面的组方规律。在构建大补脾汤“中药-四气”网络中, 大补脾汤中人参、白术、旋覆花、五味子均为温药, 麦冬性寒, 干姜性热, 甘草性平; 在构建大补脾汤“中药-五味”网络中, 五味子为酸味, 白术为苦味, 甘草、麦冬和人参属甘味, 干姜为辛味, 旋覆花为咸味; 构建大补脾汤“中药-归经”网络发现大补脾汤中麦冬、白术、旋覆花和干姜归胃经, 五味子和干姜都归肾经, 人参、白术、干姜和甘草归脾经, 五味子、人参和甘草归胃经, 麦冬、人参、旋覆花、甘草、五味子和干姜归肺经。以上分析结果提示, 大补脾汤以温性药物为主, 辅以寒性和热性药; 全方五味俱全, 多为甘味药, 性味平和; 主要归脾、胃、肺经, 脾为脏, 胃为腑, 肺为脾之子脏, 提示大补脾汤中药物的归经方面具有调节脾胃疾病的理论支撑。大补脾汤主治胃癌正气亏虚, 阴津亏损, 方中药物在性、味、归经方面具有相应的调节特点, 因此具有治疗胃癌的中医理论基础。
3 大补脾汤的潜在活性成分与潜在靶点结合细胞实验验证和大补脾汤治疗胃癌性、味、归经特点的探讨, 本研究进一步对方中药物进行不同功效分组, 以期探讨本方的配伍规律和发挥不同功效的科学内涵。首先筛选出方中不同功效分组药物的潜在活性成分和靶点, 并分析其发挥多功效作用可能的物质基础和机制。全方共收集到159个潜在活性成分(去重), 其中益气组成分97个、温中组成分15个、养阴组成分35个和降逆组成分18个。通过Swiss Target Prediction数据库预测全方化合物潜在靶点共1 079个(去重), 其中益气组化合物靶点854个、温中组化合物靶点534个、养阴组化合物靶点643个和降逆组化合物靶点577个。益气组、温中组、养阴组、降逆组化合物潜在靶点分别与胃癌疾病相关潜在靶点的共有靶点为165、110、133和115个, 大补脾汤全方与胃癌疾病相关靶点的共有靶点193个, 其中益气、养阴组潜在起效靶点更多, 可能是大补脾汤防治胃癌的主要功效。以拓扑网络参数连接度、介度、紧密度均大于其中位数为标准筛选出益气组、温中组、养阴组、降逆组及全方成分防治胃癌的关键靶点分别为50、63、43、35和77个, 表明各功效组均具有较多的防治胃癌的潜在靶点, 表明各功效组具有协同起效的生物学基础。
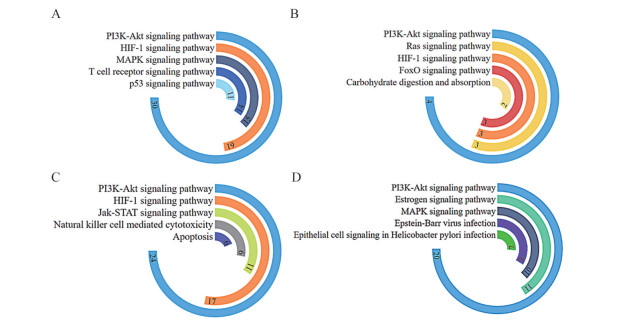
4 大补脾汤不同功效组的“药味-潜在活性成分-关键靶点”网络及通路分析鉴于大补脾汤具有多点显效、协同起效的药效特点, 因此, 本研究进一步对不同功效分组构建“药味-潜在活性成分-关键靶点”网络, 以期筛选出不同功效药物共同发挥抗胃癌作用的潜在活性成分和对应的关键靶点、通路。构建益气功效组“药味-潜在活性成分-关键靶点”网络, 得到50个关键靶点对应93个潜在活性成分, 见图 4A。其关键靶点参与的通路主要有PI3K-Akt signaling pathway、HIF-1 signaling pathway、MAPK signaling pathway、T cell receptor signaling pathway、p53 signaling pathway等, 见图 5A。构建温中功效组“药味-潜在活性成分-关键靶点”, 得到63个关键靶点对应15个潜在活性成分, 见图 4B。其关键靶点参与的通路主要有PI3K-Akt signaling pathway、Ras signaling pathway、HIF-1 signaling pathway、FoxO signaling pathway、carbohydrate digestion and absorption等, 见图 5B。构建养阴功效组“药味-潜在活性成分-关键靶点”网络, 得到43个关键靶点对应34个潜在活性成分, 见图 4C。其关键靶点参与的通路主要有PI3K-Akt signaling pathway、HIF-1 signaling pathway、Jak-STAT signaling pathway、natural killer cell mediated cytotoxicity、apoptosis等, 见图 5C。构建降逆功效组“药味-潜在活性成分-关键靶点”网络, 得到35个关键靶点对应18个潜在活性成分, 见图 4D。其关键靶点参与的通路主要有PI3K-Akt signaling pathway、estrogen signaling pathway、MAPK signaling pathway、Epstein-Barr virus infection、epithelial cell signaling in Helicobacter pylori infection等, 见图 5D。以上结果提示, 在不同功效分组的药物潜在活性成分所对应的关键靶点通路中, 既有差异的信号通路, 起到“多点显效”的作用, 也有相同的信号通路, 起到“协同起效”的作用。

|
Figure 4 Network of "drug-potential active ingredient-potential target" grouped by efficacy compatibility. A: Yiqi effect group; B: Wenzhong effect group; C: Yangyin effect group; D: Jiangni effect group |
|
Figure 5 Signal pathway grouped by efficacy compatibility. A: Signal pathways involved in the regulation of potential active components of Yiqi effect group drugs; B: Signal pathways involved in the regulation of potential active components of Wenzhong effect group drugs; C: Signal pathways involved in the regulation of potential active components of Yangyin group drugs; D: Signal pathways involved in the regulation of potential active components of Jiangni group drugs |
中药方剂往往通过多个方向、多个靶点、多个层次发挥药效作用, 这些功效组的协同作用对全方起效具有显著贡献。通过大补脾汤4个功效组关键靶点KEGG富集分析, 筛选P < 0.05的通路, 益气组得到111条通路, 养阴组得到110条通路, 温中组95条通路, 降逆组102条通路。从数量上看, 益气组合养阴组依然排前两位, 表明潜在干预的生物学通路更多。
将通路进行韦恩分析(图 6), 结果发现: 温中组、益气组、养阴组、降逆组的共有通路91条, 经筛选与胃癌相关的通路有12条, 包括: FoxO signaling pathway[7]、VEGF signaling pathway[8]、HIF-1 signaling pathway[9]、PI3K-Akt signaling pathway[10]等。养阴组、益气组、降逆组的共有通路101条, 其中包括与胃癌相关的通路有mTOR signaling pathway、Toll-like receptor signaling pathway[11]、MAPK signaling pathway[12]、Jak-STAT signaling pathway[13]等。养阴组、益气组包含共有通路7条, 其中与胃癌和肿瘤相关的通路有TGF-beta signaling pathway[14]、Wnt signaling pathway[15]等。
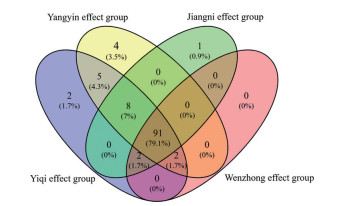
|
Figure 6 Diagram of KEGG pathway VENN among the efficacy groups of Dabupi Decoction |
基于对不同功效分组药物-潜在活性成分-关键靶点网络和通路的分析, 本研究进一步与全方的网络和通路进行对比分析。构建大补脾汤全方“药味-潜在活性成分-关键靶点”网络, 得到77个关键靶点对应154个潜在活性成分。其关键靶点参与的通路包括PI3K-Akt signaling pathway、viral carcinogenesis、HIF-1 signaling pathway、estrogen signaling pathway、carbohydrate digestion and absorption等通路。见图 7。针对全方“药味-潜在活性成分-关键靶点”拓扑网络筛选得到大补脾汤防治胃癌的核心成分59个和核心靶点36个。全方中所筛选出的关键靶点参与通路包含在各功效分组关键通路中, 提示大补脾汤全方是基于不同功效的药发挥抗胃癌作用。
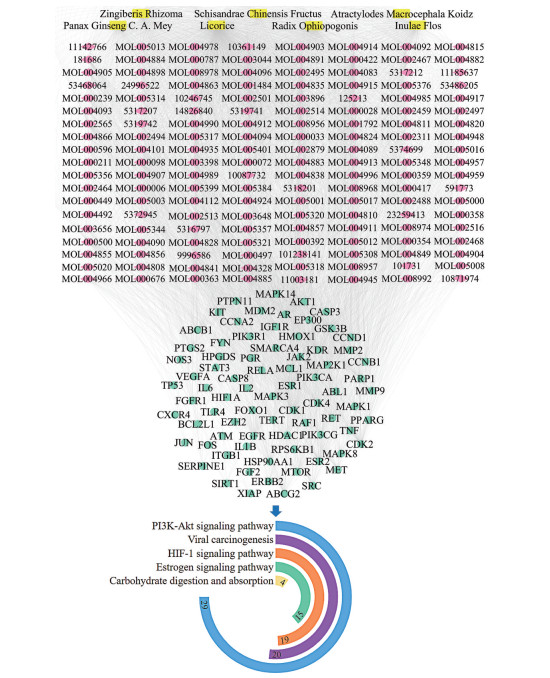
|
Figure 7 The whole prescription of Dabupi Decoction drugs-potential active ingredients-potential targets-pathway network |
通过复杂网络分析预测出大补脾汤防治胃癌的潜在活性化合物和靶点, 但其发挥抗胃癌作用的核心靶点与核心成分靶向作用仍然需要进一步明确。分子对接是计算机辅助药物设计的重要手段, 分子对接常用来研究化合物与网络中关键靶点的交互作用, 通常对接分值≤ -5表明有较好的结合活性。选取“药味-潜在活性成分-关键靶点”网络中度值排名前10的核心靶点与前20个核心成分进行了分子对接验证, 对接结果以热图形式呈现, 见图 8。结果显示, 化合物甘草素(PubChem CID: 114829)、槲皮素(PubChem CID: 5280343)、山柰酚(PubChem CID: 5280863)、异鼠李素(PubChem CID: 5281654)、麦冬高异黄酮A (PubChem CID: 5319741) 等化合物对各个靶点的结合活性均较高, 推测可能是大补脾汤起效的多靶点成分。ATP结合盒转运蛋白亚家族G2 (ATP-binding cassette superfamily G member 2, ABCG2)、雄激素受体(androgen receptor, AR)、表皮生长因子受体(epidermal growth factor receptor, EGFR)、雌激素受体1 (estrogen receptor 1, ESR1)、糖原合酶激酶3β (glycogen synthase kinase-3 beta, GSK3β) 等靶点与各个潜在活性化合物之间的亲和力较好, 推测大补脾汤通过多途径发挥药效。由此结果可以看出, 大补脾汤中的成分通过作用于不同的靶点共同起到防治胃癌的作用, 不同成分之间需要形成配伍发挥协同增效的作用。同时, 也说明了靶点反向预测结果及基于靶点反向预测结果得到的靶点网络、通路分析的可靠性。
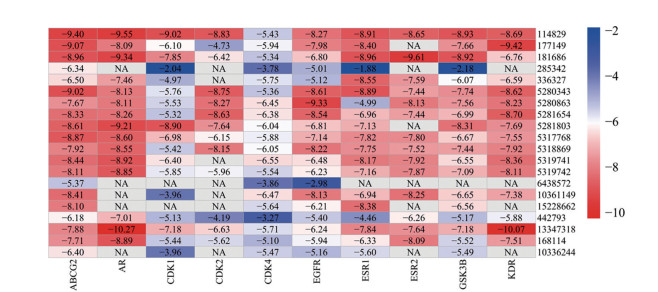
|
Figure 8 Heat map analysis of molecular docking fraction |
化合物产生药效的关键是与药物靶点是否具有合理的结合模式。为了进一步研究核心靶点与其对应成分结合模式的合理性[16], 本研究选取了对接分值较高的10个核心成分分别与其靶蛋白进行结合模式分析, 见图 9。由图 9A~D可知, 甘草素与靶蛋白ABCG2、CDK1、CDK2、GSK3β结合密切, 推测是甘草素易与蛋白形成氢键及π-π堆积作用, 如苯环上的酚羟基与羰基氧分别与残基THR 435、LEU 83、ASP 146、HID 84、ASP 145、ASN 64、VAL 135易形成氢键, 苯环与残基PHE 439、PHE 67易形成π-π堆积作用。红门兰酚与靶蛋白ESR1、ESR2及六氢姜黄素与靶蛋白AR、KDR结合密切, 推测是红门兰酚和六氢姜黄素易与蛋白形成氢键及π-π堆积作用, 如苯环上的酚羟基与残基ARG 394、GLU 305、GLU 885、CYS 919易形成氢键, 苯环与残基PHE 764、PHE 404易形成π-π堆积作用, 见图 9E~H。麦冬高异黄酮A、山柰酚分别与靶蛋白CDK4、EGFR具有良好的亲和性, 化合物与靶蛋白之间主要形成了氢键作用, 见图 9I、J。通过结合模式分析发现, 核心靶点与对应的核心成分之间有着较强的相互作用, 推测化合物可能有着一定的潜在活性。
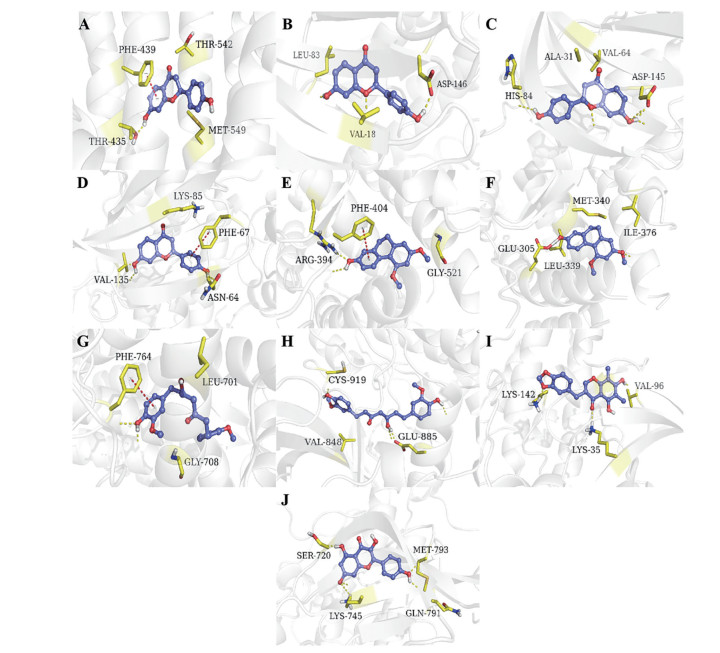
|
Figure 9 Binding pattern diagram of representative active ingredients and target protein. A: Liquiritigenin interacts with ABCG2; B: Liquiritigenin interacts with CDK1; C: Liquiritigenin interacts with CDK2; D: Liquiritigenin interacts with GSK3B; E: Orchinol interacts with ESR1; F: Orchinol interacts with ESR2; G: Hexahydrocurcumin interacts with AR; H: Hexahydrocurcumin interacts with KDR; I: Methylophiopogonanone A interacts with CDK4; J: Kaempferol interacts with EGFR. Among them, the yellow dashed line represents the hydrogen bond interaction, and the red dashed line represents the π-π interaction |
计算化合物与靶点的结合自由能是药物发现过程中的重要环节。通过计算结合自由能分析每种作用方式的贡献程度, 深层次地探究核心靶点与对应的核心成分之间结合亲和力的差异。对应的核心成分与核心靶点结合自由能数值越小, 表示结合所需能量越低, 越有利于配体与蛋白的结合。结果如表 1, 代表性核心成分与受体蛋白之间均有着较低的结合能, 进一步说明了核心成分与各靶点有一定的亲和力。
| Table 1 Energy contribution of binding free energy of potential active compounds and positive compounds at different targets of Dabupi Decoction |
从结合自由能结果可看出, 甘草素、六氢姜黄素、麦冬高异黄酮A及红门兰酚与多个靶点均具有较高的结合自由能, 可能大补脾汤防治胃癌的多靶点成分。此外, 山柰酚与抗胃癌的成药性靶点EGFR结合能力也较好, 可能是大补脾汤针对EGFR发挥抗胃癌的代表潜在活性成分。此外, 山柰酚与EGFR结合自由能高于EGFR与其原配体的结合自由能, 进一步提示山柰酚对于EGFR具有良好的靶向潜力(表 1)。
9 分子动力学模拟分子动力学是一种用于在原子水平上监测蛋白-配体复合物动力学的方法。与分子对接不同, 分子动力学模拟可真实地描绘复杂的生物系统。本研究对EGFR和山柰酚复合物进行50 ns分子动力学模拟, 研究其稳定性和构象变化。在分子动力学模拟中, 均方根偏差(root-mean-square-deviation, RMSD) 通常用于评估系统的动态稳定性, 代表了两个分子的距离和构象差异的整体度量。如图 10A所示, 经过50 ns的模拟各体系的RMSD波动值均稳定在一定范围内, 表明在MD过程中得到了稳定的构象, 体系达到良好的平衡状态, 可用于进一步分析。
|
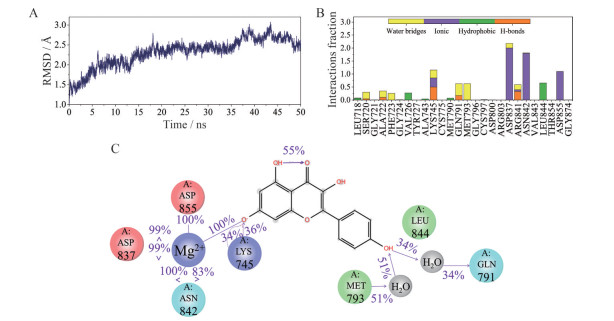
Figure 10 Molecular dynamics simulation of EGFR and kaempferol. A: The monitored root-mean-square-deviation (RMSD) of the all atoms with respect to the initial structure during the 50 ns simulation; B: Protein-ligand contact of kaempferol; C: 2D diagram of interaction between EGFR and kaempferol |
由图 10B、C可以看出, 在50 ns的模拟过程中, EGFR蛋白结构中的较多氨基酸残基与山柰酚形成了较长时间的稳定的相互作用, 表明在整个模拟过程中二者结合得较好。其中, 残基LYS 745、ASN 842、ASP 837、ASP 855在50 ns模拟过程中通过Mg2+与山柰酚形成了较为稳定的相互作用。残基MET 793和GLN 791通过水分子桥与山柰酚结构中的羟基相互作用。
讨论胃癌在中医里属于“伏梁”、“反胃”、“胃脘痛”、“噎膈”等范畴, 手术和化疗是临床治疗胃癌最常用的手段[17]。但胃癌脾胃虚弱贯穿胃癌始终: 癌瘤久存于体内, 为快速生长不断吸收五脏之精微, 导致五脏之精亏损, 精不足则无以化气而加重中焦气虚, 虚寒内生, 气血津液生化乏源, 导致正气亏虚、升降失职, 阴津亏损、燥热内生, 常常引起患者对手术或化疗的不耐受。因此, 胃癌防治应当辅以健脾温中, 益气养阴。敦煌方大补脾汤具有健脾温中、益气养阴的功效, 能够对应胃癌患者的症候特点, 具有胃癌治疗或辅助治疗的理论基础。
结合理论分析, 本研究通过细胞实验证实了大补脾汤具有抑制胃癌细胞增殖活性的效果。线粒体能够为肿瘤细胞快速生长提供能量, 是维持细胞生理活动的关键细胞器[18], 在体外细胞实验中, 本研究发现300 μg·mL-1大补脾汤冻干粉溶液能够通过降低AGS胃癌细胞线粒体膜电位, 使细胞周期阻滞在G0/G1期, 进一步抑制其增殖能力。生物学实验证实了大补脾汤具有抑制胃癌细胞的作用, 为进一步的物质基础和机制探讨提供了前提。考虑到中药复方通常具有多成分、多靶点的作用机制, 其对胃癌治疗作用可能不仅局限于对于胃癌细胞的增殖抑制, 因此本研究希望进一步通过网络药理学研究去解释大补脾汤不同功效配伍分组的科学内涵。
大补脾汤中人参、麦门冬、五味子益气养阴敛汗, 旋覆花降逆止呕, 方中白术、甘草健脾调中, 干姜温脾胃阳气以助运化。大补脾汤中多为温药, 同时辅以寒、热药互补调节; 方中甘味药居多, 同时包含了酸、苦、辛、咸味药, 五味平和; 方中各药多归于脾、胃、肺经, 既注重表里调节, 也强调母子传变的关系。一方面大补脾汤通过性、味、归经达到配伍间的平衡, 共同发挥温中回阳、益气养阴的功效; 另一方面基于各药物性、味、归经的差异, 本课题组认为不同功效配伍的药物活性成分针对多个靶点、信号通路发挥对胃癌的防治作用。
围绕该方核心功效, 将大补脾汤药味分为益气组(人参、甘草、白术)、温中组(干姜)、养阴组(麦冬、五味子) 和降逆组(旋覆花) 4个功效组, 并以此建立了“药物-潜在作用成分-潜在靶点-通路”网络, 并结合VENN分析发现, 大补脾汤所含4个功效组富集的通路主要分布于机体能量代谢、炎症-免疫系统调节和周期-凋亡功能3个模块, 各模块间通过共有靶标基因联结又各有侧重: 益气组、温中组和养阴组侧重于炎症-免疫调节, 其中PI3K-Akt、T细胞受体、NK细胞介导的细胞毒性、HIF-1信号通路等可能起到关键作用。胃癌患者预后与免疫功能紊乱密切相关[19]。除T细胞受体、NK细胞介导的细胞毒性等调节免疫细胞的信号通路外, HIF-1的激活将诱导肿瘤细胞高表达CD47, 进而避免受到巨噬细胞攻击[20, 21], 而HIF-1的过度活化会引起Th17/Treg失衡以及T细胞相关的免疫抑制[21, 22]。因此, 以上信号通路有可能是大补脾汤参与免疫调节的重要分子机制。温中组、降逆组和益气组侧重机体能量代谢调节, 其中碳水化合物消化吸收信号通路、FoxO信号通路、MAPK信号通路等可能发挥关键作用。肿瘤患者大多存在食物消化吸收障碍等问题, 尤其是肿瘤术后或化疗, 气阴耗伤, 脾虚失运, 脾胃不能运化水谷, 机体水谷精微吸收减少, 而脾胃升降失职加重了患者食欲减退及一系列消化不良的症状。当机体内正常能量代谢受影响时将影响患者的生存质量, 甚至关系到生存期[23, 24]。大补脾汤能够调理脾胃, 充养气血生化之源。除碳水化合物消化吸收信号通路外, MAPK信号通路是调节能量代谢的关键通路。在肿瘤微环境中细胞因子(如TNFα)、胰岛素、生长因子(如IGF1或EGF) 等均能够引起MAPK信号通路异常, 其中最为主要的是影响机体糖异生、糖原合成、蛋白质合成和脂肪细胞分化[25, 26]。此外, FoxO是另一调节糖代谢的重要通路, FoxO作为抑癌蛋白, 活化的PI3K-Akt信号通路通过抑制FoxO进而抑制葡萄糖6-磷酸酶, 减少葡萄糖代谢[27, 28]。因此, 大补脾汤发挥温中、健脾益气、调和脾胃功能的途径可能是基于以上潜在关键通路调节能量代谢。降逆组、益气组和养阴组侧重增殖-凋亡功能调节, 其中p53信号通路、凋亡信号通路、雌激素信号通路等可能发挥关键作用。Hanahan等[29]强调生长信号(self-sufficiency in growth signals) 和凋亡受阻(resisting cell death) 是肿瘤的重要特征, p53信号通路参与调控细胞周期, 是抑制肿瘤生长的关键通路, 而凋亡信号通路也密切参与到细胞凋亡的生理过程[30, 31]。雌激素信号通路被认为是促进癌症的关键信号通路, 其异常表达可以与MAPK、mTOR等信号通路相互影响, 促进肿瘤细胞的恶性增殖[32, 33]。大补脾汤发挥降逆、益气、养阴功效的途径可能与以上具有增殖-凋亡调节作用的信号通路相关。
此外, 温中组富集的Ras信号通路, 降逆组富集的EB病毒感染、幽门螺杆菌感染的上皮细胞信号转导均是胃癌治疗的关键信号通路[34-36]。结合全方“药物-潜在作用成分-潜在靶点-通路”网络可进一步发现, 大补脾汤发挥“温中健脾, 益气养阴”防治胃癌功效主要作用在机体能量代谢、炎症-免疫系统和周期-凋亡功能调节3个方面, 不同的功效配伍药物的多个成分既可作用于不同的信号通路发挥同一功能调节, 也可作用于同一信号通路发挥不同的功能调节, 体现了其多点显效、协同增效的作用特点与多成分、多靶点、多通路的作用机制。
通过网络预测到大补脾汤154个潜在活性成分通过186个靶点参与胃癌防治, 其中关键靶点57个, 基于复杂网络分析方法对大补脾汤全方及功效分组规律科学内涵进行初步分析。但仅是在生物数据的基础上对大补脾汤防治胃癌的潜在活性成分及靶点进行预测, 仍然缺乏针对代表成分或靶点关键性的进一步验证。而计算机辅助药物设计(computer-aided drug design, CADD) 可以高速有效筛选出网络预测出的药物活性成分, 并从多维度、多层面揭示其可能的靶向分子机制。分子对接、结合自由能计算及分子动力学模拟等CADD方法对中药化合物与靶点之间的相互作用方式和亲和力进行评估, 可为中医复方的现代化挖掘及发现潜在活性成分提供可靠的支撑[37]。因此, 本研究进一步采用CADD的技术体系, 首先通过分子对接去评价药物核心成分与核心靶点结合能力, 发现化合物甘草素、槲皮素、山柰酚、异鼠李素、麦冬高异黄酮A等对各个靶点的结合均较好, ABCG2、AR、EGFR、ESR1、GSK3β等靶点与各个潜在活性化合物之间的亲和力较好; 然后, 进一步分析化合物与靶点的结合模式及与周围氨基酸残基的相互作用, 同时针对核心靶点与对应成分的结合自由能计算的结果也进一步提示, 以上核心靶点与对应的活性成分有较稳定的结合模式和较好的结合力。ESR1[38]、AR[39]、EGFR[40, 41]、ABCG2[42]、GSK3β[15]均已被证实与胃癌的发生发展密切相关, 在经典的新加坡-杜克(Singapore-Duke)[40]、癌症基因组图谱(TCGA)[41]胃癌分子分型中, EGFR突变被认为是诱导胃癌发生的重要原因。而关于这些靶点也有大量靶向抗肿瘤药物的研发并应用于临床: 奥希替尼、阿法替尼和吉非替尼等药物已被应用于EGFR突变的肿瘤治疗中[43]。此外, ESR1拮抗剂氟维司琼也应用于乳腺癌的治疗中[44]。而在已被筛选出来的化合物中甘草素[45]已被证实能够抑制非小细胞、结直肠癌增殖, 异鼠李素[10]和槲皮素[46]能够诱导胃癌细胞凋亡, 山柰酚[47]可抑制胃癌细胞增殖。本研究通过结合自由能计算发现, 山柰酚与抗胃癌的成药性靶点EGFR有较好结合能力, 并进一步进行了分子动力学模拟证实两者具有较好的结合稳定性, 因此, 大补脾汤中代表成分山柰酚可能通过靶向EGFR发挥抗胃癌作用。本研究通过CADD的方法一方面整体验证了网络分析结果的可靠性; 另一方面分析到的关键靶点确实在调控肿瘤发生发展中具有重要意义, 而相关成分也被实验证明了具有调节肿瘤的活性, 证实了通路分析结果具有一定的参考性。
综上, 本研究首先通过体外实验证实了大补脾汤具有抑制胃癌细胞增殖活性的作用, 然后基于不同的功效配伍分组建立了“中药-潜在活性成分-关键靶点-通路”网络, 初步阐明了大补脾汤中4个功效组多点显效、协同增效的科学内涵, 最后通过CADD技术进一步探讨了大补脾汤辅助胃癌治疗的多成分、多靶点、多通路作用机制。本研究以中医理论为基础, 基于计算机辅助药物设计结合复杂网络分析策略初步揭示了大补脾汤辅助防治胃癌的物质基础和分子机制, 并探讨了大补脾汤不同功效组协同防治胃癌的科学内涵, 为大补脾汤辅助治疗胃癌的合理性进行了解释, 也为进一步深入研究包括大补脾汤在内的敦煌医方的科学内涵提供了研究模式的参考。
作者贡献: 刘永琦、靳晓杰提出研究整体思路; 李程豪负责主要实验操作及撰稿; 张敏负责分子动力学模拟; 林佳、张依茜、刘昊、王锐峰负责网络药理学和分子对接实验操作; 和建政和李亚玲负责稿件审核。
利益冲突: 所有作者声明无利益冲突。
| [1] |
Cheng B, Yuan WE, Su J, et al. Recent advances in small molecule based cancer immunotherapy[J]. Eur J Med Chem, 2018, 157: 582-598. DOI:10.1016/j.ejmech.2018.08.028 |
| [2] |
Shan S, Shi J, Yang P, et al. Apigenin restrains colon cancer cell proliferation via targeted blocking of pyruvate kinase M2-dependent glycolysis[J]. Agric Food Chem, 2017, 65: 8136-8144. DOI:10.1021/acs.jafc.7b02757 |
| [3] |
Nalinie JH, Kai KS, Khurum K. Challenges in the treatment of gastric cancer in the older patient[J]. Cancer Treat Rev, 2020, 85: 101980. DOI:10.1016/j.ctrv.2020.101980 |
| [4] |
Li TB, Yang PF. Exploration and analysis of drug pairs for diffrentiating and treating spleen and stomach diseases in Fu Xing Jue Zangfu Yong Yao Fa Yao in Dunhuang[J]. Acta Chin Med (中医学报), 2020, 35: 2097-2100. |
| [5] |
Zhang CN, Yu CZ. Study on protective effects of Dabupi Decoction of ancient prescription of Dunhuang medicine on the model rats of radiation-induced pulmonary injury[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2019, 34: 4900-4903. |
| [6] |
Wang BY, Zhang XP, Li YD, et al. Effects of Dabupi Decoction combined with Astragalus on cisplatin nephrotoxicity[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2020, 35: 431-433. |
| [7] |
Liu W, Song YY, Wang JY, et al. Dysregulation of FOXO transcription factors in Epstein-Barr virus-associated gastric carcinoma[J]. Virus Res, 2020, 276: 197808. DOI:10.1016/j.virusres.2019.197808 |
| [8] |
Kim BJ, Kim YJ, Sohn SH, et al. Tivantinib inhibits the VEGF signaling pathway and induces apoptosis in gastric cancer cells with c-MET or VEGFA amplification[J]. Invest New Drugs, 2020, 38: 1633-1640. DOI:10.1007/s10637-020-00940-3 |
| [9] |
Li H, Jia Y, Wang Y. Targeting HIF-1α signaling pathway for gastric cancer treatment[J]. Pharmazie, 2019, 74: 3-7. |
| [10] |
Li CH, Li J, Li Y, et al. Isorhamnetin promotes MKN-45 gastric cancer cell apoptosis by inhibiting PI3K-mediated adaptive autophagy in a hypoxic environment[J]. J Agric Food Chem, 2021, 69: 8130-8143. DOI:10.1021/acs.jafc.1c02620 |
| [11] |
Echizen K, Hirose O, Maeda Y, et al. Inflammation in gastric cancer: interplay of the COX-2/prostaglandin E2 and Toll-like receptor/MyD88 pathways[J]. Cancer Sci, 2016, 107: 391-397. DOI:10.1111/cas.12901 |
| [12] |
Wu S, Chen M, Huang J, et al. ORAI2 promotes gastric cancer tumorigenicity and metastasis through PI3K/Akt signaling and MAPK-dependent focal adhesion disassembly[J]. Cancer Res, 2021, 81: 986-1000. |
| [13] |
Mimura K, Teh JL, Okayama H, et al. PD-L1 expression is mainly regulated by interferon gamma associated with JAK-STAT pathway in gastric cancer[J]. Cancer Sci, 2018, 109: 43-53. DOI:10.1111/cas.13424 |
| [14] |
Yang T, Huang T, Zhang D, et al. TGF-β receptor inhibitor LY2109761 enhances the radiosensitivity of gastric cancer by inactivating the TGF-β/SMAD4 signaling pathway[J]. Aging, 2019, 11: 8892-8910. DOI:10.18632/aging.102329 |
| [15] |
Tian S, Peng P, Li J, et al. SERPINH1 regulates EMT and gastric cancer metastasis via the Wnt/β-catenin signaling pathway[J]. Aging, 2020, 12: 3574-3593. DOI:10.18632/aging.102831 |
| [16] |
Li L, Jin XJ, Li JW, et al. Systematic insight into the active constituents and mechanism of Guiqi Baizhu for the treatment of gastric cancer[J]. Cancer Sci, 2021, 112: 1772-1784. DOI:10.1111/cas.14851 |
| [17] |
Machlowska J, Baj J, Sitarz M, et al. Gastric cancer: epidemiology, risk factors, classification, genomic characteristics and treatment strategies[J]. Int J Mol Sci, 2020, 21: 4012. DOI:10.3390/ijms21114012 |
| [18] |
Kalpage HA, Bazylianska V, Recanati MA, et al. Tissue-specific regulation of cytochrome c by post-translational modifications: respiration, the mitochondrial membrane potential, ROS, and apoptosis[J]. FASEB J, 2019, 33: 1540-1553. DOI:10.1096/fj.201801417R |
| [19] |
Bizzaro N, Antico A, Villalta D. Autoimmunity and gastric cancer[J]. Int J Mol Sci, 2018, 19: 377. DOI:10.3390/ijms19020377 |
| [20] |
Vaupel P, Multhoff G. Hypoxia-/HIF-1α-driven factors of the tumor microenvironment impeding antitumor immune responses and promoting malignant progression[J]. Adv Exp Med Biol, 2018, 1072: 171-175. |
| [21] |
You L, Wu W, Wang X, et al. The role of hypoxia-inducible factor 1 in tumor immune evasion[J]. Med Res Rev, 2021, 41: 1622-1643. DOI:10.1002/med.21771 |
| [22] |
Ge Y, Yoon SH, Jang H, et al. Decursin promotes HIF-1α proteasomal degradation and immune responses in hypoxic tumour microenvironment[J]. Phytomedicine, 2020, 78: 153318. DOI:10.1016/j.phymed.2020.153318 |
| [23] |
Giezenaar C, van der Burgh Y, Lange K, et al. Effects of substitution, and adding of carbohydrate and fat to Whey-protein on energy intake, appetite, gastric emptying, glucose, insulin, ghrelin, CCK and GLP-1 in healthy older men-a randomized controlled trial[J]. Nutrients, 2018, 10: 113. DOI:10.3390/nu10020113 |
| [24] |
Gentilcore D, Hausken T, Meyer JH, et al. Effects of intraduodenal glucose, fat, and protein on blood pressure, heart rate, and splanchnic blood flow in healthy older subjects[J]. Am J Clin Nutr, 2008, 87: 156-161. DOI:10.1093/ajcn/87.1.156 |
| [25] |
Gehart H, Kumpf S, Ittner A, et al. MAPK signalling in cellular metabolism: stress or wellness?[J]. EMBO Rep, 2010, 11: 834-840. DOI:10.1038/embor.2010.160 |
| [26] |
Shin MH, Kim J, Lim SA, et al. Current insights into combination therapies with MAPK inhibitors and immune checkpoint blockade[J]. Int J Mol Sci, 2020, 21: 2531. DOI:10.3390/ijms21072531 |
| [27] |
Lee S, Dong HH. FoxO integration of insulin signaling with glucose and lipid metabolism[J]. J Endocrinol, 2017, 233: R67-R79. |
| [28] |
Unterman TG. Regulation of hepatic glucose metabolism by FoxO proteins, an integrated approach[J]. Curr Top Dev Biol, 2018, 127: 119-147. |
| [29] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144: 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [30] |
Tarangelo A, Magtanong L, Bieging-Rolett KT, et al. p53 suppresses metabolic stress-induced ferroptosis in cancer cells[J]. Cell Rep, 2018, 22: 569-575. DOI:10.1016/j.celrep.2017.12.077 |
| [31] |
Du F, Sun L, Chu Y, et al. DDIT4 promotes gastric cancer prolife-ration and tumorigenesis through the p53 and MAPK pathways[J]. Cancer Commun, 2018, 38: 45. DOI:10.1186/s40880-018-0315-y |
| [32] |
Zhang G, Cheng Y, Zhang Q, et al. ATX‑LPA axis facilitates estrogen‑induced endometrial cancer cell proliferation via MAPK/ERK signaling pathway[J]. Mol Med Rep, 2018, 17: 4245-4252. |
| [33] |
Zhu Y, Shen J, Gao L, et al. Estrogen promotes fat mass and obesity-associated protein nuclear localization and enhances endometrial cancer cell proliferation via the mTOR signaling pathway[J]. Oncol Rep, 2016, 35: 2391-2397. DOI:10.3892/or.2016.4613 |
| [34] |
Alipour M. Molecular mechanism of Helicobacter pylori-induced gastric cancer[J]. J Gastrointest Cancer, 2021, 52: 23-30. DOI:10.1007/s12029-020-00518-5 |
| [35] |
Wang X, Wu X, Xin J, et al. Genetic variants in Ras/Raf/MEK/ERK pathway are associated with gastric cancer risk in Chinese Han population[J]. Arch Toxicol, 2020, 94: 2683-2690. DOI:10.1007/s00204-020-02771-w |
| [36] |
Yang J, Liu Z, Zeng B, et al. Epstein-Barr virus-associated gastric cancer: a distinct subtype[J]. Cancer Lett, 2020, 495: 191-199. DOI:10.1016/j.canlet.2020.09.019 |
| [37] |
Lu F, Wang D, Li RL, et al. Current strategies and technologies for finding drug targets of active components from traditional Chinese medicine[J]. Front Biosci (Landmark Ed), 2021, 26: 572-589. DOI:10.52586/4968 |
| [38] |
Ge H, Yan Y, Tian F, et al. Prognostic value of estrogen receptor α and estrogen receptor β in gastric cancer based on a meta-analysis and The Cancer Genome Atlas (TCGA) datasets[J]. Int J Surg, 2018, 53: 24-31. DOI:10.1016/j.ijsu.2018.03.027 |
| [39] |
Soleymani FS, Yazdanbod M, Sotoudeh M, et al. Prognostic and therapeutic significance of androgen receptor in patients with gastric cancer[J]. Onco Targets Ther, 2020, 13: 9821-9837. DOI:10.2147/OTT.S265364 |
| [40] |
Lei Z, Tan IB, Das K, et al. Identification of molecular subtypes of gastric cancer with different responses to PI3-kinase inhibitorsand 5-fluorouracil[J]. Gastroenterology, 2013, 145: 554-565. DOI:10.1053/j.gastro.2013.05.010 |
| [41] |
Cancer Genome Atlas Research Network. Comprehensive mole-cular characterization of urothelial bladder carcinoma[J]. Nature, 2014, 507: 315-322. DOI:10.1038/nature12965 |
| [42] |
Yu B, Gu D, Zhang X, et al. The role of GLI2-ABCG2 signaling axis for 5Fu resistance in gastric cancer[J]. J Genet Genomics, 2017, 44: 375-383. DOI:10.1016/j.jgg.2017.04.008 |
| [43] |
Tamiya M, Tamiya A, Suzuki H, et al. Which is better EGFR-TKI followed by osimertinib: afatinib or gefitinib/erlotinib?[J]. Anticancer Res, 2019, 39: 3923-3929. DOI:10.21873/anticanres.13544 |
| [44] |
Blackburn SA, Parks RM, Cheung KL. Fulvestrant for the treatment of advanced breast cancer[J]. Expert Rev Anticancer Ther, 2018, 18: 619-628. DOI:10.1080/14737140.2018.1473038 |
| [45] |
Meng FC, Lin JK. Liquiritigenin inhibits colorectal cancer prolife-ration, invasion, and epithelial-to-mesenchymal transition by decreasing expression of Runt-related transcription factor 2[J]. Oncol Res, 2019, 27: 139-146. DOI:10.3727/096504018X15185747911701 |
| [46] |
Lee HH, Lee S, Shin YS, et al. Anti-cancer effect of quercetin in xenograft models with EBV-associated human gastric carcinoma[J]. Molecules, 2016, 21: 1286. DOI:10.3390/molecules21101286 |
| [47] |
Zhang F, Ma C. Kaempferol suppresses human gastric cancer SNU-216 cell proliferation, promotes cell autophagy, but has no influence on cell apoptosis[J]. Braz J Med Biol Res, 2019, 52: e7843. DOI:10.1590/1414-431x20187843 |
 2022, Vol. 57
2022, Vol. 57


