2. 广西三七综合利用技术重点实验室, 广西 梧州 543002
2. Guangxi Key Laboratory of Comprehensive Utilization Technology of Pseudo-ginseng, Wuzhou 543002, China
脑卒中主要分为出血性和缺血性脑损伤[1], 其中缺血性损伤占所有脑卒中的87%[2, 3]。脑缺血对微血管造成氧化应激、炎症反应、血脑屏障功能障碍等一系列损伤。微循环障碍是缺血性脑损伤的重要病理改变, 改善微循环是干预脑缺血的重要措施。
血栓通主要成分为三七总皂苷, 临床上主要应用于各种缺血性脑血管病。三七皂苷是三七主要有效成分[4], 研究表明, 人参皂苷Rd、Rg1、Rb1、Re、三七皂苷R1等多种皂苷单体对缺血再灌注动物具有抑制自噬、抗凋亡、抗炎和抗氧化等多种药理作用[5-12]; 三七总皂苷具有改善缺血脑血流量、保护血脑屏障的作用[12, 13]。而血栓通改善微循环障碍的作用及机制研究未见文献报道。本研究通过网络药理学与实验验证相结合, 探索和验证血栓通5种主要皂苷成分改善脑微循环障碍的可能作用靶点, 以期阐明血栓通作用的机制, 为其临床治疗脑微循环障碍相关疾病应用奠定理论基础和提供科学依据。
材料与方法血栓通药物靶点数据库建立 通过PubChem (https://pubchem.ncbi.nlm.nih.gov/) 数据库获得血栓通主要成分三七皂苷R1, 人参皂苷Rg1、Re、Rb1、Rd的结构式, 导入Swiss Target Prediction (http://www.swisstargetprediction.ch/) 数据库预测出靶基因, 通过UniprotKB (https://www.uniprot.org/) 中提取基因名, 导入Cytoscape软件绘制血栓通主要成分-靶点的拓扑图。
微循环障碍疾病靶点数据库建立 通过GeneCards (https://www.genecards.org/)、OMIM (Online Mendelian Inheritance in Man) (https://omim.org/) 数据库搜索脑微循环障碍疾病相关靶点。两个数据库获得的靶点合并去重后通过Uniprot数据库规范化后得到脑微循环障碍疾病相关靶点。
绘制VENN图和蛋白质互作 (protein-protein interaction, PPI) 图 利用VENN (http://bioinformatics.psb.ugent.be/webtools/Venn/) 在线作图工具绘制VENN图, 对血栓通的预测靶基因和脑微循环障碍的差异表达基因取交集, 获得血栓通改善脑微循环障碍的靶点。将公共靶点信息导入STRING在线分析平台, 最低置信度(minimum confidence) 设置为0.4, 绘制PPI图, 并将该图导入Cytoscape3.6.1软件进行拓扑学分析, 根据度值(degree) 和介值中心度(betweenness centrality) 筛选出大于其均值的核心靶点。
基于GO (Gene ontology) 和KEGG (Kyoto encyclopedia of genes and genomes) 分析靶基因的功能及通路 将公共靶点导入DAVID 6.8 (https://david.ncifcrf.gov/) 数据库分析靶基因的功能和富集通路, 并用生信(http://www.bioinformatics.com.cn/) 在线作图工具绘制可视化图形, 获得血栓通作用于脑微循环障碍的信号通路及生物过程。
实验药物、试剂和仪器 注射用血栓通(批号: 180806), 广西梧州制药(集团) 股份有限公司; 异氟烷, 深圳市瑞沃德生命科技有限公司; HEPES、NaCl、KCl、NaH2PO4、CaCl2、MgSO4、D-(+)-葡萄糖、Dextran-70, 国药集团; 蛋白激酶B (protein kinase B, AKT1)、肉瘤癌基因(sarcoma oncogene, SRC)、血管内皮生长因子A (vascular endothelial growth factor A, VEGFA)、成纤维细胞生长因子2 (fibroblast growth factor 2, FGF2)、半胱氨酸天冬氨酸蛋白酶-3 (caspase 3, CASP3)、基质金属蛋白酶9 (matrix metallopeptidase 9, MMP-9)、信号传导及转录激活蛋白-3 (signal transducer and activator of transcription 3, STAT3)、凝血因子II (coagulation factor II, F2) 引物, 上海捷瑞生物工程有限公司; cDNA试剂盒、Taqman SYBR试剂盒, 美国Life Technologies公司; BCA试剂盒, 大连美仑生物技术有限公司; 兔一抗磷酸化磷酯酰肌醇-3-激酶(phosphorylated phosphatidylinositol-4, 5-bisphosphate 3-kinase, p-PI3K)、p-STAT3、p-AKT、cleaved caspase-3、B淋巴细胞瘤-2 (B-cell lymphoma 2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X, Bax), 美国Cell Signaling Technology公司; 兔一抗血小板内皮细胞黏附分子-1 (platelet endothelial cell adhesion molecule-1, PECAM-1/CD31)、MMP-9, 英国Abcam公司; 生理盐水, 华裕(无锡) 制药有限公司; 大脑中动脉阻塞(middle cerebral artery occlusion, MCAO) 线栓, 北京西浓科技有限公司; 倒置荧光显微镜(IX 81), 日本Olympus公司; 实时定量PCR仪(QuantStudioTM 6 Flex System), 美国赛默飞公司。
实验动物 雄性健康SD大鼠, 体重220~250 g, 购于上海西普尔-必凯实验动物有限公司[许可证号: SCXK (沪) 2018-0006], 适应性饲养1周, 饲养条件为12 h光照/12 h黑暗, 室温(25 ± 2) ℃, 湿度40%~60%, 自由饮水进食。所有动物实验均按照上海中医药大学动物管理和使用委员会批准的方案(伦理编号: PZSHUTCM210715002) 进行。
模型建立与给药 将27只大鼠分为3组, 分别为假手术组、大脑中动脉阻塞再灌注(middle cerebral artery occlusion and reperfusion, MCAO/R) 组、MCAO/R+血栓通(48 mg·kg-1) 组。血栓通剂量由临床剂量换算获得。通过线栓法建立MCAO模型, 假手术组仅分离颈动脉。缺血2 h后拔出线栓血流复通再灌。再灌注后各组动物即刻按剂量静脉给药(3 mL·kg-1), 假手术组和模型组给予等体积0.9%氯化钠注射液。
神经行为学评价 再灌后1~7天, 每天采用单盲法由非手术实验人员参照Longa法[14]进行神经功能评分。各组观察前肢屈曲和爬行情况, 动物行为学评分越高, 表明动物行为缺陷症状越严重, 采用1~3分的动物进行后续实验。具体评分标准如下: 0分, 无神经功能缺损表现, 活动正常; 1分, 提尾时病灶对侧前肢屈曲不能伸展; 2分, 行走时身体向对侧转圈; 3分, 行走时身体向对侧倾倒; 4分, 不能自发行走, 意识丧失。
CD31免疫组织化学染色 给药7天后, 将动物异氟烷麻醉, 左心室注射0.3 mL·kg-1 1%的肝素钠后缓慢灌注生理盐水, 待大鼠肝脏变白, 右心耳流出干净清亮的液体后灌注4%多聚甲醛, 待动物身体僵硬, 断头取脑, 石蜡包埋切片。将切片脱蜡脱水, 进行抗原修复, 置于3%的双氧水溶液室温避光孵育25 min, 3% BSA室温封闭30 min, 于4 ℃一抗(CD31, 1∶3 000) 孵育过夜, 次日孵育对应二抗, DAB显色, 苏木素染细胞核, 脱水封片。显微镜下观察, 根据Weidner的方法计算微血管密度[15]。每个脑组织在高倍镜下随机选取4个不重叠视野进行统计并取平均值。
脑微血管提取 给药7天后, 将动物异氟烷麻醉, 于冰上迅速剥离出缺血侧皮层, 置于玻璃研磨器中, 每个皮层加1.4 mL预冷的微血管提取缓冲液(按10 mmol·L-1 HEPES, 141 mmol·L-1 NaCl, 4 mmol·L-1 KCl, 1 mmol·L-1 NaH2PO4, 2.8 mmol·L-1 CaCl2, 1 mmol·L-1 MgSO4, 10 mmol·L-1 D-(+)-葡萄糖, pH 7.4), 玻璃研磨器研磨, 直至均匀分布, 无块状组织。加入3.4 mL预冷的26% Dextran (26 g Dextran溶于100 mL MEM培养基), 充分混匀, 分装于4个1.5 mL EP管。9 000 ×g, 4 ℃, 离心30 min, 离心后分3层, 其中下层为富含脑微血管内皮细胞的沉淀; 用棉签去除上层微量蛋白, 弃上清, 每个EP管加入1 mL灭菌冷PBS清洗下层沉淀, 1 000 ×g离心3 min, 弃尽PBS。置于液氮中速冻, 于-80 ℃保存。
实时定量 PCR采用TRIzol试剂提取总RNA, 测定浓度后, 取1 μg RNA用cDNA逆转录试剂盒进行逆转录。采用Taqman SYBR试剂盒进行实时定量PCR反应, 检测AKT1、SRC、FGF2、CASP3、STAT3、F2、VEGFA、MMP-9基因mRNA表达水平, 分别以GAPDH为内参, 通过2-△△Ct的计算方法进行统计分析(所用引物序列见表 1)。
| Table 1 RT-qPCR primer sequence table. AKT1: Protein kinase B; SRC: Sarcoma oncogene; FGF2: Fibroblast growth factor 2; CASP3: Caspase 3; STAT3: Signal transducer and activator of transcription 3; F2: Coagulation factor II; VEGFA: Vascular endothelial growth factor A; MMP-9: Matrix metallopeptidase 9 |
Western blot 在每个包含脑微血管内皮细胞沉淀的EP管加入预冷的400 μL含有蛋白酶抑制剂和磷酸酶抑制剂的裂解液, 充分混匀后, 于冰上超声1 min; 4 ℃、12 000 r·min-1离心15 min, 收集上清。使用BCA试剂盒测定蛋白浓度, 每个样品取50 μg上样, 于10%分离胶分离, 转膜后在5% BSA中室温封闭1.5 h, 4 ℃过夜孵育一抗(p-PI3K、p-STAT3、p-AKT、cleaved caspase-3、Bax、Bcl-2、CD31、MMP-9, 1∶1 000), 次日洗涤后二抗(1∶5 000) 室温摇床孵育1 h; 最后使用ECL显色剂显色并拍照。蛋白条带使用Image J进行半定量分析。
统计学分析 用GraphPad Prism 8.0统计软件, 单因素方差分析(one-way ANOVA) 结合Dunnet分析方法分析数据, 数据均以均数±标准误的形式表示, P < 0.05则表示差异有统计学意义。
结果 1 血栓通靶基因预测将三七皂苷R1, 人参皂苷Rg1、Re、Rb1、Rd的MOL 2格式文件导入Swiss Target Prediction数据库, 对获得靶点进行并集, 去重, 得242个靶点。导入Cytoscape绘制主要成分-靶点的拓扑图(图 1)。

|
Figure 1 Xueshuantong component-target topological map. The five surrounding blue nodes are the main components of Xueshuantong: notoginsenoside R1, ginsenside Rg1, Re, Rb1, Rd. Intermediate squares are the predictive targets of the five main components. The darker the color, the more associated nodes |
通过GeneCards、OMIM数据库搜索脑微循环疾病相关靶点, GeneCards共搜索到1 096个靶点, 根据其相关性分数中位数选取相关性较高的211个疾病靶点; OMIM获得靶点去重后得到619个靶点。两个数据库获得的靶点合并去重得821个脑微循环靶点, 通过Uniprot数据库规范化后得到425个靶点。
3 血栓通改善脑微循环障碍的靶点药物靶点与脑微循环障碍靶点导入韦恩图, 取其交集, 得35个共有靶点。35个共有靶点导入STRING数据库, 获得PPI拓扑图。STRING数据导入Cytoscape软件, 以度值> 平均值, 介质中心度 > 平均值为筛选条件, 得到血栓通改善脑微循环障碍的核心靶点: AKT1、VEGFA、SRC、FGF2、EGFR、CASP3、MMP-9、PIK3CA、STAT3、F2 (表 2)。
| Table 2 Protein-protein interaction (PPI) topology network property table |
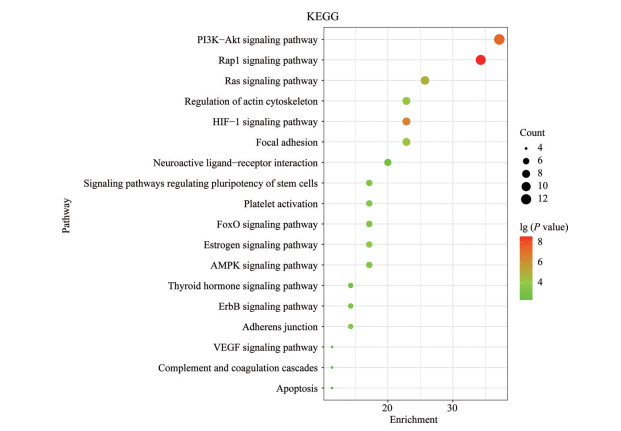
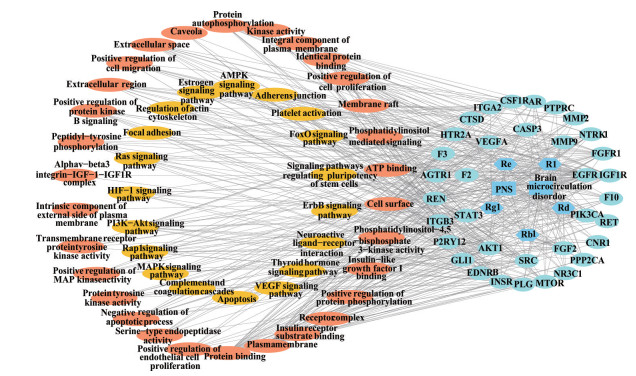
将35个共有靶点导入DAVID数据库, GO分析得205个生物过程(biological processes, BP) 结果, 27个细胞组分(cellular components, CC) 结果, 44个分子功能(molecular functions, MF) 结果; KEGG分析得63条相关通路, 以P < 0.005为筛选条件, 得到31条通路, 其中18条可能参与脑微循环障碍相关疾病进程, 分析可能与PI3K-AKT、鼠肉瘤病毒(rat sarcoma virus, Ras)、Ras相关蛋白1 (Ras-related protein 1, Rap1)、低氧诱导因子1 (hypoxia-inducible factor 1, HIF-1)、黏着斑、雌激素、腺苷酸激活蛋白激酶(AMP-activated protein kinase, AMPK)、黏附连接、血小板激活、叉头框转录因子(forkhead box O, FoxO)、血管内皮生长因子(vascular endothelial growth factor, VEGF) 等信号通路有关(图 2)。通过GO富集分析可知BP涉及细胞增殖、细胞迁移、内皮细胞增殖、凝血、凋亡等过程; CC涉及质膜、受体复合体、溶酶体、细胞外泌体、神经细胞体、轴突等细胞组分; MF涉及与跨膜受体蛋白酪氨酸激酶、蛋白质结合、ATP结合、血管内皮生长因子受体结合等过程。将核心靶点及通路导入Cytoscape软件, 得血栓通-脑微循环障碍-靶点-通路-生物过程拓扑图(图 3)。
|
Figure 2 Map of the KEGG enrichment pathway for 35 key targets (P < 0.005) |
|
Figure 3 Xueshuantong-brain microcirculation disorder-target-pathway-GO topological map. The rectangular dark blue nodes in the center of the right concentric circle is Xueshuantong and brain microcirculation disorder, dark blue hexagon is five main components of Xueshuantong, light blue circle is 35 intersection targets, including the concentric circle is the core target, and the left yellow circle is the corresponding KEGG signaling pathway, orange circle is the corresponding biological process |
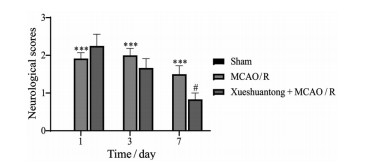
假手术组动物均未出现明显的神经行为学损伤, 与假手术组相比, 模型组大鼠均出现行走时向右侧转圈或倾倒, 提尾时右侧肢体屈曲、内收伸直等显著的神经功能损伤症状, 血栓通(48 mg·kg-1) 可显著改善大鼠神经损伤症状, 降低行为学评分, 与模型对照组比较有显著性差异(P < 0.05, 图 4)。
|
Figure 4 Effect of Xueshuantong (48 mg·kg-1) on nerve injury in middle cerebral artery occlusion and reperfusion (MCAO/R) rats. n = 6, mean ± SEM. ***P < 0.001 vs Sham group; #P < 0.05 vs MCAO/R group |
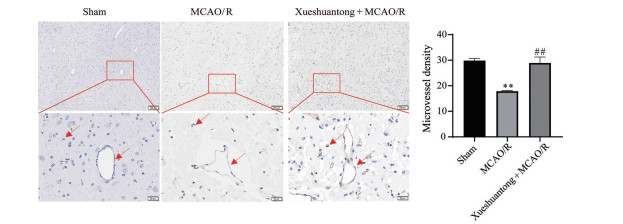
如图 5所示, 与假手术组相比, MCAO/R组动物部分脑微血管扭曲, 组织间隙变大, 微血管密度减小(P < 0.01); 与MCAO/R组相比, 脑微血管形态有所改善, 组织间隙减小, 微血管密度增大(P < 0.01)。
|
Figure 5 Effect of Xueshuantong (48 mg·kg-1) on density and morphology of the microvessels in MCAO/R rats. Arrows are shown as the microvessels. n = 3, mean ± SEM. **P < 0.01 vs Sham group; ##P < 0.01 vs MCAO/R group |
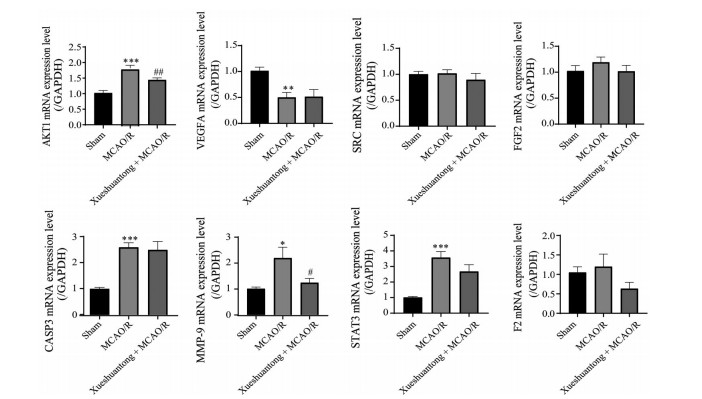
如图 6所示, 与假手术组相比, MCAO/R组AKT1、CASP3、MMP-9、STAT3 mRNA水平升高(P < 0.001, P < 0.05), VEGFA mRNA水平下降(P < 0.01), SRC、FGF2、F2 mRNA水平无明显改变; 与MCAO/R组相比, 血栓通组AKT1、MMP-9 mRNA水平下调(P < 0.01, P < 0.05), CASP3、STAT3和VEGFA无明显改变。
|
Figure 6 Effect of Xueshuantong (48 mg·kg-1) on transcription level of cerebrovascular transcription factor on ischemic side of rats. n = 6, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs Sham group; #P < 0.05, ##P < 0.01 vs MCAO/R group |
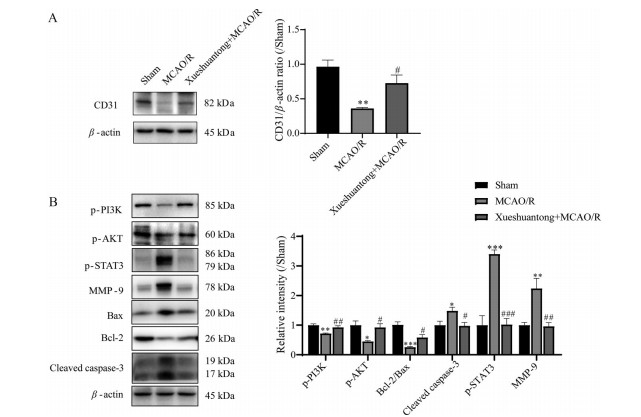
如图 7A所示, 与假手术组相比, MCAO/R组CD31蛋白水平下调(P < 0.01), 与MCAO/R组相比, 血栓通组CD31水平显著上调(P < 0.05)。如图 7B所示, 与假手术组相比, MCAO/R组磷酸化STAT3、MMP-9、cleaved caspase-3蛋白水平显著上调(P < 0.001, P < 0.01, P < 0.05), 磷酸化PI3K和AKT蛋白水平和Bcl-2/Bax比值显著下调(P < 0.01, P < 0.05, P < 0.001); 与MCAO/R组相比, 血栓通组磷酸化STAT3、MMP-9、cleaved caspase-3蛋白水平显著下调(P < 0.001, P < 0.01, P < 0.05), 磷酸化PI3K和AKT蛋白水平和Bcl-2/Bax比值显著上调(P < 0.01, P < 0.05)。
|
Figure 7 Effect of Xueshuantong (48 mg·kg-1) on cerebral microcirculation protein levels on the ischemic cotex of rats. A: Effect of Xueshuantong on the expression levels of CD31 protein; B: Effect of Xueshuantong on the protein expression levels of MMP-9, Bax, Bcl-2, cleaved caspase-3 and the phosphorylation of PI3K, STAT3, AKT. n = 4, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs Sham group; #P < 0.05, ##P < 0.01, ###P < 0.001 vs MCAO/R group |
血栓通是我国临床上广泛用于治疗急性脑梗塞的中药制剂之一, 具有抗炎、神经保护、抗细胞凋亡、改善能量代谢、抗氧化应激、抑制自噬和促血管生成作用[16-20]。研究发现, 三七皂苷通过激活PI3K/AKT信号通路激活核因子-E2相关因子2抗氧化信号通路保护脑微血管内皮细胞免受氧糖剥夺/再灌注诱导的屏障功能损伤[21], 抑制核因子-κB炎症信号传导, 减弱脂多糖诱导的血脑屏障(blood-brain barrier, BBB) 破坏和单核细胞在体外对脑内皮细胞的黏附[18]; 激活EGFR/PI3K/AKT通路和提高氧糖剥夺模型神经细胞的磷酸化水平来增强神经保护作用[22]; 激活AMPK信号通路促进HUVEC细胞增殖、迁移和管形成[23]; 激活Nrf2-VEGF通路减轻脑缺血/再灌注神经功能损伤并促进血管生成[24]。另有研究表明, Rap与Ras通路蛋白参与调节内皮细胞迁移、血管生成、血管通透性[25-29]。本研究网络药理学预测结果提示, 血栓通可能通过PI3K/AKT、Rap1、Ras、AMPK、VEGF等多个信号通路发挥抗氧化、抗炎、神经保护、促进血管新生和改善血管通透性等作用改善脑微循环障碍。
BBB主要由内皮细胞、周细胞、星形胶质细胞和基底膜组成, 构成紧密连接的脑微血管内皮细胞是BBB的核心组成部分[27]。脑缺血再灌注会破坏BBB[28]。当BBB受损后, 紧密连接被破坏, 导致外源性分子通过BBB进入大脑, 加重脑损伤[29]。Gasche等[30]在局灶性脑缺血的小鼠模型中发现, 在缺血开始后4 h观察到活化的MMP-9, 与此同时通过伊文思蓝染色法观测到BBB通透性明显增加。使用MMP-9抑制剂已被证明具有神经保护作用[31], 同时MMP-9基因沉默对BBB具有保护作用[32]。CD31是一种跨膜糖蛋白, 表达于内皮细胞的细胞间连接处[33], 调节血管完整性和免疫细胞运输[34], 是内皮细胞的标志物。研究表明, 内皮细胞缺乏CD31会损害BBB完整性[34]。本实验中血栓通可以提高CD31蛋白表达, 同时降低MMP-9的蛋白和mRNA表达, 表明其有利于恢复缺血再灌注大鼠的脑微血管的完整性。
AKT参与细胞代谢、凋亡、增殖、血管新生等生物进程[35]。AKT包含AKT1、AKT2、AKT3三个亚型[36], 其中AKT1主要存在于内皮细胞中, 与血管生成、血管成熟、维持血管完整性密切相关[37, 38]。PIK3CA是磷脂酰肌醇3-激酶(phosphoinositide 3 kinase, PI3K) 的催化亚基, 可激活PI3K/AKT信号通路[39]。研究表明, PI3K特异性抑制剂可抑制PI3K/AKT信号通路的激活, 抑制含G补缀和FHA域1的血管生成因子对BBB的保护作用及神经炎症的抑制作用[40]。在MCAO后48 h, STAT3在缺血核心的内皮中被激活[41], STAT3可直接激活MMP-9的转录, 诱导MMP-9的激活[42], 用STAT3抑制剂可改善脑缺血损伤[43]。而caspase-3与细胞凋亡密切相关, 研究发现, 抑制caspase-3的激活可减轻内皮细胞的凋亡, 对BBB具有一定保护作用[44]。在本实验中, 血栓通可降低AKT1的mRNA表达, 上调AKT和PI3K磷酸化蛋白表达; 可抑制STAT3磷酸化蛋白表达水平, 对STAT3的mRNA水平有抑制趋势; 上调凋亡调控蛋白Bcl-2/Bax的比值, 抑制cleaved caspase-3的蛋白表达水平。表明血栓通可以改善缺血再灌注后的BBB损伤, 抑制内皮细胞凋亡。
中药具有多种活性成分, 可通过多靶点、多通路发挥作用, 但也因为化学成分复杂, 缺乏有效的研究方法, 难以阐明中药配伍的分子机制。近年来, 网络药理学越来越多地应用于中药配方研究, 通过数据库获取生物活性化合物与靶标之间的相互作用以及各种靶标之间的相互作用, 再利用网络分析找出关键节点。结合本实验发现, 并非所有预测靶点对该疾病均有显著作用, 但可有效筛选出部分作用靶点。同时, 网络数据库是基于现有实验结果的预测与总结, 并不完全代表药物与疾病在机体中的作用过程。因此, 网络药理学可作为一种有效地筛选药物作用机制的一种途径, 但仍需在体内或体外进行实验验证。
综上所述, 血栓通可能通过调节PI3K、AKT、MMP-9、STAT3、caspase-3相关通路改善缺血性再灌大鼠脑微循环障碍, 减轻神经功能损伤。
作者贡献: 王高瑞设计和实施实验方案、采集实验数据、统计分析、文章撰写; 陈姿羽和吴辉设计实验方案、统计分析、技术和材料支持; 刘莹萍实施实验过程、采集实验数据; 陈明和赖树生设计实验方案、统计分析; 吴晓俊提出实验选题、指导实验设计和数据分析、批阅文章; 王峥涛指导实验设计、批阅文章、提供研究经费。
利益冲突: 全体作者均阅读并同意最终的文章, 无潜在的利益冲突。
| [1] |
Gao J, Bai P, Li Y, et al. Metabolomic profiling of the synergistic effects of ginsenoside Rg1 in combination with neural stem cell transplantation in ischemic stroke rats[J]. J Proteome Res, 2020, 19: 2676-2688. DOI:10.1021/acs.jproteome.9b00639 |
| [2] |
O'Donnell ME, Yuan JX. Pathophysiology of stroke: the many and varied contributions of brain microvasculature[J]. Am J Physiol Cell Physiol, 2018, 315: C341-C342. DOI:10.1152/ajpcell.00328.2018 |
| [3] |
Shekhar S, Cunningham MW, Pabbidi MR, et al. Targeting vascular inflammation in ischemic stroke: recent developments on novel immunomodulatory approaches[J]. Eur J Pharmacol, 2018, 833: 531-544. DOI:10.1016/j.ejphar.2018.06.028 |
| [4] |
Xu W, Qiu XH, Zhang J, et al. Analysis of saponins in Panax notoginseng by UPLC-LTQ-Orbitrap MS/MS[J]. Acta Pharm Sin (药学学报), 2012, 47: 773-778. |
| [5] |
Sun K, Fan J, Han J. Ameliorating effects of traditional Chinese medicine preparation, Chinese materia medica and active compounds on ischemia/reperfusion-induced cerebral microcirculatory disturbances and neuron damage[J]. Acta Pharm Sin B, 2015, 5: 8-24. DOI:10.1016/j.apsb.2014.11.002 |
| [6] |
Shih AY, Friedman B, Drew PJ, et al. Active dilation of penetrating arterioles restores red blood cell flux to penumbral neocortex after focal stroke[J]. J Cereb Blood Flow Metab, 2009, 29: 738-751. DOI:10.1038/jcbfm.2008.166 |
| [7] |
Dalkara T, Arsava EM. Can restoring incomplete microcirculatory reperfusion improve stroke outcome after thrombolysis?[J]. J Cereb Blood Flow Metab, 2012, 32: 2091-2099. DOI:10.1038/jcbfm.2012.139 |
| [8] |
Gu Y, Chen J, Shen J. Herbal medicines for ischemic stroke: combating inflammation as therapeutic targets[J]. J Neuroimmune Pharmacol, 2014, 9: 313-339. DOI:10.1007/s11481-014-9525-5 |
| [9] |
Lu T, Jiang Y, Zhou Z, et al. Intranasal ginsenoside Rb1 targets the brain and ameliorates cerebral ischemia/reperfusion injury in rats[J]. Biol Pharm Bull, 2011, 34: 1319-1324. DOI:10.1248/bpb.34.1319 |
| [10] |
Zhu T, Wang L, Tian F, et al. Anti-ischemia/reperfusion injury effects of notoginsenoside R1 on small molecule metabolism in rat brain after ischemic stroke as visualized by MALDI-MS imaging[J]. Biomed Pharmacother, 2020, 129: 110470. DOI:10.1016/j.biopha.2020.110470 |
| [11] |
Chen LM, Zhou XM, Cao YL, et al. Neuroprotection of ginsenoside Re in cerebral ischemia-reperfusion injury in rats[J]. J Asian Nat Prod Res, 2008, 10: 439-445. DOI:10.1080/10286020801892292 |
| [12] |
Yang PF, Song XY, Chen NH. Advances in pharmacological studies of Panax notoginseng saponins on brain ischemia-reperfusion injury[J]. Acta Pharm Sin (药学学报), 2016, 51: 1039-1046. |
| [13] |
Wu YJ, Zhu XY, Sha XY, et al. The pharmacokinetics and pharmacodynamics of intranasal preparation of Panax notoginseng Saponins[J]. Acta Pharm Sin (药学学报), 2005, 40: 377-381. |
| [14] |
Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20: 84-91. DOI:10.1161/01.STR.20.1.84 |
| [15] |
Weidner N. Tumor angiogenesis: review of current applications in tumor prognostication[J]. Semin Diagn Pathol, 1993, 10: 302-313. |
| [16] |
Wang X, Wang S, Wang J, et al. Neuroprotective effect of Xueshuantong for injection (lyophilized) in transient and permanent rat cerebral ischemia model[J]. Evid Based Complement Alternat Med, 2015, 2015: 134685. |
| [17] |
Wang FJ, Wang SX, Chai LJ, et al. Xueshuantong injection (lyophilized) combined with salvianolate lyophilized injection protects against focal cerebral ischemia/reperfusion injury in rats through attenuation of oxidative stress[J]. Acta Pharmacol Sin, 2018, 39: 998-1011. DOI:10.1038/aps.2017.128 |
| [18] |
Hu S, Liu T, Wu Y, et al. Panax notoginseng saponins suppress lipopolysaccharide-induced barrier disruption and monocyte adhesion on bEnd. 3 cells via the opposite modulation of Nrf2 antioxidant and NF-kappaB inflammatory pathways[J]. Phytother Res, 2019, 33: 3163-3176. DOI:10.1002/ptr.6488 |
| [19] |
Zhu T, Xie WJ, Wang L, et al. Notoginsenoside R1 activates the NAMPT-NAD+-SIRT1 cascade to promote postischemic angiogenesis by modulating Notch signaling[J]. Biomed Pharmacother, 2021, 140: 111693. DOI:10.1016/j.biopha.2021.111693 |
| [20] |
Luo T, Liu G, Ma H, et al. Inhibition of autophagy via activation of PI3K/Akt pathway contributes to the protection of ginsenoside Rb1 against neuronal death caused by ischemic insults[J]. Int J Mol Sci, 2014, 15: 15426-15442. DOI:10.3390/ijms150915426 |
| [21] |
Hu S, Wu Y, Zhao B, et al. Panax notoginseng saponins protect cerebral microvascular endothelial cells against oxygen-glucose deprivation/reperfusion-induced barrier dysfunction via activation of PI3K/Akt/Nrf2 antioxidant signaling pathway[J]. Molecules, 2018, 23: 2781. DOI:10.3390/molecules23112781 |
| [22] |
Wu S, Yang T, Cen K, et al. In vitro evaluation of the neuroprotective effect of Panax notoginseng saponins by activating the EGFR/PI3K/AKT pathway[J]. Evid Based Complement Alternat Med, 2020, 2020: 1403572. |
| [23] |
Wang D, Jie Q, Liu B, et al. Saponin extract from Panax notoginseng promotesangiogenesis through AMPK and eNOS dependent pathways in HUVECs[J]. Mol Med Rep, 2017, 16: 5211-5218. DOI:10.3892/mmr.2017.7280 |
| [24] |
Guo H, Adah D, James PB, et al. Xueshuantong injection (lyophilized) attenuates cerebral ischemia/reperfusion injury by the activation of Nrf2-VEGF pathway[J]. Neurochem Res, 2018, 43: 1096-1103. DOI:10.1007/s11064-018-2523-x |
| [25] |
Ramos CJ, Antonetti DA. The role of small GTPases and EPAC-Rap signaling in the regulation of the blood-brain and blood-retinal barriers[J]. Tissue Barriers, 2017, 5: e1339768. DOI:10.1080/21688370.2017.1339768 |
| [26] |
Xu K, Chong DC, Rankin SA, et al. Rasip1 is required for endothelial cell motility, angiogenesis and vessel formation[J]. Dev Biol, 2009, 329: 269-279. DOI:10.1016/j.ydbio.2009.02.033 |
| [27] |
Smyth L, Rustenhoven J, Park TI, et al. Unique and shared inflammatory profiles of human brain endothelia and pericytes[J]. J Neuroinflammation, 2018, 15: 138. DOI:10.1186/s12974-018-1167-8 |
| [28] |
Wang F, Li R, Tu P, et al. Total glycosides of Cistanche deserticola promote neurological function recovery by inducing neurovascular regeneration via Nrf-2/Keap-1 pathway in MCAO/R rats[J]. Front Pharmacol, 2020, 11: 236. DOI:10.3389/fphar.2020.00236 |
| [29] |
Greene C, Campbell M. Tight junction modulation of the blood brain barrier: CNS delivery of small molecules[J]. Tissue Barriers, 2016, 4: e1138017. DOI:10.1080/21688370.2015.1138017 |
| [30] |
Gasche Y, Fujimura M, Morita-Fujimura Y, et al. Early appea-rance of activated matrix metalloproteinase-9 after focal cerebral ischemia in mice: a possible role in blood-brain barrier dysfunction[J]. J Cereb Blood Flow Metab, 1999, 19: 1020-1028. DOI:10.1097/00004647-199909000-00010 |
| [31] |
Chaturvedi M, Kaczmarek L. MMP-9 inhibition: a therapeutic strategy in ischemic stroke[J]. Mol Neurobiol, 2014, 49: 563-573. DOI:10.1007/s12035-013-8538-z |
| [32] |
Mahajan SD, Aalinkeel R, Reynolds JL, et al. Suppression of MMP-9 expression in brain microvascular endothelial cells (BMVEC) using a gold nanorod (GNR)-siRNA nanoplex[J]. Immunol Invest, 2012, 41: 337-355. DOI:10.3109/08820139.2011.604863 |
| [33] |
Almutairi MM, Gong C, Xu YG, et al. Factors controlling permeability of the blood-brain barrier[J]. Cell Mol Life Sci, 2016, 73: 57-77. DOI:10.1007/s00018-015-2050-8 |
| [34] |
Wimmer I, Tietz S, Nishihara H, et al. PECAM-1 stabilizes blood-brain barrier integrity and favors paracellular T-cell diapedesis across the blood-brain barrier during neuroinflammation[J]. Front Immunol, 2019, 10: 711. DOI:10.3389/fimmu.2019.00711 |
| [35] |
Li L, Xu M, Li X, et al. Platelet-derived growth factor-B (PDGF-B) induced by hypoxia promotes the survival of pulmonary arterial endothelial cells through the PI3K/Akt/Stat3 pathway[J]. Cell Physiol Biochem, 2015, 35: 441-451. DOI:10.1159/000369709 |
| [36] |
Nicholson KM, Anderson NG. The protein kinase B/Akt signalling pathway in human malignancy[J]. Cell Signal, 2002, 14: 381-395. DOI:10.1016/S0898-6568(01)00271-6 |
| [37] |
Chen J, Somanath PR, Razorenova O, et al. Akt1 regulates pathological angiogenesis, vascular maturation and permeability in vivo[J]. Nat Med, 2005, 11: 1188-1196. DOI:10.1038/nm1307 |
| [38] |
Ha JM, Jin SY, Lee HS, et al. Vascular leakage caused by loss of Akt1 is associated with impaired mural cell coverage[J]. FEBS Open Bio, 2019, 9: 801-813. DOI:10.1002/2211-5463.12621 |
| [39] |
Wang J, Wang A, He H, et al. Trametenolic acid B protects against cerebral ischemia and reperfusion injury through modulation of microRNA-10a and PI3K/Akt/mTOR signaling pathways[J]. Biomed Pharmacother, 2019, 112: 108692. DOI:10.1016/j.biopha.2019.108692 |
| [40] |
Zhu Q, Enkhjargal B, Huang L, et al. Aggf1 attenuates neuroinflammation and BBB disruption via PI3K/Akt/NF-kappaB pathway after subarachnoid hemorrhage in rats[J]. J Neuroinflammation, 2018, 15: 178. DOI:10.1186/s12974-018-1211-8 |
| [41] |
Suzuki S, Tanaka K, Suzuki N. Ambivalent aspects of interleukin-6 in cerebral ischemia: inflammatory versus neurotrophic aspects[J]. J Cereb Blood Flow Metab, 2009, 29: 464-479. DOI:10.1038/jcbfm.2008.141 |
| [42] |
Liang Y, Yang N, Pan G, et al. Elevated IL-33 promotes expression of MMP2 and MMP9 via activating STAT3 in alveolar macrophages during LPS-induced acute lung injury[J]. Cell Mol Biol Lett, 2018, 23: 52. DOI:10.1186/s11658-018-0117-x |
| [43] |
Lei C, Deng J, Wang B, et al. Reactive oxygen species scavenger inhibits STAT3 activation after transient focal cerebral ischemia-reperfusion injury in rats[J]. Anesth Analg, 2011, 113: 153-159. DOI:10.1213/ANE.0b013e31821a9fbe |
| [44] |
Yang DX, Jing Y, Liu YL, et al. Inhibition of transient receptor potential vanilloid 1 attenuates blood-brain barrier disruption after traumatic brain injury in mice[J]. J Neurotrauma, 2019, 36: 1279-1290. DOI:10.1089/neu.2018.5942 |
 2022, Vol. 57
2022, Vol. 57


