2. 江西中医药大学中医学院, 江西 南昌 330004;
3. 江西中医药大学动物科技中心, 江西 南昌 330004;
4. 江西中医药大学方证研究中心, 江西 南昌 330004
2. College of Traditional Chinese Medicine, Jiangxi University of Chinese Medicine, Nanchang 330004, China;
3. Experimental Animal Science and Technology Center, Jiangxi University of Chinese Medicine, Nanchang 330004, China;
4. Formula-pattern Reasearch Center, Jiangxi University of Chinese Medicine, Nanchang 330004, China
溃疡性结肠炎(ulcerative colitis, UC) 是一类肠道慢性炎症反复发作的自身免疫性疾病, 主要累及直肠和乙状结肠, 临床多表现出腹痛、腹泻、黏液脓血便及里急后重的症状, 并伴随不同程度的全身症状和肠外表现, 如食少乏力、体重下降和发热呕吐等[1]。肠道黏膜内免疫功能和系统性免疫功能紊乱是导致UC发生发展的关键因素[2]。滤泡辅助性T细胞(follicular T helper cell, Tfh) 在促进和维持生发中心(germinal center, GC) 的形成、刺激B细胞分化、产生高亲和力抗体、抗体类别转换及维持长时间体液免疫应答中发挥重要作用[3]。滤泡调节性T细胞(follicular regulatory T cell, Tfr) 能够限制GC反应, 调节Tfh细胞分化, 起到维持免疫耐受和防止自身免疫的作用[4]。Tfh/Tfr平衡被打破, 会产生过量的促炎性细胞因子, 从而导致肠道炎症损伤, 增加UC的患病风险[5]。研究表明, 记忆性T细胞(memory T cells) 可以分化为Tfh细胞, 且大部分外周循环中的Tfh细胞是记忆性滤泡辅助性T细胞(memory follicular T helper cell, mTfh)[6], 于是本研究猜想mTfh细胞的失衡与UC发病有关。
姜黄素(curcumin, Cur) 是从姜科植物姜黄根茎中提取得到的二酮类化合物, 具有抗炎、调节血脂和调节免疫等广泛的药理作用[7, 8]。近年来有学者发现经姜黄素治疗后结肠炎小鼠调节性T细胞(regulatory T cell, Treg)/辅助性T细胞17 (T helper 17 cell, Th17) 恢复平衡, 从而对溃疡性结肠炎起到治疗及改善作用[9]。姜黄素能否通过影响mTfh细胞亚群水平来治疗UC尚不清楚。本文通过研究姜黄素对溃疡性结肠炎肥胖小鼠的改善作用及对mTfh细胞亚群的调节作用, 为姜黄素治疗溃疡性结肠炎的药理作用及机制提供依据。
材料与方法实验动物 SPF级, 雄性ob/ob小鼠, 40只, 8周龄, 购自江苏集萃药康生物科技有限公司。动物许可证号: SCXK (苏) 2018-0008。实验动物饲养于江西中医药大学实验动物科技中心屏障环境内[实验单位使用许可证号: JZLLSC20190920158, 实验严格遵守实验动物伦理学相关条例]。统一12 h光照时间, 恒温(20~26 ℃), 恒湿(40%~70% RH), 自由饮水, 采食全价标准饲料。适应性饲养3天后开始实验。
药品试剂 姜黄素购自于成都普瑞法科技开发有限公司(相对分子质量368.39, 纯度: 98%, 批号: 458377); 葡聚糖硫酸钠(dextran sulphate sodium, DSS) (相对分子质量: 36 000~50 000) 购自美国MP Biomedicals公司(批号: 160110); 苏木素-伊红染液(南京建成科技有限公司, 批号: 20190902)。红细胞裂解液(批号: 555899)、封闭剂(批号: 553141)、破核剂(批号: 562574)、分化决定簇抗原4 (cluster of differentiation 4, CD4) (Brilliant Violet 510, 批号: 563106)、趋化因子受体7 (CC chemokine receptor 7, CCR7) (Alexa Flour 647, 批号: 560766)、CXC趋化因子受体5 (CXC chemokine receptor 5, CXCR5) (Financial Institutions Training Centre, 批号: 560577)、CXC趋化因子受体3 (CXC chemokine receptor 3, CXCR3) (Phycoerythrin, 批号: 562152)、CC趋化因子受体6 (CC chemokine receptor 6, CCR6) (Brilliant Violet 421, 批号: 564736) 均购自BD公司。叉头状转录因子P3 (transcription factor forkhead box protein P3, Foxp3) (Phycoerythrin-Cyanine7, 批号: 25577382)、IL-10 (批号: 88-7105-88) 和IL-17A (批号: 88-7371-88) mouse uncoated ELISA kit购自Thermo公司。
仪器 石蜡包埋机(型号: EG1150)、石蜡切片机(型号: RM2235) (德国莱卡公司); 光学显微镜(日本Olympus公司, 型号: BX43); 台式高速冷冻离心机(德国Eppendorf公司); 流式细胞仪(美国BD公司, 型号: FACS-CantoⅡ); 组织超声匀浆机(美国SONICS公司, 型号: VCX150); 多功能酶标仪(美国Thermo公司, 型号: Varios-kan Flash)。
造模及给药 实验小鼠于江西中医药大学实验动物科技中心屏障环境内适应性饲养3天后, 随机分为4组: 对照组(control)、对照+ 姜黄素组(control+Cur) (200 mg·kg-1·d-1)、模型组(DSS) 和模型+ 姜黄素组(DSS+Cur) (200 mg·kg-1·d-1), 每组10只。每日观察各组小鼠精神状态并记录小鼠体重变化。对照组和对照+ 姜黄素组小鼠全程自由饮用蒸馏水。模型复制方法参考相关文献[10], 第1~7天, 模型组和模型+ 姜黄素组小鼠自由饮用3% DSS (w/v) 诱导结肠炎发生, OB试纸测试评分为3分(粪便潜血阳性) 提示结肠黏膜溃疡出血, 即模型复制成功[11]; 第8~14天, 结肠炎小鼠停用DSS, 开始自由饮用蒸馏水。根据本课题组前期研究及查阅文献[12, 13], 按200 mg·kg-1·d-1的剂量将姜黄素粉末用0.5%羧甲基纤维素钠(sodium carboxymethyl cellulose, CMC-Na) 溶液配制成混悬液, 灌胃给予对照+ 姜黄素组和模型+ 姜黄素组小鼠, 与此同时对照组和模型组小鼠给予等体积的0.5% CMC-Na溶液, 连续14天; 第15~21天, 采用2% DSS (w/v) 诱导小鼠结肠炎复发。第22天, 腹腔注射3%戊巴比妥钠麻醉处死小鼠。
采集样本与一般观察 小鼠处死后, 冰台上分离脾脏和肛门至回盲部的结肠组织。测量结肠长度, 用预冷的PBS缓冲液将内容物冲洗干净, 滤纸吸干后称重。将一部分组织置于4%的多聚甲醛溶液密封避光4 ℃保存, 另一部分组织置于-80 ℃冰箱中保存备用。计算结肠重量指数[结肠重量指数(%) =结肠重量/体重× 100%]。
结肠组织病理学观察 剪取结肠远端组织2 cm置于4%多聚甲醛溶液固定1周, 经梯度酒精脱水、二甲苯透明和石蜡包埋后, 制成4 μm厚的组织切片。用苏木素-伊红染液进行常规HE染色, 中性树胶封片后, 在光学显微镜下观察结肠组织病理变化并由江西中医药大学病理学科组王晓敏教授采取双盲的方法按照结肠病理损伤评分标准进行结肠黏膜损伤评分。具体评分标准如下[14]: ①炎性细胞浸润程度: 0分: 无炎性细胞; 1分: 轻度浸润; 2分: 中度浸润; 3分: 严重浸润; ②组织损伤程度: 0分: 无损伤; 1分: 损伤至黏膜; 2分: 损伤至黏膜及黏膜下层; 3分: 损伤严重, 透壁。即每只小鼠病理损伤评分=炎性细胞浸润程度+ 组织损伤程度。
流式细胞术检测记忆性Tfh细胞亚群水平 将脾脏置于培养皿中, 加入少许1640细胞培养液, 无菌研磨, 收集细胞混悬液, 用70 μm细胞筛过滤, 400 ×g离心弃上清, 重悬后加入1 mL 1×溶血素工作液离心, 弃上清, 加入1 mL stain buffer清洗细胞两次, 制成单细胞悬液。取100 μL细胞悬液, 加入1 μg FC Block (553141) 并孵育, 随后加入相应体积的表面染色抗体, 室温避光孵育30 min。洗涤两次后加入1 mL 1× Fix/Perm Buffer, 4 ℃避光孵育40 min, 再加入1 mL 1× Perm/Wash, 洗涤两次。破核完成, 加入Foxp3抗体, 4 ℃避光孵育40 min。同上洗涤两次后, 加500 μL stain buffer定容, 混匀后用流式细胞仪检测mTfh1、mTfr和mTfh17细胞亚群分化水平, 并运用Flowjo 7.6.1软件分析处理数据。
酶联免疫吸附法检测IL-10和IL-17A表达 取部分结肠, 剪碎加入裂解液, 4 ℃孵育1 h, 超声匀浆机破碎匀浆, 于超速冷冻离心机4 ℃、13 000 r·min-1离心30 min取上清。参照试剂盒说明书检测结肠组织匀浆中IL-10和IL-17A的含量。待测上清液、标准品使用量均为50 μL, 波长450 nm下测定吸光度值。
统计学分析 统计数据采用SPSS22.0软件处理, 检测结果以均数±标准误(
观察各组小鼠的行为表现, control组和control + Cur组小鼠无异常情况, 精力充沛, 善食好动, 毛发光泽柔顺。与control组相比, 经DSS诱导的结肠炎小鼠表现出精神不振、行动迟缓、食欲不佳、毛发暗淡、拱背聚群、腹泻便血等现象。经姜黄素治疗后, 结肠炎小鼠精神状态明显好转, 毛发焕发光泽、腹泻便血减轻。每日记录各组小鼠的体重变化情况(图 1) 发现, 与control组比较, control + Cur组小鼠的体重无明显变化(P > 0.05); 饮用DSS溶液的结肠炎小鼠, 体重逐渐下降。从图 1中可以看出, 从第4天起至实验结束, DSS组与control组比较出现显著性差异(P < 0.05)。自第8天, 结肠炎小鼠体重下降速度变慢并逐渐回升。自第17天, 体重恢复速度减慢甚至停滞。与DSS组比较, DSS + Cur组小鼠体重恢复时间更早、速度更快, 并从第13天开始, 体重增长明显(P < 0.05)。
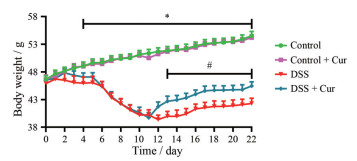
|
Figure 1 Changes in body weight of mice. n = 10, |
结肠长度、结肠重量、结肠重量指数和结肠病理损伤情况是反映结肠炎疾病严重程度的重要指标[15]。如图 2和3所示, 与control组比较, control + Cur组小鼠结肠长度、结肠重量和结肠重量指数无明显差别; DSS组小鼠结肠长度明显缩短(P < 0.01), 结肠重量和结肠重量指数显著升高(P < 0.01)。经姜黄素治疗后, 结肠炎小鼠结肠长度增加, 结肠重量和结肠重量指数下降, 并与DSS组相比具有显著性差异(P < 0.05, P < 0.01)。
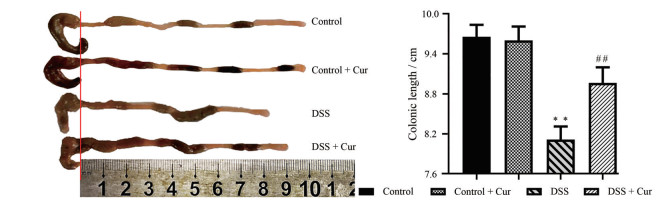
|
Figure 2 Colon length of mice in each group. n = 10, |
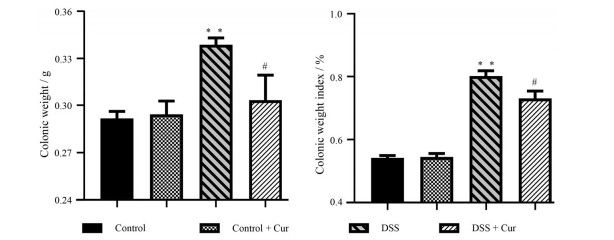
|
Figure 3 Colonic weight and colonic weight index. n = 10, |
光学显微镜下观察(图 4), control组和control + Cur组小鼠结肠组织黏膜光滑完整, 基层结构正常, 腺体排列整齐, 未见中性粒细胞浸润、增生水肿、溃疡糜烂等炎症症状。与control组相比, 可观察到DSS组小鼠结肠黏膜上皮细胞变性坏死或脱落, 腺体结构破坏且排列杂乱, 杯状细胞和隐窝数量减少, 大量的炎性细胞浸润至黏膜肌层, 结肠组织水肿充血明显, 有明显溃疡, 组织病理学评分显著升高(P < 0.01)。与DSS组比较, DSS + Cur组小鼠结肠黏膜各层次较为清晰, 固有层炎症和溃疡程度减轻, 伴有少量炎性细胞浸润, 腺体结构排列欠规则, 杯状细胞和隐窝进行了不同程度的修复, 炎性水肿和炎性充血出血减少, 未见肉芽组织增生, 结肠病理损伤情况显著改善(P < 0.01)。
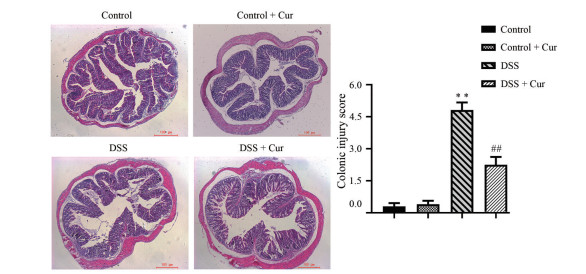
|
Figure 4 Pathological injury of colon tissue (HE, 40×). n = 10, |
流式细胞术检测各组小鼠中枢型记忆性滤泡性T细胞(central memory follicular T cells, cmTf) (CD4+CXCR5+ CCR7+) 和效应型记忆性滤泡性T细胞(effector memory follicular T cells, emTf) (CD4+CXCR5+CCR7-) 亚群分化水平, 由图 5可以看出, 与control组相比, control + Cur组小鼠记忆性滤泡性T细胞(memory follicular T cells, mTf) 细胞亚群分化水平无明显差异。反观DSS组小鼠, 与control组相比, cmTf细胞比例明显升高和emTf细胞比例明显下降(P < 0.01)。与DSS组比较, DSS + Cur组小鼠emTf细胞数量显著增多(P < 0.01), 而cmTf细胞数量则显著降低(P < 0.01)。
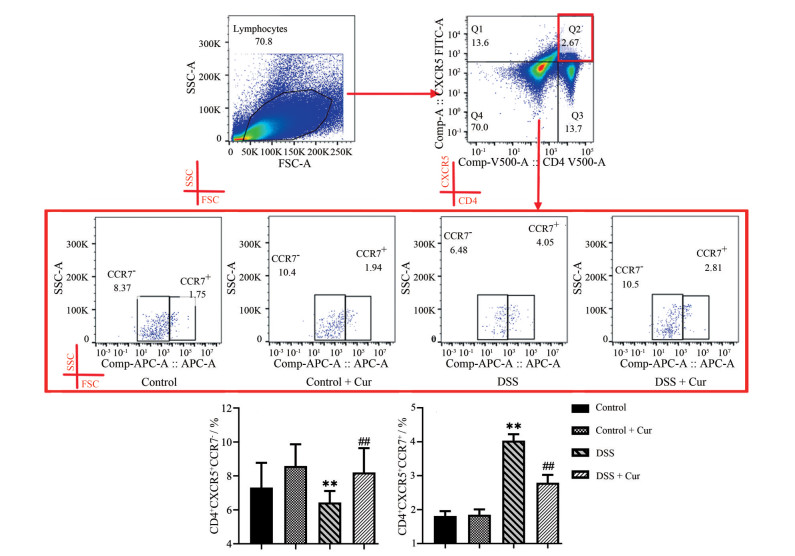
|
Figure 5 Differentiation of memory follicular T cells (mTf) cell subsets. CD4+CXCR5+CCR7+ represents central memory follicular T cells (cmTf) and CD4+CXCR5+CCR7- represents effector memory follicular T cells (emTf). n = 10, |
通过检测CXCR3、Foxp3和CCR6指标, 可分别筛选出cmTf细胞(CD4+CXCR5+CCR7+) 和emTf (CD4+CXCR5+CCR7-) 细胞中辅助性1型T细胞(memory follicular helper 1 T cells, mTfh1)(CXCR3+)、调节性T细胞(memory follicular regulatory T cells, mTfr)(Foxp3+) 和辅助性17型T细胞(memory follicular helper 17 T cells, mTfh17)(CCR6+) 细胞亚群。如图 6和7所示, 与control组比较, control + Cur组小鼠不管是在cmTf细胞, 还是在emTf细胞中, mTfh1、mTfr和mTfh17细胞水平均无显著性差异。DSS组小鼠cmTf和emTf细胞中mTfh1与mTfh17细胞水平升高(图 6A、C和7A、C), mTfr细胞水平降低(图 6B和7B), 且与control组比有显著性差异(P < 0.01)。与DSS组比较, DSS + Cur组小鼠在两类mTf细胞亚群内的mTfh1和mTfh17细胞数量均明显减少, mTfr细胞数量明显增多(P < 0.01)。
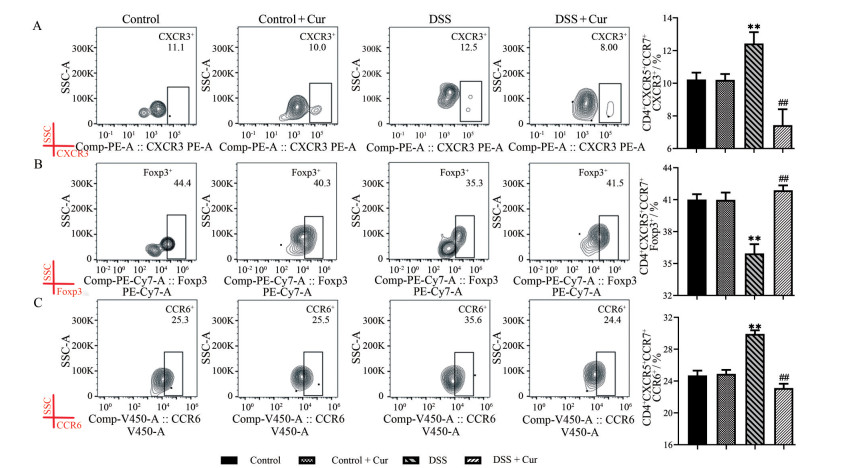
|
Figure 6 cmTf cells subgroups level. A: The percentage of CD4+CXCR5+CCR7+CXCR3+ cells (central memory follicular helper 1 T cells, cmTfh1); B: The percentage of CD4+CXCR5+CCR7+Foxp3+ cells (central memory follicular regulatory T cells, cmTfr); C: The percentage of CD4+CXCR5+CCR7+CCR6+ cells (central memory follicular helper 17 T cells, cmTfh17). n = 10, |
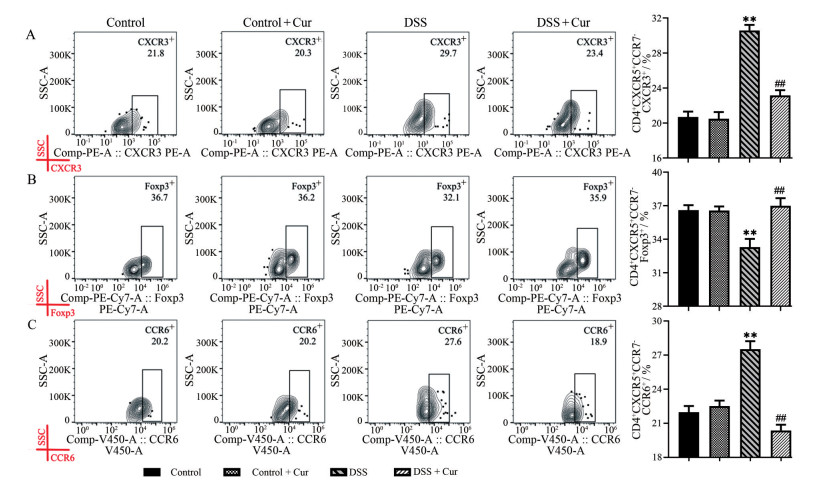
|
Figure 7 emTf cells subgroups level. A: The percentage of CD4+CXCR5+CCR7-CXCR3+ (effector memory follicular helper 1 T cells, emTfh1) cell; B: The percentage of CD4+CXCR5+CCR7-Foxp3+ cells (effector memory follicular regulatory T cells, emTfr); C: The percentage of CD4+CXCR5+CCR7-CCR6+ cells (effector memory follicular helper 17 T cells, emTfh17). n = 10, |
图 8结果显示, 与control相比, control + Cur组小鼠IL-10和IL-17A的表达水平没有明显差异(P > 0.05); 模型组小鼠结肠组织中IL-10水平显著下降, IL-17A含量明显升高(P < 0.01)。与DSS组比较, DSS + Cur组小鼠结肠组织中IL-10水平显著升高(P < 0.05), IL-17A水平明显降低(P < 0.01), 说明姜黄素可调节结肠炎小鼠结肠中IL-10和IL-17A的表达。
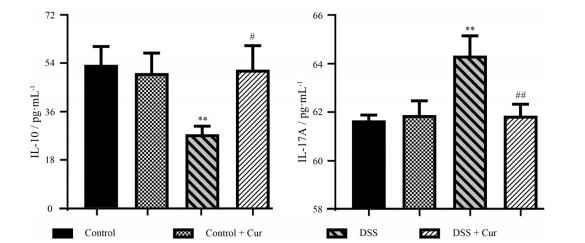
|
Figure 8 Effect of curcumin on interleukin-10 (IL-10) and interleukin-17A (IL-17A) in mice with colitis. n = 10, |
作为常见的肠道炎症性疾病, UC患病率在世界范围内逐渐上升, 然而其病因病机尚不明确[16]。目前, 机体免疫异常反应被公认在UC的发生、发展过程中占据重要地位, 尤其是系统性免疫和肠道黏膜免疫功能的紊乱[17]。近年来发现两类新型的CD4+ T细胞亚群: Tfh和Tfr细胞。Tfh在辅助体液免疫过程中发挥着关键性的作用, 可高表达CXCR5、程序性细胞死亡蛋白1 (programmed cell death protein 1, PD-1)、诱导共刺激分子(inducible costimulatory molecules, ICOS)、白细胞介素-21 (interleukin-21, IL-21)、B细胞淋巴瘤-6 (B cell lymphoma-6, Bcl-6) 等细胞因子, 能够促进和维持GC的形成、刺激B细胞分化、产生高亲和力抗体, 从而在自身免疫性疾病中扮演重要角色[18, 19]。目前常用CXCR5+CD4+ T细胞定义Tfh细胞[20]。Tfh1细胞特征性表达CXCR3, 可分泌促炎细胞因子IFN-γ, 在抗微生物免疫中发挥较大作用[21]。Tfr细胞高表达Foxp3, 通过迁移至GC, 调节Tfh和GC-B细胞分化, 起到维持机体免疫耐受和防止自身免疫的作用[22]。Tfh17细胞能够高表达CCR6、RORγT以及分泌IL-17, 并促进B细胞发生Ig类别转换[23]。研究显示, Tfh/Tfr细胞比例失衡, 则自身免疫性疾病发病风险增加, 如炎症性肠病、系统性红斑狼疮、原发性干燥综合征等[24]。
肥胖导致脂肪组织的过度堆积形成一种慢性低水平炎症状态, 能引起炎性因子IL-1β、IL-6、肿瘤坏死因子α等持续释放[25], 这些炎症因子在炎症性肠病(inflammatory bowel disease, IBD) 患者体内较正常人显著升高, 提示肥胖可能会使炎症性肠病的发病风险增大。IBD患者伴有不同程度的超重、肥胖及血脂异常现象。对IBD患者的流行病学研究表明, 大约有15%~40%的患者伴有肥胖, 另外20%~40%患者超重[26, 27]。肥胖的发病和IBD严重程度密切相关, 控制肥胖或者维持血脂水平正常, IBD病情也会得到控制[28]。本研究采用ob/ob小鼠[遗传背景为C57BL/6J, 因瘦素(leptin) 基因点突变导致leptin信号通路发生障碍, 常作为自发性肥胖症动物模型] 作为实验对象, 旨在为结肠炎患者, 尤其为伴有肥胖的患者提供一种疗效显著、毒副作用小的解决方案。DSS诱导的UC模型是目前国际公认的经典结肠炎实验研究模型, 其诱导的结肠炎病理改变和症状与临床UC患者十分相似。在本研究中对照+ 姜黄素组小鼠在日常行为表现及体重、结肠长度、结肠重量、结肠重量指数和结肠病理损伤等方面与对照组没有明显差别, 表明姜黄素在200 mg·kg-1·d-1剂量内对正常小鼠无明显不良反应。而模型+ 姜黄素组小鼠体重恢复明显, 结肠长度明显变长, 结肠重量、结肠重量指数和病理损伤评分显著下调, 提示姜黄素对DSS诱导的结肠炎有良好的改善作用。
越来越多的证据表明, UC是由先天性和适应性免疫系统对肠道微生物群的反应引起的[29, 30], 尽管治疗后能够缓解, 但这种反应经常复发且具有持续性。免疫记忆可以防止处于稳态的病原体再次入侵, 而免疫记忆障碍会导致自身免疫性疾病, 如溃疡性结肠炎的发生[31]。记忆性T细胞是免疫反应后期少数存活下来的抗原特异性T细胞, 当机体再次受到抗原刺激时迅速增殖分化, 发挥相应作用。根据细胞表面趋化因子受体(CCR7) 表达量不同, 可将记忆性T细胞分为CCR7+中枢性记忆性T细胞(central memory T cell, Tcm) 和CCR7-效应性记忆性T细胞(effector memory T cell, Tem)。抗原初次接触并刺激机体产生的Tcm储存在免疫中枢部位, 二次刺激后, Tcm快速位移至效应局部, 并转化成Tem, 并在效应局部释放炎性因子导致二次损伤。Tcm与Tem的转化及其各自水平紊乱是自身免疫性疾病的重要发病机制之一。研究表明, 姜黄素可能通过升高Tcm水平, 抑制Tem水平, 恢复Tcm/Tem和CD4+/CD8+ Tem平衡而有效缓解实验性溃疡性结肠炎, 提示调控Tcm和Tem间平衡是治疗溃疡性结肠炎的重要策略之一[32]。同样, cmTfh和emTfh失衡也会导致效应性免疫反应放大, 促进炎性因子过度表达, 进而加重炎性损伤[33]。在本研究中, 对照组和对照+姜黄素组小鼠记忆性T细胞各个亚群之间平衡稳定, 而结肠炎小鼠cmTfh细胞与emTfh细胞及其亚群细胞mTfh1/mTfr/mTfh17的数量和比例处于严重失衡的状态。经姜黄素干预14天后, 各个细胞亚群得以调节, 中枢性mTfh细胞与效应性mTfh细胞趋于平衡, mTfh1和mTfh17细胞数量显著减少, mTfr细胞数量明显增多, 同时伴有IL-10水平显著升高, 且IL-17A水平显著抑制。以上结果提示, 姜黄素有效治疗肥胖小鼠结肠炎, 可能是通过调控mTf细胞亚群平衡来实现的(图 9)。
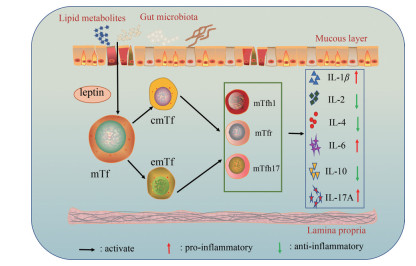
|
Figure 9 Curcumin-treatment of DSS induced ob/ob mice colitis may be achieved by regulating mTfh cell subpopulation balance |
综上所述, 姜黄素调控DSS诱导的小鼠结肠炎mTfh细胞亚群平衡, 为揭示姜黄素治疗溃疡性结肠炎的作用机制研究提供了科学的证据, 同时拓宽和丰富了姜黄素的免疫药理范畴。然而, 姜黄素调控记忆性Tfh/Tfr细胞之间平衡的作用机制尚不明朗, 还有待于进一步从细胞活化、细胞代谢、基因突变等方面进行全面的阐述。
作者贡献: 康增平、赵海梅、王梦雪和黄佳琦负责完成相关实验研究; 王梦雪和黄佳琦负责数据采集与处理分析工作; 康增平和赵海梅负责完成撰写论文工作; 钟友宝和刘端勇负责对本课题实验设计思路进行指导与修改论文工作。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Gu XW, Liang YL, Yang HG, et al. Clinical efficacy and safety of Jiedu Qushi Yuyang Decoction combined with rabeprazole in the treatment of ulcerative colitis[J]. Liaoning J Trdit Chin Med (辽宁中医杂志), 2021, 48: 147-149. |
| [2] |
Feng N, Zhu Y, Huo YY, et al. Effects of enteral nutrition supplemented with glutamine and syngenin on Treg/Th17 immune balance in newborn mice with colitis[J]. Chin J Immunol (中国免疫学杂志), 2020, 36: 2576-2581. |
| [3] |
Qin L, Waseem TC, Sahoo A, et al. Insights into the molecular mechanisms of T follicular helper-mediated immunity and pathology[J]. Front Immunol, 2018, 9: 1884-1905. DOI:10.3389/fimmu.2018.01884 |
| [4] |
Yang YG, Lǚ XD, Chen L, et al. Advances in the relationship between follicular helper T cells and follicular regulatory T cells and inflammatory bowel disease[J]. Chin J Dig (中华消化杂志), 2017, 37: 359-360. |
| [5] |
Long Y, Xia C, Xu L, et al. The imbalance of circulating follicular helper T cells and follicular regulatory T cells is associated with disease activity in patients with ulcerative colitis[J]. Front Immunol, 2020, 11: 104-118. DOI:10.3389/fimmu.2020.00104 |
| [6] |
Liang JH, Shen J, Luo Q, et al. Cyclosporine A inhibited IL-21 and CD40L and Bcl-6 expression in human tonsil Tfh cells[J]. J Trop Med (热带医学杂志), 2016, 16: 423-429. |
| [7] |
Li WF, Jiang JL. Research status of pharmacological action of curcumin[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2017, 33: 957-960. |
| [8] |
Duan YT, Meng LH. Progress in the study of multi-target antitumor natural products[J]. Acta Pharm Sin (药学学报), 2021, 56: 403-413. |
| [9] |
Wei C, Wang JY, Xiong F, et al. Curcumin ameliorates DSS‑induced colitis in mice by regulating the Treg/Th17 signaling pathway[J]. Mol Med Rep, 2021, 23: 34. |
| [10] |
Qi Y, Yuan ZW, Wan CH, et al. Effects of Kuijiekang on NLRP3 inflammasome gene expression and downstream inflammatory factors in mice with ulcerative colitis[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2020, 38: 229-233, 275-278. |
| [11] |
Yu QQ, Li T, Zhang ZY, et al. Electroacupuncture sensitized acupoints activate cholinergic neurons of vagus dorsal motor nucleus to improve colonic inflammatory injury in rats[J]. Chin Acupunct Moxib (中国针灸), 2021, 41: 45-51. |
| [12] |
Wang Y, Fu X, Zhang C, et al. Effects of curcumin on expression of colonic tissue related cytokines in mice with colitis[J]. J Tianjin Univ Tradit Chin Med (天津中医药大学学报), 2020, 39: 686-689. |
| [13] |
Liu DY, Xu R, Huang MF, et al. Effects of curcumin on the expression of costimulatory molecules on the surface of splenic dendritic cells in mice with colitis[J]. Chin Tradit Pat Med (中成药), 2016, 38: 2039-2041. |
| [14] |
Schmidt N, Gonzalez E, Visekruna A, et al. Targeting the proteasome: partial inhibition of the proteasome by bortezomib or deletion of the immunosubunit LMP7 attenuates experimental colitis[J]. Gut, 2010, 59: 896. DOI:10.1136/gut.2009.203554 |
| [15] |
Liu Y, Ge W, Liu XK, et al. Effect of Sishen Pill on expression of related factors in colon tissue of chronic colitis rats[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2019, 37: 330-333. |
| [16] |
Wang PC, Zhao S, Feng J, et al. Research progress of Chinese medicine against ulcerative colitis based on NF-κB signaling pathway[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 1556-1561. |
| [17] |
Wang M, Guo J, Zhao YQ, et al. IL-21 mediates microRNA-423-5p/claudin-5 signal pathway and intestinal barrier function in inflammatory bowel disease[J]. Aging, 2020, 12: 16099-16110. DOI:10.18632/aging.103566 |
| [18] |
Noël G, Langouo FM, Garaud S, et al. Functional Th1-oriented T follicular helper cells that infiltrate human breast cancer promote effective adaptive immunity[J]. J Clin Invest, 2021, 131: e139905. DOI:10.1172/JCI139905 |
| [19] |
Clement RL, Daccache J, Mohammed MT, et al. Follicular regulatory T cells control humoral and allergic immunity by restraining early B cell responses[J]. Nat Immunol, 2019, 20: 1360-1371. DOI:10.1038/s41590-019-0472-4 |
| [20] |
Cao XD, Wei RX, Zhang XX, et al. Analysis of cytokine levels of helper T cells in follicular of experimental immune sterile male mice[J]. Chin J Immunol (中国免疫学杂志), 2021, 37: 1419-1422. |
| [21] |
Xu SQ. Surfactant Protein A Ameliorate Allergic Asthma Airway Inflammation by Modulating Tfh Subsets Differentiation in a DC-dependent Manner (SP-A通过树突细胞调控Tfh细胞分化参与缓解哮喘气道炎症反应) [D]. Shanghai: Shanghai Jiaotong University, 2020.
|
| [22] |
Wu N. The Preliminary Research on T Helper Cell in the Pathogenesis of Diabetic Retinopathy (辅助性T细胞参与糖尿病视网膜病变发病机制的初步研究) [D]. Nanchang: Nanchang University, 2021.
|
| [23] |
Liu Y, Yuan X, Li X, et al. Constitutive changes in circulating follicular helper T cells and their subsets in patients with Graves' disease[J]. J Immunol Res, 2018, 2018: 8972572-8972582. |
| [24] |
Tangye SG, Ma CS, Brink R, et al. The good, the bad and the ugly-TFH cells in human health and disease[J]. Nat Rev Immunol, 2013, 13: 412-426. DOI:10.1038/nri3447 |
| [25] |
Xu XF, Wang EL, Yang TY, et al. Research of influence on inflammation of Xieheyin on PCOS-IR mice based on intestinal mucosal barrier and TLR4/NF-κB/NLRP3 pathway[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2021, 27: 90-98. |
| [26] |
Seminerio JL, Koutroubakis IE, Ramos-Rivers C, et al. Impact of obesity on the management and clinical course of patients with inflammatory bowel disease[J]. Inflamm Bowel Dis, 2015, 21: 2857-2863. DOI:10.1097/MIB.0000000000000560 |
| [27] |
Stabroth-Akil D, Leifeld L, Pfützer R, et al. The effect of body weight on the severity and clinical course of ulcerative colitis[J]. Int J Colorectal Dis, 2015, 30: 237-242. DOI:10.1007/s00384-014-2051-3 |
| [28] |
Wang L, Wang R, Wei GY, et al. Cryptotanshinone alleviates chemotherapy-induced colitis in mice with colon cancer via regulating fecal-bacteria-related lipid metabolism[J]. Pharmacol Res, 2021, 163: 105232. DOI:10.1016/j.phrs.2020.105232 |
| [29] |
Zou J, Liu C, Jiang S, et al. Cross talk between gut microbiota and intestinal mucosal immunity in the development of ulcerative colitis[J]. Infect Immun, 2021, 89: e1421. |
| [30] |
Du XK, Ran QS, Liu L, et al. Research status of drugs for the treatment of inflammatory bowel disease based on the regulation of intestinal mucosal healing by macrophages[J]. Acta Pharm Sin (药学学报), 2021, 56: 3392-3400. |
| [31] |
Ge W, Wang HY, Zhao HM, et al. Effect of Sishen Pill on memory T cells from experimental colitis induced by dextran sulfate sodium[J]. Front Pharmacol, 2020, 11: 908-920. DOI:10.3389/fphar.2020.00908 |
| [32] |
Zhong YB, Kang ZP, Zhou BG, et al. Curcumin regulated the homeostasis of memory T cell and ameliorated dextran sulfate sodium-induced experimental colitis[J]. Front Pharmacol, 2020, 11: 630244. |
| [33] |
Lüthje K, Kallies A, Shimohakamada Y, et al. The development and fate of follicular helper T cells defined by an IL-21 reporter mouse[J]. Nat Immunol, 2012, 13: 491-498. DOI:10.1038/ni.2261 |
 2022, Vol. 57
2022, Vol. 57


