由于饮食环境的改变、运动的减少及压力的增大, 肥胖已成为全球性健康问题。据世界卫生组织的最新统计数据[1], 18岁以上成年人中约39%超重, 其中13%属于肥胖。研究表明, 肥胖和超重个体患糖尿病、心血管疾病、癌症、内分泌障碍的风险更高[2], 因此, 肥胖将成为可预防的致死因素。
肥胖是人体能量摄取与消耗失衡所致, 过量的能量在脂肪组织不断累积, 尤其表现为白色脂肪的增生肥大。目前已成功上市的减肥药物主要通过以下3种方式达到减肥效果: ①作用于肠道, 抑制脂肪分解, 减少脂肪吸收。代表药物是奥利司他, 其通过抑制胃肠脂肪酶阻止甘油三酯分解为脂肪酸并在肠内被吸收, 但在减少脂肪吸收的同时, 也减少了脂溶性维生素、矿物元素及某些药物的吸收, 还会导致腹泻、油性便等药物不良反应, 因此难以实现长期服用; ②作用于中枢神经系统, 抑制食欲, 增加饱腹感。代表药物中芬特明和托吡酯缓释剂胶囊(qsymia) 通过诱导中枢神经去甲肾上腺素的释放, 抑制食欲, 但去甲肾上腺素同时具有增强心肌收缩力、加快心率的作用, 因此不适用于心血管疾病、甲状腺机能亢进、烦躁不安等患者; ③促进能量消耗, 代表药物盐酸纳曲酮与盐酸安非他酮复方缓释片(contrave) 通过刺激下丘脑阿片-促黑素细胞皮质素原释放神经元(proopiomelanocortin, POMC) 减少食物的摄入, 同时纳曲酮还能增加能量消耗, 但因含有安非他酮, 这种药物有增加自杀想法及行为的风险[3]。由此可见, 目前可供使用的多种抗肥胖药物存在的不良反应不仅限制了其使用期限和适用人群, 还会增加患其他疾病的风险[4], 因此亟待开发新型抗肥胖药物, 使肥胖治疗更安全有效。采用直接对脂肪组织进行干预的方式可通过提高能量消耗达到减肥效果, 并可减少对其他组织的损伤。
人体中白色脂肪组织将多余能量转为甘油三酯, 储存能量, 当摄入能量过多时, 白色脂肪细胞中脂滴增大, 细胞数目增多, 而棕色脂肪组织则是能量消耗器官, 有研究通过氟代脱氧葡萄糖(fludeoxyglucose, 18F-FDG) 对健康成年人进行正电子发射计算机断层显像扫描, 对其中1例受试者的数据进行分析发现, 若使锁骨上的63 g棕色脂肪完全活化, 每年可消耗4.1 kg质量[5]。研究表明, 棕色脂肪组织的质量不仅与肥胖呈负相关, 在人类肥胖和能量稳态中发挥重要作用, 还与其他慢性疾病相关。白色脂肪棕色化可改善脂肪肝和胰岛素抵抗。随着对不同脂肪细胞的深入研究, 人们发现了第3种脂肪细胞—米色脂肪细胞, 是白色脂肪细胞在寒冷或某些条件下表达出棕色脂肪细胞特有的产热基因和蛋白从而转化为米色脂肪细胞。因此, 白色脂肪组织棕色化可增加能量消耗, 为降低肥胖的发生提供了一种可行的新思路。目前文献[6]虽已报道了多个可诱导白色脂肪组织棕色化的褐变剂, 但其不仅作用于脂肪组织, 同时还会影响其他器官或系统的发育或功能, 限制了其进一步应用。通过构建靶向递送载体将褐变剂靶向递送至白色脂肪组织以诱导其棕色化, 可有效提高褐变剂的作用效率并降低其不良反应。
1 脂肪组织分类及功能 1.1 白色脂肪组织白色脂肪细胞由肌源性因子5阴性(Myf5-) 的肌细胞前体分化而来, 在人体中广泛分布并占主导地位, 主要分布于皮下、附睾和肠系膜等处[7]。白色脂肪细胞中脂滴较大, 因细胞质中线粒体较少, 体内过剩的能量可在白色脂肪细胞中以甘油三酯的形式贮存下来。因此, 白色脂肪组织起着贮存能量、保持体温和参与脂肪代谢等功能。
1.2 棕色脂肪组织棕色脂肪细胞由肌源性因子5阳性(Myf5+) 的肌细胞前体分化而来, 主要分布在颈部、肩胛间区和脊柱两侧的皮下等多处, 仅存在于婴幼儿时期, 占总体重2%~5%, 且随年龄增长而逐渐减少[8]。棕色脂肪细胞内的脂滴较多, 但多数为小脂滴, 细胞质中含有大量多嵴线粒体, 线粒体内膜上存在特异性高表达的解偶联蛋白1 (uncoupling protein 1, UCP1)。此外, 过氧化物酶体增殖子激活受体γ共激活因子1α (peroxisome proliferator activator receptor gamma coactivator 1 alpha, PGC1α)、含PR结构域的锌指蛋白16 (PR domain containing protein 16, PRDM16)、诱导细胞死亡DNA片段化因子α样效应因子A (cell death-inducing DNA fragmentation factor alpha-like effector A, CIDEA) 等在棕色脂肪细胞中也存在高表达, 是棕色脂肪组织的生物标志物[9]。当机体处于寒冷环境下, 其脂肪细胞内的脂质分解氧化, 通过非战栗产热产生大量热量, 从而使机体免受寒冷的侵袭。
1.3 米色脂肪组织米色脂肪细胞主要存在于皮下白色脂肪库和数量有限的内脏脂肪库中, 可由脂肪基质干细胞(adipose tissue-derived stem cells, ADSCs) 重新分化或成熟的白色脂肪细胞转分化形成。米色脂肪细胞是一种低功能的静息细胞, 其形态与分化程度介于白色脂肪细胞与棕色脂肪细胞之间, 具有类似棕色脂肪细胞的多房脂滴形态和UCP1的高表达[10]。
白色脂肪细胞在特定的条件下(如寒冷刺激、运动、药物) 可转变成棕色样的产热脂肪细胞, 发挥与经典棕色脂肪细胞类似的功能。由此看出, 脂肪细胞具有可逆性表型重新编程的能力, 以满足自身产热需求, 该过程称为“白色脂肪棕色化”。
2 白色脂肪棕色化的机制白色脂肪细胞和棕色脂肪细胞均由间充质干细胞分化为白色或棕色前体脂肪细胞, 进而转分化为成熟脂肪细胞, 但二者的基因、蛋白和功能各不相同。
在棕色化过程中, UCP1、PGC1α和PRDM16的表达会显著上调。UCP1是一种质子转运蛋白, 特异性表达于棕色脂肪细胞线粒体内膜, 通过消除线粒体内膜两侧的跨膜质子浓度差, 减缓质子浓度差驱动的氧化磷酸化, 抑制三磷酸腺苷(adenosine triphosphate, ATP) 的正常生成过程, 使过剩能量以热能的形式散失。PGC1α是过氧化物酶体增殖物激活受体γ (peroxisome proliferator activator receptor gamma, PPARγ) 的共激活物, 在线粒体生物发生等与能量代谢相关的生物学过程中发挥关键作用, PGC1α和PPARγ作用于UCP1启动子促进UCP1的表达。有研究发现PGC1α的缺失会破坏棕色脂肪的产热和线粒体功能发挥作用[11], 因此, PGC1α在棕色脂肪产热中是必不可少的。PRDM16是棕色脂肪细胞分化的决定因子, 也是促进白色脂肪棕色化的关键因子。PRDM16与C-末端结合蛋白(C-terminal binding proteins, CtBPs) 形成复合体可招募PGC1α, 进而促进UCP1、CIDEA等棕色脂肪特异性基因的表达, 诱导白色脂肪组织棕色化, 增加机体的产热[12]。上述3种标志性蛋白和基因的上调过程受多种蛋白和转录因子的交叉调控, 是一个多级复杂的过程, 其中腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)、β3肾上腺素受体(β3-adrenergic receptor, β3-AR)、过氧化物酶体增殖物激活受体(peroxisome proliferator activator receptors, PPARs) 等在该过程中发挥了重要作用(图 1)。

|
Figure 1 Mechanism of drugs induced browning of white fat. β3-AR: β3-Adrenergic receptor; cAMP: Cyclic adenosine monophosphate; PKA: Protein kinase A; CREB: cAMP response element-binding protein; PGC1α: Peroxisome proliferator activator receptor gamma coactivator 1 alpha; RXR: Retinoid X receptor; PPAR: Peroxisome proliferator activator receptor; AMPK: Adenosine monophosphate activated protein kinase; SIRT1: Silent information regulator 1; UCP1: Uncoupling protein 1; PPARγ: Peroxisome proliferator activator receptor gamma |
AMPK是能量代谢的关键调控因子, 在脑、心脏、骨骼肌等代谢器官中均有表达, 在白色脂肪细胞中AMPK激活可增加PGC1α的表达和活性, 且可激活AMPK/沉默信息调节因子1 (silent information regulator 1, SIRT1) 信号通路, 诱导PGC1α去乙酰化并激活[13]。研究发现, AMPK可通过作用于肾上腺素能神经系统影响棕色脂肪产热, 也可通过促进PRDM16启动子区的去甲基化促进PRDM16表达, 进而促进棕色脂肪生成。此外, 有研究者敲除AMPKα1亚基后发现可减弱牛磺酸(taurine) 对PGC1α和UCP1的诱导[14], 由此推测AMPKα1亚基在激活AMPK的褐变剂诱导白色脂肪棕色化中起关键作用。
2.2 β3-ARβ3-AR高表达于脂肪组织中, 是寒冷刺激或饮食诱导产热所必需的通路。当机体受到寒冷、运动和药物等刺激时, 激活β3-AR, 细胞内环磷酸腺苷(cyclic adenosine monophosphate, cAMP) 含量大量增加, 启动甘油三酯水解和蛋白激酶A (protein kinase A, PKA) 激活的信号级联, cAMP反应元件结合蛋白(cAMP response element-binding protein, CREB) 招募PGC1α以促进视黄醇类X受体(retinoid X receptor, RXR) 异源二聚化, 然后RXR异源二聚化与核受体相互作用以增强UCP1转录[15], 进而上调棕色脂肪组织的标志基因PGC1α、PRDM16和UCP1等的转录表达, 同时脂解相关基因的表达水平也显著升高[16]。
2.3 PPARsPPARs是核激素受体家族中的配体依赖的转录调节因子, 当被特定的配体激活时, 与RXR结合形成异源二聚体, 这些异源二聚体转运到细胞核与位于启动子的过氧化物酶体增殖物反应元件(peroxisome proliferation response elements, PPREs) 结合发挥其功能。
过氧化物酶体增殖物激活受体α (peroxisome proliferator activator receptor alpha, PPARα) 是调节血脂的重要靶点。近年来发现白色脂肪细胞中内源性促红细胞生成素(erythropoietin, EPO) 在预防肥胖和激活棕色脂肪样基因中具有很大潜力, Li等[17]在实验中发现EPO增加PPARα及其下游PGC1α的表达, 同时促进NAD+水平升高, 激活SIRT1与PPARα协同介导白色脂肪细胞中UCP1、PGC1α和PRDM16的增加。有研究发现[18], 部分PPARα激动剂直接激活PGC1α和PRDM16的表达, 诱导产热基因、线粒体基因和脂质氧化基因的转录和表达。
在脂肪组织中大量表达的PPARγ是调节脂肪细胞分化、增加胰岛素敏感性的关键因子。在棕色化过程中SIRT1被激活并与PPARγ结合, PPARγ发生构象变化使Lys268和Lys293去乙酰化并与PRDM16相互作用, 促进产热基因的选择性表达[19]。
2.4 骨形态发生蛋白7骨形态发生蛋白(bone morphogenetic proteins, BMPs) 是一组具有类似结构的高度保守的功能蛋白, 在脂肪生成和分化过程中有重要调控作用, 其中BMP7在促进白色脂肪棕色化过程发挥重要作用。BMP7能激活棕色脂肪形成, 包括诱导棕色脂肪形成早期调节因子PRDM16和PGC1α, 通过p38丝裂原活化蛋白激酶(p38 mitogen activited protein kinase, p38MAPK) 和PGC1α依赖途径, 增加棕色脂肪标记物UCP1和PPARγ表达, 以及促进线粒体生物发生和功能运转。BMP7敲除胚胎明显缺乏棕色脂肪且几乎完全缺乏UCP1蛋白。腺病毒介导的BMP7在小鼠中的表达导致棕色脂肪量显著增加, 并导致能量消耗增加和体重增加减少。这些结果揭示了BMP7在体内外促进棕色脂肪细胞分化和产热的重要作用[20]。
2.5 成纤维细胞生长因子21 (fibroblast growth factor 21, FGF21)FGF21是一种主要表达于肝脏的代谢调节因子。研究显示, 在肝细胞中FGF21可显著降低脂代谢合成关键基因表达, 上调脂肪分解关键基因表达, 可显著上调UCP1的基因转录水平, 促进脂肪分解和能量代谢[21], 在脂肪细胞中能促进葡萄糖吸收, 且呈剂量依赖性[22]。脂肪组织来源的FGF21以自分泌或旁分泌方式增加脂肪细胞中UCP1等产热基因的表达, FGF21对PGC1α转录水平几乎没有影响, 但增加了脂肪组织中这一关键调控因子的蛋白含量。有研究者发现寒冷暴露和β3-AR激活可增加FGF21合成, 而FGF21敲除小鼠的棕色脂肪细胞中的脂滴显著增大, 表现出适应慢性冷暴露的能力受损, 白色脂肪棕色化减少[23]。
虽然存在多个转录因子和信号通路与白色脂肪棕色化有关, 但大多存在于全身各器官中, 且参与多种生理过程, 因此当褐变剂进入体内后无法定向转运至脂肪组织, 若大量褐变剂因脱靶效应引起机体其他组织器官的生理作用发生改变, 将失去其诱导白色脂肪棕色化的抗肥胖意义, 如罗格列酮(rosiglitazone, Rosi) 和异丙肾上腺素(isoprenaline, Iso) 具有强大的褐变活性, 但在研究中发现二者有肝毒性和心脏毒性风险, 因此构建靶向递送系统减少其他组织中褐变剂的积累十分有必要。
3 诱导白色脂肪棕色化的药物随着研究者对白色脂肪棕色化的关注, 人们逐渐发现某些药物, 包括化学药物和天然药物, 存在诱导白色脂肪棕色化的可能并展开了进一步研究, 研究发现, 其中大多数药物是通过激动AMPK和PPARs发挥诱导作用。
3.1 AMPK激动剂 3.1.1 辣椒素(capsaicin, Cap)Cap是TRPV1通道的激活剂, 具有潜在的抗癌、抗炎、抗氧化、抗菌和抗肥胖作用。其中, Cap在提高能量消耗和体重调节方面的作用已被广泛研究。在Cap抗肥胖作用相关的潜在分子机制中, Cap诱导的TRPV1激活是关键因素。Baskaran等[24]首次揭示了膳食辣椒素刺激白色脂肪细胞褐变的新机制, Cap通过激活TRPV1使细胞内Ca2+浓度增加, 从而激活钙-钙调蛋白激酶II (calcium-calmodulin dependent kinase II, CaMK II)/AMPK信号, 随后激活SIRT1触发PRDM16和PPARγ去乙酰化, 二者相互作用介导白色脂肪细胞棕色化过程。
3.1.2 白藜芦醇(resveratrol, Resv)Resv是一种天然的多酚化合物, 存在于葡萄皮、葡萄籽及多种食物中, 具有调节脂肪细胞分化、脂肪酸氧化和增强线粒体活力的功能。Wang等[25]报道, Resv可激活AMPK磷酸化, 促进白色脂肪细胞中米色脂肪细胞选择性基因UCP1、PRDM16、细胞色素C (cytochrome C, Cyto C) 和丙酮酸脱氢酶(pyruvate dehydrogenase, PDH) 的表达。结果表明, Resv可诱导白色脂肪细胞向米色脂肪细胞的转化。
3.1.3 木犀草素(luteolin, Lu)Lu是一类天然黄酮类化合物, 具有抗炎、抗肿瘤、抗病毒等药理作用。有研究表明, Lu能抑制3T3-L1前脂肪细胞的脂质分化和脂质积累。Zhang等[26]发现用Lu处理后, 皮下脂肪细胞中出现产热基因的表达和AMPK/PGC1α信号分子的活性提高, 且增加了SIRT1、磷酸化AMPKα和磷酸化乙酰辅酶A羧化酶(acetyl CoA carboxylase, ACC) 的表达水平。该结果表明, Lu可通过激活AMPK/PGC1α信号转导诱导脂肪细胞褐变并产热。
3.2 PPARs激动剂 3.2.1 PPARγPPARγ是噻唑烷二酮类药物(TZDs) 的作用靶点, TZDs通过激动PPARγ增加骨骼肌和脂肪组织的葡萄糖摄取, 减少肝脏葡萄糖输出, 是有效的糖尿病治疗药物。此外, 吡格列酮(pioglitazone, Pio) 和Rosi是TZDs的代表药物, 有报道[27, 28]称二者在降糖作用外还能诱导白色脂肪褐变, 具有抗肥胖作用, Ohno等[28]以PPARγ拮抗剂、PPARγ弱激动剂为对照, 考察PPARγ诱导白色脂肪组织棕色化效果。结果发现, 仅有PPARγ完全激动剂组能在皮下白色脂肪组织中通过稳定和积累PRDM16蛋白来诱导棕色脂肪基因程序, 促进白色脂肪组织棕色化。
3.2.2 PPARα非诺贝特(fenofibrate) 是临床常用于降脂的PPARα激动剂, 已有研究表明[29], 其可增加肥胖小鼠的脂肪酸β-氧化, 减小脂肪细胞并抑制脂肪的异位堆积。Rachid等[18]对非诺贝特诱导白色脂肪棕色化研究发现, 非诺贝特处理后的白色脂肪细胞中PGC1α、UCP1和PRDM16等棕色化标志基因的表达显著增加。由此推测, 非诺贝特通过激动PPARα触发UCP1转录引起白色脂肪褐变。
4 诱导白色脂肪棕色化的靶向递送载体使用药物诱导白色脂肪棕色化将为肥胖和肥胖引起的代谢性疾病的治疗提供新策略。然而, 系统性给药因不能靶向肥胖相关脂肪组织如白色脂肪组织, 导致其在体内其他组织器官的积累和出现旁观者效应。此外, 由于褐变剂药物的水溶性强、稳定性差和生物利用度低的限制[30], 有必要构建靶向白色脂肪组织的药物递送载体以减少褐变剂产生的脱靶效应进而提高其诱导白色脂肪棕色化的效果。目前临床上虽然没有白色脂肪的靶向递送载体的应用, 但对白色脂肪靶向递送褐变剂药物具有重要的研究价值和临床意义, 有利于进行安全有效的抗肥胖治疗。
4.1 被动靶向白色脂肪组织由脂肪细胞、基质细胞和脂肪细胞间为其输送营养物质、氧气、生长因子和细胞因子等的毛细血管网构成。脂肪组织的肥胖既依赖于脂肪细胞的肥大, 也依赖于新生脂肪细胞的增生。脂肪组织的组织学评估显示, 脂肪组织是高度血管化的, 每个脂肪细胞均与多个毛细血管接触。因此, 血管生成簇是脂肪组织生长的关键[31]。
脂肪组织的血管系统由带孔微血管组成, 这些微血管可能在确定脂肪因子的局部或全身作用中发挥重要作用。在肥胖脂肪组织中, 原有血管系统中新血管的生长与脂肪细胞聚集区新脂肪细胞的形成相结合, 且肥胖患者的脂肪组织是一个慢性炎症部位, 巨噬细胞和白细胞浸润等炎症反应导致血管通透性增加[32], 使得纳米递送载体可以被动靶向于此。Hossen等[33]发现, 经荧光标记的未修饰配体肽的载体在脂肪组织血管中也出现了荧光信号, 推测在肥胖脂肪组织中存在类似肿瘤组织的高通透性和滞留效应(enhanced permeability and retention effect, EPR) 机制使得载体在肥胖脂肪组织周围血管中被动聚集。
4.2 主动靶向 4.2.1 靶向脂肪血管生成簇和白色脂肪细胞Kolonin等[34]发现, 短肽(CKGGRAKDC) 能与主要表达于白色脂肪组织血管内皮细胞和成熟白色脂肪细胞表面的抑制素(prohibitin, PHB) 进行特异性结合。Hiradate等[35]将Rosi包载于表面修饰CKGGRAKDC和八精氨酸肽(octaarginine, R8) 的脂质体以靶向白色脂肪组织(图 2), 分别对前体脂肪细胞和成熟脂肪细胞进行诱导。激光共聚焦显微镜结果显示, PHB高表达的成熟脂肪细胞内的荧光强度更强, 提示所构建的载体有较强的PHB靶向性。实验结果也发现, 两种细胞中褐变基因的转录和表达均有显著升高, 且抑制肥胖相关的毒性指标均在正常范围, 这表明所构建的靶向递送系统对白色脂肪组织具有很好的靶向性且安全性良好。Sibuyi等[36]将靶向PHB的短肽与金纳米粒结合, 极大提高了载体对脂肪组织的靶向性和选择性, 减少了其在网状内皮系统和肝脏的积累。
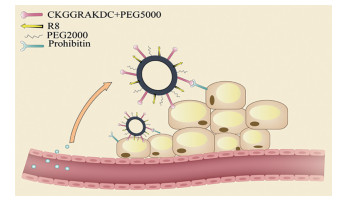
|
Figure 2 Ligand peptide mediated targeted delivery system. PEG: Polyethylene glycol; R8: Octaarginine |
Xue等[37]制备由三嵌段共聚物PLGA-b-PEG形成的载有Rosi的疏水内核和亲水性PEG外层的聚合物纳米粒, 其表面修饰血管内皮细胞优先表达的抗原结合靶向肽iRGD (CRGDK/RGPD/EC) 和CKGGRAKDC。其中, iRGD与生成血管内皮细胞上的整合素αv结合, 并进一步分裂成CRGDK片段, 该片段与神经毡蛋白-1结合, 从而促进载体渗透到局部组织中, 而CKGGRAKDC则与白色脂肪组织中过表达的PHB特异性结合。结果表明, 与非靶向或游离药物组相比, 靶向载体组对小鼠体重的抑制和对白色脂肪棕色化的诱导作用更强。Chen等[38]将PHB特异性结合蛋白与乙型肝炎核心蛋白病毒样颗粒(virus-like particles, VLPs) 结合, 构建了具有白色脂肪归巢能力的重组蛋白颗粒, 同时包裹Rosi和四磺酸酞菁锌(ZnPcS4), 实现了光动力疗法与白色脂肪棕色化的联合治疗。
适配体(adipo) 是类似于抗体的DNA或RNA分子, 特殊的三维结构使得其能与目标蛋白质结合, 以区分靶细胞与其他细胞, 具有亲和力高且特异性强的特点, 此外, 其具有易于化学合成和修饰、优异的稳定性、低免疫原性和快速的组织渗透等独特优点, 使其成为靶向修饰的理想配体。Liu等[39]利用cell-SELEX技术筛选获得一条仅与分化成熟脂肪细胞具有高特异性和高亲和力结合的适配体adipo8, 其不与任何其他细胞及未分化的前体脂肪细胞结合。Yu等[40]将adipo8修饰于PLG-PEG形成的纳米载体表面, 用于大黄素的靶向递送, 可将药物选择性地递送至白色脂肪细胞。结果显示, adipo8的结合大大增强了纳米载体对分化3T3-L1细胞的附着, 并可特异性增加分化3T3-L1细胞内的药物浓度。由于单链适配体稳定性差, 有研究者利用脂肪适配体靶向序列制备了DNA纳米化药物递送系统, 并通过静电作用和碱基堆积高效结合了褐变剂大蒜素, 此药物递送系统对脂肪细胞的靶向能力和稳定性都得到了提高, 有利于对肥胖组织能量代谢的精准调控[41]。
4.2.2 靶向脂肪基质细胞与经典的棕色脂肪细胞相比, 米色脂肪细胞是通过脂肪基质干细胞(ASCs) 的重新分化或白色脂肪细胞的转化诱导形成。因此, 通过增强ASCs向米色脂肪细胞的分化使皮下白色脂肪组织褐变将成为对抗肥胖及其并发症的一种有前景的策略。Daquinag等[42]发现糖基化位点缺乏的核心蛋白聚糖(glycanation site-deficient decorin, ΔDCN) 在人和小鼠的白色脂肪组织中均存在并暴露于ASCs表面, 且富含半胱氨酸的环肽文库的肽CSWKYWFGEC能够与ΔDCN受体特异性结合。Zu等[43]制备了包载Resv的线性ASCs靶向肽修饰的药物递送系统(L-Rnano), 并对此药物递送系统的靶向性及褐变作用进行了评价。结果显示, L-Rnano对ΔDCN阳性细胞具有明显的靶向作用, 在小鼠皮下白色脂肪组织的ASCs中累积尤为显著, 且L-Rnano处理组的脂肪细胞粒径明显减小, 并出现多房脂滴形态, UCP1表达显著增加。靶向ASCs的药物递送系统为褐变剂发挥其褐变作用、对抗肥胖带来了新思路。
4.3 外部刺激 4.3.1 磁诱导TZDs的许多抗糖尿病作用是通过脂肪组织介导的, 临床应用发现系统性给予TZDs治疗会增加患者患膀胱癌、充血性心力衰竭和骨折等风险[44]。将该类药物如Rosi定向输送到特定脂肪组织的靶向给药有望减少或消除该类药物的不良反应, 并保持或增强治疗效果。Saatchi等[45]评估了磁性纳米粒(magnetic nanoparticles, MNPs) 作为Rosi递送载体对脂肪组织的靶向。结果表明, 疏水涂层可将Rosi吸附到MNPs上, 吸附于MNPs上的Rosi保持了诱导PPARγ靶基因表达的能力。放射性标记Rosi-MNPs的生物分布显示, 皮下注射Rosi-MNPs显著增强了Rosi在预先皮下植入磁铁的肥胖小鼠中对目标脂肪组织的定位。磁铁矿不仅能结合各种药物, 并可通过与细胞膜相互作用和被细胞吞噬而有效保留于目标组织中[46]。因此, 构建磁诱导靶向的药物递送载体不仅增强褐变剂定位诱导白色脂肪棕色化, 还可延长药物在脂肪细胞中的滞留时间, 增强褐变剂的作用效果。
4.3.2 超声诱导BMP7能诱导PRDM16和PGC1α并增加UCP1、PPARγ和CCAAT区/增强子结合蛋白(CCAAT/enhancer binding proteins, C/EBPs) 的表达进而实现诱导白色脂肪组织棕色化。但BMP7对心血管和代谢等也会产生诸多影响, 因此, 将BMP7靶向递送至白色脂肪组织至关重要。Guo等[47]在外泌体中嵌入声敏剂氯e6 (chlorin e6, Ce6), 并通过硫缩酮键连接能与外泌体CD63结合的肽CP05 (CRHSQMTVTSRL) 和PEG, 由此构建了载有BMP7 mRNA的超声靶向递送系统。通过定点对脂肪组织外部超声干预产生大量活性氧导致递送系统中的硫缩酮键断裂, 脱掉PEG的外泌体被胞吞进入脂肪细胞后释放BMP7, 增加UCP1的表达, 激活棕色化进程。这种通过超声辅助的智能药物递送系统提供了一种可控的给药平台, 可根据靶部位的位置选择特定波长的声波, 对深部组织也能达到良好的靶向和褐变剂药物控释效果。
4.4 局部给药 4.4.1 局部注射纳米递送系统先前有报道称, 通过腹腔注射苯二氮卓类药物(benzodiazepines, DBZ) 抑制Notch信号通路能诱导白色脂肪细胞褐变[48], 但该类药物对肝脏中Notch信号通路的抑制作用也会影响肝糖和肝脂质的产生和积累[49]。因此, 将DBZ靶向递送至特定的白色脂肪组织可诱导局部褐变并避免脱靶效应。Jiang等[50]制备了包载DBZ的聚乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid, PLGA) 纳米粒DBZ-NPs并局部注射到腹股沟白色脂肪组织中。结果显示, NPs可被白色脂肪细胞有效摄取并滞留其中, 通过可持续释放DBZ抑制Notch信号促进白色脂肪细胞褐变并改善能量稳态。Hiradate等[35]构建的CKGGRAKDC与R8双靶向的Rosi药物递送系统也是通过局部注射给药, 不仅可减少全身不良反应, 还可减少药物在白色脂肪血管内皮细胞和肝脏中的积累。
4.4.2 微针微针技术具有非侵入性、无痛、局部给药、可减少全身不良反应且不需专业人员操作的优点, 使其成为创伤修复和胰岛素研究中常用的给药方式。微针给药也是局部诱导白色脂肪组织棕色化的一种有效方式。Zhang等[51]以酸敏感的右旋葡聚糖衍生物为原料制备可降解微针, 包载含有Rosi的葡聚糖纳米粒局部诱导白色脂肪细胞的褐变, 同时引入葡萄糖氧化酶和过氧化氢酶, 这两种酶可在生理葡萄糖浓度下产生酸性环境, 使微针降解并释放药物。研究发现, 可降解微针在酸性环境下释放褐变剂, 褐变剂进入皮下区域, 上调棕色标志基因UCP1、CIDEA和PGC1α等的表达, 进而促进白色脂肪组织向棕色样脂肪组织转化[51]。更重要的是, 微针贴片将褐变剂局部限制于作用区域, 极大减少了褐变剂对其他器官潜在的不良反应。
5 总结与展望逆转白色脂肪棕色化在肥胖治疗中已成为一种备受关注的策略, 对褐变剂诱导白色脂肪组织棕色化机制的研究也取得了一定的进展, 因此有望将白色脂肪组织棕色化作为临床治疗肥胖及肥胖相关代谢性疾病的方法。然而, 白色脂肪棕色化的效果受脂肪位置的影响。与皮下脂肪相比, 腹部/内脏脂肪堆积更易引起胰岛素抵抗, 导致肝脏中游离脂肪酸和胆固醇的增多而影响肝脏代谢。此外, 白色脂肪细胞也是内分泌细胞, 当内脏白色脂肪细胞增生肥大时会分泌更多的白介素6和肿瘤坏死因子等促炎因子, 因此肥厚的腹部脂肪对机体的危害远大于皮下脂肪的堆积。将褐变剂靶向递送至腹部或内脏的白色脂肪组织更有利于褐变剂对肥胖及其引起的代谢性疾病的治疗效果, 减少系统不良反应。然而, 目前白色脂肪组织的特异性标志物发现较少, 因此关于此类靶向递送系统虽有报道但仍较少, 未来挖掘更多白色脂肪组织的生物标志物和构建相关的靶向药物递送系统诱导腹部和内脏白色脂肪组织棕色化具有重要意义和广阔前景。
作者贡献: 孙倩雯负责文献检索、撰写和修改文章; 许雅琪、陈微参与文章修改并检查图片内容; 叶军、王洪亮、高丽丽、高越负责文献资料分析; 刘玉玲对稿件整体内容进行指导和修改; 杨艳芳负责文章选题、指导和审阅文章。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
World Health Organization. Obesity and overweight 2021 [EB/OL]. Geneva: WHO Press, 2021 [2022-01-10]. https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight.
|
| [2] |
Olumuyiwa F. Recent advances and current trend in the pharmacotherapy of obesity[J]. Arch Med Health Sci, 2018, 6: 99-116. DOI:10.4103/amhs.amhs_30_18 |
| [3] |
Son JW, Kim S. Comprehensive review of current and upcoming anti-obesity drugs[J]. Diabetes Metab J, 2020, 44: 802-818. DOI:10.4093/dmj.2020.0258 |
| [4] |
Sibuyi N, Moabelo KL, Meyer M, et al. Nanotechnology advances towards development of targeted-treatment for obesity[J]. J Nanobiotechnol, 2019, 17: 122-143. DOI:10.1186/s12951-019-0554-3 |
| [5] |
Virtanen KA, Lidell ME, Orava J, et al. Functional brown adipose tissue in healthy adults[J]. N Engl J Med, 2009, 360: 1518-1525. DOI:10.1056/NEJMoa0808949 |
| [6] |
Ma P, He P, Xu CY, et al. Recent developments in natural products for white adipose tissue browning[J]. Chin J Nat Med, 2020, 18: 803-817. |
| [7] |
Guan YQ, Liu J, Nurbiya N. Mechanism and research progress of white fat browning[J]. J Xinjiang Med Univ (新疆医科大学学报), 2019, 42: 1122-1125. |
| [8] |
Heaton JM. The distribution of brown adipose tissue in the human[J]. J Anat, 1972, 112: 35-39. |
| [9] |
Kosaku S, Luijten IHN, Hasegawa Y, et al. Genetic and functional characterization of clonally derived adult human brown adipocytes[J]. Nat Med, 2015, 21: 389-394. DOI:10.1038/nm.3819 |
| [10] |
Lizcano F. The beige adipocyte as a therapy for metabolic diseases[J]. Int J Mol Sci, 2019, 20: 5058-5082. DOI:10.3390/ijms20205058 |
| [11] |
Wang HN, Qi Z, Li XL, et al. Research progress on bioactive substances and mechanisms regulating browning of white adipose[J]. Prog Physiol Sci (生理科学进展), 2021, 52: 317-321. |
| [12] |
Chen L, Zhang SF, Ma D, et al. Research progress on browning of white adipose tissue[J]. Hunan J Tradit Chin Med (湖南中医杂志), 2019, 35: 4. |
| [13] |
Zheng JW, Liu WJ, Zhu JD, et al. Pterostilbene and treadmill exercise induce white adipose browning in rats[J]. J Third Mil Med Univ (第三军医大学学报), 2020, 42: 367-374. |
| [14] |
Guo YY, Li BY, Peng WQ, et al. Taurine-mediated browning of white adipose tissue is involved in its anti-obesity effect in mice[J]. J Biol Chem, 2019, 294: 15014-15024. DOI:10.1074/jbc.RA119.009936 |
| [15] |
Liu J, Wang Y, Lin L. Small molecules for fat combustion: targeting obesity[J]. Acta Pharm Sin B, 2019, 9: 220-236. DOI:10.1016/j.apsb.2018.09.007 |
| [16] |
Zhu XL, Du SS, Yan QH, et al. Effects and mechanisms of curcumin promoting the browning of mouse subcutaneous preadipocytes[J]. J Nanjing Med Univ (Nat Sci) (南京医科大学学报(自然科学版)), 2020, 40: 796-802. |
| [17] |
Li W, Teng R, Di L, et al. PPARα and Sirt1 mediate erythropoietin action in increasing metabolic activity and browning of white adipocytes to protect against obesity and metabolic disorders[J]. Diabetes, 2013, 62: 4122-4131. DOI:10.2337/db13-0518 |
| [18] |
Rachid TL, Penna-de-Carvalho A, Bringhenti I, et al. Fenofibrate (PPARα agonist) induces beige cell formation in subcutaneous white adipose tissue from diet-induced male obese mice[J]. Mol Cell Endocrinol, 2015, 402: 86-94. DOI:10.1016/j.mce.2014.12.027 |
| [19] |
Qiang L, Wang L, Kon N, et al. Brown remodeling of white adipose tissue by SIRT1-dependent deacetylation of PPARγ[J]. Cell, 2012, 150: 620-632. DOI:10.1016/j.cell.2012.06.027 |
| [20] |
Tseng YH, Kokkotou E, Schulz TJ, et al. New role of bone morphogenetic protein 7 in brown adipogenesis and energy expenditure[J]. Nature, 2008, 454: 1000-1004. DOI:10.1038/nature07221 |
| [21] |
Zhu SL, Zhang ZY, Ren GP, et al. Therapeutic effect of fibroblast growth factor 21 on NAFLD in MSG-IR mice and its mechanism[J]. Acta Pharm Sin (药学学报), 2013, 48: 1778-1784. |
| [22] |
Ren GP, Hou YT, Jiang YY et al. Efficient expression of soluble human FGF-21 and its glucose regulation activity[J]. Acta Pharm Sin (药学学报), 2009, 44: 548-552. |
| [23] |
Fisher FM, Kleiner S, Douris N, et al. FGF21 regulates PGC-1α and browning of white adipose tissues in adaptive thermogenesis[J]. Genes Dev, 2012, 26: 271-281. DOI:10.1101/gad.177857.111 |
| [24] |
Baskaran P, Krishnan V, Ren J, et al. Capsaicin induces browning of white adipose tissue and counters obesity by activating TRPV1 channel-dependent mechanisms[J]. Br J Pharmacol, 2016, 173: 2369-2389. DOI:10.1111/bph.13514 |
| [25] |
Wang S, Liang X, Yang Q, et al. Resveratrol induces brown-like adipocyte formation in white fat through activation of AMP-activated protein kinase (AMPK) α1[J]. Int J Obes, 2015, 39: 967-976. DOI:10.1038/ijo.2015.23 |
| [26] |
Zhang X, Zhang QX, Wang X, et al. Dietary luteolin activates browning and thermogenesis in mice through an AMPK/PGC1α pathway-mediated mechanism[J]. Int J Obes (Lond), 2016, 40: 1841-1849. DOI:10.1038/ijo.2016.108 |
| [27] |
Collier JJ, Batdorf HM, Merrifield KL, et al. Pioglitazone reverses markers of islet beta-cell de-differentiation in db/db mice while modulating expression of genes controlling inflammation and browning in white adipose tissue from insulin-resistant mice and humans[J]. Biomedicines, 2021, 9: 1189-1225. DOI:10.3390/biomedicines9091189 |
| [28] |
Ohno H, Shino DK, Spiegelman B, et al. PPARγ agonists induce a white-to-brown fat conversion through stabilization of PRDM16 protein[J]. Cell Metab, 2012, 15: 395-404. DOI:10.1016/j.cmet.2012.01.019 |
| [29] |
Jeong S, Yoon M. Fenofibrate inhibits adipocyte hypertrophy and insulin resistance by activating adipose PPARα in high fat diet-induced obese mice[J]. Exp Mol Med, 2009, 41: 397-405. DOI:10.3858/emm.2009.41.6.045 |
| [30] |
Whittle A, Relat-Pardo J, Vidal-Puig A. Pharmacological strategies for targeting BAT thermogenesis[J]. Trends Pharmacol Sci, 2013, 34: 347-355. DOI:10.1016/j.tips.2013.04.004 |
| [31] |
Gao XY, Bai NN, Hu RW, et al. Research progress on the mechanism of adipose tissue angiogenesis in obesity[J]. J Med Res (医学研究杂志), 2019, 48: 188-191. |
| [32] |
Nishimura S, Manabe I, Nagasaki M, et al. Adipogenesis in obesity requires close interplay between differentiating adipocytes, stromal cells, and blood vessels[J]. Diabetes, 2007, 56: 1517-1526. DOI:10.2337/db06-1749 |
| [33] |
Hossen MN, Kajimoto K, Akita H, et al. Vascular-targeted nanotherapy for obesity: unexpected passive targeting mechanism to obese fat for the enhancement of active drug delivery[J]. J Control Release, 2012, 163: 101-110. DOI:10.1016/j.jconrel.2012.09.002 |
| [34] |
Kolonin MG, Saha PK, Chan L, et al. Reversal of obesity by targeted ablation of adipose tissue[J]. Nat Med, 2004, 10: 625-632. DOI:10.1038/nm1048 |
| [35] |
Hiradate R, Khalil IA, Matsuda A, et al. A novel dual-targeted rosiglitazone-loaded nanoparticle for the prevention of diet-induced obesity via the browning of white adipose tissue[J]. J Control Release, 2020, 329: 665-675. |
| [36] |
Sibuyi NRS, Thovhogi N, Gabuza KB, et al. Peptide-functionalized nanoparticles for the selective induction of apoptosis in target cells[J]. Nanomedicine (Lond), 2017, 12: 1631-1645. DOI:10.2217/nnm-2017-0085 |
| [37] |
Xue Y, Xu XY, Zhang XQ, et al. Preventing diet-induced obesity in mice by adipose tissue transformation and angiogenesis using targeted nanoparticles[J]. Proc Natl Acad Sci U S A, 2016, 113: 5552-5557. DOI:10.1073/pnas.1603840113 |
| [38] |
Chen RH, Huang SS, Lin TT, et al. Photoacoustic molecular imaging-escorted adipose photodynamic browning synergy for fighting obesity with virus-like complexes[J]. Nat Nanotechnol, 2021, 16: 455-465. DOI:10.1038/s41565-020-00844-6 |
| [39] |
Liu J, Liu H, Kwame S, et al. Selection of aptamers specific for adipose tissue[J]. PLoS One, 2012, 7: 37789-37798. DOI:10.1371/journal.pone.0037789 |
| [40] |
Yu B, Pu Y, Liu J, et al. Targeted delivery of emodin to adipocytes by aptamer-functionalized PEG-PLGA nanoparticles in vitro[J]. J Drug Deliv Sci Technol, 2020, 57: 101739-101748. DOI:10.1016/j.jddst.2020.101739 |
| [41] |
Xu WT, He XY, Huang KL, et al. A preparation method of DNA nanoflower drug targeting regulation of white fat browning: CN, 112587670B [P]. 2021-05-11.
|
| [42] |
Daquinag AC, Dadbin A, Snyder B, et al. Non-glycanated decorin is a drug target on human adipose stromal cells[J]. Mol Ther Oncolytics, 2017, 6: 1-9. DOI:10.1016/j.omto.2017.05.003 |
| [43] |
Zu YJ, Zhao L, Hao L, et al. Browning white adipose tissue using adipose stromal cell-targeted resveratrol-loaded nanoparticles for combating obesity[J]. J Control Release, 2021, 333: 339-351. DOI:10.1016/j.jconrel.2021.03.022 |
| [44] |
Zhu ZN, Jiang YF, Ding T. Risk of fracture with thiazolidinediones: an updated meta-analysis of randomized clinical trials[J]. Bone, 2014, 68: 115-123. DOI:10.1016/j.bone.2014.08.010 |
| [45] |
Saatchi K, Tod SE, Leung D, et al. Characterization of alendronic and undecylenic acid coated magnetic nanoparticles for the targeted delivery of rosiglitazone to subcutaneous adipose tissue[J]. Nanomedicine, 2017, 13: 559-568. DOI:10.1016/j.nano.2016.08.012 |
| [46] |
Häfeli UO, Riffle JS, Harris-Shekhawat L, et al. Cell uptake and in vitro toxicity of magnetic nanoparticles suitable for drug delivery[J]. Mol Pharm, 2009, 6: 1417-1428. DOI:10.1021/mp900083m |
| [47] |
Guo Y, Wan Z, Zhao P, et al. Ultrasound triggered topical delivery of BMP7 mRNA for white fat browning induction via engineered smart exosomes[J]. J Nanobiotechnol, 2021, 19: 402-414. DOI:10.1186/s12951-021-01145-3 |
| [48] |
Bi PP, Shan TZ, Liu WY, et al. Notch signaling regulates adipose browning and energy metabolism[J]. Nat Med, 2014, 20: 911-918. DOI:10.1038/nm.3615 |
| [49] |
Pajvani UB, Qiang L, Kangsamaksin T, et al. Inhibition of Notch uncouples Akt activation from hepatic lipid accumulation by decreasing mTorc1 stability[J]. Nat Med, 2013, 19: 1054-1060. DOI:10.1038/nm.3259 |
| [50] |
Jiang C, Cano-Vega MA, Yue F, et al. Dibenzazepine-loaded nanoparticles induce local browning of white adipose tissue to counteract obesity[J]. Mol Ther, 2017, 25: 1718-1729. DOI:10.1016/j.ymthe.2017.05.020 |
| [51] |
Zhang Y, Liu Q, Yu J, et al. Locally induced adipose tissue browning by microneedle patch for obesity treatment[J]. ACS Nano, 2017, 11: 9223-9230. DOI:10.1021/acsnano.7b04348 |
 2022, Vol. 57
2022, Vol. 57


