肽对现代制药业的发展产生了深远影响。自1922年美国FDA (Food and Drug Administration) 批准胰岛素用于糖尿病治疗以来, 已有80多种肽类药物陆续进入市场, 用于治疗多种疾病, 包括糖尿病、癌症、骨质疏松症、肢端肥大症等。伴随着肽疗法相关研究的稳步推进, 有150多种肽处于临床开发阶段, 另有400~600种肽正在进行临床前研究[1]。2019年, 肽类药物占全球医药市场的5%, 销售规模达到500亿美元, 并呈现持续增长的势头[2]。肽类药物的出现填补了过去小分子药物(通常分子质量 < 500 Da) 和生物制剂(通常分子质量 > 5 000 Da) 之间的空白[3]。作为大多数内分泌信号通路的天然信使, 肽在体内往往能发挥高度特异性的调节作用, 相较小分子药物靶向性更强、效力更高。同时, 作为内源性物质, 肽类药物对正常生物功能的干扰及造成不良反应的几率也更低[4]。与蛋白质药物相比, 肽类药物尺寸更小, 可能具备更高的口服生物利用度, 且部分肽可通过化学方法合成, 生产便利成本低。
尽管肽类药物具备诸多优点, 但受其低生物利用度的限制, 肽类药物通常采取注射给药。这一给药途径具有高生物利用度的优点却也伴随一定的不良反应。首先, 注射给药容易引起注射部位反应(injection site reactions, ISR), 包括注射部位周围的肿胀、红斑、瘙痒和疼痛[5]。其次, 注射用药患者的依从性较差, 尤其对于需要长期监测和重复给药的慢性疾病患者, 这一缺点被进一步放大[6]。此外, 经专业人员注射给药会耗费更多时间、金钱及精力, 但若自行注射易招致他人误解。例如在工作场所或者旅行中注射胰岛素, 患者易产生负面情绪从而影响治疗积极性[7]。因此, 尽管注射给药可显著提高生物利用度, 绝大多数患者更倾向于口服给药[6]。目前口服给药往往应用于小分子药物, 对于肽类药物, 口服递送过程中受其分子质量大小、稳定性、胃肠道生理障碍以及理化性质的限制, 导致肽类药物难以被吸收入血并发挥药效。本综述主要介绍口服递送肽类药物涉及的关键屏障, 总结近年来提高肽类药物口服生物利用度的相关技术手段, 重点关注已上市或处于临床试验阶段的口服肽类药物制剂, 以此为口服肽类制剂的研发和临床转化提供新思路。
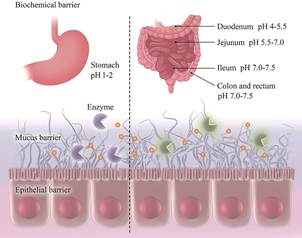
1 口服生物屏障 1.1 生化屏障肽一般是由2~50个氨基酸组成的具有特定空间结构的化合物, 超过50个氨基酸构成的肽被称为蛋白质[8]。肽类药物通过口服途径进入人体消化道, 其生物活性会受到诸多因素抑制, 其中最关键的两个生化因素分别为pH值和消化水解酶。肽类药物口服进入消化道后会经历从胃(pH 1.0~2.0) 到十二指肠(pH 4.5~5.0)、空肠(pH 5.5~7.0) 和回肠(pH 7.0~7.5), 然后转移到结肠和直肠(pH 7.0~7.5) 的过程[9]。多变的pH梯度会改变肽在正常情况下的空间折叠状态, 易造成药物变性直至失去活性。另一方面, 胃肠道内存在的蛋白酶及相关水解酶通过识别肽链上的特定位点, 对其进行降解, 使之生物活性降低甚至完全失活。并且, 各类消化水解酶均处于活性最佳的pH环境条件下, 对肽类药物的降解效果最强。在胃(pH 1.0~2.0) 内, 胃蛋白酶的活性最佳。作为一种内肽酶, 它可水解苯丙氨酸、色氨酸和酪氨酸等芳香族残基之间的肽键[10], 从而使肽水解失活。当肽类药物到达小肠, 由胰腺分泌的消化酶进一步发挥作用, 包括丝氨酸蛋白酶(胰蛋白酶、糜蛋白酶和弹性蛋白酶) 和羧肽酶。胰蛋白酶在碱性氨基酸残基位点水解肽; 糜蛋白酶水解含有芳香族氨基酸残基的相关肽; 弹性蛋白酶在不带电荷的小氨基酸(如丙氨酸、甘氨酸和丝氨酸) 残基处发挥作用[11]。羧肽酶A识别肽链C末端芳香族、中性或酸性氨基酸残基发挥作用, 而羧肽酶B则在碱性氨基酸残基处发挥作用[12]。对于口服肽类药物在生理环境下的降解, 通常使用酶抑制剂直接降低酶活性, 或借助pH调节剂如柠檬酸等改变局部pH来间接降低酶活性以抑制水解。
1.2 黏液屏障黏液是一种覆盖在胃肠道上皮细胞层的凝胶状物质, 主要由杯状细胞分泌的黏蛋白组成。在胃肠道中主要的分泌型黏蛋白(mucin, MUC) 包括MUC2、MUC5AC和MUC6[13]。上述黏蛋白单体通过二硫键连接形成大分子, 并借助可逆的疏水作用等交联缠结形成聚合物网络, 进一步形成动态弹性凝胶[14, 15]。胃肠道表面附着的黏液可细分为两层, 分别为松散黏附层和牢固黏附层。松散黏附层的黏蛋白不断分泌和脱落, 导致黏液层不断更新, 在有效清除潜在有害物质的同时, 也大幅减少了肽类药物的摄取; 牢固黏附层紧邻上皮内层, 包含与细胞结合的黏蛋白、糖脂和糖蛋白, 这一系列物质同时起到屏障和传递信号的作用[16]。黏液本身会产生类似网筛的结构, 可在空间上阻挡无法穿透黏液网眼孔径的颗粒(10~200 nm), 起到保护作用[17]。药物进入松散黏附层后, 会被黏蛋白完全附着并被特异性剪切, 最终被黏液中的酶水解[18]。因此, 为提高药物生物利用度, 肽类药物应快速穿过松散黏附层。另一方面, 牢固黏附层黏液清除速度较慢, 有助于提高药物的吸收效率[19]。故而可通过增强牢固黏附层黏附(包括借助静电相互作用、疏水相互作用、范德华相互作用等) 来延长肽类药物在胃肠道中的停留时间来增强吸收。
1.3 上皮屏障胃肠道上皮由单层上皮细胞组成, 包括肠上皮细胞、上皮内淋巴细胞、杯状细胞、M细胞(microfold cell) 和树突细胞。作为将管腔与组织分隔的保护屏障, 胃肠道上皮在抵御多种病原体以及维持胃肠道稳态中发挥着重要作用。药物分子穿过黏液层后, 进入上皮细胞主要有2种途径: 细胞转运(跨细胞途径) 和通过上皮细胞之间的空间扩散(细胞旁途径)。对于跨细胞途径, 多数肽类药物由于分子质量较大、亲水性较强, 难以直接通过细胞膜, 往往需借助特定细胞进行内吞摄取。例如M细胞可介导管腔抗原内吞并将其呈递给黏膜免疫系统, 故肽类药物可通过M细胞胞吞作用内化, 但其会因主动转运机制被排回管腔[20]。P-糖蛋白、乳腺癌耐药蛋白和多药耐药相关蛋白2作为表达在肠细胞顶膜上的3种外排泵, 可有效降低药物的入胞效率, 从而降低药物的生物利用度[21]。对于细胞旁途径, 各类上皮细胞会通过紧密连接、黏附连接和桥粒相互连接形成致密结构, 使得肽类药物难以通过[22]。
1.4 其他除上述屏障外, 沿胃肠道的渗透应力、胃肠道肌肉的蠕动以及腔内胃液流速引起的剪切应力, 会对药物进行机械降解而降低药物效率[18]。流动的胃液也可能减少药物分子与上皮细胞之间的接触时间, 从而阻碍其入胞吸收[23]。口服生物屏障汇总如图 1所示。
|
Figure 1 Physiological barriers to oral peptide delivery. The biochemical barrier includes enzymes and pH, which can cleave peptides or render the peptide inactive. The mucus barrier limits the diffusion of peptide drugs and the epithelial barrier involves the paracellular transport and the transcellular transport reducing the efficacy of oral peptide drugs |
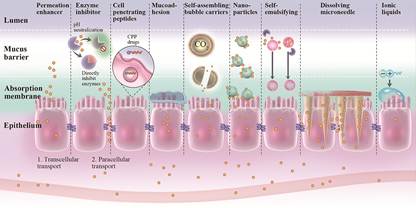
鉴于肽类药物胃肠道吸收屏障多而复杂, 口服生物利用度低等问题, 现有研究已尝试研发各类技术方法以针对不同吸收屏障进行抗干扰、促进肽类药物吸收(图 2)。
|
Figure 2 Approaches to improve the absorption of peptide drugs. Categories of promoting oral peptide delivery include permeation enhancers, enzyme inhibitors, cell penetrating peptides (CPP), mucoadhesion, nanoparticles, self-emulsifying, dissolving microneedle and ionic liquids via enhanced permeation, transportation and protecting peptides from enzymatic degradation |
渗透增强剂有助于减少上皮屏障对肽类药物吸收的阻碍, 主要通过打开细胞间紧密连接, 促进肽类药物的细胞旁转运, 或借助膜扰动来增强药物的跨细胞转运, 通过增加肠上皮细胞的瞬时通透性而促进肽类药物的吸收[24]。Whitehead等[25]借助肠上皮Caco-2细胞模型发现脂肪酸酯主要促进细胞间紧密连接打开, 而两性离子和阳离子表面活性剂主要增强细胞通透性。Stuettgen等[26]发现在结肠黏膜中, 苯基哌嗪类物质如1-苯基哌嗪等会激活5-羟色胺(5-hydroxytryptamine, 5-HT) 受体、肌球蛋白轻链激酶(myosin light-chain kinase, MLCK) 和基底外侧Na+-K+-2Cl-协同转运蛋白, 从而打开细胞间紧密连接。相较于使用任意单一渗透增强剂, 包括表面活性剂、胆汁盐等渗透增强剂所构成的复合辅料具备协同优势[27]。然而, 渗透增强剂提高肽类药物吸收是非特异性的, 可能增加将毒素或过敏原输入的风险, 从而导致不良反应[28]。因此, 虽有许多渗透增强剂用于临床前研究, 但只有少数渗透增强剂展现出足够的安全性和有效性可进入临床试验, 渗透增强剂汇总如表 1[26, 29-35]。
| Table 1 List of permeation enhancers. TJ: Tight junction; 5-HT: 5-Hydroxytryptamine; MLCK: Myosin light-chain kinase |
酶抑制剂通过抑制与肽类药物失活密切相关的水解酶活性来提高肽类药物稳定性, 下调生化屏障对肽的吸收阻碍。常用的酶抑制剂包括抑肽酶、胰蛋白酶抑制剂、杆菌肽、嘌呤霉素和胆汁盐等[36]。Del Curto等[37]将酶抑制剂甲磺酸卡莫司他应用于胰岛素的结肠给药系统, 有效提高胰岛素口服生物利用度。除此之外, 由于蛋白酶的最佳活性受所处环境pH值影响, 故可通过改变生理环境的pH来抑制蛋白酶的活性。例如胰岛素的主要蛋白水解酶为糜蛋白酶, 其最适pH值为6.5。Welling等[38]使用柠檬酸降低局部pH值来抑制糜蛋白酶活性, 发现胰岛素的降解速率明显降低。但酶抑制剂在抑制药物降解的同时也抑制了其他蛋白质的正常降解, 会改变胃肠道内的正常生理代谢情况并伴随一定不良反应, 影响患者的用药体验。
2.3 细胞穿透肽(cell penetrating peptides, CPP)CPP是一种少于40个氨基酸组成的短肽, 可作为有效的细胞递送载体装载药物, 通过多种机制进入细胞, 并可进一步借助细胞胞吐作用将药物输送到体循环[39], 故其主要针对上皮屏障, 促进药物吸收入胞。CPP通过静电相互作用附着到细胞膜上, 在结合位点进入细胞。CPP的入胞途径具体可被分为3种类型: 在CPP浓度较高的情况下, 可直接渗透入胞; 在CPP浓度较低时, 通过内吞途径包括胞饮、吞噬和受体介导的内吞作用进行运输; 在CPP浓度适宜时, CPP与细胞膜的相互作用会导致膜的脂双层被破坏, 形成倒置胶束, 借助胶束的不稳定性形成过渡结构而易位入胞[40]。CPP的来源包括肝素结合蛋白、DNA结合蛋白、信号肽、抗菌肽等各种天然蛋白质, 可细分为带正电荷的CPP、两亲性CPP和疏水性CPP。首先发现的CPP是人类免疫缺陷病毒(human immunodeficiency virus, HIV) 的转录激活因子(transcription activator, Tat), 其可实现细胞渗透以及HIV病毒颗粒的细胞内递送。通过结构域定位发现Tat蛋白起作用的是11个氨基酸构成的阳离子结构域(YGRKKRRQRRR), 主要依靠正电荷与细胞表面的蛋白聚糖相互作用[41]。Wender等[42]发现在碱性氨基酸中, 精氨酸具有最大的细胞渗透潜力。富含精氨酸的CPP包括反式激活因子肽、寡精氨酸、穿透素、低分子质量鱼精蛋白(low molecular weight protamine, LMWP)。He等[43]将LMWP作为CPP, 借助聚乙二醇(polyethylene glycol, PEG) 与胰岛素偶联, 通过Caco-2细胞模型发现胰岛素-PEG-LMWP结合物的渗透率比胰岛素对照组高4、5倍。在家兔体内研究发现, 相较于口服胰岛素溶液生物利用度为3.15%, 胰岛素-PEG-LMWP结合物的生物利用度为21.34%, 与注射胰岛素溶液相比, 其相对生物利用度达到26.86%[44]。而两亲性CPP是将CPP的疏水结构域通过共价键连接到核定位信号上而生成的嵌合肽[45]。Oehlke等[46]合成模型两亲性肽(model amphipathic peptide, MAP), 发现MAP中高度两亲性的α-螺旋结构有助于细胞摄取。而疏水性CPP由于其疏水性强, 更有利于促进膜扰动, 增加渗透性[47]。另一方面, 对于CPP在肽类药物递送中的应用, 需考虑其细胞毒性和稳定性, 可对天然蛋白质来源的CPP进行适当编辑, 如借助在疏水性氨基酸与磷脂双分子层相互作用或进行化学修饰借助二硫键等增加相互作用。
2.4 黏膜黏附通过反向利用黏膜屏障的特性增强黏膜黏附可延长肽类药物在黏膜停留的时间促进吸收, 提高药物的生物利用度。增强黏膜黏附的材料通常由天然聚合物和合成聚合物组成, 由于其表面张力小、易润湿从而铺展于黏液层, 并可通过化学键如共价键、离子键结合或通过聚合物链与黏蛋白缠绕增强吸附[48], 有助于减缓黏膜对活性药物分子的清除速率。同时, 黏膜黏附聚合物可抑制胃肠道中存在的蛋白水解酶, 其通常与酶系统中必需的酶辅因子钙和锌结合, 导致酶的构象变化和酶失活。目前常用的黏膜黏附聚合物包括壳聚糖及其硫醇化衍生物、果胶、聚丙烯酸、海藻酸盐、聚乙烯醇和纤维素衍生物如羧甲基纤维素钠、羟丙基甲基纤维素[49]。M Ways等[50]借助离体猪膀胱进行黏膜黏附研究, 用荧光强度来表征药物吸收, 发现相比于使用聚乙二醇等传统材料, 用壳聚糖包裹药物的荧光强度最大, 表明其具有优异的黏膜黏附特性。
2.5 自组装气泡载体由于口服药物包衣的肠溶聚合物在小肠中不会立刻完全溶解, 故包封的肽类药物可能部分滞留在胶囊内。同时, 肽类分子大量释放后可能会聚集, 限制其吸收入血, 降低口服生物利用度[51]。自组装气泡载体可改善上述问题, 可通过局部环境pH的改变突破生化屏障对药物的抑制水解作用, 同时通过影响上皮屏障实现药物的快速输送。首先, 该载体系统借助二乙基三胺五乙酸(DTPA) 形成酸性环境, 并通过发泡剂碳酸氢钠分解产生CO2气体。同时该系统通过表面活性剂十二烷基硫酸钠(SDS) 的亲水头部连接水相, 疏水尾部与气体相连接, 从而使包含肽类药物的气泡载体在双层SDS之间实现自组装。随着CO2气泡不断膨胀直至撞到肠壁破裂, 气泡载体系统可实现瞬时改变上皮细胞膜形态并瞬时打开细胞膜顶端连接复合物, 从而促进肽类药物例如胰岛素分子穿过上皮细胞并使其最终吸收入体循环[52]。
2.6 纳米颗粒载体纳米颗粒载体包括胶束、脂质体、纳米胶囊、纳米球等[53]。与其他固体剂型相比, 纳米颗粒载体可促进药物在肠上皮的分布[54]。纳米颗粒载体通过载体包裹实现对药物的保护, 降低了水解酶等生化屏障对药物的抑制。同时借助表面修饰等方式突破上皮屏障, 促进药物吸收。脂质作为可生物降解的赋形剂, 不易在组织中积聚, 故基于脂质的纳米载体成为一项研究热点。脂质纳米载体可通过暂时破坏细胞磷脂双分子层, 增加跨细胞转运效率, 也可通过改变细胞间紧密连接, 增加通过细胞旁途径入胞的药物浓度[55]。Xu等[56]发现用二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG 2000) 进行表面修饰的脂质纳米载体装载药物, 可显著增强纳米载体的生物学效应。艾塞那肽通过直接靶向肠道L细胞增加胰高血糖素样肽-1 (glucagon-like peptide-1, GLP-1) 的分泌, 实现降血糖。利用未修饰的纳米载体递送艾塞那肽可使正常小鼠的内源性GLP-1水平提高4倍, 而采用DSPE-PEG 2000修饰的纳米粒递送该药物可将相同的小鼠内源性GLP-1水平提升至8倍。同时, Xu等[56]利用口服葡萄糖耐量实验发现, 仅DSPE-PEG 2000修饰的纳米载体可有效实现艾塞那肽的口服治疗。另一方面, 肽类药物的亲水特性致使其包封效率较差, 故可通过添加硫醇官能团进行共价脂化或通过与离子表面活性剂络合进行非共价脂化来增加它们的亲脂性。Millotti等[57]使用硫醇化壳聚糖的纳米粒, 与未修饰的壳聚糖纳米粒相比, 胰岛素的药-时曲线下面积提高了4倍。近年来, 将细胞内膜的小囊泡外泌体作为纳米粒药物递送系统来递送相关生物分子引起较多的关注。由于外泌体固有的小尺寸以及内源性, 其作为载体可避免巨噬细胞的吞噬和溶酶体降解, 实现体内长时间循环, 还可将药物直接输送到细胞质中[58], 具备口服递送肽类药物的潜力。
2.7 自乳化给药系统(self-emulsifying drug delivery systems, SEDDS)SEDDS由油、表面活性剂和助表面活性剂/助溶剂混合物组成, 口服后会迅速分散在胃肠液中, 生成包裹药物的微乳剂或纳米乳剂。SEDDS系统主要针对于难溶性或亲脂性药物, 提高药物的溶出度, 构建的微/纳米乳化药物凭借其小尺寸可通过淋巴途径被吸收, 绕过肝脏首过效应从而提高生物利用度[59]。同时, SEDDS可保护肽类药物免受酶促降解, 降低生化屏障对其的影响。Hetényi等[60]以亮丙瑞林、胰岛素作为模式药物时发现, 胰蛋白酶、胰凝乳蛋白酶和弹性蛋白酶由于亲水性强而无法进入SEDDS的油相中, 故而这些蛋白酶在SEDDS中不显示任何酶活性。然而, 对于亲水性较强的肽类药物, 可通过离子络合与表面活性剂、磷脂、脂肪酸等结合, 以使其有效掺入SEDDS[61]。借助非共价相互作用可使肽类部分未折叠构象的暂时稳定, 从而暴露其疏水侧链以改变稳定构象的脂溶性, 并选择最合适的疏水性反离子, 肽类药物的有效载荷比可由1%升到10%以上[62]。然而, SEDDS储存稳定性差。为克服该缺点, 研究者开发了固体SEDDS, 通过添加吸附剂或多孔载体如交联的多孔二氧化硅、微孔硅酸钙将液体SEDDS预浓缩物转移到固体中制备成固体自乳化粉末。此方法既提供固体剂型的优点, 同时保留液体SEDDS的大部分特性, 并提高药物的溶出度[63]。
2.8 微针给药系统微针给药直接避开常规口服制剂所面临的生化屏障、黏液屏障及细胞屏障等挑战, 通过微针插入胃肠道借助本身微米级传输通路而直接让肽类药物入胞, 增加渗透性[64]。微针分为用于皮肤预处理的实心微针、具有水溶性药物制剂的涂层微针、无残留碎片的溶解微针和用于液体制剂的空心微针[65]。为减少胃肠道残留, 用于口服肽类制剂的微针多为溶解性微针。Abramson等[66]开发了一种自定位毫米级释药装置(self-orienting millimeter-scale applicator, SOMA), 可自定位于胃黏膜并自主触发驱动载药针穿入胃黏膜, 从而输送肽类药物如胰岛素。而后, Abramson等[67]又开发了一种在管腔中展开的微针注射器装置(luminal unfolding microneedle injector, LUMI), 其靶向小肠, 借助聚甲基丙烯酸酯涂层会在pH ≥ 5的环境下溶解这一特性解封压缩弹簧, 从而将LUMI推出, 可溶解的载药微针会快速推进肠道组织。该装置利用小肠的管状几何形状, 设计有3个方向的展开臂, 使之与组织产生多个接触点保证用药量, 以此装置释放的胰岛素其全身生物利用度与皮下注射相比高出10%。Rani Therapeutics公司推出了RaniPill™ 肠溶微针胶囊, 其甲羟丙基甲基纤维素胶囊壳在pH > 6.5的肠道环境下溶解, 胶囊内的枸橼酸和碳酸氢钠反应产生气体, 使气囊膨胀, 从而推出可溶解的蔗糖基微针, 刺穿肠壁并将药物输送到血流中[68]。
2.9 离子液体离子液体是在100 ℃下呈液态的熔融盐, 由离散的无机/有机阴离子和有机阳离子组成[69]。通过改变其阳离子和阴离子的种类以及所连接的取代基, 可以调整相应组合的性质, 如黏度、疏水性、密度和生物降解性。虽然离子液体可提高所装载活性物质的溶解性, 但仍需考虑其细胞毒性, Gouveia等[70]通过HeLa细胞系、枯草芽孢杆菌和大肠杆菌的生物检查比较各种离子液体毒性, 发现咪唑鎓和吡啶鎓离子液体比胆碱-氨基酸的离子液体毒性高10倍。故目前生物离子液体主要是胆碱阳离子和氨基酸阴离子(天冬氨酸、谷氨酸和组氨酸) 的组合, 具有高生态安全性和生物相容性。离子液体可增加肽类药物的溶解度, 提高肽类稳定性。面对上皮屏障, 离子液体可分别借助亲水基团或亲脂基团促进药物的细胞旁转运及改善上皮细胞的通透性, 促进药物的跨细胞转运[71]。
3 口服肽类药物专利技术及其应用尽管当前涌现了许多新型技术可尝试用于实现肽类药物的高效口服递送, 但多数仅局限于克服口服递送的某一类主要屏障, 距离口服肽类药物的临床转化仍有较大距离。系统性地说明已实现商业化的口服肽类药物专利技术对促进口服肽类药物临床转化具有重要意义, 表 2整合了其中关键技术的使用策略。
| Table 2 The commercialization applications of oral peptide drugs and their delivery technologies in clinical development |
POD™由以色列Oramed公司研究开发, 主要用于胰岛素口服制剂。该制剂由肽类药物、酶抑制剂(如胃酶抑素、抑肽酶、大豆胰蛋白酶抑制剂等) 和omega-3脂肪酸吸收增强剂(如EDTA或胆盐) 和肠溶胶囊组成[72]。考虑到部分酶抑制剂、胆盐等其他因素对正常生理功能的影响, Oramed的口服胰岛素胶囊ORMD-0801选择大豆胰蛋白酶抑制剂以及EDTA作为最终处方。大豆胰蛋白酶抑制剂抑制胰蛋白酶对胰岛素的蛋白水解作用, EDTA作为螯合剂和Ca2+结合从而促进Ca2+依赖性细胞黏附蛋白E-钙黏蛋白裂解, 破坏黏附连接。而黏附连接中的肌动蛋白丝结合蛋白afadin和α-catenin会和紧密连接的封闭小带蛋白(zonula occludens-1, ZO-1) 相互作用, 故当黏附连接被破坏后细胞间紧密连接被打开, 突破上皮屏障从而促进胰岛素的肠道吸收[73]。此外, POD™技术分别将胰岛素、酶抑制剂、吸收促进剂微球化。将各个成分的微球注入肠溶胶囊, 形成双重保护。该技术通过调整冷冻干燥速率、搁板温度等调节微球的厚度、孔隙率等物理性质, 从而实现每种成分在胃肠道中特定位点的快速释放, 达到胰岛素的最佳释放吸收。包埋微粒的肠溶聚合物被设计在十二指肠中的最佳位点(pH 6.3~6.5) 释放活性成分。该位置pH值高于胰岛素蛋白质等电点(pI = 5.6), 可确保胰岛素释放后保持高溶解度。为实现这一目标, 肠溶聚合物选用甲基丙烯酸-丙烯酸乙酯共聚物[Eudragit L30 D55 (Degussa, Rohm America)], 会在高于5.5的pH值下溶解。
应用POD™技术的ORMD-0801口服胰岛素胶囊, 借助蛋白酶抑制剂和渗透增强剂突破生化屏障和上皮屏障, 从而提高了胰岛素的口服生物利用度。目前已进行了4项小型Ⅱ期研究[2项用于1型糖尿病(type 1 diabetes mellitus, T1DM)患者, 2项用于2型糖尿病(T2DM) 患者], 研究结果显示ORMD-0801耐受性良好, 可降低血浆葡萄糖水平。连续10天用口服胰岛素胶囊治疗发现T1DM患者血糖水平总体降低[74]。而在2021年进行的Ⅱ期安慰剂对照研究中, 研究者发现睡前服用ORMD-0801的T2DM患者相较安慰剂组, 其夜间血糖、24 h血糖和糖化血红蛋白(glycated haemoglobin A1c, HbA1c) 表达受抑制, 且不良反应事件和低血糖发生率与安慰剂组类似, 证明其治疗的安全性和有效性[75]。目前ORMD-0801口服胰岛素胶囊对T2DM患者的疗效和安全性相关Ⅲ期研究正在进行中, 预计2023年完成, 已获得我国国家药品监督管理局批准, 即将开展中国地区临床试验。
3.2 Peptelligence™Peptelligence™技术由美国Enteris Biopharma公司开发, 相关制剂由冻干肽、有机酸颗粒(多选择柠檬酸)、渗透增强剂酰基肉碱、抗氧化剂丙酮酸钠等组成[76]。其中, 柠檬酸作为酸调节剂通过降低肠道pH抑制酶的降解作用, 抑制生化屏障对肽类药物的不良影响。酰基肉碱选用月桂酰-L-肉碱, 该组分作为渗透增强剂, 可暂时性地打开紧密的连接复合物, 促使相邻胃肠道上皮细胞之间的紧密连接被破坏从而促进细胞旁转运, 增强肽类药物的吸收[35]。丙酮酸钠作为抗氧化剂可防止甲硫氨酸和色氨酸氧化。该技术的关键在于涂覆性的柠檬酸颗粒, 柠檬酸颗粒的表面涂层将酸与活性肽分离, 避免了酸对肽的不良作用。另一方面, 该涂层有助于保护肠溶衣免受酸对外衣快速均匀溶解所造成的不良影响。将上述成分压制成片剂, 再将片剂芯分别涂上一层水溶性聚合物基底漆和一层酸稳定肠溶涂层, 保证其到达十二指肠后, 在pH > 5.5的环境下才会溶解释放其内容物。而用水溶性底膜封闭片剂核心的内容物可防止酸对保护性载体的不良影响。当涂层溶解, 片剂的内容物在崩解剂的帮助下迅速释放到十二指肠。释放的柠檬酸颗粒在局部微环境中迅速溶解并降低肠道pH值, 从而阻止肽类药物被肠道蛋白酶和羧肽酶降解。在保护药物的同时释放酰基肉碱, 增强肽吸收[77]。当管腔pH值低于酰基肉碱亲水部分中最强酸的pKa时, 酰基肉碱带正电荷, 可作为阳离子表面活性剂引起更广泛的黏膜扰动以促进吸收[73]。
采用该技术的口服鲑鱼降钙素制剂被应用于治疗绝经后妇女的骨质疏松症, 目前已进入Ⅲ期临床试验。该试验比较了口服降钙素和经批准的鼻降钙素喷雾剂治疗绝经后骨质疏松症效果, 共565名年龄在46~86岁的女性被随机分为3组, 分别是口服重组鲑鱼降钙素(recombinant salmon calcitonin, rsCT) 片剂组(每天0.2 mg)、合成鲑鱼降钙素(synthetic salmon calcitonin, ssCT) 鼻腔喷雾剂组(每天200 IU) 和安慰剂组, 疗程为48周。研究发现与ssCT鼻腔喷雾剂相比, 口服rsCT治疗更有效地提高了股骨粗隆和股骨近端的骨密度。同时口服rsCT出现不良反应概率与ssCT鼻腔喷雾剂或安慰剂类似, 说明其具备良好的安全性与耐受性。但是口服降钙素的生物利用度约为1%, 仍处于较低水平[78]。
3.3 GIPET™GIPET™由爱尔兰Merrion Pharmaceuticals公司开发, 主要应用中链脂肪酸作为渗透增强剂以促进肽类口服吸收[79]。GIPET™由3种形式的肠溶包衣组成: ① GIPET Ⅰ由粉末形式的中链脂肪酸与相应重量比的药物组成; ② GIPET Ⅱ由在肠溶凝胶胶囊中的油、表面活性剂与药物的微乳液预浓缩物组成; ③ GIPET Ⅲ由肠溶凝胶胶囊中的脂肪酸衍生物混合物组成[80]。相关制剂主要使用癸酸钠(sodium caprate, C10) 促进胃肠道渗透性增强, 研究表明C10可能通过磷脂酶C依赖性肌醇三磷酸/二酰基甘油途径影响上皮渗透性[81]。C10借助磷脂酶C细胞内Ca2+的激活和上调, 使附着在细胞紧密连接结构域的肌动蛋白-肌球蛋白丝依赖性钙调素收缩, 紧密连接打开, 从而促进肽类药物的细胞旁途径转运[82]。同时, 药物可形成混合胶束结构, 且在较高浓度下会形成多层胶束结构。只要药物与渗透增强剂在目标吸收区域共同释放, 在设定的时间段内始终保持混合胶束浓度高于临界胶束浓度(critical micelle concentration, CMC) 的状态, 可进一步促进药物渗透。故而使用肠溶衣在肠内快速分解, 确保渗透增强剂和有效载荷在适当浓度下共同释放, 以改变肠道上皮细胞膜的渗透性。
对人体GIPET™的研究集中在各种不同类型的生物药剂学分类系统(Biopharmaceutics Classification System, BCS) Ⅲ类化合物上, 如肝素钠、唑来膦酸等。其中唑来膦酸口服制剂Orazol用于治疗前列腺癌, 已进入Ⅱ期临床试验。根据生物标志物尿Ⅰ型原胶原C-末端肽交联(NTX)、血清β胶原降解产物(β-CTx)、血清骨特异性碱性磷酸酶和血清钙的变化情况, 比较Orazol与唑来膦酸注射剂Zometa对前列腺癌患者的药效, 发现口服制剂Orazol相较于静脉注射剂Zometa表现出更显著的治疗效果[83]。目前严格意义上应用GIPET™的肽类药物仍处于上市前阶段, 还需进一步检测升级。
3.4 TPE™TPE™由美国Chiasma Pharmaceuticals公司研究开发。该技术应用于制备药物悬浮液, 由制成冻干颗粒的亲水药物部分和疏水的油性悬浮液组成。由于肽水解酶在油中不表现出酶活性, 故配成油性悬浮液可提供一定保护, 其中包含多种赋形剂, 这些赋形剂可通过打开肠上皮紧密连接瞬时改变上皮屏障的完整性, 增强渗透。首先将辛酸钠、聚乙烯吡咯烷酮PVP-12和亲水药物如醋酸奥曲肽, 溶解制成水溶液将其冻干; 疏水部分则混合聚山梨醇酯80、单辛酸甘油酯、三辛酸甘油酯和蓖麻油[84]。再将亲水部分缓慢加入到疏水介质中制备成相应悬浮液, 最后填充入硬明胶胶囊, 用pH依赖性甲基丙烯酸共聚物Acryl-EZE®进行肠溶衣包裹[84]。C8即辛酸钠作为主要的渗透增强剂, 比长链羧酸盐具有更高的CMC, 因此更易溶解, 其会作用于封闭小带ZO-1和紧密连接蛋白claudin-3, 导致紧密连接蛋白暂时重新分布, 瞬时增强渗透[85]。与此同时, 使用高浓度的赋形剂包括PVP、甘油单辛酸酯和聚山梨醇酯80作为两亲性物质同样具有与生物膜相互作用的能力, 可引起额外的增强渗透效应。一项大鼠研究表明, 聚山梨醇酯80会改变肠黏液蛋白的表达和上皮屏障的完整性[86]。Tuvia等[85]发现相比于油性悬浮液和药物的同时释放体系, 如果药物比油性悬浮液晚10 min释放, 则吸收率会下降, 说明TPE相关制剂对渗透性的影响不仅是暂时性的, 而且需在上皮细胞中和药物高浓度共同呈递时才能发挥最佳功效。
目前已利用该技术开发口服奥曲肽制剂MYCAPSSA用于治疗肢端肥大症。与每月1次的长效注射相比, 许多肢端肥大症患者更倾向于每天服用2次奥曲肽口服制剂[87]。Ⅲ期临床试验评估了口服奥曲肽胶囊对已注射生长激素抑制素受体配体的肢端肥大症患者的疗效和安全性, 证明口服奥曲肽胶囊可用于相应患者的有效维持治疗[88]。目前, 相应缓释奥曲肽胶囊已上市。虽然口服奥曲肽制剂MYCAPSSA对肢端肥大症患者有一定治疗效果, 但其口服生物利用度较低, 约为0.25%[85]。
3.5 Eligen™Eligen™技术由美国Emisphere公司研究开发, 其技术核心在于使用N-8-(2-羟基苯甲酰胺基)辛酸钠(SNAC)、N-(5-氯水杨酸酰基)8-氨基丙酸等作为吸收增强剂。这些辅料可与药物通过非共价键相互作用, 增加药物亲脂性, 并借助细胞旁途径促进药物吸收。研究表明在Caco-2细胞模型中, SNAC使胰岛素渗透性增加了大约10倍, 且不会对细胞膜造成不可逆损伤[89]。相较于C10等渗透促进剂, SNAC促进渗透能力更强[90], 可促进索马鲁肽单体化, 抑制GLP-1类似物形成低聚体, 从而减少制剂本身对口服吸收的影响。同时, SNAC可改善细胞膜流动性, 并通过弱分子间作用结合与胃上皮结合促进吸收[91]。在促进吸收的同时, SNAC可通过瞬时中和酸性环境局部调节胃肠道pH值, 抑制胃蛋白酶活性, 减少蛋白水解作用。
临床Ⅲ期试验结果表明, 在T2DM患者的26周治疗过程中, 口服索马鲁肽相较于安慰剂可更好地控制血糖水平, 且患者的HbA1c水平随着口服索马鲁肽的使用而降低。同时, 口服索马鲁肽组中发生的不良反应数要少于注射索马鲁肽组。另一方面, 口服索马鲁肽和皮下注射剂表现出减肥功效, 这是安慰剂所不具备的特性[92]。同时索马鲁肽相较于其他降血糖药物借助葡萄糖浓度依赖性机制降低血糖, 故患者低血糖的风险降低。但是Rybelsus的口服生物利用度为0.5%~1%, 处于较低水平[93]。
3.6 Axcess™Axcess™技术由美国的Diabetology公司研究开发, 其核心在于使用胆碱和香叶酸盐口服离子液体(choline and geranate, CAGE)。离子液体可作为生物相容性溶剂, 具有增强皮肤通透性的出色能力[94]。相关制剂中, 将香叶酸与碳酸氢胆碱混合制成香叶酸盐(胆碱与香叶酸酯摩尔比为1∶2的混合物渗透效率显著增加[95]), 与胰岛素混合后用溶解在异丙醇中的Eudragit® L-100进行3次肠溶包衣, 以保护胶囊在胃的酸性环境中免受降解, 实现药物在小肠部位的特异性递送[96]。CAGE可保护胰岛素免受酶促降解, 并显著增强胰岛素的细胞旁转运。此外, Nurunnabi等[97]发现CAGE可与脂肪分子相互作用以防止其通过肠道组织吸收, 进一步达到控制体重的效果。
Diabetology公司应用该技术开发了口服胰岛素胶囊Capsulin, 其优势在于通过离子液体的包裹显著提高胰岛素的稳定性, 在室温下长时间放置依然保持稳定, 其口服生物利用度相较其他同类药物未见明显提高。目前, Capsulin口服胰岛素胶囊处于临床Ⅱb阶段。该阶段主要考察二甲双胍(不使用其他伴随药物) 与Capsulin口服胰岛素胶囊联用对T2DM患者的治疗效果, 并比较3种不同剂量Capsulin口服胰岛素(75、150和300 IU) 的治疗结果。该研究结果显示, 二甲双胍与Capsulin联用后, 主要评价指标HbA1c下降≥ 0.5。同时, 空腹血糖、餐后葡萄糖、甘油三酯和胆固醇均有一定程度下降, 其中150 IU剂量组疗效最佳[98]。
4 总结与展望口服肽类药物具有注射剂无法比拟的高便利性和高依从性, 如口服索马鲁肽, 为非侵入性长期使用提供无可争议的治疗优势。但开发口服制剂替代注射剂, 其对应的低口服生物利用度仍是最大限制因素。已上市或处于临床试验的口服肽类药物生物利用度均较低, 如口服奥曲肽制剂MYCAPSSA的口服生物利用度约为0.25%[85], 口服索马鲁肽Rybelsus其生物利用度为0.5%~1%[93], 口服降钙素的生物利用度约为1%[78]。同时, 口服肽类递送技术也带来了安全性挑战。例如渗透增强剂缺乏特异性, 在促进药物吸收的同时可能会损害黏液层, 促进管腔细菌扩散到肠上皮并最终干扰患者体内正常微生物群。研究发现经批准的赋形剂聚山梨醇酯80和羧甲基纤维素会扰乱微生物群组成并诱发小鼠肥胖[99]。另一方面, 通过诱发膜扰动改善膜流动性的渗透增强剂可能会引起胃肠道不良反应包括呕吐腹泻等, 从而给患者造成困扰。此外, 一些新型输送装置例如微针等可能会导致部分肠梗阻、感染或穿孔[24]。为了解决肽类药物口服生物利用度低以及存在不良反应等问题, 可调整相应辅料的类型和剂量, 如选择合适的特异性酶抑制剂, 在保护肽类药物活性的同时避免或减少对机体正常代谢的干扰。通过对渗透增强剂等辅料剂量的调节, 在肽类药物口服递送的有效性和安全性之间寻求平衡, 找到最适辅料剂量。其次, 可对肽类药物及其载体进行化学改造, 例如在肽类药物上添加碳链增加空间稳定性或掩蔽或阻断极性酰胺键和末端氨基和羧基, 隐藏活性肽的酶切位点等。针对载体改造, 可添加疏水基团增加其亲脂性或应用内源性生物材料例如外泌体等通过内源性减少对药物的识别代谢从而促进药物的吸收。此外, 可借助SEDDS、微针给药等手段改变肽类药物吸收入血的途径, 从而避免酶类水解、黏液清除等屏障或减少肝首过效应等开发高效安全的口服肽类药物递送技术。但是另一方面, 针对纳米载体、微针给药等方式, 需考虑治疗的实际意义。当体外研究由动物过渡到人体或当提供效力较低的药物时, 相关材料用量就会增加, 需确定患者可合理摄入的材料量的上限及其他安全性问题。纳米载体如脂质体保质期差、稳定性差、封装效率低且清除快。对于SEDDS, 其体外-体内相关性较差, 缺乏合适方法确定体外SEDDS的药物释放, 故对其效果难以评估。
尽管目前有多种口服肽类递送技术在文献中报道, 但大多处于临床前研究, 其长期安全性和临床有效性仍有待深入探究。因不同肽类药物分子质量、稳定性、吸收部位等因素差异较大, 往往需根据特定药物开发具有针对性的口服给药系统。随着更多肽类药物的出现及新型功能辅料的获得, 能够克服人体生理屏障的肽类递送技术将不断涌现, 促进肽类药物更广泛的临床应用。
作者贡献: 李琪负责收集资料和撰写文章; 陈宏达负责审阅并修改文章; 刘祥瑞拟定文章框架并提供建议; 周天华审校全文并提供指导性意见。
利益冲突: 所有作者均声明不存在任何利益冲突。
| [1] |
Lau JL, Dunn MK. Therapeutic peptides: historical perspectives, current development trends, and future directions[J]. Bioorg Med Chem, 2018, 26: 2700-2707. DOI:10.1016/j.bmc.2017.06.052 |
| [2] |
Muttenthaler M, King GF, Adams DJ, et al. Trends in peptide drug discovery[J]. Nat Rev Drug Discov, 2021, 20: 309-325. DOI:10.1038/s41573-020-00135-8 |
| [3] |
Craik DJ, Fairlie DP, Liras S, et al. The future of peptide-based drugs[J]. Chem Biol Drug Des, 2013, 81: 136-147. DOI:10.1111/cbdd.12055 |
| [4] |
Leader B, Baca QJ, Golan DE. Protein therapeutics: a summary and pharmacological classification[J]. Nat Rev Drug Discov, 2008, 7: 21-39. DOI:10.1038/nrd2399 |
| [5] |
Thomaidou E, Ramot Y. Injection site reactions with the use of biological agents[J]. Dermatol Ther, 2019, 32: 12817-12820. DOI:10.1111/dth.12817 |
| [6] |
Spain CV, Wright JJ, Hahn RM, et al. Self-reported barriers to adherence and persistence to treatment with injectable medications for type 2 diabetes[J]. Clin Ther, 2016, 38: 1653-1664. e1. DOI:10.1016/j.clinthera.2016.05.009 |
| [7] |
Liu NF, Brown AS, Folias AE, et al. Stigma in people with type 1 or type 2 diabetes[J]. Clin Diabetes, 2017, 35: 27-34. DOI:10.2337/cd16-0020 |
| [8] |
Eie LV, Rye TK, Hansen F, et al. Electromembrane extraction of peptides and amino acids–status and perspectives[J]. Bioanalysis, 2021, 13: 277-289. DOI:10.4155/bio-2020-0285 |
| [9] |
Daugherty AL, Mrsny RJ. Transcellular uptake mechanisms of the intestinal epithelial barrier Part one[J]. Pharm Sci Technol Today, 1999, 2: 144-151. DOI:10.1016/S1461-5347(99)00142-X |
| [10] |
Allen A, Flemstrom G, Garner A, et al. Gastroduodenal mucosal protection[J]. Physiol Rev, 1993, 73: 823-857. DOI:10.1152/physrev.1993.73.4.823 |
| [11] |
Walker WA. Pediatric Gastrointestinal Disease: Pathophysiology, Diagnosis, Management[M]. Hamilton: BC Decker Inc., 2004: 9-12.
|
| [12] |
Human pancreatic digestive enzymes[J]. Dig Dis Sci, 2007, 52: 1-17. DOI:10.1007/s10620-006-9589-z |
| [13] |
Mucins in the gastrointestinal tract in health and disease[J]. Front Biosci, 2001, 6: 1321-1357. DOI:10.2741/Corfield |
| [14] |
Selective permeability of mucus barriers[J]. Curr Opin Biotechnol, 2018, 52: 124-133. DOI:10.1016/j.copbio.2018.03.010 |
| [15] |
Barrier properties of mucus[J]. Adv Drug Deliv Rev, 2009, 61: 75-85. DOI:10.1016/j.addr.2008.09.008 |
| [16] |
Mucins in cancer: protection and control of the cell surface[J]. Nat Rev Cancer, 2004, 4: 45-60. DOI:10.1038/nrc1251 |
| [17] |
Rapid transport of large polymeric nanoparticles in fresh undiluted human mucus[J]. Proc Natl Acad Sci U S A, 2007, 104: 1482-1487. DOI:10.1073/pnas.0608611104 |
| [18] |
Oral drug delivery with polymeric nanoparticles: the gastrointestinal mucus barriers[J]. Adv Drug Deliv Rev, 2012, 64: 557-570. DOI:10.1016/j.addr.2011.12.009 |
| [19] |
The two mucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host–microbial interactions[J]. Proc Natl Acad Sci U S A, 2011, 108: 4659-4665. DOI:10.1073/pnas.1006451107 |
| [20] |
Intestinal epithelial cells: regulators of barrier function and immune homeostasis[J]. Nat Rev Immunol, 2014, 14: 141-153. DOI:10.1038/nri3608 |
| [21] |
P-glycoprotein inhibition for optimal drug delivery[J]. Drug Target Insights, 2013, 7: 27-34. |
| [22] |
Challenges and recent progress in oral drug delivery systems for biopharmaceuticals[J]. Pharmaceutics, 2019, 11: 129-157. DOI:10.3390/pharmaceutics11030129 |
| [23] |
Intestinal delivery of non-viral gene therapeutics: physiological barriers and preclinical models[J]. Drug Discov Today, 2011, 16: 203-218. DOI:10.1016/j.drudis.2011.01.003 |
| [24] |
Advances in oral peptide therapeutics[J]. Nat Rev Drug Discov, 2020, 19: 277-289. DOI:10.1038/s41573-019-0053-0 |
| [25] |
Mechanistic analysis of chemical permeation enhancers for oral drug delivery[J]. Pharm Res, 2008, 25: 1412-1419. DOI:10.1007/s11095-008-9542-2 |
| [26] |
Investigations of piperazine derivatives as intestinal permeation enhancers in isolated rat intestinal tissue mucosae[J]. AAPS J, 2020, 22: 33-46. DOI:10.1208/s12248-020-0416-9 |
| [27] |
Maiti S. Nanometric biopolymer devices for oral delivery of macromolecules with clinical significance [M] //Grumezescu AM. Multifunctional Systems for Combined Delivery, Biosensing and Diagnostics. Amsterdam: Elsevier, 2017: 109-138.
|
| [28] |
Current status of selected oral peptide technologies in advanced preclinical development and in clinical trials[J]. Adv Drug Deliv Rev, 2016, 106: 223-241. DOI:10.1016/j.addr.2016.02.004 |
| [29] |
Epithelial transport of drugs in cell culture. Ⅱ: Effect of extracellular calcium concentration on the paracellular transport of drugs of different lipophilicities across monolayers of intestinal epithelial (Caco-2) cells[J]. J Pharm Sci, 1990, 79: 595-600. DOI:10.1002/jps.2600790710 |
| [30] |
Cytochalasin B modulation of Caco-2 tight junction barrier: role of myosin light chain kinase[J]. Am J Physiol Gastrointest Liver Physiol, 2000, 279: 875-885. DOI:10.1152/ajpgi.2000.279.5.G875 |
| [31] |
A permeation enhancer for increasing transport of therapeutic macromolecules across the intestine[J]. J Control Release, 2013, 172: 541-549. DOI:10.1016/j.jconrel.2013.05.002 |
| [32] |
Safety and efficacy of sodium caprate in promoting oral drug absorption: from in vitro to the clinic[J]. Adv Drug Deliv Rev, 2009, 61: 1427-1449. DOI:10.1016/j.addr.2009.09.006 |
| [33] |
Absorption enhancement of acylcarnitine through changes in tight junction protein in Caco-2 cell monolayers[J]. Drug Metab Pharmacokinet, 2011, 26: 162-170. DOI:10.2133/dmpk.DMPK-10-RG-071 |
| [34] |
Absorption-enhancing effects of bile salts[J]. Molecules, 2015, 20: 14451-14473. DOI:10.3390/molecules200814451 |
| [35] |
Intestinal permeation enhancers for oral peptide delivery[J]. Adv Drug Deliv Rev, 2016, 106: 277-319. DOI:10.1016/j.addr.2016.06.005 |
| [36] |
Strategies and industrial perspectives to improve oral absorption of biological macromolecules[J]. Expert Opin Drug Deliv, 2018, 15: 223-233. DOI:10.1080/17425247.2017.1395853 |
| [37] |
Oral delivery system for two-pulse colonic release of protein drugs and protease inhibitor/absorption enhancer compounds[J]. J Pharm Sci, 2011, 100: 3251-3259. DOI:10.1002/jps.22560 |
| [38] |
The role of citric acid in oral peptide and protein formulations: relationship between calcium chelation and proteolysis inhibition[J]. Eur J Pharm Biopharm, 2014, 86: 544-551. DOI:10.1016/j.ejpb.2013.12.017 |
| [39] |
Cell-penetrating peptides: design, synthesis, and applications[J]. ACS Nano, 2014, 8: 1972-1994. DOI:10.1021/nn4057269 |
| [40] |
Cell penetrating peptides: a concise review with emphasis on biomedical applications[J]. Biomed Pharmacother, 2018, 108: 1090-1096. DOI:10.1016/j.biopha.2018.09.097 |
| [41] |
Cell penetrating peptides, novel vectors for gene therapy[J]. Pharmaceutics, 2020, 12: 225-245. DOI:10.3390/pharmaceutics12030225 |
| [42] |
The design, synthesis, and evaluation of molecules that enable or enhance cellular uptake: peptoid molecular transporters[J]. Proc Natl Acad Sci U S A, 2000, 97: 13003-13008. DOI:10.1073/pnas.97.24.13003 |
| [43] |
The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption[J]. Biomaterials, 2013, 34: 7733-7743. DOI:10.1016/j.biomaterials.2013.06.047 |
| [44] |
Effects of intestinal luminal contents and the importance of microfold cells on the ability of cell-penetrating peptides to enhance epithelial permeation of insulin[J]. Eur J Pharm Biopharm, 2020, 155: 77-87. DOI:10.1016/j.ejpb.2020.08.001 |
| [45] |
Incorporation of a nuclear localization signal in pH responsive LAH4-L1 peptide enhances transfection and nuclear uptake of plasmid DNA[J]. Mol Pharm, 2016, 13: 3141-3152. DOI:10.1021/acs.molpharmaceut.6b00338 |
| [46] |
Cellular uptake of an α-helical amphipathic model peptide with the potential to deliver polar compounds into the cell interior non-endocytically[J]. Biochim Biophys Acta, 1998, 1414: 127-139. DOI:10.1016/S0005-2736(98)00161-8 |
| [47] |
SPA: a peptide antagonist that acts as a cell-penetrating peptide for drug delivery[J]. Drug Deliv, 2020, 27: 91-99. DOI:10.1080/10717544.2019.1706669 |
| [48] |
Buccal drug delivery: a technical approach[J]. J Drug Deliv Ther, 2012, 2: 26-33. |
| [49] |
Intestinal patch systems for oral drug delivery[J]. Curr Opin Pharmacol, 2017, 36: 58-65. DOI:10.1016/j.coph.2017.08.005 |
| [50] |
Chitosan and its derivatives for application in mucoadhesive drug delivery systems[J]. Polymers (Basel), 2018, 10: 267. DOI:10.3390/polym10030267 |
| [51] |
Self-assembling bubble carriers for oral protein delivery[J]. Biomaterials, 2015, 64: 115-124. DOI:10.1016/j.biomaterials.2015.06.035 |
| [52] |
Safety and efficacy of self-assembling bubble carriers stabilized with sodium dodecyl sulfate for oral delivery of therapeutic proteins[J]. J Control Release, 2017, 259: 168-175. DOI:10.1016/j.jconrel.2016.12.018 |
| [53] |
Recent progress in drug delivery[J]. Acta Pharm Sin B, 2019, 9: 1145-1162. DOI:10.1016/j.apsb.2019.08.003 |
| [54] |
Oral drug delivery research in Europe[J]. J Control Release, 2012, 161: 247-253. DOI:10.1016/j.jconrel.2012.01.017 |
| [55] |
Lipid-based nanocarriers for oral peptide delivery[J]. Adv Drug Deliv Rev, 2016, 106: 337-354. DOI:10.1016/j.addr.2016.04.001 |
| [56] |
Targeted nanoparticles towards increased L cell stimulation as a strategy to improve oral peptide delivery in incretin-based diabetes treatment[J]. Biomaterials, 2020, 255: 120209. DOI:10.1016/j.biomaterials.2020.120209 |
| [57] |
The use of chitosan-6-mercaptonicotinic acid nanoparticles for oral peptide drug delivery[J]. Drug Deliv, 2011, 18: 190-197. DOI:10.3109/10717544.2010.522611 |
| [58] |
Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes: current perspectives and future challenges[J]. Acta Pharm Sin B, 2016, 6: 287-296. DOI:10.1016/j.apsb.2016.02.001 |
| [59] |
Self-emulsifying drug delivery systems (SEDDS): formulation development, characterization, and applications[J]. Crit Rev Ther Drug Carrier Syst, 2009, 26: 427-521. DOI:10.1615/CritRevTherDrugCarrierSyst.v26.i5.10 |
| [60] |
Comparison of the protective effect of self-emulsifying peptide drug delivery systems towards intestinal proteases and glutathione[J]. Int J Pharm, 2017, 523: 357-365. DOI:10.1016/j.ijpharm.2017.03.027 |
| [61] |
Hydrophobic ion pairing of an insulin-sodium deoxycholate complex for oral delivery of insulin[J]. Int J Nanomedicine, 2011, 6: 3049-3056. |
| [62] |
Hydrophobic ion pairing: key to highly payloaded self-emulsifying peptide drug delivery systems[J]. Int J Pharm, 2017, 520: 267-274. DOI:10.1016/j.ijpharm.2017.02.019 |
| [63] |
Development and characterization of solid self-emulsifying drug delivery system of cilnidipine[J]. Chem Pharm Bull (Tokyo), 2015, 63: 408-417. DOI:10.1248/cpb.c14-00326 |
| [64] |
Microneedles: a smart approach and increasing potential for transdermal drug delivery system[J]. Biomed Pharmacother, 2019, 109: 1249-1258. DOI:10.1016/j.biopha.2018.10.078 |
| [65] |
Recent advances of microneedles for biomedical applications: drug delivery and beyond[J]. Acta Pharm Sin B, 2019, 9: 469-483. DOI:10.1016/j.apsb.2019.03.007 |
| [66] |
An ingestible self-orienting system for oral delivery of macromolecules[J]. Science, 2019, 363: 611-615. DOI:10.1126/science.aau2277 |
| [67] |
A luminal unfolding microneedle injector for oral delivery of macromolecules[J]. Nat Med, 2019, 25: 1512-1518. DOI:10.1038/s41591-019-0598-9 |
| [68] |
New perspectives in oral peptide delivery[J]. Drug Discov Today, 2021, 26: 1097-1105. DOI:10.1016/j.drudis.2021.01.020 |
| [69] |
Antimicrobial ionic liquid‐based materials for biomedical applications[J]. Adv Funct Mater, 2021, 31: 57-84. |
| [70] |
Toxicity of ionic liquids prepared from biomaterials[J]. Chemosphere, 2014, 104: 51-56. DOI:10.1016/j.chemosphere.2013.10.055 |
| [71] |
Jiang YX, Jiang Q, Wangi D, et al. The applications of ionic liquids in drug delivery[J]. Acta Pharm Sin (药学学报), 2022, 57: 331-342. |
| [72] |
Shimoni E, Ramon O, Kopelman IJ, et al. Oral delivery of proteins and peptides: US, 20100303901 [P]. 2010-12-2.
|
| [73] |
Intestinal permeation enhancers to improve oral bioavailability of macromolecules: reasons for low efficacy in humans[J]. Expert Opin Drug Deliv, 2021, 18: 273-300. DOI:10.1080/17425247.2021.1825375 |
| [74] |
Glucose-reducing effect of the ORMD-0801 oral insulin preparation in patients with uncontrolled type 1 diabetes: a pilot study[J]. PLoS One, 2013, 8: e59524. DOI:10.1371/journal.pone.0059524 |
| [75] |
Efficacy and safety of 28-day treatment with oral insulin (ORMD-0801) in patients with type 2 diabetes: a randomized, placebo-controlled trial[J]. Diabetes Obes Metab, 2021, 23: 2529-2538. DOI:10.1111/dom.14499 |
| [76] |
Stern W, Consalvo AP. Peptide pharmaceutical for oral delivery: US, 20160339081 [P]. 2016-11-24.
|
| [77] |
Oral delivery of peptides by Peptelligence™ technology[J]. Drug Dev Delivery, 2013, 13: 36-40. |
| [78] |
A phase 3 trial of the efficacy and safety of oral recombinant calcitonin: the Oral Calcitonin in Postmenopausal Osteoporosis (ORACAL) trial[J]. J Bone Miner Res, 2012, 27: 1821-1829. DOI:10.1002/jbmr.1602 |
| [79] |
Coughlan DC, Leonard TW, Adamczyk B, et al. Solid pharmaceutical composition with enhancers and methods of preparing thereof: US, 20110182985 [P]. 2011-7-28.
|
| [80] |
Oral delivery of macromolecules: rationale underpinning Gastrointestinal Permeation Enhancement Technology (GIPET®)[J]. Ther Deliv, 2011, 2: 1595-1610. DOI:10.4155/tde.11.132 |
| [81] |
Absorption enhancement through intracellular regulation of tight junction permeability by medium chain fatty acids in Caco-2 cells[J]. J Pharmacol Exp Ther, 1998, 284: 362-369. |
| [82] |
Regulation of tight junction permeability by sodium caprate in human keratinocytes and reconstructed epidermis[J]. Biochem Biophys Res Commun, 2009, 381: 171-175. DOI:10.1016/j.bbrc.2009.02.005 |
| [83] |
MER-101-03, a multicenter, phase Ⅱ study to compare MER-101 20 mg tablets to intravenous zoledronic acid 4 mg in prostate cancer patients[J]. J Clin Oncol, 2009, 27: 5161. DOI:10.1200/jco.2009.27.15_suppl.5161 |
| [84] |
Salama P, Mamluk R, Marom K, et al. Pharmaceutical compositions and related methods of delivery: US, 8329198 [P]. 2012-12-11.
|
| [85] |
A novel suspension formulation enhances intestinal absorption of macromolecules via transient and reversible transport mechanisms[J]. Pharm Res, 2014, 31: 2010-2021. DOI:10.1007/s11095-014-1303-9 |
| [86] |
Food emulsifier polysorbate 80 promotes the intestinal absorption of mono-2-ethylhexyl phthalate by disturbing intestinal barrier[J]. Toxicol Appl Pharmacol, 2021, 414: 115411. DOI:10.1016/j.taap.2021.115411 |
| [87] |
Patient-reported outcomes of parenteral somatostatin analogue injections in 195 patients with acromegaly[J]. Eur J Endocrinol, 2016, 174: 355-362. DOI:10.1530/EJE-15-1042 |
| [88] |
Maintenance of acromegaly control in patients switching from injectable somatostatin receptor ligands to oral octreotide[J]. J Clin Endocrinol Metab, 2020, 105: 3785-3797. DOI:10.1210/clinem/dgaa526 |
| [89] |
Oral delivery of insulin with the eligen® technology: mechanistic studies[J]. Curr Drug Deliv, 2005, 2: 191-197. DOI:10.2174/1567201053586001 |
| [90] |
Intestinal permeation enhancers for oral delivery of macromolecules: a comparison between salcaprozate sodium (SNAC) and sodium caprate (C10)[J]. Pharmaceutics, 2019, 11: 78-98. DOI:10.3390/pharmaceutics11020078 |
| [91] |
Transcellular stomach absorption of a derivatized glucagon-like peptide-1 receptor agonist[J]. SciTransl Med, 2018, 10: 7047-7059. |
| [92] |
Effect of oral semaglutide compared with placebo and subcutaneous semaglutide on glycemic control in patients with type 2 diabetes: a randomized clinical trial[J]. JAMA, 2017, 318: 1460-1470. DOI:10.1001/jama.2017.14752 |
| [93] |
Oral semaglutide: a review of the first oral glucagon-like peptide 1 receptor agonist[J]. Diabetes Technol Ther, 2020, 22: 10-18. DOI:10.1089/dia.2019.0185 |
| [94] |
Ionic liquids as potential enhancers for transdermal drug delivery[J]. Int J Pharm, 2017, 516: 45-51. DOI:10.1016/j.ijpharm.2016.11.020 |
| [95] |
Transdermal insulin delivery using choline-based ionic liquids (CAGE)[J]. J Control Release, 2018, 286: 137-144. DOI:10.1016/j.jconrel.2018.07.029 |
| [96] |
Mitragotri S, Banerjee A, Brown T, et al. Ionic liquids for internal delivery: US, 20200289421 [P]. 2020-9-17.
|
| [97] |
Oral ionic liquid for the treatment of diet-induced obesity[J]. Proc Natl Acad Sci U S A, 2019, 116: 25042-25047. DOI:10.1073/pnas.1914426116 |
| [98] |
New RRC, Bogus M, Travers GN, et al. 99-LB: a phase 2b study of oral insulin (Capsulin™) administered to patients with type 2 diabetes [J/OL]. Diabetes, 2021, 70: Article 99-LB [2021-10-10].https://www.diabeteswa.com.au/wp-content/uploads/2021/06/99-lb-a-phase-2b-study-of-oral-insulin-poster.pdf.
|
| [99] |
Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome[J]. Nature, 2015, 519: 92-96. DOI:10.1038/nature14232 |
 2022, Vol. 57
2022, Vol. 57


