2. 陕西省中药绿色制造技术协同创新中心, 陕西 咸阳 712046;
3. 西安电子科技大学生命科学技术学院, 陕西 西安 710126
2. Collaborative Innovation Center of Green Manufacturing Technology for Traditional Chinese Medicine in Shaanxi Province, Xianyang 712046, China;
3. School of Life Science and Technology, Xidian University, Xi'an 710126, China
积雪草酸(asiatic acid, AA, 图 1) 是从伞形科植物积雪草中分离得到的一种具有乌苏烷型骨架的五环三萜类化合物[1]。自1971年发现积雪草酸能够治疗皮肤创伤的作用后[2], 随后对其开展了大量的研究并发现积雪草酸还具有抗菌[3]、抗肿瘤[4]、抗炎[5]、护肝[6]、改善神经认知障碍[7]、降糖[8]等多种药理活性。特别是其抗肿瘤活性被进行了广泛的研究, 目前发现积雪草酸能够有效抑制包括肝癌、乳腺癌、人舌鳞癌、卵巢癌、黑色素瘤在内的多种癌细胞的增殖[9]。更深入的机制研究发现, 积雪草酸主要通过诱导肿瘤细胞凋亡、影响肿瘤细胞周期、抑制肿瘤细胞增殖和影响肿瘤调节蛋白表达来发挥抗肿瘤效果[10]。
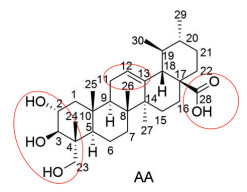
|
Figure 1 Structure of asiatic acid (AA) and its major modification sites |
虽然积雪草酸拥有多种药理活性、具有广阔的开发前景, 但是其自身药理作用弱、水溶性差、生物利用度低等缺点严格限制了其在临床上的广泛应用。为了获得药理活性更强、理化性能优良的积雪草酸衍生物, 近些年人们对积雪草酸进行了大量的结构改造[11], 以期进一步开发和应用积雪草酸及其衍生物。目前针对积雪草酸的结构改造主要是集中在A环、C环和C-28位羧基等化学反应活性位点上, 特别是对羟基和羧基同时修饰获得了大量的衍生物。本文对积雪草酸的结构修饰及生物活性研究进展进行了归纳和总结, 这一工作对今后开发新型的积雪草酸衍生物具有非常重要的意义。
1 积雪草酸的结构修饰与抗肿瘤活性 1.1 A环修饰积雪草酸A环的修饰主要是对C-2位、C-3位和C-23位羟基进行修饰或者将A环进行缩环或扩环。
1.1.1 羟基修饰积雪草酸羟基修饰主要是将其制成酯、醚或氧化成羰基及羧基。2013年Wang等[12]首先用2, 2-二甲氧基丙烷将C-3和C-23位羟基保护起来, 然后再将C-2位羟基与琥珀酸酐和苯甘氨酸反应制得了2个酯类化合物1和2 (图 2); 体外抗增殖活性研究表明, 虽然化合物1 (IC50 = 26.03 ± 2.47 μmol·L-1, 25.57 ± 0.51 μmol·L-1) 和2 (IC50 = 40.21 ± 2.01 μmol·L-1, 21.66 ± 0.97 μmol·L-1) 对人非小细胞肺癌细胞A549和PC9/G只展现出了中等的抑制活性, 但仍然显著地强于积雪草酸(IC50 > 60 μmol·L-1); 进一步的机制研究发现, 这类化合物通过下调Ras/Raf/MEK/ERK信号通路, 使得肿瘤细胞阻滞在G1/S和G2/M期。随后, 该课题组[13]以化合物1为先导化合物, 在其琥珀酸侧链上又引入了碱性的哌嗪基团得到了化合物3 (图 2)。与化合物1相比, 化合物3 (IC50 = 13.13 ± 4.37 μmol·L-1) 对A549的抑制活性提高了近2倍, 同时还对人乳腺癌细胞MCF-7 (IC50 = 7.58 ± 1.25 μmol·L-1) 和人宫颈癌细胞HeLa (IC50 = 8.13 ± 1.69 μmol·L-1) 展现出了良好的抑制活性; 进一步机制研究发现, 化合物3能够通过上调肿瘤抑制蛋白p16和p21表达以及下调细胞周期蛋白依赖性激酶1 (CDK1)、细胞周期蛋白D1 (cyclin D1) 和细胞周期蛋白B (cyclin B) 表达来发挥抗肿瘤效果。
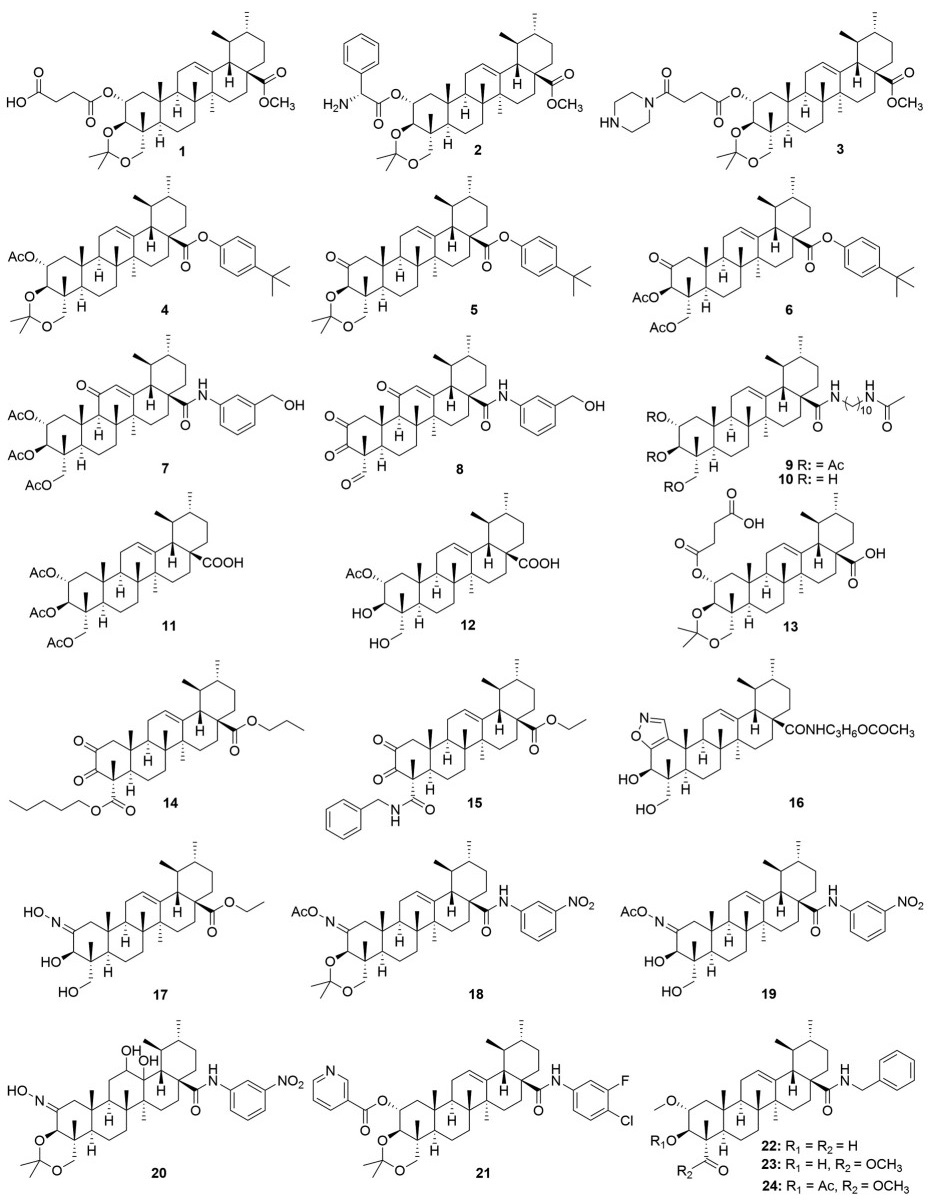
|
Figure 2 Structures of asiatic acid derivatives 1-24 with anti-tumor activity |
与此同时, 孟艳秋课题组[14]也发现积雪草酸C-2位、C-3位和C-23位羟基进行不同的保护和修饰对活性影响较大(图 2)。当C-2位羟基为乙酰基, C-3和C-23位羟基为2, 2-二甲氧基丙烷保护时(化合物4), 其抑制A549的IC50值为29.38 μmol·L-1, 但是将C-2位羟基直接氧化成羰基(化合物5, IC50 = 41.7 μmol·L-1) 后显著降低了抗肿瘤活性, 而将化合物5的C-3和C-23位羟基保护基换成乙酰基后(化合物6, IC50 = 29.6 μmol·L-1) 又能提高抗肿瘤活性。这些结果表明, C-3和C-23位羟基采用乙酰基保护有利于提高抑制A549活性。随后, 孟艳秋课题组[15]又证实了将积雪草酸的羟基进行乙酰化后抗肿瘤活性也要高于氧化。例如乙酰化衍生物7 (IC50 = 2.24 μmol·L-1) 抑制HepG2活性是积雪草酸的21.5倍, 而2, 3-二羰基-23-醛基衍生物8 (IC50 = 3.85 μmol·L-1) 抑制HepG2的活性仅是积雪草酸(IC50 = 48.15 μmol·L-1) 的12.5倍(图 2)。通过分子对接研究发现, 化合物7能够与凋亡抑制蛋白家族的survivin蛋白相互作用。这些结果表明, 积雪草酸的3个羟基乙酰化是提高抗肿瘤活性的一个有效修饰方法。的确, Van等[16]研究结果也证明了这种修饰策略能显著提高活性。例如, 化合物9抑制人口腔表皮样癌细胞KB、人肝癌细胞HepG2和人低分化肺腺癌细胞SK-LU-1的IC50值分别为1.11、1.09和1.27 μmol·L-1, 但是将其C-2、C-3和C-23位脱乙酰基(化合物10, 图 2) 后抑制这3种肿瘤细胞的IC50值则分别降到35.93、192.22和80.40 μmol·L-1; 进一步研究还发现积雪草酸衍生物的3个乙酰化基团仅保留一个也将显著降低抗肿瘤活性, 例如化合物11 (图 2) 抑制KB、HepG2和SK-LU-1的IC50值分别为36.2、39.77和89.32 μmol·L-1, 但是将其C-3和C-23位脱乙酰基(化合物12, 图 2) 后抑制这3种肿瘤细胞的IC50值则分别降到50.94、144.36和151.85 μmol·L-1, 而将C-2位乙酰基换成其他酯(化合物13) 也未能提高活性。佟贺等[17]研究发现将2, 3-二羰基-23-醛基衍生物的C-23位醛基进一步氧化成羧酸衍生物后能够提高其抗肿瘤活性。其中化合物14 (IC50 = 5.88 μmol·L-1) 和15 (IC50 = 4.03 μmol·L-1) 抑制HepG2的活性优于临床药物吉非替尼(IC50 = 21.34 μmol·L-1) (图 2)。通过分子模拟发现, 化合物14和15也能够与survivin蛋白相互作用, 其C-23的羧基均能与survivin蛋白的氨基酸残基形成氢键作用。因此, 将积雪草酸A环的羟基进行氧化, 有望得到靶向survivin的抑制剂, 通过诱导肿瘤细胞凋亡发挥抗肿瘤效果。
此外, 王楠等[18]还研究发现在积雪草酸(IC50 = 16.461 μmol·L-1) 的C-1和C-2位引入噁唑杂环(化合物16, IC50 = 8.052 μmol·L-1) 可将抑制A549活性提高2倍, 而将C-2位羟基转化成肟(化合物17, IC50 > 50 μmol·L-1) 后却丧失了抗肿瘤活性(图 2); 但是, 当C-2位肟基被乙酰化并在C-28位羧基引入其他基团又显著提高了抑制A549活性, 同时这些2-乙酰氧亚胺基衍生物还对人胃癌细胞SGC7901展现出了良好的抑制活性。其中C-28位为酰胺的衍生物活性总体要强于酯基衍生物, 例如化合物18 (图 2) 抑制SGC7901和A549的IC50值可达10.28和11.25 μmol·L-1, 分别是阳性药物吉非替尼的约2倍以及积雪草酸的4倍[19]。通过分子对接研究发现, 化合物18能够与血管内皮生长因子(VEGF) 相互作用, 其C-2位的乙酰基能与VEGF的氨基酸残基相互作用形成氢键。这也许解释了为什么将C-2位肟基乙酰化后能显著提高抗肿瘤活性。随后, 颜廷良等[20]研究表明, 脱去化合物18的C-3和C-23位羟基保护基(化合物19, 图 2) 可进一步提高抑制SGC7901 (IC50 = 9.18 μmol·L-1) 和A549 (IC50 = 8.54 μmol·L-1) 的活性。分子对接研究表明, 化合物19的C-2位羟基能够与VEGF的氨基酸残基形成氢键。与此同时, 林碧琦等[21]也对化合物18进行了修饰并发现当其C环C-12与C-13位双键改造成羟基(化合物20, 图 2) 后对A549 (IC50 = 6.43 μmol·L-1) 抑制活性提高了1.7倍。
最近, 孟艳秋课题组[22]又发现将积雪草酸C-3和C-23位羟基采用2, 2-二甲氧基丙烷保护以及C-2位引入烟酰基后能够显著提高抗肿瘤活性, 尤其是衍生物21 (图 2, IC50 = 1.82 ± 0.10 μmol·L-1) 抑制A549是积雪草酸的24.8倍; 流式细胞实验表明, 化合物21可以通过诱导A549凋亡的方式来发挥抗肿瘤效果, 进一步通过分子对接研究发现其与抗凋亡蛋白Bcl-xL有良好的结合能力, 其C-2位烟酰基的N原子能与Bcl-xL活性口袋的氨基酸残基形成氢键作用, 而进一步的酶抑制实验发现化合物21抑制Bcl-xL的IC50为0.17 μmol·L-1。这些结果表明, 在积雪草酸C-2位引入烟酰基后有望发现新型的Bcl-xL抑制剂。
在2020年, Lu等[23]在参考山楂酸的结构修饰中发现其C-28位引入苄胺后拥有良好的抗卵巢癌活性, 因此对修饰积雪草酸时也在其C-28位保留了苄胺, 同时对其A环进行修饰。首先, 将C-2位羟基进行甲基化以及C-23位和(或) C-3羟基进行氧化, 但是这种修饰并没有提高对卵巢癌的抑制活性; 令人意外的是, 这种修饰后的衍生物却对人结肠癌细胞HCT116有良好的抑制活性, 尤其是化合物22 (图 2, IC50 = 8.46 ± 1.64 μmol·L-1) 抑制HCT116的活性是积雪草酸(IC50 = 24.64 ± 3.26 μmol·L-1) 的2.9倍。接着, 以化合物22为先导化合物进行修饰, 虽然将其C-23位醛基进一步氧化成羧基后活性降低了2倍, 但是进一步将羧基进行酯化(化合物23, 图 2, IC50 = 3.07 ± 1.48 μmol·L-1) 后抑制HCT116的活性显著提高, 是先导化合物22的2.7倍; 而将化合物23的C-23位酯基换成酰胺, 尽管也保留了良好的HCT116抑制活性, 但是这种酰胺修饰后抗肿瘤活性仍然低于酯基化合物23; 进一步将化合物23的C-2位羟基乙酰化(化合物24, 图 2, IC50 = 1.08 ± 0.66 μmol·L-1) 后活性可再提高2.8倍, 而将化合物24的C-23位酯基转化成酰胺后却没有提高活性, 事实上大部分酰胺化合物反而丧失了抗肿瘤活性。随后, 通过测试发现化合物24还对人卵巢癌细胞A2780 (IC50 = 1.28 ± 0.32 μmol·L-1)、HepG2 (IC50 = 1.43 ± 0.32 μmol·L-1)、人急性白血病细胞HL-60 (IC50 = 0.47 ± 0.08 μmol·L-1) 和MCF-7 (IC50 = 3.99 ± 1.21 μmol·L-1) 有良好的抑制活性, 而对正常的脐静脉内皮细胞HUVEC没有抑制活性。
1.1.2 缩环修饰积雪草酸缩环修饰主要是将其的A环由六元环缩为五元环(图 3), 目前这种修饰策略主要是Gonçalves课题组在研究。2016年, 该课题组[24]首先将积雪草酸C-28位羧基进行酯化得到先导化合物25 (图 3), 其(IC50 = 27.50 ± 2.50 μmol·L-1) 抑制HeLa的活性较积雪草酸(IC50 = 52.47 ± 0.06 μmol·L-1) 提高了2倍; 随后将化合物25的A环变成五元环后(化合物26, IC50 = 0.6 ± 0.07 μmol·L-1) 对HeLa细胞的抑制活性进一步提高了46倍; 然而, 将化合物26的C-2位醛基用氰基取代(化合物27, IC50 = 8.90 ± 0.53 μmol·L-1) 活性则降低了14倍, 但化合物27的抗肿瘤活性仍然是先导化合物25的3倍; 而在化合物26的C环引入羰基(化合物28, IC50 = 0.3 ± 0.02 μmol·L-1) 后活性提高了2倍; 进一步将化合物26和28的羟基修饰成磺酸酯(化合物29和30) 后还能进一步提高抑制HeLa活性。随后也发现化合物28~30抑制人白血病T淋巴细胞Jurkat、人前列腺癌细胞PC-3、人胰腺癌细胞MiaPaca-2和A-375的IC50值均在纳摩尔水平。这些结果表明, 将积雪草酸A环缩成五元环能够显著提高抗肿瘤活性。
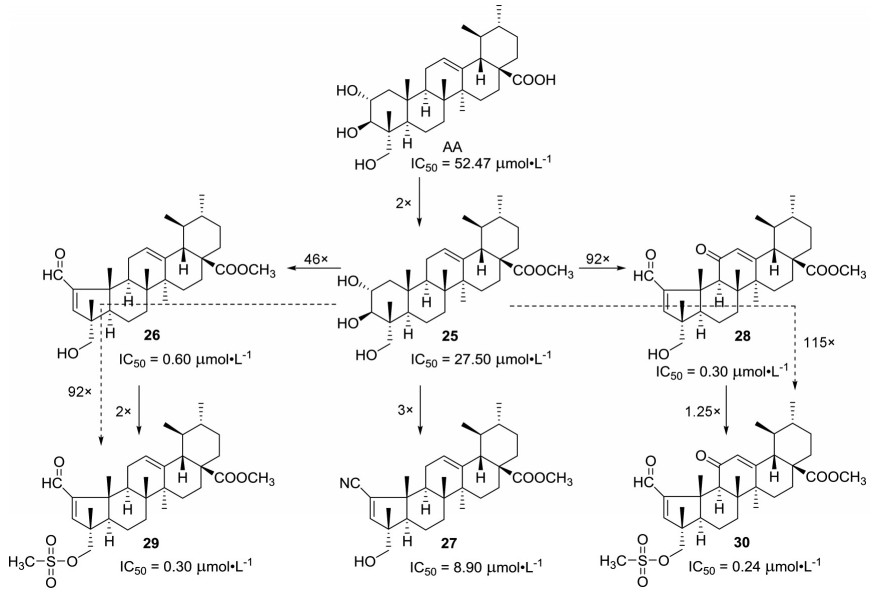
|
Figure 3 Structures of asiatic acid derivatives 25-30 with anti-tumor activity |
2016年, Gonçalves课题组[25]继续对积雪草酸的A环进行修饰(图 4), 以化合物26的羧基衍生物(化合物31) 为先导化合物, 首先将化合物31的醛基还原成羟基得到了2-羟基衍生物32, 但是化合物32 (IC50 = 45.00 ± 1.55 μmol·L-1) 抑制HeLa细胞的活性较化合物31 (IC50 = 5.30 ± 0.20 μmol·L-1) 降低了约9倍。虽然将化合物32的羟基进行乙酰化(化合物33, IC50 = 22.50 ± 0.75 μmol·L-1) 后提高了1倍的抑制HeLa细胞活性, 但仍然显著低于先导化合物31。进一步将烷基胺、咪唑或者苄胺衍生物通过酰胺反应引入到化合物33的羧基或者将羧酸转化成肟酸后, 尽管活性有所提高, 但是大部分衍生物活性仍然低于先导化合物31, 仅化合物34 (IC50 = 4.54 ± 0.84 μmol·L-1) 的活性略高于化合物31, 但仍然是积雪草酸的11.6倍。这些结果表明, 将积雪草酸衍生物的羟基进行乙酰化也许能提高抑制HeLa活性。因此, Gonçalves课题组随后直接通过乙酰化修饰积雪草酸, 将其C-2、C-3和C-23位3个羟基乙酰化得到了化合物35 (IC50 = 6.10 ± 0.28 μmol·L-1), 其抑制HeLa细胞的活性与化合物31相当, 但是从结构上看, 化合物35更简单, 仅通过一步反应就能合成。接着, 将化合物35的羧基转化成肟酸(化合物36, IC50 = 1.62 ± 0.10 μmol·L-1) 后可进一步提高抗肿瘤活性, 是积雪草酸的32.4倍。随后的机制研究发现, 化合物36能将HeLa细胞阻滞在G0/G1期。
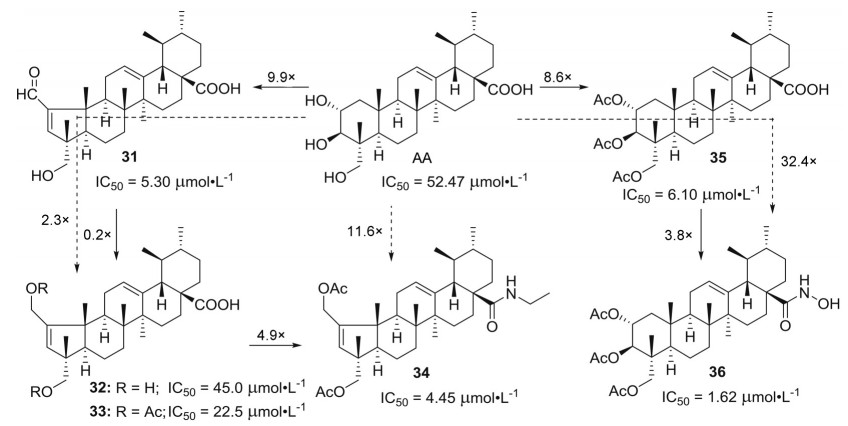
|
Figure 4 Structures of asiatic acid derivatives 31-36 with anti-tumor activity |
Gonçalves课题组[26]在前期研究的基础上继续对积雪草酸进行结构修饰(图 5), 首先直接将积雪草酸的C环与C-28位羧基进行内酯化得到了化合物37 (IC50 = 60.17 ± 2.75 μmol·L-1), 但是这种修饰却没有提高抑制HeLa细胞活性。考虑到前期研究将积雪草酸的羟基进行乙酰化或者A环缩成五元环能提高抗肿瘤活性, 随后又将化合物37的羟基进行了乙酰化(化合物38, IC50 = 4.43 ± 0.25 μmol·L-1) 和缩环(化合物39, IC50 = 1.08 ± 0.04 μmol·L-1)。的确, 这两种结构修饰后抑制HeLa细胞活性较化合物37分别提高了13.6和55.7倍; 进一步将化合物38的内酯转化为内酰胺后(化合物40, IC50 = 2.37 ± 0.15 μmol·L-1) 抗肿瘤活性又提高了近2倍; 同时, 将化合物39的羟基进行酯化或者酰胺化也能提高抗肿瘤活性, 但总的来说成酯的活性高于酰胺衍生物, 例如酯衍生物41 (IC50 = 0.67 ± 0.07 μmol·L-1) 抑制HeLa活性是化合物39的1.6倍和积雪草酸的78.3倍。进一步的机制研究表明, 化合物41能够上调p21cip1/waf1和p27kip1表达、下调cyclin E/CDK2和cyclin D3-CDK4/6表达, 使HeLa细胞阻滞在G0/G1期。
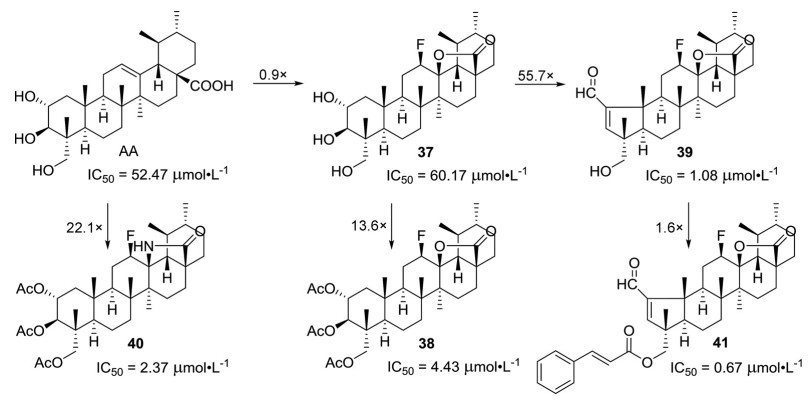
|
Figure 5 Structures of asiatic acid derivatives 37-41 with anti-tumor activity |
A环扩环修饰是五环三萜类化合物常见的一种修饰方法, 通常是将含氮杂环如吲哚、吡嗪等引入A环来提高生物活性[27]。2020年, 孟艳秋课题组[28]通过分析survivin配体YM155和SC144与活性口袋的相互作用发现吡嗪是一个重要的药效团, 而该课题组前期研究发现积雪草酸衍生物具有抑制survivin活性, 因此该课题组将吡嗪基引入到了积雪草酸的A环, 构建出了吡嗪并积雪草酸和喹喔啉并积雪草酸2个系列的衍生物。这些含吡嗪基的衍生物抑制HepG2和SGC-7901的活性显著的强于积雪草酸。其中化合物42和43 (图 6) 抑制这两种肿瘤细胞的IC50值均低于10 μmol·L-1, 其抗肿瘤活性是积雪草酸的6倍以上。但是, 将化合物43的酰胺基换成酯基则显著降低抗肿瘤活性, 例如酯基衍生物44 (图 6) 抑制HepG2和SGC-7901的IC50值均大于18 μmol·L-1。随后通过分子对接也发现, 化合物42和43能够很好地嵌入到survivin活性口袋, 其中吡嗪基还能与活性口袋的氨基酸残基形成氢键作用。随后, 李孝孝等[29]又对化合物43进行修饰, 在其C环引入羰基形成α, β-不饱和酮结构, 得到的衍生物45抑制HepG2活性较先导化合物43提高了1.3倍, 而当化合物45的酰胺键转化为酯基(化合物46, 图 6) 则明显降低抗肿瘤活性, 但是化合物46抑制HepG2的活性仍然高于C环无α, β-不饱和酮结构的化合物42。这些研究结果表明, 在积雪草酸衍生物的C环引入α, β-不饱和酮结构或C-28位为酰胺有利于提高抑制HepG2活性。
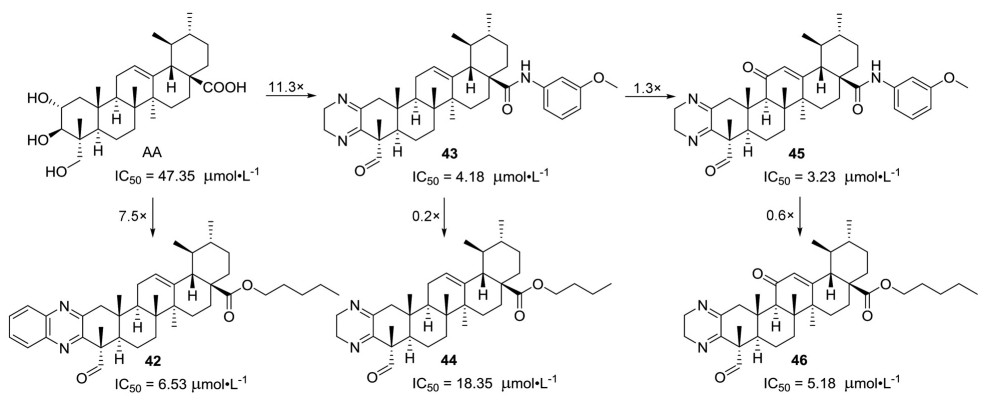
|
Figure 6 Structures of asiatic acid derivatives 42-46 with anti-tumor activity |
在五环三萜类化合物的修饰中, 将A环打开后其抗肿瘤活性一般要优于母体化合物[30]。因此, 在2017年, 孟艳秋课题组[31]采用高碘酸钠将积雪草酸A环打开, 再将C-28羧基进行酯化或者制成酰胺衍生物(图 7)。总体来看, 积雪草酸开环修饰能够提高抑制SGC-7901和A549的活性, 其中酰胺衍生物活性要优于酯基化合物。例如酰胺化合物47抑制SGC-7901和A549的IC50值分别为15.35和19.23 μmol·L-1, 而酯基系列活性最佳的化合物48抑制这两种肿瘤细胞的IC50则分别为25.46和20.10 μmol·L-1; 但是, 将开环衍生物的C-23羟基进行乙酰化后能进一步提高活性。例如化合物47乙酰化后(化合物49) 抑制SGC-7901和A549的IC50值降低到了10.18和8.32 μmol·L-1, 而化合物48乙酰化后(化合物50) 抑制SGC-7901和A549的IC50值也降低到了20.39和11.10 μmol·L-1。
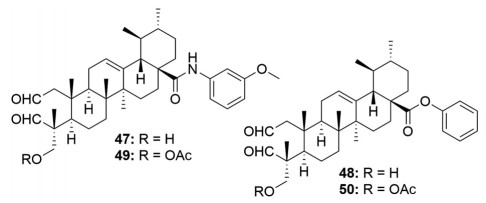
|
Figure 7 Structures of asiatic acid derivatives 47-50 with anti-tumor activity |
积雪草酸的C环修饰主要是在其C-12位引入取代基, 其中以在C-12位引入羰基构建出α, β-不饱和酮的研究最多。早在2011年, 赵龙铉等[32]就将羰基引入到了积雪草酸的C环得到了化合物51 (IC50 = 6.611 μmol·L-1), 虽然该化合物对MCF-7展现出了良好抑制活性, 但是其活性却低于C-12位无羰基的化合物52 (IC50 = 4.390 μmol·L-1), 而进一步将化合物51的C-28位甲酯还原成羧基(化合物53, IC50 > 100 μmol·L-1) 后又丧失了活性(图 8)。这些结果预示着在积雪草酸C环构建α, β-不饱和酮也许并不能显著地提高活性。随后, 孟艳秋课题组[33]也发现在三乙酰基积雪草酸衍生物C-12位上引入羰基也没显著提高抗肿瘤活性。例如化合物54抑制HeLa (IC50 = 0.65 ± 0.32 μmol·L-1) 和BGC823 (IC50 = 0.12 ± 0.26 μmol·L-1) 的IC50值均在纳摩尔水平, 但是在C-12位引入羰基后(化合物55) 抗肿瘤活性却降低了至少40倍(图 8)。随后, 孟艳秋课题组[34]又将C环羰基修饰和A环的乙酰化修饰进行了比较, 结果发现C环羰基修饰并没有像A环乙酰化修饰那样起着决定性的作用(图 8)。例如, 在5个乙酰化衍生物中活性最佳衍生物(化合物56) 抑制HeLa和HepG2的IC50值分别为4.81和6.53 μmol·L-1, 而进一步在其C环引入羰基修饰后并没有显著地提高活性, 在这些羰基衍生物中活性最佳的化合物55抑制这两种肿瘤细胞的IC50值也仅与化合物56相当; 但是, 当乙酰基被水解成羟基后活性却显著降低, 所得到的羟基衍生物抑制肿瘤细胞的IC50值均大于10 μmol·L-1。尽管在积雪草酸及衍生物的C-12位引入羰基并不能明显增加抗肿瘤活性, 但是将羰基转化成肟基或用溴取代却能显著提高活性[35]。例如肟基化合物57 (IC50 = 1.077 5 μmol·L-1) 和溴代化合物58 (IC50 = 1.204 μmol·L-1) 抑制HT-1080的活性是积雪草酸(IC50 > 50 μmol·L-1) 的40倍以上。
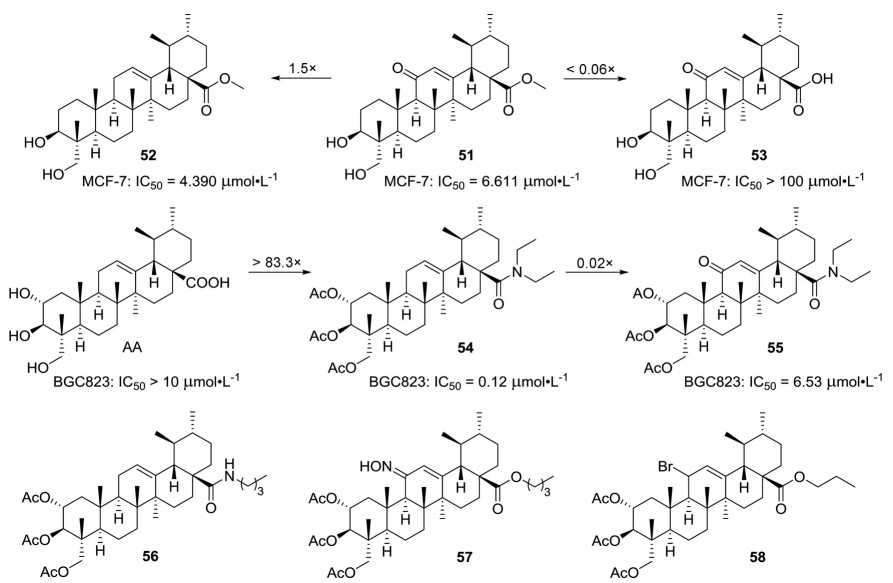
|
Figure 8 Structures of asiatic acid derivatives 51-58 with anti-tumor activity |
积雪草酸C-28羧基修饰主要是将积雪草酸与其他活性化合物的羟基或者氨基反应制成酯或酰胺衍生物。但是, 大量的研究表明, 积雪草酸C-28的酯化修饰普遍来说并没有显著提高抗肿瘤活性, 而经过酰胺修饰得到的衍生物常常展现出良好的抗肿瘤活性。因此, 相对来说, 将积雪草酸制成酰胺衍生物的研究要明显多于酯化物。
1.3.1 酯化修饰早在2008年, 陈海生[36]就通过酯键将积雪草酸和有机铂进行偶联, 构建出了2个积雪草酸衍生物59和60 (图 9), 随后的体内抗肿瘤活性研究表明这类化合物对Lewis肺癌有显著的抗肿瘤效果。2017年, Pattnaik等[37]根据药物拼合原理通过点击化学将积雪草酸与熊果酸进行偶联得到了酯化物61 (图 9), 其对乳腺癌MCF-7 (IC50 = 12.8 ± 2.1 μmol·L-1) 和MDA-MB-231 (IC50 = 7.4 ± 1.9 μmol·L-1) 均展现出了良好的抑制活性, 并强于先导化合物积雪草酸(MCF-7: IC50 = 19.1 ± 0.9 μmol·L-1; MDA-MB-231: IC50 = 18.1 ± 0.6 μmol·L-1) 与熊果酸(MCF-7: IC50 = 21.0 ± 1.0 μmol·L-1; MDA-MB-231: IC50 = 11.1 ± 1.3 μmol·L-1)。
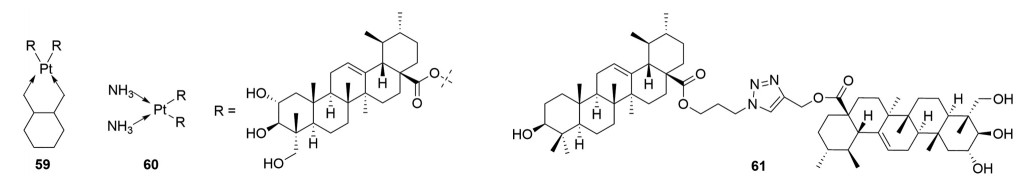
|
Figure 9 Structures of asiatic acid derivatives 59-61 with anti-tumor activity |
酰胺修饰是积雪草酸及其衍生物最常见的一种结构改造策略。早在2014年, Li课题组[38]就直接将芳胺引入到了12-羰基积雪草酸的C-28位上, 构建出了20个积雪草酸酰胺衍生物(图 10)。这些衍生物具有广谱的抗肿瘤效果且对正常HUVEC没有毒性, 尤其是化合物62对MGC-803 (IC50 = 14.33 ± 0.25 μmol·L-1)、NCI-H460 (IC50 = 23.58 ± 0.31 μmol·L-1)、HepG2 (IC50 = 5.97 ± 0.34 μmol·L-1)、HeLa (IC50 = 28.18 ± 0.083 μmol·L-1) 和BEL-7404 (IC50 = 14.13 ± 0.16 μmol·L-1) 的抑制活性均强于阳性药物5-氟尿嘧啶。随后的抗肿瘤机制研究表明, 化合物62可通过上调HepG2细胞中的Bax、caspase-3和caspase-9蛋白表达、下调Bcl-2蛋白表达来发挥肿瘤效果。随后, 该课题组[39]又将抗肿瘤药效团α-氨基膦酸酯活性单元引入到三乙酰基积雪草酸衍生物中构建出了20个积雪草酸衍生物。这些衍生物对人膀胱癌细胞T24展现出了良好的抑制活性。通过构效关系研究发现, 膦酸酯单元上苯环的取代基和位置对活性影响较大, 以卤素在苯环的邻位取代较佳, 其中活性最佳化合物63 (IC50 = 6.59 ± 0.16 μmol·L-1) 抑制T24的活性是积雪草酸(IC50 = 33.72 ± 1.25 μmol·L-1) 的5倍; 同时还发现, 在这些衍生物的C环引入羰基也没有显著地提高抗肿瘤活性。例如化合物64抑制T24的IC50值为17.81 μmol·L-1, 而在其C环引入羰基(化合物65, IC50 = 33.72 ± 1.25 μmol·L-1) 后反而降低了抗肿瘤活性。但是, 随后作者[40]又发现在保留C环羰基结构下, 通过点击化学构建的积雪草酸三氮唑衍生物能抑制核因子κB (NF-κB) 蛋白, 而且C-2、C-3和C-23位为羟基的化合物活性要高于乙酰基衍生物。其中活性最强的化合物66 (图 10) 抑制NF-κB的KD值达到了0.36 μmol·L-1。通过分子对接研究发现, 化合物66的C-2和C-23羟基能够与NF-κB活性口袋的氨基酸残基ASP291和ARG295形成氢键作用。这也许解释了为什么羟基衍生物抑制NF-κB活性要强于乙酰基化合物的原因。随后的抗肿瘤活性研究表明, 化合物66对T24、HepG2、A549、人大细胞肺癌细胞NCI-H460和耐Dox的NCI-H460这五种肿瘤细胞均展现出了良好的抑制活性, 其IC50分别为3.96、5.24、2.67、4.46和4.84 μmol·L-1。这些研究结果表明, 积雪草酸衍生物可作为NF-κB抑制剂来发挥抗肿瘤效果。
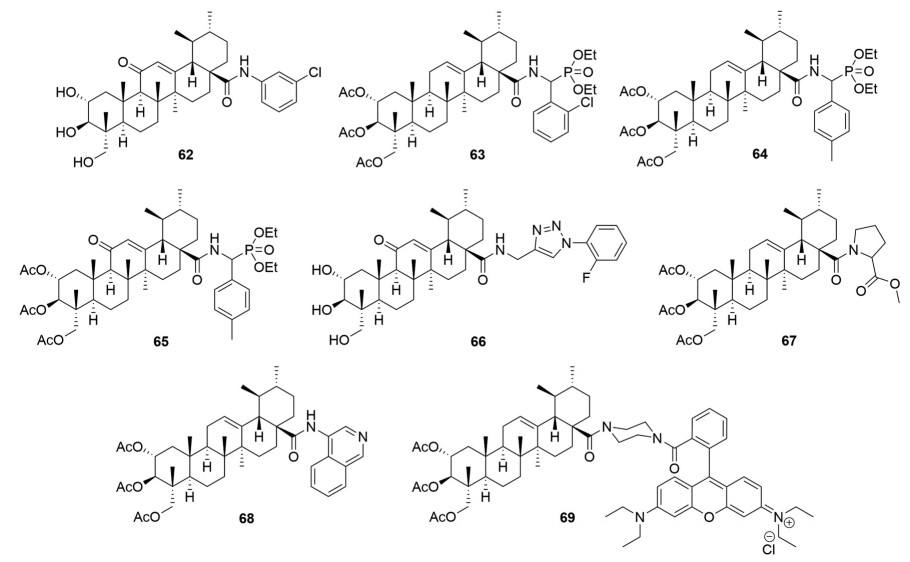
|
Figure 10 Structures of asiatic acid derivatives 62-69 with anti-tumor activity |
2015年, Jing等[41]将各种氨基酸通过酰胺反应直接引入到了积雪草酸C-28位上, 但是绝大部分积雪草酸氨基酸衍生物抗肿瘤活性弱于积雪草酸, 而将这些衍生物的羟基进行乙酰化后却显著提高了抗肿瘤活性。其中化合物67 (图 10) 抑制A549 (IC50 = 2.4 ± 0.4 μmol·L-1)、B16F10 (IC50 = 4.2 ± 0.2 μmol·L-1)、HeLa (IC50 = 4.8 ± 0.3 μmol·L-1)、HepG2 (IC50 = 0.9 ± 0.3 μmol·L-1)、SGC7901 (IC50 = 4.6 ± 0.1 μmol·L-1)、MCF-7 (IC50 = 4.5 ± 0.1 μmol·L-1) 和PC3 (IC50 = 9.2 ± 2.0 μmol·L-1) 的活性是积雪草酸的4倍以上。进一步的机制研究发现, 化合物67是一个多靶点抑制剂, 能够阻滞肿瘤细胞在G0/G1期, 下调cyclin D1、周期依赖性激酶CDK4以及抑制信号传导与转录激活因子3 (STAT3)[42, 43]。
2016年, Sommerwerk课题组[44]发现将5-氨基喹啉引入到2, 3, 23-三乙酰基积雪草酸中可使得到的酰胺衍生物68 (图 10) 抑制人黑素瘤细胞518A2、人结肠癌细胞HT29、MCF-7、A549和A2780的IC50值达到了纳摩尔水平, 分别为0.19、0.22、0.54、0.29和0.08 μmol·L-1; 而当2, 3, 23-三乙酰基积雪草酸与罗丹明B偶联后(化合物69, 图 10)[45], 其抑制518A2 (IC50 = 0.006 ± 0.002 μmol·L-1)、A2780 (IC50 = 0.008 ± 0.002 μmol·L-1)、HT29 (IC50 = 0.017 ± 0.013 μmol·L-1) 和MCF-7 (IC50 = 0.012 ± 0.002 μmol·L-1) 的活性较积雪草酸提高了至少1 500倍。
1.4 其他修饰上述的积雪草酸修饰均是通过形成新的共价键获得新型积雪草酸衍生物, 除此之外, 近些年还开发了一些新的方法来修饰积雪草酸以期获得活性优良的衍生物。例如, 张蓉仙等[46]将积雪草酸与同样具有抗肿瘤活性的稀土硝酸盐配合获得了3种积雪草酸配合物LnAA (NO3)3•3C2H5OH•nH2O (Ln = La, Ce, Eu), n = 1或2。体外抗肿瘤活性研究表明, 这些配合物抑制ECa-109的活性是积雪草酸的2倍, 而其IC50值却均大于27 μmol·L-1, 但这类化合物可直接作用于线粒体, 这为肿瘤的线粒体靶向药物的研发提供了参考。此外, 为了解决积雪草酸水溶性差难以穿透血脑屏障问题, Garanti等[47]用甘油酯将其包裹制成了固体纳米脂质体。虽然这种积雪草酸脂质体具有好的水溶性并能精准靶向脑胶质瘤细胞, 但由于积雪草酸的装载率不足6%, 使得该脂质体抗肿瘤活性反而低于积雪草酸。
通过上述的文献调研, 可以得出积雪草酸的结构修饰与抗肿瘤活性的构效关系(图 11): ①将积雪草酸的C-2、3和23位羟基同时进行乙酰化能够显著提高抗肿瘤活性, 仅1或2个羟基被乙酰化并不能明显提高活性; ②将积雪草酸的C-2羟基转化成肟降低活性, 但进一步转化成乙酰肟基可明显增强活性; ③将积雪草酸的C-3和23位的羟基与2, 2-二甲氧基丙烷反应制成醚能显著提高活性; ④将积雪草酸的C-23位羟基氧化成羧酸后对活性影响不大, 但是进一步修饰成羧酸酯后能明显提高活性, 且酯类衍生物活性通常高于酰胺类衍生物; ⑤将积雪草酸的A环缩成五元环有利于提高活性; ⑥在积雪草酸的A环并吡嗪、喹喔啉等杂环可提高活性; ⑦将积雪草酸的A环进行开环后能增强活性; ⑧在积雪草酸的C-11位引入羰基形成α, β-不饱和酮不能明显增强活性; ⑨在积雪草酸的C-11位引入肟基或卤素溴原子能明显增强活性; ⑩将积雪草酸C-12和C-13位之间的双键加成形成C-12和C13位二羟基也能提高活性; ⑪ 将积雪草酸C-13位与C-28位羧基进行反应形成内酯化合物可提高活性; ⑫ 将积雪草酸C-28位羧基修饰成酰胺化合物活性通常高于对应的酯类化合物。
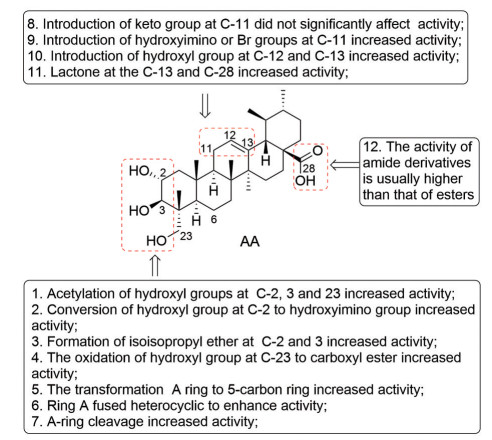
|
Figure 11 Schematic representation of the structure-activity relationship of asiatic acid for the antiproliferative activity |
积雪草酸及其衍生物主要是通过抑制糖原磷酸化酶和α-葡萄糖苷酶来发挥抗糖尿病作用。早在2009年Zhang等[48]就对积雪草酸开展了结构修饰期望得到对糖原磷酸化酶具有良好抑制活性的衍生物, 首先将积雪草酸的C-2、C-3和C-23位羟基进行乙酰化(图 12), 但是乙酰化衍生物11 (IC50 = 33 ± 2.9 μmol·L-1) 抑制糖原磷酸化酶的活性较积雪草酸(IC50 = 17 ± 1.2 μmol·L-1) 降低了近2倍, 而在积雪草酸C-28位引入不同的氨基酸片段(化合物70) 甚至丧失了活性; 随后发现, 将积雪草酸修饰成酯能够有效地抑制糖原磷酸化酶, 其中苄酯衍生物活性要强于烷基酯衍生物。例如, 苄酯化合物71抑制糖原磷酸化酶的IC50值为3.8 μmol·L-1, 而烷基酯(化合物72, IC50 = 173 ± 27.4 μmol·L-1) 衍生物的IC50值均高于100 μmol·L-1; 但是, 将化合物71的C-2位α-OH转化为β-OH (化合物73, IC50 = 55 ± 3.2 μmol·L-1) 后活性降低了14倍; 同样地, 直接将积雪草酸C-2位α-OH转化为β-OH (化合物74, IC50 = 93 ± 7.1 μmol·L-1) 后活性也降低了5倍。这表明积雪草酸的C-2位α-OH是抑制糖原磷酸化酶活性的药效团。与此同时, Wen等[49]通过分子模拟发现积雪草酸C-3和C-23位羟基能够与糖原磷酸化酶活性口袋的氨基酸残基Gln72和Asp42′形成氢键作用, 同时C-2位羟基能够与Gln72形成范德华力。这也许解释了为什么将积雪草酸3个羟基进行乙酰化修饰或者将C-2位α-OH转化为β-OH后均降低了活性。此外, 还发现将积雪草酸进行糖基化(化合物75, 图 12) 也将丧失活性。
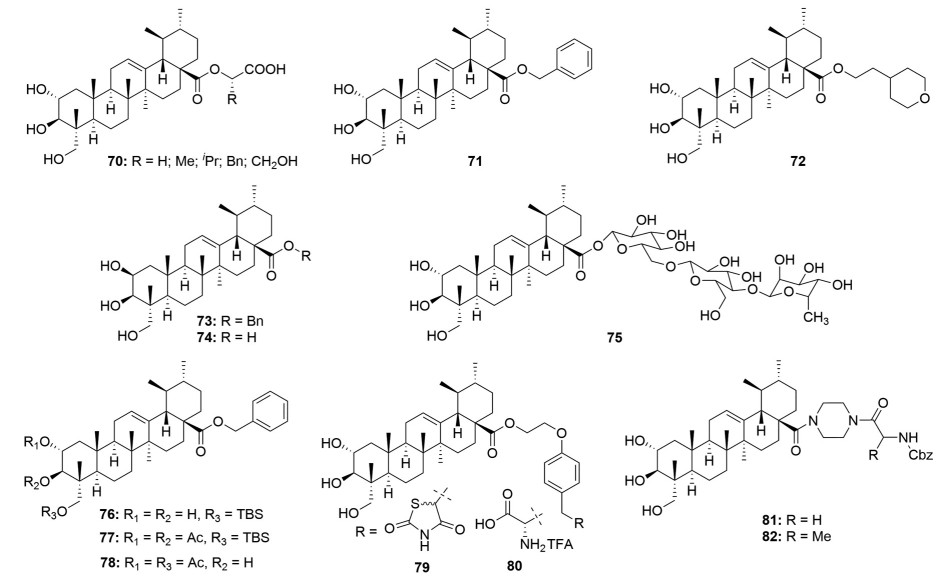
|
Figure 12 Structures of asiatic acid derivatives 70-82 with anti-diabetes activity |
在2016年, 王友德等[50]也证实了苄酯化合物71抑制糖原磷酸化酶的活性要优于积雪草酸的活性; 同时, 将化合物71的一个羟基、二个羟基或者三个羟基进行修饰(化合物76~78, 图 12) 均降低了活性, 并低于先导化合物积雪草酸。与此同时, 该课题组还根据药效团拼合原理将同样具有抗糖尿病活性的噻唑烷二酮和L-酪氨酸单元引入到积雪草酸的C-28位。但是, 这两个衍生物(化合物79、80, 图 12) 抑制糖原磷酸化酶的活性均低于积雪草酸[51, 52]。
除了上述以糖原磷酸化酶为靶点开发了部分具有抗糖尿病潜力的积雪草酸衍生物外, 一些以α-葡萄糖苷酶为靶点的积雪草酸衍生物也被发现了。例如, 在2020年Ahn等[53]从Actinidia arguta中分离出了5个对α-葡萄糖苷酶有优秀抑制活性的香豆酰积雪草酸衍生物。在2021年, Huang等[54]通过哌嗪连接键(linker) 将2种N-苄氧羰基-L-氨基酸偶联到了积雪草酸的C-28位获得了2个具有α-葡萄糖苷酶抑制活性的衍生物(化合物81和82, 图 12)。但是, 化合物81 (IC50 = 1 505 ± 19 μmol·L-1) 和82 (IC50 = 1 193 ± 22 μmol·L-1) 的活性仅是积雪草酸(IC50 = 214 ± 25 μmol·L-1) 的20%。
3 积雪草酸结构修饰与抗肝纤维化活性肝纤维化是一种由诸如酒精中毒性肝炎、乙型或丙型肝炎病毒感染等引起的慢性肝损伤疾病, 若肝纤维化持续发展将演变成肝硬化、肝癌, 最终导致肝衰竭, 造成患者死亡。早在上个世纪90年代就已经报道了五环三萜化合物具有护肝作用[55]。在2004年Dong等[56]报道了积雪草酸(EC50 = 29.80 μg·mL-1) 能够通过抑制肝星状细胞(HSC-T6) 发挥抗肝纤维作用, 并获得了积雪草酸衍生物抑制HSC-T6的构效关系(化合物83, 图 13): ①将积雪草酸的C-2位羟基修饰成苄酯、甲醚、乙酰基或氧化成羰基及羧基均不能明显提高活性, 而将其转化成氰基(CN) 可显著提高活性; ② C-3和C-23位羟基引入体积大的基团(例如用2, 2-二甲氧基丙烷将C-3和C-23位羟基保护) 有利于提高活性; ③ C环的C-11位引入羰基降低活性; ④ C-28位连接糖单元或者将羧基还原成醇均降低活性。在这些衍生物中, 化合物84 (EC50 = 5.56 μg·mL-1) 展现出了最强的HSC-T6抑制活性, 是积雪草酸的5倍。机制研究表明, 这类化合物可以通过抑制胶原脯氨酸4-羟化酶、组织金属蛋白酶抑制因子2 (TIMP2) 和转化生长因子β1 (TGF-β1) 等多条途径来抑制肝星状细胞。随后, Jeong等[57]又研究了积雪草酸及C-2位修饰后衍生物对氨基半乳糖(GaIN) 和四氯化碳(CCl4) 致急性肝损伤的保护作用。研究发现, 当积雪草酸C-2位羟基被氧化成羰基(化合物85) 或者直接消除(化合物86) 后, 所得到的衍生物在10 μmol·L-1的浓度下护肝效果优于先导化合物积雪草酸和阳性药物水飞蓟素。
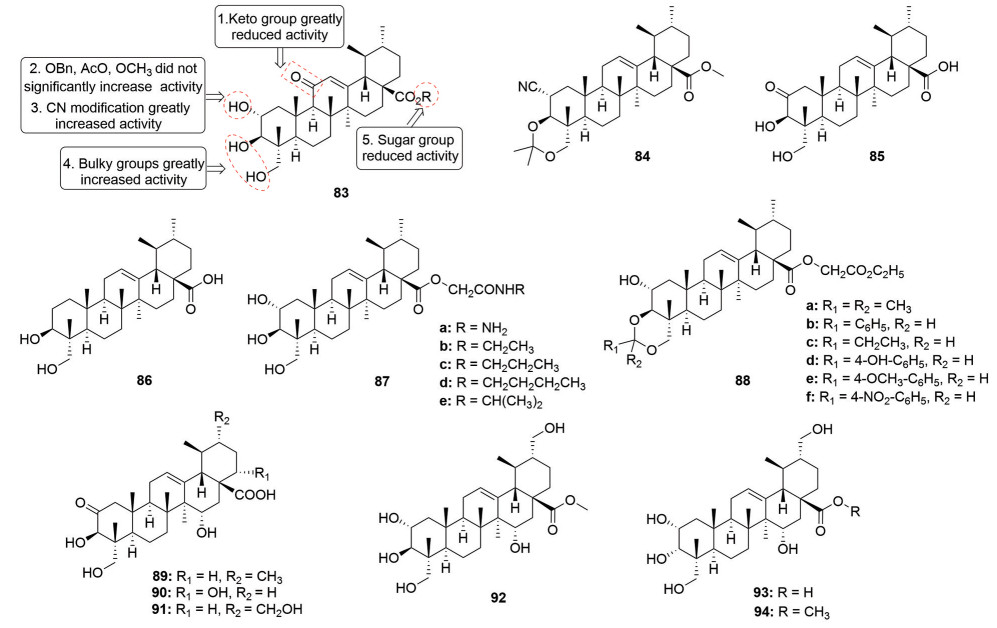
|
Figure 13 Structures of asiatic acid derivatives 83-94 with anti-fibrotic activity |
在2015年, Li等[58]通过对积雪草酸C-28位羧基和A环羟基修饰获得了2个系列的积雪草酸衍生物(化合物87和88, 图 13), 在四氯化碳致急性肝损伤模型中发现这些衍生物可以通过降低血清中天门冬氨酸氨基转氨酶(AST) 和丙氨酸氨基转移酶(ALT) 含量来发挥抗肝纤维化作用。从结构上看, 在化合物87中C-28位的烷基为正丁基(化合物87d) 降低AST及ALT的效果强于其他基团; 在化合物88中以苯环上含有吸电子基团(化合物88f) 活性较佳。最近, Guo等[59]通过微生物转化的方法也构建出了一系列具有抗肝纤维化的多羟基积雪草酸衍生物(化合物89~94, 图 13)。虽然这些衍生物可通过抑制丙型肝炎病毒(HCV) 感染来发挥作用, 但是这些化合物抗HCV的活性均不高, 而且化合物中羟基的个数和位置对活性影响均不大。因此, 还需要对积雪草酸采用其他修饰来进一步提高其抗HCV活性。
4 积雪草酸结构修饰与促进创面愈合创面愈合是一个连续而又复杂的过程, 虽然正常情况下伤口在一定时间内能够自愈, 但是在自身免疫能力低或者创面受感染将会造成伤口经久不愈, 长期以来科研人员一直在寻找促进创面愈合的药物。在60年代就有研究报道积雪草酸具有创面愈合的作用[60]。随后的机制研究表明, 积雪草酸可以通过增加细胞的迁移存活率、促进血管再生、促进皮肤成纤维细胞增殖以及Ⅰ型胶原蛋白和纤维连接蛋白的合成等方式来促进伤口愈合[61, 62]; 同时, 积雪草酸可激活细胞外信号转导激酶(ERK) 信号通路来加速伤口受损神经元的修复[63]; 此外, 积雪草酸还可激活过氧化物酶体增殖物激活受体-γ (PPAR-γ) 来下调TGF-β1和纤溶酶原激活物抑制剂-1 (PAI-1) mRNA的表达、上调Smad-7 mRNA的表达来抑制瘢痕增生[64]。
在2006年, Jeong[65]对积雪草酸进行了结构修饰, 首先将积雪草酸的C-3和C-23位羟基进行醚化、再将C-28位羧基进行酯化, 尽管这种修饰得到的衍生物活性均低于先导化合物积雪草酸, 但构效关系表明短链甲酯(化合物95, 图 14) 和甲基乙醚酯(化合物96, 图 14) 衍生物活性要优于其他长链酯衍生物。随后, 将化合物95和96的C-2位羟基氧化成酮(化合物97和98) 又进一步提高了活性(图 14), 尤其是羰基衍生物98的HT50 (治疗50%创伤面所需时间) 值要低于先导化合物积雪草酸。这些结果表明, C-2位羟基氧化有利于促进创面愈合。
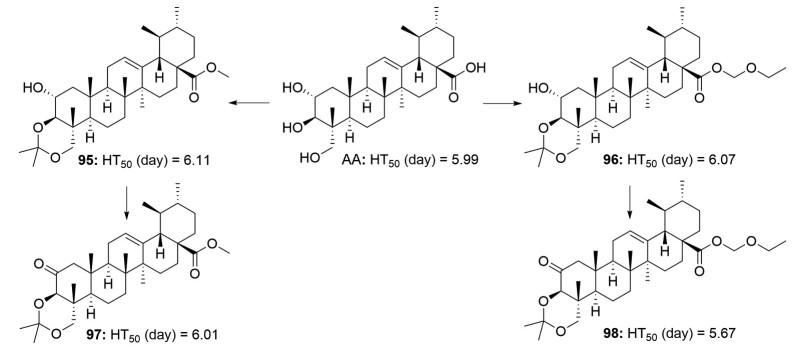
|
Figure 14 Structures of asiatic acid derivatives 95-98 with activity of promoting wound healing |
老年痴呆症, 又称阿尔茨海默病, 是一种严重危害人类健康的中枢神经退行性疾病。早在1999年, Mook-Jung等[66]就发现积雪草酸可抑制β-淀粉样蛋白(Aβ) 的表达, 并认为积雪草酸是一种治疗老年痴呆症的潜在有效药物。随后的机制研究表明, 积雪草酸还可通过抗神经细胞凋亡[67]、抗氧化应激[68]、抑制tau蛋白异常磷酸化[69]、抑制乙酰胆碱酯酶(AChE) 活性[70]以及抑制炎症反应[7]等作用机制来发挥抗老年痴呆症活性。
尽管积雪草酸可通过下调丝氨酸蛋白酶HtrA2/Omi表达、上调Bax、caspase 3表达以及ERK1/2的去磷酸化、激活PI3K/Akt/GSK-3β信号通路等多条途径来发挥抗老年痴呆症作用, 但是对积雪草酸进行结构优化以增强其抗老年痴呆症活性的研究却甚少。目前仅有Jew等[71]在2000年报道的一项研究, 即合成了一系列具有抑制Aβ活性的积雪草酸衍生物。通过构效关系发现, 这些积雪草酸衍生物C-28位酯基类型对活性影响较大, 其中甲酯(化合物25, 图 3) 和长链烷基酯衍生物99 (图 15) 活性仅是积雪草酸的一半左右, 而当甲酯换成四氢吡喃基(化合物100, 图 15) 后活性与积雪草酸相当; 将积雪草酸的C-2位羟基进行乙酰化(化合物12, 图 2)、氧化(化合物85, 图 13) 或C-3位和C-23位羟基进行醚化(化合物101和102, 图 15) 以及脱羟基[化合物86 (图 13) 和103 (图 15)] 均明显地降低了活性。
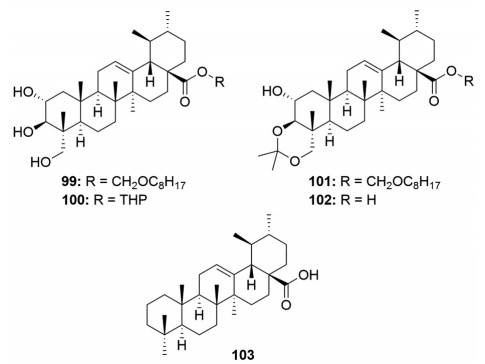
|
Figure 15 Structures of asiatic acid derivatives 99-103 with anti-Alzheimer's disease activity |
从天然产物中寻找到具有生物活性的先导化合物、再对其进行结构修饰, 以提高其生物活性或改善其理化性能已成为当前新药研发的一个重要并有效的策略[72, 73]。尽管积雪草酸来源广泛且具有多种药理活性, 但是溶解性差、作用靶点缺乏导致生物利用度低等缺点使其临床应用受到了限制。因此, 对积雪草酸进行结构修饰来提高其成药性已成为天然药物开发领域中的一个热点研究。
从上述的文献综述也可以发现, 目前对积雪草酸结构修饰已开展了大量的工作, 例如对其C-2、C-3和C-23位羟基进行乙酰化或C-28位羧基形成酰胺能显著地提高抗肿瘤活性; 将积雪草酸用甘油酯包裹能提高其血脑屏障穿透性。但是, 目前研究人员大多只关注积雪草酸衍生物的抗肿瘤活性, 而对其他药理活性的研究较少, 这使得积雪草酸类新药开发具有一定的局限性。此外, 目前对积雪草酸衍生物作用靶点的研究也相对较少。
因此, 未来对积雪草酸的结构修饰需要进行更广泛的研究, 获得一些有益的构效关系, 以便更加有利于对积雪草酸进行合理的修饰和改造; 同时, 还需要扩大积雪草酸及其衍生物的生物活性筛选类型, 并对其作用机制和靶点进行更深入的研究。希望本文的归纳、总结能对积雪草酸相关新药的研发提供参考。
作者贡献: 刘斌、唐文强、仝红娟和朱周静负责综述的撰写及修改; 唐初负责论文的指导与审阅。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Li CW, Zhang H, Rao P, 等. Research progress on biosynthesis pathway of pentacyclic triterpenoids in plants[J]. Chin Tradit Herb Drugs (中草药), 2021, 52: 3436-3452. |
| [2] |
Beljanski M, Vapaille N. Role of triterpenes in the binding of L-amino acids by matricial RNA[J]. Rev Rur Etud Clin Biol, 1971, 16: 897-905. |
| [3] |
Sycz Z, Tichaczek-Goska D, Jezierska-Domaradzka A, et al. Are uropathogenic bacteria living in multispecies biofilm susceptible to active plant ingredient-asiatic acid?[J]. Biomolecules, 2021, 11: 1754. DOI:10.3390/biom11121754 |
| [4] |
Li J, Chen K, Huang J, et al. Asiatic acid induces endoplasmic reticulum stress and activates the Grp78/IRE1α/JNK and calpain pathways to inhibit tongue cancer growth[J]. Front Pharmacol, 2021, 12: 690612. DOI:10.3389/fphar.2021.690612 |
| [5] |
Qian XP, Zhang XH, Sun LN, et al. Corosolic acid and its structural analogs: a systematic review of their biological activities and underlying mechanism of action[J]. Phytomedicine, 2021, 91: 153696. DOI:10.1016/j.phymed.2021.153696 |
| [6] |
He LF, Guo CC, Peng C, et al. Advances of natural activators for Nrf2 signaling pathway on cholestatic liver injury protection: a review[J]. Eur J Pharmacol, 2021, 910: 174447. DOI:10.1016/j.ejphar.2021.174447 |
| [7] |
Wong JH, Barron AM, Abdullah JM. Mitoprotective effects of Centella asiatica (L.) Urb.: anti-inflammatory and neuroprotective opportunities in neurodegenerative disease[J]. Front Pharmacol, 2021, 12: 687935. DOI:10.3389/fphar.2021.687935 |
| [8] |
Fang M, Wan W, Li Q, et al. Asiatic acid attenuates diabetic retinopathy through TLR4/MyD88/NF-κB p65 mediated modulation of microglia polarization[J]. Life Sci, 2021, 277: 119567. DOI:10.1016/j.lfs.2021.119567 |
| [9] |
Islam MT, Ali ES, Uddin SJ, et al. Anti-cancer effects of asiatic acid, a triterpene from Centilla asiatica L: a review[J]. Anticancer Agents Med Chem, 2020, 20: 536-547. DOI:10.2174/1871520619666191211103006 |
| [10] |
Gou BJ, Ling CQ. Anti-tumor effect of asiatic acid and its mechanism[J]. Chin J Cancer Biother (中国肿瘤生物治疗杂志), 2019, 26: 597-601. |
| [11] |
Wu YJ, Du SX, Mei Y, 等. Research progress of antitumor activities of asiatic acid and its derivatives[J]. Contemp Chem Ind (当代化工), 2021, 50: 1200-1204. |
| [12] |
Wang L, Xu J, Zhao CH, et al. Antiproliferative, cell-cycle dysregulation effects of novel asiatic acid derivatives on human non-small cell lung cancer cells[J]. Chem Pharm Bull, 2013, 61: 1015-1123. DOI:10.1248/cpb.c13-00328 |
| [13] |
Zhao CH, Zhang CL, Shi JJ, et al. Design, synthesis, and biofunctional evaluation of novel pentacyclic triterpenes bearing O-[4-(1-piperazinyl)-4-oxo-butyryl moiety as antiproliferative agents[J]. Bioorg Med Chem Lett, 2015, 25: 4500-4504. DOI:10.1016/j.bmcl.2015.08.076 |
| [14] |
Meng YQ, Zhao MJ, Zhang Y, 等. Synthesis of asiatic acid C2, C3, and C28 derivatives and their antitumor activities derivatives[J]. Drugs Clin (现代药物与临床), 2015, 30: 355-361. |
| [15] |
Meng YQ, Cui HB, Li L, et al. Synthesis and antitumor activity evaluation of asiatic acid derivatives as survivin inhibitor[J]. J Asian Nat Prod Res, 2018, 20: 897-908. DOI:10.1080/10286020.2017.1405940 |
| [16] |
Van LT, Thi ONV, Van CT, et al. Synthesis of asiatic acid derivatives and their cytotoxic activity[J]. Med Chem Res, 2018, 27: 1609-1623. DOI:10.1007/s00044-018-2176-y |
| [17] |
Tong H, Li XX, Ning WF, 等. Synthesis and antitumor activity of asiatic acid derivatives in vitro[J]. Chin J Med Chem (中国药物化学杂志), 2019, 29: 10-17. |
| [18] |
Wang N, Zhang M, Meng YQ. Synthesis and characterization of asiatic acid derivatives and its anti-tumor activities[J]. J Shenyang Univ Chem Technol (沈阳化工大学学报), 2015, 29: 242-248. |
| [19] |
Lin BQ, Meng YQ. Synthesis of 2-acetoxyimio asiatic acid derivatives and their antitumor activity[J]. Chin New Drugs J (中国新药杂志), 2020, 29: 2221-2228. |
| [20] |
Yan TL, Lin BQ. Synthesis and antitumor activity of asiatic acid A ring derivatives based on VEGF target[J]. Chin J Med Chem (中国药物化学杂志), 2022, 32: 1-7. |
| [21] |
Lin BQ, Meng YQ. Synthesis and in vitro antitumor activity of asiatic acid analogues[J]. J Shenyang Univ Chem Technol (沈阳化工大学学报), 2021, 35: 323-328. |
| [22] |
Meng YQ, Du LH, Mei Y. Synthesis and biological activity of asiatic acid derivatives based on Bcl-xL target[J]. Chin J Med Chem (中国药物化学杂志), 2020, 30: 526-536. |
| [23] |
Lu YH, Chen MC, Liu F, et al. Synthesis and cytotoxic activity of novel C-23-modified asiatic acid derivatives[J]. Molecules, 2020, 25: 3709. DOI:10.3390/molecules25163709 |
| [24] |
Gonçalves BMF, Salvador JAR, Marín S, et al. Synthesis and biological evaluation of novel asiatic acid derivatives with anticancer activity[J]. RSC Adv, 2016, 6: 3967-3985. DOI:10.1039/C5RA19120C |
| [25] |
Gonçalves BMF, Salvador JAR, Santos DSM, et al. Design, synthesis, and biological evaluation of novel asiatic acid derivatives as potential anticancer agents[J]. RSC Adv, 2016, 6: 39296-39309. DOI:10.1039/C6RA04597A |
| [26] |
Gonçalves BMF, Salvador JAR, Marín S, et al. Synthesis and anticancer activity of novel fluorinated asiatic acid derivatives[J]. Eur J Med Chem, 2016, 114: 101-117. DOI:10.1016/j.ejmech.2016.02.057 |
| [27] |
Liu GZ, Li JX, Shi LJ, 等. Advances in the study of structural modification and biological activities of ursolic acid[J]. Chin J Org Chem (有机化学), 2021, 41: 2974-2989. |
| [28] |
Meng YQ, Tong H, Li XX, et al. Synthesis and anti-tumor activity of derivatives of ring A of asiatic acid[J]. J Asian Nat Prod Res, 2020, 22: 689-700. DOI:10.1080/10286020.2019.1616693 |
| [29] |
Li XX, He T, Meng YQ. Synthesis and antitumor activity of A-ring derivatives of asiatic acid[J]. J Shenyang Univ Chem Technol (沈阳化工大学学报), 2020, 34: 9-17. |
| [30] |
Tang C, Chen Y, Bai S, 等. Advances in the study of structural modification and biological activities of oleanolic acid[J]. Chin J Org Chem (有机化学), 2013, 33: 46-65. |
| [31] |
Meng YQ, Zhang WC, Ning ZT, 等. Synthesis and anti-tumor activity of novel asiatic acid A ring-cleavage derivatives in vitro[J]. Chin New Drugs J (中国新药杂志), 2017, 26: 1157-1162. |
| [32] |
Zhao LX, Tian MZ, Jin LJ, 等. Synthesis and characterization of derivatives of asiatic acid and primary study on anti-tumor activity[J]. Chin J Org Chem (有机化学), 2011, 31: 646-652. |
| [33] |
Meng YQ, Li YY, Li FQ, et al. Synthesis and antitumor activity evaluation of new asiatic acid derivatives[J]. J Asian Nat Prod Res, 2012, 14: 844-855. DOI:10.1080/10286020.2012.699961 |
| [34] |
Meng YQ, Zhang LF, Zhang Y, 等. Synthesis and anti-tumor activity of asiatic acid derivatives[J]. Chemistry (化学通报), 2015, 78: 358-363. |
| [35] |
Xue J, Wang N, Meng YQ. Synthesis and anti-tumor activity of asiatic acid derivatives[J]. J Shenyang Univ Chem Technol (沈阳化工大学学报), 2014, 28: 24-31. |
| [36] |
Chen HS. Organic acid platinum salt and its preparation method and application in preparing anticancer drugs: CN, 101289467A[P]. 2008-10-22.
|
| [37] |
Pattnaik B, Lakshmi JK, Kavitha R, et al. Synthesis, structural studies, and cytotoxic evaluation of novel ursolic acid hybrids with capabilities to arrest breast cancer cells in mitosis[J]. J Asian Nat Prod Res, 2017, 19: 260-271. DOI:10.1080/10286020.2016.1240169 |
| [38] |
Li JF, Huang RZ, Yao GY, et al. Synthesis and biological evaluation of novel aniline-derived asiatic acid derivatives as potential anticancer agents[J]. Eur J Med Chem, 2014, 86: 175-188. DOI:10.1016/j.ejmech.2014.08.003 |
| [39] |
Huang ZR, Wang CY, Li JF, et al. Synthesis, antiproliferative and apoptosis-inducing effects of novel asiatic acid derivatives containing α-aminophosphonates[J]. RSC Adv, 2016, 6: 62890-62906. DOI:10.1039/C6RA11397D |
| [40] |
Huang ZR, Liang GB, Li MS, et al. Synthesis and discovery of asiatic acid based 1, 2, 3-triazoles derivatives as antitumor agents blocking NF-κB activation and cell migration[J]. MedChemComm, 2019, 10: 584-597. DOI:10.1039/C8MD00620B |
| [41] |
Jing Y, Wang G, Ge Y, et al. Synthesis, anti-tumor and anti-angiogenic activity evaluations of asiatic acid amino acid derivatives[J]. Molecules, 2015, 20: 7309-7324. DOI:10.3390/molecules20047309 |
| [42] |
Jing Y, Wang G, Ge Y, et al. AA-PMe, a novel asiatic acid derivative, induces apoptosis and suppresses proliferation, migration, and invasion of gastric cancer cells[J]. Onco Targets Ther, 2016, 9: 1605-1621. |
| [43] |
Wang G, Jing Y, Cao L, et al. A novel synthetic asiatic acid derivative induces apoptosis and inhibits proliferation and mobility of gastric cancer cells by suppressing STAT3 signaling pathway[J]. Onco Targets Ther, 2016, 10: 55-66. DOI:10.2147/OTT.S121619 |
| [44] |
Sommerwerk S, Heller L, Kuhfs J, et al. Selective killing of cancer cells with triterpenoic acid amides-the substantial role of an aromatic moiety alignment[J]. Eur J Med Chem, 2016, 122: 452-464. DOI:10.1016/j.ejmech.2016.06.053 |
| [45] |
Kahnt M, Wiemann J, Fischer L, et al. Transformation of asiatic acid into a mitocanic, bimodal-acting rhodamine B conjugate of nanomolar cytotoxicity[J]. Eur J Med Chem, 2018, 159: 143-148. DOI:10.1016/j.ejmech.2018.09.066 |
| [46] |
Zhang RX, Zhu Y, Guo WJ, 等. Study on the synthesis and antitumor properties of asiatic acid lanthanide complexes to target mitochondria[J]. Chem Reagents (化学试剂), 2009, 31: 961-963. |
| [47] |
Garanti T, Stasik A, Burrow AJ, et al. Anti-glioma activity and the mechanism of cellular uptake of asiatic acid-loaded solid lipid nanoparticles[J]. Int J Pharm, 2016, 500: 305-315. DOI:10.1016/j.ijpharm.2016.01.018 |
| [48] |
Zhang L, Chen J, Gong Y, et al. Synthesis and biological evaluation of asiatic acid derivatives as inhibitors of glycogen phosphorylases[J]. Chem Biodiv, 2009, 6: 864-874. DOI:10.1002/cbdv.200800092 |
| [49] |
Wen X, Sun H, Liu J, et al. Naturally occurring pentacyclic triterpenes as inhibitors of glycogen phosphorylase: synthesis, structure-activity relationships, and X-ray crystallographic studies[J]. J Med Chem, 2008, 51: 3540-3554. DOI:10.1021/jm8000949 |
| [50] |
Wang YD, Zhang LY. Synthesis and evaluation of natural compounds of pentacyclic triterpenes as inhibitors of glycogen phosphorylase[J]. Guangzhou Chem Ind (广州化工), 2016, 44: 59-61. |
| [51] |
Wang YD, Yang ZW, Zhang LY. Synthesis and pentacyclic triterpenes bearing L-tyrosine and their inhibitory activity against glycogen phosphorylase[J]. Food Drug (食品与药品), 2016, 18: 156-160. |
| [52] |
Yan ZW, Wang YD, Zhang LY. Synthesis and activity of asiatic acid- thiazolidinedione conjugates[J]. J Chengde Med Univ (承德医学院学报), 2016, 33: 322-323. |
| [53] |
Ahn JH, Park Y, Yeon SW, et al. Phenylpropanoid-conjugated triterpenoids from the leaves of Actinidia arguta and their inhibitory activity on α‑glucosidase[J]. J Nat Prod, 2020, 83: 1416-1423. DOI:10.1021/acs.jnatprod.9b00643 |
| [54] |
Huang JX, Zang XF, Yang WY, et al. Pentacyclic triterpene carboxylic acids derivatives integrated piperazine-amino acid complexes for α-glucosidase inhibition in vitro[J]. Bioorg Chem, 2021, 115: 105212. DOI:10.1016/j.bioorg.2021.105212 |
| [55] |
Liu J, Liu Y, Mao Q, et al. The effects of 10 triterpenoid compounds on experimental liver injury in mice[J]. Fundam Appl Toxicol, 1994, 22: 34-40. DOI:10.1006/faat.1994.1005 |
| [56] |
Dong MS, Jung SH, Kim HJ, et al. Structure-related cytotoxicity and anti-hepatofibric effect of asiatic acid derivatives in rat hepatic stellate cell-line, HSC-T6[J]. Arch Pharm Res, 2004, 27: 512-517. DOI:10.1007/BF02980124 |
| [57] |
Jeong BS, Lee MK, Kim YC, et al. Modification of C2 functional group on asiatic acid and the evaluation of hepatoprotective effects[J]. Arch Pharm Res, 2007, 30: 282-289. DOI:10.1007/BF02977607 |
| [58] |
Li Y, Yang F, Yuan MX, et al. Synthesis and evaluation of asiatic acid derivatives as anti-fibrotic agents: structure/activity studies[J]. Steroids, 2015, 96: 44-49. DOI:10.1016/j.steroids.2014.11.001 |
| [59] |
Guo ZH, Gao RR, Dong XR, et al. Selective oxidation-reduction and esterification of asiatic acid by Pestalotiopsis microspora and anti-HCV activity[J]. Phytochem Lett, 2017, 19: 108-113. DOI:10.1016/j.phytol.2016.12.014 |
| [60] |
Lawrence JC. The morphological and pharmacological effects of asiaticoside upon skin in vitro and in vivo[J]. Eur J Pharmacol, 1967, 1: 414-424. DOI:10.1016/0014-2999(67)90104-5 |
| [61] |
Ruksiriwanich W, Khantham C, Sringarm K, et al. Depigmented Centella asiatica extraction by pretreated with supercritical carbon dioxide fluid for wound healing application[J]. Processes, 2020, 8: 277. DOI:10.3390/pr8030277 |
| [62] |
Lv JW, Sharma A, Zhang T, et al. Pharmacological review on asiatic acid and its derivatives: a potential compound[J]. SLAS Technol, 2018, 23: 111-127. DOI:10.1177/2472630317751840 |
| [63] |
Soumyanath A, Zhong YP, Gold SA, et al. Centella asiatica accelerates nerve regeneration upon oral administration and contains multiple active fractions increasing neurite elongation in-vitro[J]. J Pharm Pharmacol, 2005, 57: 1221-1229. |
| [64] |
Bian DF, Zhang JZ, Wu X, et al. Asiatic acid isolated from Centella asiatica inhibits TGF-β1-induced collagen expression in human keloid fibroblasts via PPAR-γ activation[J]. Int J Biol Sci, 2013, 9: 1032-1042. DOI:10.7150/ijbs.7273 |
| [65] |
Jeong BS. Structure-activity relationship study of asiatic acid derivatives for new wound healing agent[J]. Arch Pharm Res, 2006, 29: 556-562. DOI:10.1007/BF02969264 |
| [66] |
Mook-Jung I, Shin JE, Yun SH, et al. Protective effects of asiaticoside derivatives against beta-amyloid neurotoxicity[J]. J Neurosci Res, 1999, 58: 417-425. DOI:10.1002/(SICI)1097-4547(19991101)58:3<417::AID-JNR7>3.0.CO;2-G |
| [67] |
Zhang XN, Wu JY, Dou Y, et al. Asiatic acid protects primary neurons against C2-ceramide-induced apoptosis[J]. Eur J Pharmacol, 2012, 679: 51-59. DOI:10.1016/j.ejphar.2012.01.006 |
| [68] |
Ahmad Rather M, Justin-Thenmozhi A, Manivasagam T, et al. Asiatic acid attenuated aluminum chloride-induced tau pathology, oxidative stress and apoptosis via AKT/GSK-3β signaling pathway in wistar rats[J]. Neurotox Res, 2019, 35: 955-968. DOI:10.1007/s12640-019-9999-2 |
| [69] |
Cheng W, Chen W, Wang P, et al. Asiatic acid protects differentiated PC12 cells from Aβ25-35-induced apoptosis and tau hyperphosphorylation via regulating PI3K/Akt/GSK-3β signaling[J]. Life Sci, 2018, 208: 96-101. DOI:10.1016/j.lfs.2018.07.016 |
| [70] |
Jusril NA, Muhamad Juhari ANN, Abu Bakar SI, et al. Combining in silico and in vitro studies to evaluate the acetylcholinesterase inhibitory profile of different accessions and the biomarker triterpenes of Centella asiatica[J]. Molecules, 2020, 25: 3353. DOI:10.3390/molecules25153353 |
| [71] |
Jew SS, Yoo CH, Lim DY, et al. Structure-activity relationship study of asiatic acid derivatives against beta amyloid (A beta)-induced neurotoxicity[J]. Bioorg Med Chem Lett, 2000, 10: 119-121. DOI:10.1016/S0960-894X(99)00658-7 |
| [72] |
Duan YT, Meng LH. Research progress in multi-targeted anti-tumor natural products[J]. Acta Pharm Sin (药学学报), 2021, 56: 403-413. |
| [73] |
Fu ZP, Zhou ZX, Liu XY, 等. Advances in the study of antiviral natural products[J]. Acta Pharm Sin (药学学报), 2020, 55: 703-719. |
 2022, Vol. 57
2022, Vol. 57


