2. 中国药科大学药学院, 江苏 南京 211198
2. School of Pharmacy, China Pharmaceutical University, Nanjing 211198, China
阿尔茨海默症(Alzheimer's disease, AD) 也称老年痴呆症, 是在老年人群中的一种慢性、进行性的神经退行性疾病, 最早在1907年由Alois Alzheimer医生提出, 该疾病表现为认知能力下降, 包括短期记忆丧失、语言障碍和执行功能障碍等[1]。随着中国老龄化问题逐渐严重, 预计在2050年我国AD患者数量将超过3 000万, 是2020年的2倍[2], 而全球AD患者数量将增加到1.52亿[3]。从病理学角度看, AD的特征是细胞外淀粉样蛋白(amyloid beta, Aβ) 的聚集形成斑块和Tau蛋白过度磷酸化导致的神经纤维缠结。AD的发生和发展主要包括细胞凋亡、氧化应激、神经炎症、线粒体功能障碍和胆碱功能障碍等。目前大型制药企业主要以降低Aβ和Tau蛋白作为策略, 但至今尚未找到逆转AD疾病进程的有效治疗方式。然而在当前的临床前药效评价中还存在许多动物模型和评价方法上的缺陷, 因此难以进行临床转化[4]。
中医药在治疗慢性疾病方面有得天独厚的优势。在我国早已有对AD相关症状的记载, 例如在《灵枢·调经论》中提到“血并于下, 气并于上, 乱而善忘。”另外在《灵枢·天年》中提到: “六十岁, 心气始衰, 若忧悲, 血气懈惰, 故好卧。七十岁, 脾气虚, 皮肤枯。八十岁, 肺气衰, 魄离, 故言善误。”说明随着年龄的增加, 体内气血消耗过尽会导致记忆认知功能下降和语言功能障碍等症状。中医讲究辨证论治, 以益肾填精, 养心健脾达到以求痰瘀标实得化, 肾中精髓得充, 以期“邪尽正复, 神明复主”之效[5]。中医药文化是中华民族的灿烂瑰宝, 在疾病的预防和治疗方面有独特优势。近年来越来越多的科研人员开始探究中药中活性成分对阿尔茨海默症临床应用的科学性和有效性。本文主要综述了目前临床上治疗AD的研究进展和活性天然产物治疗AD的机制研究, 为今后AD药物研发提供参考。
1 治疗AD的临床研究进展 1.1 小分子药物治疗根据AD发病机制, 治疗药物可分为以下几类: 乙酰胆碱酯酶(AChE) 抑制剂、非竞争性N-甲基-D-天冬氨酸受体(NMDA) 拮抗剂、天冬氨酸蛋白酶β位点淀粉样前体蛋白裂解酶1 (BACE1) 抑制剂、抗炎类药物及调节肠道菌群药物。美国食品药品监督管理局(Food and Drug Administration, FDA) 批准用于治疗AD的AChE抑制剂主要有他克林、多奈哌齐、卡巴拉汀及加兰他敏, 而NMDA拮抗剂只有美金刚。以上药物主要以改善AD的症状为主, 还难以逆转疾病的进程。BACE1是Aβ产生的限速酶, 设计针对BACE1的抑制剂是一种很有前景的治疗方法。但在临床研究中有部分BACE1抑制剂的临床试验存在认知恶化或其他安全问题而不得不终止项目。对于一些BACE1抑制剂临床试验的失败似乎还需进一步加深对Aβ和BACE1生理学过程的理解[6]。胡文辉研究团队[7, 8]设计的神经炎症抑制剂GIBH-130 (AD16, 哌哒甲酮片) 在AD模型小鼠中显示可有效减少Aβ斑块沉积且可减轻Aβ沉积导致的神经胶质细胞激活。近期刚完成的Ⅰ期临床试验结果显示AD16具有良好的安全性和耐受性, 有希望成为我国首个针对神经炎症开发的AD新药。研究发现肠道菌群失调促使神经炎症的发生, 从海洋褐藻中提取的有效成分可通过调节肠道菌群治疗AD[9]。由上海药物研究所和绿谷制药联合自主研发的新药甘露特钠(GV-971) 于2019年1月2日在我国上市。但目前对于肠道菌群和中枢神经系统之间的关联尚未完全阐明, 因此对于临床有效性还需进一步观察。
1.2 免疫治疗AD免疫疗法可分为主动免疫治疗和被动免疫治疗, 其中最具有代表性的是疫苗和单克隆抗体。目前针对AD的免疫疗法主要以Aβ和Tau蛋白为靶点, 刺激机体产生特异性中和抗体或直接往体内注入特异性抗体阻止这一类致病物质聚集。早期疫苗(AN1792) 是以人工合成的Aβ1-42为抗原, 虽然用同源肽在转基因小鼠上有效减少了斑块[10], 但在临床研究中发现有6%患者出现脑膜炎症状导致项目被迫终止[11]。因此研究人员开始致力于研究只产生针对表位特异性抗体而避免产生T细胞反应的疫苗。几种靶向Aβ1-42的N端的第二代Aβ疫苗正在探索中, 如CAD106和UB-311。CAD106是一种将Aβ1-6的短肽偶联到噬菌体Qβ上的病毒样颗粒疫苗, 在转基因鼠中可产生特异性体液免疫反应而不激活T细胞且显著减少淀粉样蛋白沉积[12]。Ⅰ期和Ⅱ期临床研究中显示CAD106安全性好且产生可耐受的体液免疫反应[13, 14]。另一个第二代Aβ疫苗UB-311包含2个靶向Aβ1-14的B细胞表位, 分别与2个辅助型T细胞表位连接, 在所有患者中都产生特异性抗体且在部分轻度患者中出现认知能力改善的趋势[15]。此外还有一些针对Tau蛋白的疫苗研究正在进行中, 如AADvac-1。AADvac-1是由Tau294-305序列和匙孔血蓝蛋白(KLH) 载体结合而得的, 对转基因大鼠接种后可有效减少Tau蛋白过度磷酸化[16]。临床研究显示AADvac-1疫苗具有较好的安全性, 但仍需进一步扩大试验来验证临床疗效[17]。除了疫苗激活主动免疫治疗外, 直接向体内注射特异性抗体的被动免疫也被用于免疫治疗。随着抗体技术的不断发展, 特别是单克隆抗体已被应用到多种疾病的治疗当中。近期美国FDA通过加速审批通道批准了由百健(Biogen) 生物制药公司和卫材(Eisai) 生物制药公司联合研发的aducanumab用于治疗AD[18]。虽然aducanumab对于AD的治疗带来了很多争议, 药物的有效性仍需进一步研究, 但为今后靶向Aβ药物的研发带来了希望。除了针对Aβ靶点的被动免疫治疗, 还有靶向Tau蛋白的单克隆抗体临床试验正在进行, 如ABBV-8E12[19]。AD免疫治疗被认为是一种具有潜力的治疗方法, 但免疫治疗对认知功能的改善及是否可为健康者提供预防性接种还需进一步研究。
1.3 其他治疗方法除了小分子治疗和免疫治疗外, 目前临床上还报道了几种治疗方法, 如干细胞疗法、血浆治疗及激素疗法等。这里主要介绍2种比较新颖的治疗方法即干细胞疗法和血浆疗法。干细胞具有再生潜能, 在退行性疾病中能发挥出巨大作用。间充质干细胞(MSCs) 具有较强的自我更新和进一步分化成多种类型细胞的能力, 且MSCs可通过多种机制缓解神经炎症、改善突触功能障碍及降低Aβ负荷来有效治疗AD[20-22]。在一项Ⅰ期临床研究中发现, 从脐带血中分离到的MSCs (hUCB-MSCs) 通过手术方法输送到海马和楔前叶是安全可耐受的[23]。此外, 为了提高hUCB-MSCs的治疗效果, 研究人员还进一步反复将hUCB-MSCs注入9名轻度至中度的AD痴呆患者右侧脑室, 患者每次注射过后会出现短暂性发热但1~2天后症状消失[24]。此项研究还需进一步长时间对患者进行随访观察。
血浆治疗可能作为用于治疗AD的有效手段。斯坦福大学研究人员发现老年小鼠给予年幼小鼠血浆治疗后可通过恢复突触可塑性来改善认知功能障碍而对抗衰老[25]。此外, 同组研究人员发现人脐带血血浆和年幼小鼠血浆中富含大量金属蛋白酶组织抑制剂2 (TIMP2), 它可改善老年小鼠突触可塑性和认知功能[26]。在随后的临床试验中发现年轻供体的新鲜冷冻血浆用于治疗轻度至中度的AD患者表现出良好的安全性和可耐受性[27]。但由于受到样本量小、研究设计改变、治疗时间短的因素影响, 对患者的疗效无法确定, 结果还需进一步通过更大规模的随机双盲临床试验来证实。
2 天然产物治疗AD及其机制研究目前临床上AD的治疗药物只能轻微缓解一些症状, 还难以达到逆转疾病进程的目的。并且AD是由多种机制共同影响所致, 临床上大多数采用的是单一治疗方法, 因此难以达到治疗的目的。有研究表明与单靶点药物单一治疗相比, 双功能或多功能药物治疗可能更能发挥更大疗效[28]。天然产物具有结构新颖、多靶点和活性多样的特点, 是治疗AD的先导化合物重要来源。例如多酚类化合物具有抗炎抗氧化的功效, 生物碱类具有抑制胆碱酯酶的活性, 两者在临床前研究中多次被报道具有成为AD治疗药物的潜力[29, 30]。现如今已上市的小分子药物GV971和加兰他敏是治疗AD的代表性天然产物。本文主要围绕公认的发病机制, 分别对多糖类、糖苷类、黄酮类、醌类、多酚类、萜类和生物碱类等天然产物及其治疗AD的机制研究进行介绍(图 1)。
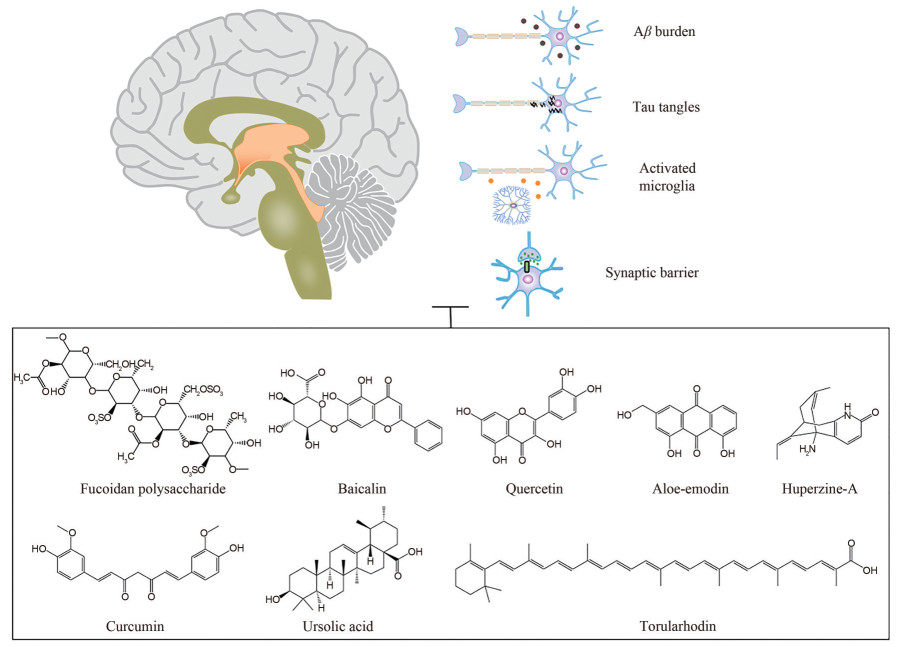
|
Figure 1 The natural products modulate Alzheimer's disease |
多糖是构成基本生命活动的成分之一, 在自然界广泛分布且参与细胞膜和细胞壁的构成。在体外实验中发现褐色海藻(Ecklonia radiata) 中的多糖提取物能有效抑制Aβ1-42诱导的PC12细胞凋亡, 还能抑制过氧化氢产生的细胞毒性[31]。研究发现从冰岛刺参(Cucumaria frondosa) 中提取的硫酸盐多糖可有效抑制Aβ的聚集和细胞毒性, 表明海参中提取的多糖可作为Aβ的抑制剂[32]。另外, 乙酰胆碱的释放减少也是AD的一大特征, AChE抑制剂目前也是AD药物研究的热点之一。在食用菌中多糖提取物显示具有AChE的抑制活性[33]。基于目前的实验结果显示天然产物多糖类成分在治疗AD中表现出巨大的潜力。
2.2 糖苷类本课题组早期研究发现, 从传统中药川续断(Dipsacus asper wall) 中分离到的三萜类皂苷化合物木通皂苷D (Akebia saponin D, ASD) 可通过改善胆碱能系统的酶活性来提高基底核(NBM) 损伤后的SD (Sprague-Dawley) 大鼠的学习记忆能力[34]。同时也发现ASD可能通过抑制MAPK通路激活来抑制细胞凋亡[34]。此外, 还发现ASD可抑制核转录因子κB (nuclear factor-kappa B, NF-κB) 通路激活来减少炎症反应, 能改善由Aβ1-42诱导的大鼠认知障碍[35]。苯乙醇苷(phenylethanoid glycosides, PHG) 是肉苁蓉(Herba Cistanche) 中的主要糖苷类化合物, 体外实验发现PHG可通过减少氧化应激对Aβ1-42或H2O2损伤的PC12细胞产生神经保护作用[36]。Jia等[37, 38]发现PHG在AD动物模型中也能发挥神经保护作用。从Aβ1-42诱导的大鼠模型和SAMP8小鼠中可观察到PHG显著提高了突触后致密物95 (PSD-95) 的蛋白表达, 降低了丙二醛(MDA) 的含量, 还提高了超氧化物歧化酶(SOD) 和谷胱甘肽过氧化物酶(GSH-Px) 的活性, 表明PHG对突触可塑性的保护作用可能与降低氧化应激有关。黄芩苷(baicalin, BAI) 是从黄芩根(Scutellaria baicalensis) 中分离到的黄酮苷类化合物, 可抑制NOD样受体热蛋白结构域相关蛋白3 (NLRP3) 炎症小体激活和阻断Toll样受体4 (TLR4)/NF-κB信号通路来抑制小胶质细胞产生的神经炎症[39]。黄酮苷类的另一个常见的化合物芦丁(rutin, quercetin-3-rutinoside) 因具有多种生物活性被广泛研究, 其钠盐形式可增加小胶质细胞吞噬相关受体的表达并促进无氧糖酵解向线粒体氧化磷酸化(OXPHOS) 的转换来增强能量代谢从而增强小胶质细胞对Aβ的清除[40]。山茱萸环烯醚萜苷(cornel iridoid glycoside, CIG) 是山茱萸(Cornus officinalis) 中的一个主要活性成分。CIG通过增加解整合素样金属蛋白酶1 (ADAM1) 和可溶性淀粉样前体蛋白α (sAPPα) 来促进脑中淀粉样前体蛋白APP生成并下调SAMP8小鼠大脑中的受体相互作用蛋白激酶1/混合谱系激酶结构域样蛋白(RIPK1/MLKL) 通路来抑制细胞坏死性凋亡[41]。雷公藤多苷(tripterygium glycoside, TG) 在Aβ25-35诱导的AD小鼠模型中可通过减少脑组织中核因子κB抑制剂α (inhibitor nuclear factor kappa-Bα, IκBα) 和p38的磷酸化抑制促炎因子的释放来发挥神经保护作用[42]。
2.3 黄酮类黄酮是以C6-C3-C6为骨架的一大类次生代谢产物, 在天然食物中广泛存在, 如蔬菜、水果、茶叶和红酒。黄酮类化合物由于具有抗氧化、抗炎和抗淀粉样蛋白生成的特性, 也同样作为AD治疗的潜在候选药物获得关注[43]。槲皮素(quercetin) 是一类具有广泛生物活性的黄酮化合物, 研究表明其具有抗癌、抗氧化、抗炎、抗病毒和抗高血压等活性[44]。还有研究发现槲皮素对APP/PS1/Tau三重转基因阿尔茨海默症模型小鼠治疗后, 从组织水平观察到海马体和杏仁核区域胞外Aβ沉积、神经纤维缠结、星状胶质细胞和小胶质细胞活化程度显著减少, 从行为学水平还可观察到小鼠空间学习和记忆能力及焦虑情绪得到改善[45]。此外, 作者进一步发现长期经口给予槲皮素预防干预还可显著减少转基因模型小鼠中海马体的Aβ, 延迟认知功能缺陷的发展[46]。体内外实验多次证明槲皮素可通过多种途径对神经细胞起到保护作用, 但其进入肠道后被广泛代谢且血脑屏障通透率较低, 因此在未来的研究中需进一步提高其生物利用度[47]。花青素(anthocyanins) 是广泛存在于植物中的天然色素, 是一类特殊的黄酮类化合物[48]。韩国研究人员发现花青素可调节磷脂酰肌醇3激酶/蛋白激酶B/糖原合成酶激酶3 (PI3K/Akt/GSK3) 通路, 激活下游核因子E2相关因子2/血红素加氧酶-1 (Nrf2/HO-1) 通路来减少氧化应激从而防止神经退行性病变, 其可作为一种膳食添加剂来预防与年龄相关的神经退行性疾病[49]。
2.4 醌类醌类(quinones) 化合物是天然植物中多样化的次生代谢产物之一, 具有抗氧化、抗炎、抗菌活性和神经保护作用。研究发现从铁皮石斛(Rheum offificinale Baill.) 中分离到的芦荟大黄素(aloe-emodin, AE) 可通过抑制AChE和调节氧化应激作用改善东莨菪碱诱导的小鼠认知缺陷[50]。高同型半胱氨酸血症(HHcy) 也是诱发AD的一个风险因素[51], 同样来源于铁皮石斛中的大黄素(emodin) 可缓解同型半胱氨酸(Hcy) 诱导SD大鼠的AD特征[52]。另一种蒽醌衍生物大黄酚(chrysophanol, CHR) 可通过抑制钙调蛋白/钙调蛋白依赖性蛋白激酶IV (CaM-CaMKIV) 信号通路缓解Tau蛋白过度磷酸化来保护神经细胞免受损伤[53]。白花丹素(5-羟基-2-甲基-1, 4萘醌, plumbagin) 可通过激活Nrf2/抗氧化反应元件(ARE) 通路来抑制链脲佐菌素(STZ) 诱导的AD小鼠星状胶质细胞增生并且改善认知功能缺陷[54]。蒽贝素(2, 5-二羟基-3-十一烷基-1, 4-苯醌, embelin) 是白花酸藤果(Embelia ribes Burm) 果实中的一个活性成分, 在SD大鼠中通过提升BDNF、CREB1和抗氧化基因(SOD1和CAT) 的mRNA水平改善东莨菪碱诱导的抗遗忘作用[55]。
2.5 多酚类多酚类化合物是天然植物中富含酚羟基的一类次生代谢产物, 具有很强的抗炎和抗氧化活性[56]。本文主要介绍2个具有代表性的化合物即白藜芦醇(resveratrol, RSV) 和姜黄素(curcumin, CUR)。RSV是一种从藜芦中分离出来的天然多酚类化合物, 可通过多种途径对神经起到保护作用[57]。近年来研究发现RSV可通过激活Sirt1通路来调节氧化应激和抗炎反应从而缓解糖尿病并发的AD神经退行性病变过程[58]。除了抗氧化和抗炎活性外, RSV也被报道具有破坏Aβ1-42结构的能力从而抑制Aβ1-42肽聚集[59]。研究发现RSV结合运动的方式联合治疗可有效缓解三转基因AD模型小鼠中的神经炎症、神经元凋亡及Aβ负荷[60]。该项研究提示运动结合饮食调节的方式可作为一种保护大脑健康的手段。作为另一种多酚类天然产物, CUR也被报道可通过多种途径治疗AD[61]。Liu等[62]研究发现CUR可通过抑制NF-κB信号通路及激活PPARγ通路来改善AD模型小鼠的记忆缺陷。金属Al3+也是诱发炎症反应和突触结构异常的风险因素, 近期一项研究结果显示, 在AlCl3诱导的AD模型中, CUR可调节神经炎症和氧化应激来减少神经元凋亡[63]。
2.6 萜类萜类是广泛存在于自然界中的化合物, 其环系结构复杂多变且碳原子数量为5的倍数, 根据异戊二烯的单位数量划分为单萜、倍半萜、二萜、二倍半萜、三萜等。但相对来说, 萜类化合物在治疗AD中并不常见, 大部分化合物还有待进一步开发。熊果酸也称乌苏酸(ursolic acid), 是一种五环三萜类化合物, 具有抗癌、抗病毒、抗菌等活性[64]。Hong等[65]在早期研究中发现熊果酸通过减少活性氧(reactive oxygen species, ROS) 产生从而保护PC12细胞免受Aβ25-35诱导的细胞毒性。近年来一些研究还发现熊果酸具有AChE抑制活性且还通过增强泛素蛋白酶体活性来抑制Aβ毒性, 为熊果酸治疗AD的药理机制作进一步补充[66, 67]。Lu等[68]从雷公藤科植物雷公藤(Tripterygium wilfordii) 中分离到的二萜类化合物雷公藤甲素(triptolide, T10) 和其衍生物雷公藤氯内酯醇(tripchlorolide, T4) 可通过调控表观遗传途径影响神经胶质蛋白(NLGN1) 表达从而提高突触可塑性来改善AD症状。具体来说, T10和T4在AD小鼠体内抑制组氨酸去乙酰化酶(HDAC2) 和甲基化CpG结合蛋白(MeCP2) 水平, 并抑制海马区HDAC2和MeCP2与NLGN1启动子结合以及NLGN1启动子的胞嘧啶甲基化, 从而增加NLGN1表达。
2.7 生物碱类生物碱是生物体中结构复杂的含氮有机化合物, 具有胆碱酯酶抑制活性, 在神经退行性疾病中发挥重要作用[69]。石杉碱甲(huperzine-A, HupA) 是从我国传统中药蛇足石杉(Huperzia Serrata) 中分离到的倍半萜类生物碱, 在临床上能为AD患者的认知功能和日常生活活动带来益处[70]。HupA除了AChE抑制活性外, 还可通过调节APP加工及减少海马体中β淀粉样蛋白累积等途径对神经产生保护作用[71]。近期有研究发现HupA还可降低淀粉样蛋白结合醇脱氢酶(ABAD) 水平且进一步降低Aβ和ABAD复合物水平从而缓解APP/PS1小鼠的线粒体功能障碍[72]。通过进一步明确HupA独特的作用机制更好地阐述了其临床获益。石蒜属生物碱加兰他敏是另一种与AChE可逆选择性竞争的抑制剂, 在2001年被美国FDA批准用于治疗早中期AD[73]。从中药黄连素中分离到的小檗碱(berberine, BBR) 是一种异喹啉类生物碱, 近年来有研究表明其可通过调节Akt/GSK3β通路来减少Tau蛋白的过度磷酸化, 并可调节PI3K/beclin-1/Bcl-2途径, 通过增强自噬使Tau蛋白被清除[74]。
2.8 其他除了上述探讨的几种常见结构外, 天然产物中还蕴含着丰富的其他种类结构类型。红酵母红素(torularhodin) 是从锁掷酵母(Sporidiobolus pararoseus JD-2) 分离到的含14个共轭双键的天然产物, 其可通过调节Nrf2/NF-κB通路来改善由D-gal/AlCl3诱导的氧化应激和神经炎症及认知功能障碍[75]。藏红花醛(safranal) 是藏红花(Saffron) 的主要成分, 可显著缓解由Aβ25-35和H2O2诱导的PC12细胞凋亡和氧化应激[76]。此研究结果在AD动物模型体内得到进一步验证, 它通过改善氧化应激、炎症反应、胆碱酯酶活性、中性粒细胞浸润及保持线粒体完整性来保护神经元, 从而减缓学习和记忆能力下降[77]。
3 总结与展望AD是老年人群最常见的痴呆症, 是以认知功能下降为特征的中枢神经系统退行性疾病。随着中国乃至世界人口老龄化进程不断加剧, AD患者也在不断增多, 给社会和家庭带来巨大的医疗经济负担。AD患者表现出认知障碍特征, 其中涉及到多种病理机制, 如Aβ累积形成斑块; Tau蛋白过度磷酸化导致神经纤维缠结; 氧自由基形成诱导氧化应激; 小胶质细胞增生促使炎症反应导致神经元凋亡和突触损伤。目前临床上治疗AD仍采用对症治疗原则, 无法逆转疾病进程。例如AChE抑制剂他克林和加兰他敏及NMDA拮抗剂美金刚在临床上可改善患者认知和记忆功能并提高日常生活能力, 但仍无法阻止神经元变性和凋亡。而近年来上市的新药甘露特钠和aducanumab还存在着许多争议, 在临床上的有效性还有待进一步观察。AD的发病机制多样且过程复杂, 单靶点药物治疗方法可能存在一定的局限性。天然产物具有结构多样化、靶点多样化和活性多样化的特点, 可作为小分子药物研究中的先导化合物来源。例如CUR可通过抑制Aβ、抗炎抗氧化通路和抑制AChE等多种途径来治疗AD。我国中药资源丰富, 结合中医药理论和现代技术开发有效治疗AD的天然产物有着得天独厚的优势。近年来越来越多的研究者发现中药中的有效成分在AD药物临床前研究中可发挥出较好的疗效。因此, 利用现代技术从传统中药中筛选出具有治疗AD潜力的天然产物有重要意义。
中药作为中华民族几千年的文化瑰宝, 在治疗AD中发挥出了巨大优势。中药中的活性成分在治疗AD上受到众多科研人员关注并逐渐成为AD研究中的热点。近年来报道了大量天然产物治疗AD的作用机制, 显示出天然产物在治疗AD中的优势(图 1)。
本文对目前临床研究中的治疗手段和具有潜力作为治疗AD的代表性天然活性成分进行总结, 希望为今后AD新药研发提供参考。但由于目前有的活性较好的天然产物存在着生物利用度低和难以透过血脑屏障等问题受到限制, 到临床应用上还需进一步做深入研究。
作者贡献: 张平负责文献整理和论文撰写; 胡庆华和季晖负责论文整体思路设计及文章指导和修改。
利益冲突: 本文作者无任何利益冲突。
| [1] |
Alzheimer A. Über eine eigenartige Erkrankung der Hirnrinde[J]. Allg Zschr Psychiatr Psych Gerichtl Med, 1907, 64: 146-148. |
| [2] |
Wang YQ, Liang JH, Jia RX, 等. Alzheimer disease in China (2015-2050) estimated using the 1% population sampling survey in 2015[J]. Chin J Alzheimers Dis Relat Disord (阿尔茨海默病及相关病杂志), 2019, 2: 289-298. |
| [3] |
Alzheimer's Disease International. World Alzheimer Report 2019: attitudes to dementia[R]. London: ADI, 2019.
|
| [4] |
Huang LJ, Zhao CY, Feng XH, 等. Exploration of nonclinical pharmacodynamics evaluation system of Alzheimer's disease[J]. Acta Pharm Sin (药学学报), 2020, 55: 789-805. |
| [5] |
He J. TCM etiology and pathogenesis of Alzheimer's disease and its treatment ideas[J]. Lishizhen Med Mat Med Res (时珍国医国药), 2012, 23: 2. |
| [6] |
Hampel H, Vassar R, De Strooper B, et al. The β-secretase BACE1 in Alzheimer's disease[J]. Biol Psychiatry, 2021, 89: 745-756. DOI:10.1016/j.biopsych.2020.02.001 |
| [7] |
Zhou W, Zhong G, Fu S, et al. Microglia-based phenotypic screening identifies a novel inhibitor of neuroinflammation effective in Alzheimer's disease models[J]. ACS Chem Neurosci, 2016, 7: 1499-1507. DOI:10.1021/acschemneuro.6b00125 |
| [8] |
Sun P, Yue H, Xing Q, et al. Compound AD16 reduces amyloid plaque deposition and modifies microglia in a transgenic mouse model of Alzheimer's disease[J]. ACS Pharmacol Transl Sci, 2020, 3: 1100-1110. DOI:10.1021/acsptsci.0c00073 |
| [9] |
Wang X, Sun G, Feng T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer's disease progression[J]. Cell Res, 2019, 29: 787-803. DOI:10.1038/s41422-019-0216-x |
| [10] |
Sigurdsson EM, Scholtzova H, Mehta PD, et al. Immunization with a nontoxic/nonfibrillar amyloid-β homologous peptide reduces Alzheimer's disease-associated pathology in transgenic mice[J]. Am J Pathol, 2001, 159: 439-447. DOI:10.1016/S0002-9440(10)61715-4 |
| [11] |
Orgogozo JM, Gilman S, Dartigues JF, et al. Subacute meningoencephalitis in a subset of patients with AD after Aβ42 immunization[J]. Neurology, 2003, 61: 46-54. DOI:10.1212/01.WNL.0000073623.84147.A8 |
| [12] |
Wiessner C, Wiederhold KH, Tissot AC, et al. The second-generation active Aβ immunotherapy CAD106 reduces amyloid accumulation in APP transgenic mice while minimizing potential side effects[J]. J Neurosci, 2011, 31: 9323-9331. DOI:10.1523/JNEUROSCI.0293-11.2011 |
| [13] |
Winblad B, Andreasen N, Minthon L, et al. Safety, tolerability, and antibody response of active Aβ immunotherapy with CAD106 in patients with Alzheimer's disease: randomised, double-blind, placebo-controlled, first-in-human study[J]. Lancet Neurol, 2012, 11: 597-604. DOI:10.1016/S1474-4422(12)70140-0 |
| [14] |
Vandenberghe R, Riviere ME, Caputo A, et al. Active Aβ immunotherapy CAD106 in Alzheimer's disease: a phase 2b study[J]. Alzheimers Dement (N Y), 2017, 3: 10-22. DOI:10.1016/j.trci.2016.12.003 |
| [15] |
Wang CY, Wang PN, Chiu MJ, et al. UB-311, a novel UBITh® amyloid β peptide vaccine for mild Alzheimer's disease[J]. Alzheimers Dement (N Y), 2017, 3: 262-272. DOI:10.1016/j.trci.2017.03.005 |
| [16] |
Kontsekova E, Zilka N, Kovacech B, et al. First-in-man tau vaccine targeting structural determinants essential for pathological tau-tau interaction reduces tau oligomerisation and neurofibrillary degeneration in an Alzheimer's disease model[J]. Alzheimers Res Ther, 2014, 6: 44. DOI:10.1186/alzrt278 |
| [17] |
Novak P, Schmidt R, Kontsekova E, et al. FUNDAMANT: an interventional 72-week phase 1 follow-up study of AADvac1, an active immunotherapy against tau protein pathology in Alzheimer's disease[J]. Alzheimers Res Ther, 2018, 10: 108. DOI:10.1186/s13195-018-0436-1 |
| [18] |
Selkoe DJ. Treatments for Alzheimer's disease emerge[J]. Science, 2021, 373: 624-626. DOI:10.1126/science.abi6401 |
| [19] |
West T, Hu Y, Verghese PB, et al. Preclinical and clinical development of ABBV-8E12, a humanized anti-tau antibody, for treatment of Alzheimer's disease and other tauopathies[J]. J Prev Alzheimers Dis, 2017, 4: 236-241. |
| [20] |
Huang N, Li Y, Zhou Y, et al. Neuroprotective effect of tanshinone ⅡA-incubated mesenchymal stem cells on Aβ25-35-induced neuroinflammation[J]. Behav Brain Res, 2019, 365: 48-55. DOI:10.1016/j.bbr.2019.03.001 |
| [21] |
Kim DH, Lim H, Lee D, et al. Thrombospondin-1 secreted by human umbilical cord blood-derived mesenchymal stem cells rescues neurons from synaptic dysfunction in Alzheimer's disease model[J]. Sci Rep, 2018, 8: 354. DOI:10.1038/s41598-017-18542-0 |
| [22] |
Kim DY, Choi SH, Lee JS, et al. Feasibility and efficacy of intra-arterial administration of embryonic stem cell derived-mesenchymal stem cells in animal model of Alzheimer's disease[J]. J Alzheimers Dis, 2020, 76: 1281-1296. DOI:10.3233/JAD-200026 |
| [23] |
Kim HJ, Seo SW, Chang JW, et al. Stereotactic brain injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer's disease dementia: a phase 1 clinical trial[J]. Alzheimers Dement (N Y), 2015, 1: 95-102. DOI:10.1016/j.trci.2015.06.007 |
| [24] |
Kim HJ, Cho KR, Jang H, et al. Intracerebroventricular injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer's disease dementia: a phase I clinical trial[J]. Alzheimers Res Ther, 2021, 13: 154. DOI:10.1186/s13195-021-00897-2 |
| [25] |
Villeda SA, Plambeck KE, Middeldorp J, et al. Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice[J]. Nat Med, 2014, 20: 659-663. DOI:10.1038/nm.3569 |
| [26] |
Castellano JM, Mosher KI, Abbey RJ, et al. Human umbilical cord plasma proteins revitalize hippocampal function in aged mice[J]. Nature, 2017, 544: 488-492. DOI:10.1038/nature22067 |
| [27] |
Sha SJ, Deutsch GK, Tian L, et al. Safety, tolerability, and feasibility of young plasma infusion in the plasma for Alzheimer symptom amelioration study: a randomized clinical trial[J]. JAMA Neurol, 2019, 76: 35-40. DOI:10.1001/jamaneurol.2018.3288 |
| [28] |
Youdim MBH, Buccafusco JJ. Multi-functional drugs for various CNS targets in the treatment of neurodegenerative disorders[J]. Trends Pharmacol Sci, 2005, 26: 27-35. DOI:10.1016/j.tips.2004.11.007 |
| [29] |
Gaudreault R, Mousseau N. Mitigating Alzheimer's disease by natural polyphenols: a review[J]. Curr Alzheimer Res, 2019, 16: 529-543. DOI:10.2174/1567205016666190315093520 |
| [30] |
Singh AK, Singh SK, Nandi MK, et al. Berberine: a plant-derived alkaloid with therapeutic potential to combat Alzheimer's disease[J]. Cent Nerv Syst Agents Med Chem, 2019, 19: 154-170. DOI:10.2174/1871524919666190820160053 |
| [31] |
Alghazwi M, Charoensiddhi S, Smid S, et al. Impact of Ecklonia radiata extracts on the neuroprotective activities against amyloid beta (Aβ1-42) toxicity and aggregation[J]. J Funct Foods, 2020, 68: 103893. DOI:10.1016/j.jff.2020.103893 |
| [32] |
Li G, Zhou Y, Yang WY, et al. Inhibitory effects of sulfated polysaccharides from the sea cucumber Cucumaria frondosa against Aβ40 aggregation and cytotoxicity[J]. ACS Chem Neurosci, 2021, 12: 1854-1859. DOI:10.1021/acschemneuro.1c00223 |
| [33] |
Pejin B, Tesanovic K, Jakovljevic D, et al. The polysaccharide extracts from the fungi Coprinus comatus and Coprinellus truncorum do exhibit AChE inhibitory activity[J]. Nat Prod Res, 2019, 33: 750-754. DOI:10.1080/14786419.2017.1405417 |
| [34] |
Yu X, Wang LN, Ma L, et al. Akebia saponin D attenuates ibotenic acid-induced cognitive deficits and pro-apoptotic response in rats: involvement of MAPK signal pathway[J]. Pharmacol Biochem Behav, 2012, 101: 479-486. DOI:10.1016/j.pbb.2012.02.014 |
| [35] |
Yu X, Wang LN, Du QM, et al. Akebia saponin D attenuates amyloid beta-induced cognitive deficits and inflammatory response in rats: involvement of Akt/NF-κB pathway[J]. Behav Brain Res, 2012, 235: 200-209. DOI:10.1016/j.bbr.2012.07.045 |
| [36] |
Yang J, Ju B, Yan Y, et al. Neuroprotective effects of phenylethanoid glycosides in an in vitro model of Alzheimer's disease[J]. Exp Ther Med, 2017, 13: 2423-2428. DOI:10.3892/etm.2017.4254 |
| [37] |
Jia JX, Yan XS, Cai ZP, et al. The effects of phenylethanoid glycosides, derived from Herba cistanche, on cognitive deficits and antioxidant activities in male SAMP8 mice[J]. J Toxicol Environ Health A, 2017, 80: 1180-1186. DOI:10.1080/15287394.2017.1367097 |
| [38] |
Jia JX, Yan XS, Song W, et al. The protective mechanism underlying phenylethanoid glycosides (PHG) actions on synaptic plasticity in rat Alzheimer's disease model induced by beta amyloid 1-42[J]. J Toxicol Environ Health A, 2018, 81: 1098-1107. DOI:10.1080/15287394.2018.1501861 |
| [39] |
Jin X, Liu MY, Zhang DF, et al. Baicalin mitigates cognitive impairment and protects neurons from microglia-mediated neuroinflammation via suppressing NLRP3 inflammasomes and TLR4/NF-κB signaling pathway[J]. CNS Neurosci Ther, 2019, 25: 575-590. DOI:10.1111/cns.13086 |
| [40] |
Pan RY, Ma J, Kong XX, et al. Sodium rutin ameliorates Alzheimer's disease-like pathology by enhancing microglial amyloid-β clearance[J]. Sci Adv, 2019, 5: eaau6328. DOI:10.1126/sciadv.aau6328 |
| [41] |
Ma D, Li Y, Zhu Y, et al. Cornel iridoid glycoside ameliorated Alzheimer's disease-like pathologies and necroptosis through RIPK1/MLKL pathway in young and aged SAMP8 mice[J]. Evid Based Complement Alternat Med, 2021, 2021: 9920962. |
| [42] |
Tang L, Xiang Q, Xiang J, et al. Tripterygium glycoside ameliorates neuroinflammation in a mouse model of Aβ25-35-induced Alzheimer's disease by inhibiting the phosphorylation of IκBα and p38[J]. Bioengineered, 2021, 12: 8540-8554. DOI:10.1080/21655979.2021.1987082 |
| [43] |
Airoldi C, La Ferla B, Orazio GD, et al. Flavonoids in the treatment of Alzheimer's and other neurodegenerative diseases[J]. Curr Med Chem, 2018, 25: 3228-3246. DOI:10.2174/0929867325666180209132125 |
| [44] |
Batiha GE, Beshbishy AM, Ikram M, et al. The pharmacological activity, biochemical properties, and pharmacokinetics of the major natural polyphenolic flavonoid: quercetin[J]. Foods, 2020, 9: 374. DOI:10.3390/foods9030374 |
| [45] |
Sabogal-Guaqueta AM, Munoz-Manco JI, Ramirez-Pineda JR, et al. The flavonoid quercetin ameliorates Alzheimer's disease pathology and protects cognitive and emotional function in aged triple transgenic Alzheimer's disease model mice[J]. Neuropharmacology, 2015, 93: 134-145. DOI:10.1016/j.neuropharm.2015.01.027 |
| [46] |
Paula PC, Angelica Maria SG, Luis CH, et al. Preventive effect of quercetin in a triple transgenic Alzheimer's disease mice model[J]. Molecules, 2019, 24: 2287. DOI:10.3390/molecules24122287 |
| [47] |
Khan H, Ullah H, Aschner M, et al. Neuroprotective effects of quercetin in Alzheimer's disease[J]. Biomolecules, 2019, 10: 59. DOI:10.3390/biom10010059 |
| [48] |
Khoo HE, Azlan A, Tang ST, et al. Anthocyanidins and anthocyanins: colored pigments as food, pharmaceutical ingredients, and the potential health benefits[J]. Food Nutr Res, 2017, 61: 1361779. DOI:10.1080/16546628.2017.1361779 |
| [49] |
Ali T, Kim T, Rehman SU, et al. Natural dietary supplementation of anthocyanins via PI3K/Akt/Nrf2/HO-1 pathways mitigate oxidative stress, neurodegeneration, and memory impairment in a mouse model of Alzheimer's disease[J]. Mol Neurobiol, 2018, 55: 6076-6093. DOI:10.1007/s12035-017-0798-6 |
| [50] |
Tao L, Xie J, Wang Y, et al. Protective effects of aloe-emodin on scopolamine-induced memory impairment in mice and H2O2-induced cytotoxicity in PC12 cells[J]. Bioorg Med Chem Lett, 2014, 24: 5385-5389. DOI:10.1016/j.bmcl.2014.10.049 |
| [51] |
Sharma M, Tiwari M, Tiwari RK. Hyperhomocysteinemia: impact on neurodegenerative diseases[J]. Basic Clin Pharmacol Toxicol, 2015, 117: 287-296. DOI:10.1111/bcpt.12424 |
| [52] |
Zeng P, Shi Y, Wang XM, et al. Emodin rescued hyperhomocysteinemia-induced dementia and Alzheimer's disease-like features in rats[J]. Int J Neuropsychopharmacol, 2019, 22: 57-70. DOI:10.1093/ijnp/pyy090 |
| [53] |
Ye T, Li X, Zhou P, et al. Chrysophanol improves memory ability of D-galactose and Aβ25-35 treated rat correlating with inhibiting tau hyperphosphorylation and the CaM-CaMKIV signal pathway in hippocampus[J]. 3 Biotech, 2020, 10: 111. |
| [54] |
Nakhate KT, Bharne AP, Verma VS, et al. Plumbagin ameliorates memory dysfunction in streptozotocin induced Alzheimer's disease via activation of Nrf2/ARE pathway and inhibition of β-secretase[J]. Biomed Pharmacother, 2018, 101: 379-390. DOI:10.1016/j.biopha.2018.02.052 |
| [55] |
Bhuvanendran S, Kumari Y, Othman I, et al. Amelioration of cognitive deficit by embelin in a scopolamine-induced Alzheimer's disease-like condition in a rat model[J]. Front Pharmacol, 2018, 9: 665. DOI:10.3389/fphar.2018.00665 |
| [56] |
Singh A, Yau YF, Leung KS, et al. Interaction of polyphenols as antioxidant and anti-inflammatory compounds in brain-liver-gut axis[J]. Antioxidants (Basel), 2020, 9: 669. DOI:10.3390/antiox9080669 |
| [57] |
Ahmed T, Javed S, Javed S, et al. Resveratrol and Alzheimer's disease: mechanistic insights[J]. Mol Neurobiol, 2017, 54: 2622-2635. DOI:10.1007/s12035-016-9839-9 |
| [58] |
Ma X, Sun Z, Han X, et al. Neuroprotective effect of resveratrol via activation of Sirt1 signaling in a rat model of combined diabetes and Alzheimer's disease[J]. Front Neurosci, 2019, 13: 1400. |
| [59] |
Al-Edresi S, Alsalahat I, Freeman S, et al. Resveratrol-mediated cleavage of amyloid β1-42 peptide: potential relevance to Alzheimer's disease[J]. Neurobiol Aging, 2020, 94: 24-33. DOI:10.1016/j.neurobiolaging.2020.04.012 |
| [60] |
Broderick TL, Rasool S, Li R, et al. Neuroprotective effects of chronic resveratrol treatment and exercise training in the 3xTg-AD mouse model of Alzheimer's disease[J]. Int J Mol Sci, 2020, 21: 7337. DOI:10.3390/ijms21197337 |
| [61] |
Tang M, Taghibiglou C. The mechanisms of action of curcumin in Alzheimer's disease[J]. J Alzheimers Dis, 2017, 58: 1003-1016. DOI:10.3233/JAD-170188 |
| [62] |
Liu ZJ, Li ZH, Liu L, et al. Curcumin attenuates β-amyloid-induced neuroinflammation via activation of peroxisome proliferator-activated receptor-γ function in a rat model of Alzheimer's disease[J]. Front Pharmacol, 2016, 7: 261. |
| [63] |
ELBini-Dhouib I, Doghri R, Ellefi A, et al. Curcumin attenuated neurotoxicity in sporadic animal model of Alzheimer's disease[J]. Molecules, 2021, 26: 3011. DOI:10.3390/molecules26103011 |
| [64] |
Sun Q, He M, Zhang M, et al. Ursolic acid: a systematic review of its pharmacology, toxicity and rethink on its pharmacokinetics based on PK-PD model[J]. Fitoterapia, 2020, 147: 104735. DOI:10.1016/j.fitote.2020.104735 |
| [65] |
Hong SY, Jeong WS, Jun M. Protective effects of the key compounds isolated from Corni fructus against β-amyloid-induced neurotoxicity in PC12 cells[J]. Molecules, 2012, 17: 10831-10845. DOI:10.3390/molecules170910831 |
| [66] |
Loesche A, Kowitsch A, Lucas SD, et al. Ursolic and oleanolic acid derivatives with cholinesterase inhibiting potential[J]. Bioorg Chem, 2019, 85: 23-32. DOI:10.1016/j.bioorg.2018.12.013 |
| [67] |
Wang N, Wang E, Wang R, et al. Ursolic acid ameliorates amyloid β-induced pathological symptoms in Caenorhabditis elegans by activating the proteasome[J]. Neurotoxicology, 2022, 88: 231-240. DOI:10.1016/j.neuro.2021.12.004 |
| [68] |
Lu X, Yang B, Yu H, et al. Epigenetic mechanisms underlying the effects of triptolide and tripchlorolide on the expression of neuroligin-1 in the hippocampus of APP/PS1 transgenic mice[J]. Pharm Biol, 2019, 57: 453-459. DOI:10.1080/13880209.2019.1629463 |
| [69] |
Kong YR, Tay KC, Su YX, et al. Potential of naturally derived alkaloids as multi-targeted therapeutic agents for neurodegenerative diseases[J]. Molecules, 2021, 26: 728. DOI:10.3390/molecules26030728 |
| [70] |
Ghassab-Abdollahi N, Mobasseri K, Ahmadabad AD, et al. The effects of huperzine A on dementia and mild cognitive impairment: an overview of systematic reviews[J]. Phytother Res, 2021, 39: 4971-4987. |
| [71] |
Friedli MJ, Inestrosa NC. Huperzine A and its neuroprotective molecular signaling in Alzheimer's disease[J]. Molecules, 2021, 26: 6531. DOI:10.3390/molecules26216531 |
| [72] |
Xiao X, Chen Q, Zhu X, et al. ABAD/17β-HSD10 reduction contributes to the protective mechanism of huperzine a on the cerebral mitochondrial function in APP/PS1 mice[J]. Neurobiol Aging, 2019, 81: 77-87. DOI:10.1016/j.neurobiolaging.2019.05.016 |
| [73] |
Marco Luis, Maria DCC. Galanthamine, a natural product for the treatment of Alzheimer's disease[J]. Recent Pat CNS Drug Discov, 2006, 1: 105-111. |
| [74] |
Chen Y, Chen Y, Liang Y, et al. Berberine mitigates cognitive decline in an Alzheimer's disease mouse model by targeting both tau hyperphosphorylation and autophagic clearance[J]. Biomed Pharmacother, 2020, 121: 109670. DOI:10.1016/j.biopha.2019.109670 |
| [75] |
Zhang W, Hua H, Guo Y, et al. Torularhodin from Sporidiobolus pararoseus attenuates D-galactose/AlCl3-induced cognitive impairment, oxidative stress, and neuroinflammation via the Nrf2/NF-κB pathway[J]. J Agric Food Chem, 2020, 68: 6604-6614. DOI:10.1021/acs.jafc.0c01892 |
| [76] |
Rafieipour F, Hadipour E, Emami SA, et al. Safranal protects against β-amyloid peptide-induced cell toxicity in PC12 cells via MAPK and PI3K pathways[J]. Metab Brain Dis, 2019, 34: 165-172. DOI:10.1007/s11011-018-0329-9 |
| [77] |
Baluchnejadmojarad T, Mohamadi-Zarch SM, Roghani M. Safranal, an active ingredient of saffron, attenuates cognitive deficits in amyloid β-induced rat model of Alzheimer's disease: underlying mechanisms[J]. Metab Brain Dis, 2019, 34: 1747-1759. DOI:10.1007/s11011-019-00481-6 |
 2022, Vol. 57
2022, Vol. 57


