2. 山西大学化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
3. 地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006
2. The Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China;
3. The Key Laboratory of Effective Substances Research and Utilization in TCM of Shanxi Province, Taiyuan 030006, China
“细胞衰老”概念由Hayflick和Moorhead在1961年首次提出, 近年来研究者认为细胞周期停滞是细胞衰老的主要特征, 表现为细胞复制能力丧失, 同时伴随细胞代谢、表观遗传调控和基因表达的变化[1]。大脑对衰老尤为敏感[2], 脑衰老是导致阿尔茨海默症(Alzheimer's disease, AD) 的重要危险因素, 其发生与大脑皮层出现广泛的老年斑以及脑组织出现的纤维丝缠结有关。中枢神经系统内细胞种类众多, 如神经元、星形胶质细胞、小胶质细胞、神经干细胞和少突胶质细胞, 这些细胞的衰老及不同类型细胞之间的相互作用和相互影响均与AD的发病机制密切相关。本文将综述不同类型脑细胞衰老导致阿尔茨海默症的潜在机制, 以及它们之间的相互影响, 对于阿尔茨海默症等神经退行性疾病的防治有重要意义。
1 细胞衰老细胞衰老死亡与新生细胞生长的动态平衡是维持机体正常生命活动的基础, 衰老细胞可被T辅助细胞识别, 并被巨噬细胞和自然杀伤淋巴细胞清除[3], 但随着年龄增长, 脑内细胞更新清除能力下降, 衰老的细胞在病理部位堆积, 导致大脑功能逐渐退化[4]。因此, 以细胞衰老为切入点研究AD等神经退行性疾病的病理机制和防治策略具有重要意义。
大量研究表明, 细胞衰老有九大特征[1]: ①永久的细胞周期停滞; ②衰老相关分泌表型(senescence-associated secretory phenotype, SASP) 产生; ③线粒体功能和形态学改变; ④细胞代谢改变; ⑤ DNA损伤; ⑥表观遗传改变; ⑦细胞形态学改变; ⑧蛋白质稳态改变; ⑨癌基因激活。其中, 永久性细胞周期停滞和线粒体改变被认为是细胞衰老的标志[5]。研究发现细胞衰老会影响其周围组织微环境, 导致细胞受损, 清除衰老的细胞可延长正常小鼠和早衰小鼠的寿命[6]。因此, 细胞衰老为衰老及衰老相关疾病的研究提供了一个新方向。
2 脑细胞衰老在阿尔茨海默症中的作用 2.1 脑细胞的分类脑组织中存在着多种细胞如神经元、星形胶质细胞、小胶质细胞、少突胶质细胞、神经干细胞, 这些细胞行使各自的功能, 并相互协作以保障大脑能够正常活动。其中, 能够快速传导电信号的细胞为神经元, 是神经活动的核心参与者, 而神经胶质细胞扮演着支持神经元的角色[7], 包括星形胶质细胞、小胶质细胞和少突胶质细胞。神经元由神经干细胞分化而来, 神经干细胞在整个哺乳动物生命中持续存在, 具有自我更新和分化为新神经元和神经胶质的能力[8], 在维持认知功能(如学习和记忆形成), 促进受损组织的修复和再生(包括神经发生) 方面起重要作用。星形胶质细胞可由神经干细胞分化而来, 是大脑中最为广泛的一类细胞, 占神经胶质细胞的20%[9], 在突触形成、维持神经元稳态等方面发挥重要的功能[10]。小胶质细胞占中枢神经系统细胞的5%~12%, 可影响大脑发育, 促进损伤修复[11]。小胶质细胞可充当大脑免疫细胞协调先天性免疫反应, 促进神经元增殖和分化、突触重塑以及碎片和异常蛋白的清除。少突胶质细胞是终末分化的有丝分裂后细胞。在中枢神经系统中, 少突胶质细胞产生髓鞘, 能够实现快速的跳跃性神经传导和轴突完整性保护, 保持神经元的正常运转。髓鞘缺失或丢失可导致AD说明了髓鞘形成的重要性[12]。
2.2 AD与脑细胞衰老密切相关AD是常见的神经退行性疾病之一, 主要症状为记忆力减退和认知功能障碍[13]。临床研究表明, 在AD患者的大脑中经常观察到衰老细胞的积累[14], 经鉴定这些衰老细胞涉及星形胶质细胞、小胶质细胞、神经元、少突胶质细胞和神经干细胞。
大量研究表明, 神经细胞衰老与AD的典型病理机制Aβ聚集和Tau蛋白过度磷酸化密切相关。Aβ假说认为细胞外Aβ积累和Aβ造成的毒性是AD的主要发病机制之一[5]。Aβ积累可能与淀粉样前体蛋白(APP) 相关[15], 其异常裂解可引起神经元应激和神经炎症, 激活神经胶质细胞并诱导SASP表达[16]。Aβ清除有两种方式, 一是清除受体(SRs) 的吞噬作用和内吞作用, 二是Aβ降解酶引起的细胞外降解[17], 而Aβ清除率的降低可导致其积累。星形胶质细胞和小胶质细胞在Aβ的清除和降解过程中起着重要作用。在衰老的星形胶质细胞和小胶质细胞中, 参与摄取和清除Aβ的受体[如低密度脂蛋白受体1 (LRP1)、B族清道夫受体(SR-B1)] 表达减少[18], 使细胞摄取和降解Aβ的能力受损, 导致Aβ聚集[11, 19, 20]。此外, Aβ对少突胶质细胞有毒性, Aβ诱导的氧化应激可导致少突胶质细胞死亡和功能障碍[21]。
AD的另一个标志是细胞内过度磷酸化的Tau蛋白聚集, 其在神经元中的积累可导致神经元功能障碍[22]。研究表明, 衰老星形胶质细胞在Tau蛋白积聚和Tau蛋白相关疾病的发病机制中起着重要作用, 清除衰老的星形胶质细胞几乎能完全阻止Tau蛋白过度磷酸化导致的神经原纤维缠结(NFT), 从而保留认知功能[23]。此外, 小胶质细胞一方面可以吞噬、降解和清除细胞外Tau蛋白; 另一方面可介导Tau蛋白神经毒性。衰老的小胶质细胞清除细胞外Tau蛋白的效率降低, 增加Tau蛋白磷酸化, 并促进Tau病理学的扩散[24, 25]。少突胶质细胞的主要作用是产生髓鞘, 随着年龄增长, 会导致产生的髓鞘节间变短, 引发功能性白质缺陷, 导致灰质中的Tau蛋白磷酸化, 出现认知功能障碍和AD病理改变[21]。
2.3 脑细胞衰老导致AD的共有机制 2.3.1 DNA损伤DNA的完整性和稳定性不断受到外源性物理、化学和生物因素及内源性威胁的挑战, 如DNA复制错误、自发水解反应和活性氧(ROS) 等。为了减少这些损伤, 生物体有复杂的DNA修复机制。随着年龄增长, DNA修复基因的转录抑制以及相关修复酶活性下降, 可导致DNA损伤的积累[26]。据报道, 在缺乏DNA修复机制时, 神经干细胞无法增殖分化, 少突胶质细胞中与年龄相关的DNA损伤可能导致髓鞘丢失。在老年人中, 衰老的少突胶质细胞DNA损伤过度, 导致DNA修复不足, 细胞严重受损[27, 28]。此外, DNA损伤后, 氧化应激增加, 细胞代谢发生改变, 基因突变逐渐增多, 加速神经元衰老[29]。
2.3.2 线粒体功能障碍线粒体是细胞呼吸的重要场所。在衰老的细胞中, 线粒体形态发生显著变化, 其表面积减小, 导致代谢能力减弱。此外, 线粒体产生的ROS可以通过增强DNA损伤和DNA损伤应答(DDR) 来加剧细胞衰老[30, 31]。在衰老过程中, 由于功能失调的线粒体积累和线粒体分裂减少, 致使线粒体数量增加, 此现象与氧化/硝化应激、RNA氧化损伤、ROS上调和诱导型一氧化氮合酶表达水平升高有关[32]。线粒体功能障碍与衰老密切相关, 神经干细胞、小胶质细胞、神经元等代谢高度活跃的细胞对线粒体功能的改变尤为敏感[33]。线粒体功能失调的衰老细胞辅酶Ⅰ/还原型辅酶Ⅰ (NAD+/NADH) 比率降低, 并导致代谢重编程[34]。此外, 线粒体转录因子A (TFAM) 是一种核编码蛋白, 敲除小鼠TFAM会在小鼠海马中产生衰老的组织学和病理学特征, 使神经干细胞增殖受损[35]。
2.3.3 端粒缩短端粒由位于染色体末端的串联重复核苷酸序列(TTAGGG) 组成。端粒缩短被认为是复制衰老的决定因素, 这是由于DNA聚合酶无法完全复制端粒, 导致端粒在每次分裂期间逐渐丢失。当端粒达到极短的长度时, 染色体不稳定性和DDR被激活, 导致细胞周期停滞[36]。在人类和大鼠衰老小胶质细胞中均发现端粒缩短, 促使DDR增加, 可能导致SASP的分泌[19]。此外, 端粒酶逆转录酶(TERT) 是端粒酶主要成分之一, 可以防止端粒过短, 起到抗衰老的作用。在细胞衰老过程中, TERT的表达受到抑制, 无法检测到端粒酶活性, 迫使神经元发生凋亡, 而TERT的相对缺乏可进一步促使DNA损伤的发生[37]。神经干细胞在缺少端粒酶活性的情况下, 端粒出现损伤, p53表达水平增加, 导致其增殖能力丧失[37]。
2.3.4 SASP衰老细胞分泌的细胞因子、趋化因子、蛋白酶和生长因子总称为SASP, 被认为是DNA损伤的下游结果[38]。研究表明, 星形胶质细胞衰老的典型特征是白介素-6 (IL-6)、IL-8、肿瘤坏死因子α (TNF-α) 等的高表达[39]。不仅如此, 衰老的小胶质细胞过度释放IL-6、IFN-γ、TNF-α、ROS等神经炎性介质, 表明了其分泌SASP的可能性。p38/丝裂原活化蛋白激酶(MAPK) 通路参与调控SASP分泌, 抑制衰老星形胶质细胞中的p38/MAPK活性可抑制SASP水平的升高[38]。此外, 高迁移率族蛋白B1 (HMGB1) 可能是SASP的重要调节因子。在大脑衰老过程中, 星形胶质细胞内HMGB1表达上调, 通过与核转录因子-κB (NF-κB) 复合物相互作用, 激活NF-κB通路, 从而增强SASP的炎症反应[40]。现已证明SASP可作为自分泌和旁分泌信号诱导邻近细胞的衰老, 从而加速衰老的进程。总之, SASP可以产生慢性低度炎症, 从而加剧衰老, 引发AD等衰老相关疾病。
2.4 不同类型脑细胞衰老导致阿尔茨海默症的特有机制 2.4.1 神经元随着年龄的增长, 大脑神经元的数量减少。研究表明, 神经元衰老与AD神经变性之间存在关联。在与衰老相关的认知功能受损小鼠模型中, 观察到神经元内β-半乳糖苷酶(SA-β-Gal) 活性增加, 同时在AD患者中, 证明了具有NFT的神经元存在细胞衰老特征[41, 42]。此外, 体外培养的神经元暴露于Aβ后, 衰老相关基因p16、p53的表达上调[43], 促使细胞周期失调, 表明Aβ可能诱导神经元衰老[3]。衰老神经元分泌的促炎细胞因子可能在神经变性中占据核心作用。研究表明, AD患者的神经元具有衰老表型, 如p38/MAPK活性增加, TGF-β mRNA和IL-6表达增加, 而SASP的升高能够以旁分泌方式诱导邻近细胞进入衰老状态, 加剧AD的发生[5]。此外, 由突触丢失和突触功能障碍引起的神经元丢失或神经元死亡会导致患者认知和记忆功能下降, 衰老细胞分泌的SASP会使神经毒性增加, 神经元稳态的功能受损, 引发AD。因此, 神经元在AD中占有重要地位, 其功能受损可导致神经退行性病变的发生。
2.4.2 星形胶质细胞星形胶质细胞衰老在AD发病机制中起着关键作用。胶质纤维酸性蛋白(GFAP) 是星形胶质细胞标志物, 有助于星形胶质细胞对血脑屏障的支持, 促进血脑屏障功能, 抑制神经元增殖和神经突触延伸, 形成物理屏障以隔离受损组织, 支持髓鞘形成。多项研究表明, 伴随着星形胶质细胞的衰老, GFAP表达增加[39], 反应性星形胶质细胞增加, 使谷氨酸-谷氨酰胺代谢改变, 认知功能下降。同时GFAP表达增加促使神经炎症加剧, 引起神经元的死亡, 引发AD[44]。
血脑屏障对于维持脑微环境的稳态至关重要, 在AD患者中观察到血脑屏障功能障碍。星形胶质细胞通过诱导屏障特性和转运蛋白的极化参与维持血脑屏障功能, 而衰老的星形胶质细胞会产生SASP因子, 影响血脑屏障的通透性[45], 如血管内皮生长因子(VEGF) 通过下调内皮细胞紧密连接(TJ) 相关蛋白, 引起内皮细胞凋亡并破坏TJ, 导致血脑屏障破坏[46]。抑制星形胶质细胞的衰老可以减少SASP, 降低星形胶质细胞介导的神经毒性[47], 维持血脑屏障正常功能。
谷氨酸对学习和记忆至关重要, 而谷氨酸具有兴奋性毒性, 过量会导致细胞死亡。兴奋性氨基酸转运蛋白2 (EAAT2) 是一种主要的谷氨酸转运蛋白, 在星形胶质细胞中含量丰富[48], 而EAAT2的缺失是AD的发病机制之一。神经元释放的谷氨酸被谷氨酸转运体1 (GLT-1) 和EAAT2带入星形胶质细胞后, 被谷氨酰胺合成酶(GS) 转化为谷氨酰胺[49, 50]。研究发现, GS的表达和活性具有年龄依赖性, 衰老星形胶质细胞中GS蛋白水平显著下降[51]。衰老的星形胶质细胞对谷氨酸的摄取和清除能力降低可能导致谷氨酸兴奋性毒性[52], 加重AD进程。
胆固醇是大脑重要的代谢底物, 支持神经元的平衡、突触完整性和受体功能。星形胶质细胞在脑胆固醇代谢中起重要作用, 主要受胆固醇调节元件结合蛋白2 (SREBP2) 和载脂蛋白E (ApoE) 控制[53, 54]。ApoE将脂质传递到神经元, 在AD病理学中起着重要作用。ApoE的分泌受酪氨酸激酶受体(Axl) 控制, 抑制受体可导致抑制的ApoE释放, 从而减缓AD进程[48]。
ATP是神经元活动的重要能量来源, 在大脑中, 星形胶质细胞通过有氧糖酵解将葡萄糖转化为ATP, 从而支持神经元的活动; 而衰老的星形胶质细胞糖代谢方式转化为氧化磷酸化, ATP生成减少, 导致神经元丢失或死亡[39], 最终导致AD。
2.4.3 小胶质细胞在AD患者和AD模型大鼠中, 小胶质细胞的数目均增加, 与患病程度呈正相关[55]。小胶质细胞呈现衰老时, 形态上表现为营养不良、细胞迁移能力降低, 并对损伤有更持续的炎症反应。研究发现, 过量的ROS可引起衰老小胶质细胞的促炎反应, 激活NF-κB通路促进促炎因子的表达, 而促炎因子的释放可以进一步刺激ROS的产生, 导致其吞噬功能减弱, 这一过程与髓细胞触发受体2 (TREM2) 密切相关[56]。富含铁的小胶质细胞在AD中的作用不容忽视[57]。有报道称在AD患者海马区, 特别是淀粉样斑块中发现铁积聚。小胶质细胞中释放的铁, 促使血红素加氧酶-1 (HO-1) 过度表达[58], 不仅能引起氧化应激, 使细胞死亡, 认知能力下降; 还加剧促炎反应, 损害小胶质细胞本身并加速衰老, 增加神经元的铁负荷, 导致神经元变性[19], 从而促进AD的发生。
2.4.4 少突胶质细胞有研究表明, AD患者大脑和转基因小鼠模型中存在表现出衰老表型的少突胶质细胞, 并且在Aβ刺激下会加速其衰老[56], 损害其功能。少突胶质细胞的髓鞘形成缺陷会破坏神经传导和认知功能, 髓鞘损伤被认为是导致AD的机制之一[57]。一些研究已经证明, 慢性缺氧抑制了中枢神经系统的少突胶质细胞分化和髓鞘形成[58], 与髓鞘碱性蛋白(MBP) 有关, MBP的缺失减少了Aβ的积累, 而损伤的少突胶质细胞导致AD中MBP增加[57]。此外, 少突胶质细胞表达多种受体和膜通道, 如ATP受体、钙通道, 兴奋性毒性或高水平的ATP会导致少突胶质细胞胞浆中钙离子过量, 激活caspase-3通路凋亡, 导致髓鞘破坏。因此, 兴奋性毒性和钙调节失调引起的少突胶质细胞和髓鞘损伤可能是AD的早期病理特征[20]。综上所述, 针对髓鞘损伤进行研究可能是治疗AD的另一个新方向。
2.4.5 神经干细胞在老年动物中, 衰老的神经干细胞细胞周期缩短, 修复能力和增殖能力减弱[59, 60], 而海马神经干细胞的加速耗竭与星形胶质细胞分化增加、神经发生减少相关[61]。神经干细胞具有自我更新和分化能力, 叉头盒转录因子O家族(FOXO) 通过调控基因来维持其功能[62]。研究表明, 敲除小鼠中的FOXO3基因会减少神经干细胞数量, 并导致自我更新能力下降, 并且FOXO3的丧失可导致Aβ的积累, 与AD密切相关[63]。此外, 转录抑制蛋白基因家族[如B细胞淋巴瘤滤过性病毒插入位点1 (BMI-1) 基因] 具有保护神经干细胞更新和增殖能力的作用, 敲除BMI-1可引起细胞周期阻滞, 导致其功能和数量下降, 即神经干细胞的衰老[62]。
神经干细胞存在氧气感应, 缺乏缺氧诱导因子1α (HIF-1α) 可导致神经干细胞增殖的丧失。研究表明, 小鼠处于低氧浓度时神经干细胞端粒缩短, 引起细胞周期阻滞, 增殖能力明显下降, 促使衰老、凋亡[64]。细胞衰老通常会损害神经发生, 导致脑功能丧失, 引发神经退行性疾病。
2.5 脑细胞之间的相互作用神经细胞衰老都有其特点, 但它们之间可相互影响、相互作用(表 1)。其中星形胶质细胞对其他细胞衰老影响较大。衰老的星形胶质细胞会导致Aβ积累, Aβ持续刺激可激活小胶质细胞释放大量的炎性介质, 如IL-6、TNF-α和IL-1α等, 形成慢性炎症反应, 其中TNF-α具有神经毒性, IL-6可抑制神经干细胞的增殖, 对神经干细胞的影响尤为突出重要。而激活的小胶质细胞迅速激活邻近细胞, 影响神经元的存活[65]。此外, 衰老的星形胶质细胞导致谷氨酸释放量增加, Aβ聚集, 使少突胶质细胞对损伤更敏感, 导致其衰老。
| Table 1 Senescence characteristics of brain cells and the mechanism involved in Alzheimer's disease (AD). SASP: Senescence-associated secretory phenotype; γH2AX: The γ phosphorylated form of the histone H2AX; SA-β-Gal: Beta-galactosidase; TREM2: Triggering receptor expressed on myeloid cells 2; NFTs: Neurofibrillary tangles; Aβ: Amyloid-β |
少突胶质细胞的主要作用是产生髓鞘, 衰老小鼠的髓鞘再生受损与小胶质细胞密切相关。而少突胶质细胞对神经元起支持和调节作用, 包括产生神经营养因子、抑制轴突生长和稳定神经元连接[21], 在缺氧条件下髓鞘受损, 可导致神经元减少[66]。
星形胶质细胞衰老、小胶质细胞激活、少突胶质细胞衰老等均会影响神经元的存活, 与AD的发生相关(图 1)。神经元的存活需要星形胶质细胞的支持, 星形胶质细胞中NF-κB通路的抑制可限制组织损伤, 并促进受损功能的恢复, 增加神经元存活率。此外, 小胶质细胞的慢性激活可诱导星形胶质细胞进入称为“A1”的神经毒性状态, 共同介导补体依赖性神经毒性, 导致神经元死亡[67]。
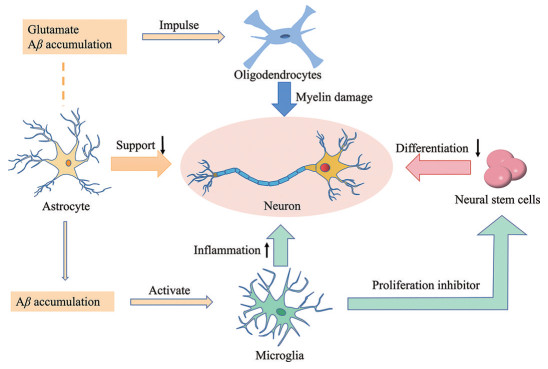
|
Figure 1 Brain cells interact with each other, which eventually caused neuron damage |
鉴于脑细胞衰老与AD的发病机制相关, 靶向脑细胞衰老成为一种有希望的治疗策略, 目前仍处于研究阶段。基于细胞衰老机制, 开发了senolytics——选择性消除衰老细胞的药物[68]。最具代表性的senolytics之一是酪氨酸激酶抑制剂达沙替尼(dasatinib) 和槲皮素(quercetin) 的联合使用(DQ)。研究表明, 在Tau转基因小鼠模型和APP/PS1转基因AD模型中, DQ可选择性地去除衰老的神经元和少突胶质细胞[69], 减少神经炎症, 起到神经保护作用, 并减轻Aβ聚集, 缓解认知功能缺陷, 改善记忆功能。Fisetin (F) 是一种随后发现的senolytic, 在老年小鼠的研究中发现, 间歇性F给药增强了认知功能。虽然senolytics为探索神经退行性疾病等衰老相关疾病的治疗方法提供了一条有希望的途径, 但这些药物的有效性和安全性尚需进一步研究[42]。
4 展望大量研究表明, 随着年龄的增长, 脑内衰老细胞积累, 且可能与AD等神经退行性疾病的病因密切相关。因此, 抑制神经元、星形胶质细胞、小胶质细胞等中枢神经系统内的细胞衰老及其功能改变, 有望为AD的治疗提供新的思路和方向。探索各神经细胞衰老特点和分子机制, 研究各细胞衰老之间的相互影响, 进一步确证不同类型细胞衰老与AD的关系, 可为防治AD等神经退行性疾病的发生提供科学依据。然而, 衰老的脑细胞是诱发AD的原因还是AD病理改变产生的结果尚不明确[70], 仍需要进行深入研究。迄今为止, 由于缺乏识别、分离或清除这些细胞的工具, 难以辨别不同类型衰老细胞对AD等神经退行性疾病病理机制的意义和贡献。细胞衰老特征及调控机制复杂, SASP作为细胞衰老的典型特征, 在AD等神经退行性疾病中的重要作用有待被深入挖掘和认识[71]。
作者贡献: 刘雨欣负责完成文章撰写; 高丽和秦雪梅负责文章思路的指导和文章的修改; 所有作者均对本文有所贡献。
利益冲突: 无利益冲突。
| [1] |
Martínez-Cué C, Rueda N. Cellular senescence in neurodegenerative diseases[J]. Front Cell Neurosci, 2020, 14: 16. |
| [2] |
Isaev NK, Stelmashook EV, Genrikhs EE. Neurogenesis and brain aging[J]. Rev Neurosci, 2019, 30: 573-580. DOI:10.1515/revneuro-2018-0084 |
| [3] |
Kritsilis M, Rizou SV, Koutsoudaki PN, et al. Ageing, cellular senescence and neurodegenerative disease[J]. Int J Mol Sci, 2018, 19: 2937. DOI:10.3390/ijms19102937 |
| [4] |
Calcinotto A, Kohli J, Zagato E, et al. Cellular senescence: aging, cancer, and injury[J]. Physiol Rev, 2019, 99: 1047-1078. DOI:10.1152/physrev.00020.2018 |
| [5] |
Si Z, Sun L, Wang X. Evidence and perspectives of cell senescence in neurodegenerative diseases[J]. Biomed Pharmacother, 2021, 137: 111327. DOI:10.1016/j.biopha.2021.111327 |
| [6] |
Hernandez-Segura A, Nehme J, Demaria M. Hallmarks of cellular senescence[J]. Trends Cell Biol, 2018, 28: 436-453. DOI:10.1016/j.tcb.2018.02.001 |
| [7] |
Lian H, Zheng H. Signaling pathways regulating neuron-glia interaction and their implications in Alzheimer's disease[J]. J Neurochem, 2016, 136: 475-491. DOI:10.1111/jnc.13424 |
| [8] |
Khacho M, Harris R, Slack RS. Mitochondria as central regulators of neural stem cell fate and cognitive function[J]. Nat Rev Neurosci, 2019, 20: 34-48. DOI:10.1038/s41583-018-0091-3 |
| [9] |
Cohen J, Torres C. Astrocyte senescence: evidence and significance[J]. Aging Cell, 2019, 18: e12937. DOI:10.1111/acel.12937 |
| [10] |
Vasile F, Dossi E, Rouach N. Human astrocytes: structure and functions in the healthy brain[J]. Brain Struct Funct, 2017, 222: 2017-2029. DOI:10.1007/s00429-017-1383-5 |
| [11] |
Hickman S, Izzy S, Sen P, et al. Microglia in neurodegeneration[J]. Nat Neurosci, 2018, 21: 1359-1369. DOI:10.1038/s41593-018-0242-x |
| [12] |
Domingues HS, Cruz A, Chan JR, et al. Mechanical plasticity during oligodendrocyte differentiation and myelination[J]. Glia, 2018, 66: 5-14. DOI:10.1002/glia.23206 |
| [13] |
Zhang H, Zheng Y. β Amyloid hypothesis in Alzheimer's disease: pathogenesis, prevention, and management[J]. Acta Acad Med Sin (中国医学科学院学报), 2019, 41: 702-708. |
| [14] |
Hou Y, Dan X, Babbar M, et al. Ageing as a risk factor for neurodegenerative disease[J]. Nat Rev Neurol, 2019, 15: 565-581. DOI:10.1038/s41582-019-0244-7 |
| [15] |
Batarseh YS, Duong QV, Mousa YM, et al. Amyloid-β and astrocytes interplay in amyloid-β related disorders[J]. Int J Mol Sci, 2016, 17: 338. DOI:10.3390/ijms17030338 |
| [16] |
Tiwari S, Atluri V, Kaushik A, et al. Alzheimer's disease: pathogenesis, diagnostics, and therapeutics[J]. Int J Nanomedicine, 2019, 14: 5541-5554. DOI:10.2147/IJN.S200490 |
| [17] |
Jonsson T, Stefansson H, Steinberg S, et al. Variant of TREM2 associated with the risk of Alzheimer's disease[J]. N Engl J Med, 2013, 368: 107-116. DOI:10.1056/NEJMoa1211103 |
| [18] |
Iram T, Trudler D, Kain D, et al. Astrocytes from old Alzheimer's disease mice are impaired in Aβ uptake and in neuroprotection[J]. Neurobiol Dis, 2016, 96: 84-94. DOI:10.1016/j.nbd.2016.08.001 |
| [19] |
Angelova DM, Brown DR. Microglia and the aging brain: are senescent microglia the key to neurodegeneration?[J]. J Neurochem, 2019, 151: 676-688. DOI:10.1111/jnc.14860 |
| [20] |
Wei Z, Cui XL, Chen XC, 等. Oligomeric amyloid-β accelerated microglia senescence[J]. J Apoplexy Nerv Dis (中风与神经疾病杂志), 2020, 37: 680-684. |
| [21] |
Nasrabady SE, Rizvi B, Goldman JE, et al. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes[J]. Acta Neuropathol Commun, 2018, 6: 22. DOI:10.1186/s40478-018-0515-3 |
| [22] |
Musi N, Valentine JM, Sickora KR, et al. Tau protein aggregation is associated with cellular senescence in the brain[J]. Aging Cell, 2018, 17: e12840. DOI:10.1111/acel.12840 |
| [23] |
Bussian TJ, Aziz A, Meyer CF, et al. Clearance of senescent glial cells prevents Tau-dependent pathology and cognitive decline[J]. Nature, 2018, 562: 578-582. DOI:10.1038/s41586-018-0543-y |
| [24] |
Bemiller SM, McCray TJ, Allan K, et al. TREM2 deficiency exacerbates Tau pathology through dysregulated kinase signaling in a mouse model of tauopathy[J]. Mol Neurodegener, 2017, 12: 74. DOI:10.1186/s13024-017-0216-6 |
| [25] |
Vogels T, Murgoci AN, Hromádka T. Intersection of pathological Tau and microglia at the synapse[J]. Acta Neuropathol Commun, 2019, 7: 109. DOI:10.1186/s40478-019-0754-y |
| [26] |
Nicaise AM, Willis CM, Crocker SJ, et al. Stem cells of the aging brain[J]. Front Aging Neurosci, 2020, 12: 247. DOI:10.3389/fnagi.2020.00247 |
| [27] |
Tse KH, Herrup K. DNA damage in the oligodendrocyte lineage and its role in brain aging[J]. Mech Ageing Dev, 2017, 161: 37-50. DOI:10.1016/j.mad.2016.05.006 |
| [28] |
Al-Mashhadi S, Simpson JE, Heath PR, et al. Oxidative glial cell damage associated with white matter lesions in the aging human brain[J]. Brain Pathol, 2015, 25: 565-574. DOI:10.1111/bpa.12216 |
| [29] |
Fang EF, Scheibye-Knudsen M, Chua KF, et al. Nuclear DNA damage signalling to mitochondria in ageing[J]. Nat Rev Mol Cell Biol, 2016, 17: 308-321. DOI:10.1038/nrm.2016.14 |
| [30] |
Chapman J, Fielder E, Passos JF. Mitochondrial dysfunction and cell senescence: deciphering a complex relationship[J]. FEBS Lett, 2019, 593: 1566-1579. DOI:10.1002/1873-3468.13498 |
| [31] |
Weidling IW, Swerdlow RH. Mitochondria in Alzheimer's disease and their potential role in Alzheimer's proteostasis[J]. Exp Neurol, 2020, 330: 113321. DOI:10.1016/j.expneurol.2020.113321 |
| [32] |
Vasileiou PVS, Evangelou K, Vlasis K, et al. Mitochondrial homeostasis and cellular senescence[J]. Cells, 2019, 10: 686. |
| [33] |
Kang I, Chu CT, Kaufman BA. The mitochondrial transcription factor TFAM in neurodegeneration: emerging evidence and mechanisms[J]. FEBS Lett, 2018, 592: 793-811. DOI:10.1002/1873-3468.12989 |
| [34] |
Chini C, Hogan KA, Warner GM, et al. The NADase CD38 is induced by factors secreted from senescent cells providing a potential link between senescence and age-related cellular NAD+ decline[J]. Biochem Biophys Res Commun, 2019, 513: 486-493. DOI:10.1016/j.bbrc.2019.03.199 |
| [35] |
Beckervordersandforth R, Ebert B, Schäffner I, et al. Role of mitochondrial metabolism in the control of early lineage progression and aging phenotypes in adult hippocampal neurogenesis[J]. Neuron, 2017, 93: 560-573. DOI:10.1016/j.neuron.2016.12.017 |
| [36] |
Flynn RL, Heaphy CM. Surviving telomere attrition with the MiDAS touch[J]. Trends Genet, 2019, 35: 783-785. DOI:10.1016/j.tig.2019.08.008 |
| [37] |
Liu MY, Nemes A, Zhou QG. The emerging roles for telomerase in the central nervous system[J]. Front Mol Neurosci, 2018, 11: 160. DOI:10.3389/fnmol.2018.00160 |
| [38] |
Borodkina AV, Deryabin PI, Giukova AA, et al. " Social life" of senescent cells: what is SASP and why study it?[J]. Acta Naturae, 2018, 10: 4-14. DOI:10.32607/2075-8251-2018-10-2-48-5710.32607/20758251-2018-10-4-4-18 |
| [39] |
Han X, Zhang T, Liu H, et al. Astrocyte senescence and Alzheimer's disease: a review[J]. Front Aging Neurosci, 2020, 12: 148. DOI:10.3389/fnagi.2020.00148 |
| [40] |
Gaikwad S, Puangmalai N, Bittar A, et al. Tau oligomer induced HMGB1 release contributes to cellular senescence and neuropathology linked to Alzheimer's disease and frontotemporal dementia[J]. Cell Rep, 2021, 36: 109419. DOI:10.1016/j.celrep.2021.109419 |
| [41] |
Ishikawa S, Ishikawa F. Proteostasis failure and cellular senescence in long-term cultured postmitotic rat neurons[J]. Aging cell, 2020, 19: e13071. |
| [42] |
Wissler Gerdes EO, Zhu Y, Weigand BM, et al. Cellular senescence in aging and age-related diseases: implications for neurodegenerative diseases[J]. Int Rev Neurobiol, 2020, 155: 203-234. |
| [43] |
Wei Z, Chen XC, Song Y, et al. Amyloid β protein aggravates neuronal senescence and cognitive deficits in 5XFAD mouse model of Alzheimer's disease[J]. Chin Med, 2016, 129: 1835-1844. DOI:10.4103/0366-6999.186646 |
| [44] |
Jurga AM, Paleczna M, Kadluczka J, et al. Beyond the GFAP-astrocyte protein markers in the brain[J]. Biomolecules, 2021, 11: 1361. DOI:10.3390/biom11091361 |
| [45] |
Yamazaki Y, Kanekiyo T. Blood-brain barrier dysfunction and the pathogenesis of Alzheimer's disease[J]. Int J Mol Sci, 2017, 18: 1965. DOI:10.3390/ijms18091965 |
| [46] |
Horng S, Therattil A, Moyon S, et al. Astrocytic tight junctions control inflammatory CNS lesion pathogenesis[J]. J Clin Invest, 2017, 127: 3136-3151. DOI:10.1172/JCI91301 |
| [47] |
Ungerleider K, Beck J, Lissa D, et al. Astrocyte senescence and SASP in neurodegeneration: Tau joins the loop[J]. Cell Cycle, 2021, 20: 752-764. DOI:10.1080/15384101.2021.1909260 |
| [48] |
Meldolesi J. Astrocytes: news about brain health and diseases[J]. Biomedicines, 2020, 8: 394. DOI:10.3390/biomedicines8100394 |
| [49] |
Pajarillo E, Rizor A, Lee J, et al. The role of astrocytic glutamate transporters GLT-1 and GLAST in neurological disorders: potential targets for neurotherapeutics[J]. Neuropharmacology, 2019, 161: 107559. DOI:10.1016/j.neuropharm.2019.03.002 |
| [50] |
Lin DD, Wei CW, Wu AS. Recent advance in influence of astrocyte senescence in neurodegenerative diseases[J]. Chin J Neuromed (中华神经医学杂志), 2021, 20: 844-848. |
| [51] |
Bellaver B, Souza DG, Souza DO, et al. Hippocampal astrocyte cultures from adult and aged rats reproduce changes in glial functionality observed in the aging brain[J]. Mol Neurobiol, 2017, 54: 2969-2985. DOI:10.1007/s12035-016-9880-8 |
| [52] |
González-Reyes RE, Nava-Mesa MO, Vargas-Sánchez K, et al. Involvement of astrocytes in Alzheimer's disease from a neuroinflammatory and oxidative stress perspective[J]. Front Mol Neurosci, 2017, 10: 427. DOI:10.3389/fnmol.2017.00427 |
| [53] |
Ferris HA, Perry RJ, Moreira GV, et al. Loss of astrocyte cholesterol synthesis disrupts neuronal function and alters whole-body metabolism[J]. Proc Natl Acad Sci U S A, 2017, 114: 1189-1194. DOI:10.1073/pnas.1620506114 |
| [54] |
Mahley RW. Central nervous system lipoproteins: ApoE and regulation of cholesterol metabolism[J]. Arterioscler Thromb Vasc Biol, 2016, 36: 1305-1315. DOI:10.1161/ATVBAHA.116.307023 |
| [55] |
Olmos-Alonso A, Schetters ST, Sri S, et al. Pharmacological targeting of CSF1R inhibits microglial proliferation and prevents the progression of Alzheimer's-like pathology[J]. Brain, 2016, 139: 891-907. DOI:10.1093/brain/awv379 |
| [56] |
Yeh FL, Hansen DV, Sheng M. TREM2, microglia, and neurodegenerative diseases[J]. Trends Mol Med, 2017, 23: 512-533. DOI:10.1016/j.molmed.2017.03.008 |
| [57] |
Masaldan S, Clatworthy SAS, Gamell C, et al. Iron accumulation in senescent cells is coupled with impaired ferritinophagy and inhibition of ferroptosis[J]. Redox Biol, 2018, 14: 100-115. DOI:10.1016/j.redox.2017.08.015 |
| [58] |
Fernández-Mendívil C, Luengo E, Trigo-Alonso P, et al. Protective role of microglial HO-1 blockade in aging: implication of iron metabolism[J]. Redox Biol, 2021, 38: 101789. DOI:10.1016/j.redox.2020.101789 |
| [59] |
Ma RJ, Zhu L, Xu J. Wnt/β-catenin signal pathway regulates senescence of human neural stem cells[J]. J Tongji Univ (Med Sci) (同济大学学报(医学版)), 2017, 38: 1-6. |
| [60] |
Apple DM, Solano-Fonseca R, Kokovay E. Neurogenesis in the aging brain[J]. Biochem Pharmacol, 2017, 141: 77-85. DOI:10.1016/j.bcp.2017.06.116 |
| [61] |
Díaz-Moreno M, Armenteros T, Gradari S, et al. Noggin rescues age-related stem cell loss in the brain of senescent mice with neurodegenerative pathology[J]. Proc Natl Acad Sci U S A, 2018, 115: 11625-11630. DOI:10.1073/pnas.1813205115 |
| [62] |
Navarro Negredo P, Yeo RW, Brunet A. Aging and rejuvenation of neural stem cells and their niches[J]. Cell Stem Cell, 2020, 27: 202-223. DOI:10.1016/j.stem.2020.07.002 |
| [63] |
Goswami S, Kareem O, Goyal RK, et al. Role of forkhead transcription factors of the O class (FoxO) in development and progression of Alzheimer's disease[J]. CNS Neurol Disord Drug Targets, 2020, 19: 709-721. DOI:10.2174/1871527319666201001105553 |
| [64] |
Min JZ, Xiao MW. Advances in neural stem cell senescence[J]. Chin J Pract Nerv Dis (中国实用神经疾病杂志), 2016, 19: 141-142. |
| [65] |
Ye S, Yao YC, Wang Y. The research progress on the mechanism of microglia in Alzheimer's disease[J]. Guangdong Chem Ind (广东化工), 2020, 47: 101-102. |
| [66] |
Wang F, Yang YJ, Yang N, et al. Enhancing oligodendrocyte myelination rescues synaptic loss and improves functional recovery after chronic hypoxia[J]. Neuron, 2018, 99: 689-701. DOI:10.1016/j.neuron.2018.07.017 |
| [67] |
Hansen DV, Hanson JE, Sheng M. Microglia in Alzheimer's disease[J]. J Cell Biol, 2018, 217: 459-472. DOI:10.1083/jcb.201709069 |
| [68] |
Robbins PD, Jurk D, Khosla S, et al. Senolytic drugs: reducing senescent cell viability to extend health span[J]. Annu Rev Pharmacol Toxicol, 2021, 61: 779-803. DOI:10.1146/annurev-pharmtox-050120-105018 |
| [69] |
Lee S, Wang EY, Steinberg AB, et al. A guide to senolytic intervention in neurodegenerative disease[J]. Mech Ageing Dev, 2021, 200: 111585. DOI:10.1016/j.mad.2021.111585 |
| [70] |
Saez-Atienzar S, Masliah E. Cellular senescence and Alzheimer disease: the egg and the chicken scenario[J]. Nat Rev Neurosci, 2020, 21: 433-444. DOI:10.1038/s41583-020-0325-z |
| [71] |
Guerrero A, De Strooper B, Arancibia-Cárcamo IL. Cellular senescence at the crossroads of inflammation and Alzheimer's disease[J]. Trends Neurosci, 2021, 44: 714-727. DOI:10.1016/j.tins.2021.06.007 |
 2022, Vol. 57
2022, Vol. 57


