阿尔茨海默病(Alzheimer's disease, AD) 是老年神经退行性疾病中发病率最高的疾病。据国际阿尔茨海默病协会(ADI) 发布的报告显示[1], 到2018年9月, 全球的痴呆症患者约有5 000万名, 且每3秒就会增加一名。根据2020年我国第7次全国人口普查显示, 我国60岁及以上人口数为26 402万, 占全国总人口数的18.70% (其中, 65岁及以上人口为19 064万人, 占13.50%)。与2010年相比, 60岁及以上人口的比重上升了5.44%[2]。随着我国社会人口结构老龄化的加剧, AD等衰老相关疾病已经成为我国面临的重要公共卫生和社会问题。而目前针对AD的脑内病理特征, 如β-淀粉样蛋白(amyloid β-protein, Aβ) 和Tau蛋白沉积, 已有多种药物尝试, 但至今所有临床试验药物均未能治愈AD。我国在中草药的临床应用和基础研究中, 积累了大量的临床经验和药效学资料, 在认知能力改善的临床诊疗、中药应用方面也有长期积累。且已有研究证实, 许多中药单分子都具有明确的认知改善效应。因此, 基于中药在改善认知功能方面的长期临床实践和研究, 深入挖掘中药分子在衰老相关认知功能障碍中发挥作用的有效成分及其机制, 对于研发有效改善衰老和防治AD的新药具有重要的意义。
1 AD的发病机制 1.1 老年痴呆的主要类型目前在临床上, 主要将老年痴呆分为AD、血管性痴呆以及混合型痴呆。其中, AD的发病率最高。该病是涉及中枢与外周多因素引发的以认知损伤为主要表现的综合征, 它的主要特征是Aβ沉积、神经元纤维缠结和认知功能损害等。AD患者的临床表现主要为渐进性发病, 最终发展为全面的认知功能衰退。
1.2 AD发病的主要假说目前, 针对AD的发病机制已有广泛的研究, 其中Aβ淀粉样蛋白假说、Tau蛋白假说、氧化应激假说、神经炎症假说等占主导地位, 除此之外, 糖原合成激酶3 (glycogen synthase kinase-3, GSK-3) 假说、线粒体功能障碍等假说也被逐步提出。
1.2.1 Aβ淀粉样蛋白假说淀粉前体蛋白(amyloid precursor protein, APP) 是一种在神经元突触中集中存在的膜内在蛋白, 可以被β-分泌酶或γ-分泌酶切割生成Aβ, 并以单体、二聚体和高级低聚物等多种形式存在于脑内, 其中Aβ40与Aβ42最为常见, 而Aβ42具有极强的形成淀粉样斑块的能力。细胞内中性内肽酶等Aβ降解酶水平的降低会导致Aβ过表达, 进而在脑内累积并引起老年斑的形成和沉积, 同时伴有炎症反应、小胶质细胞活化、星形胶质细胞增生等复杂的级联事件, 最终引起患者的神经元受损和认知功能障碍[3, 4]。
1.2.2 Tau蛋白假说微管是维持细胞完整性的重要因素之一, 而Tau蛋白在维持微管的稳定性中起着重要作用。
研究发现, Tau蛋白具有84个磷酸化位点, 正常情况下, Tau蛋白的磷酸化和去磷酸化处于动态平衡; 病理条件下, Tau蛋白将会过度磷酸化, 从而无法被微管蛋白识别, 破坏微管的稳定性, 在细胞内积累并导致肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) 等炎性因子的过度产生, 引起脑细胞的炎症反应和神经损伤。同时, 过度产生的炎性介质还会激活一系列激酶, 这些激酶又将进一步引起Tau蛋白的磷酸化和螺旋聚集, 在AD患者的脑内形成神经元纤维缠结, 导致其神经损伤及认知功能障碍[5, 6]。
1.2.3 氧化应激假说AD早期, Aβ可能进入线粒体以增加自由基的产生, 引起细胞内氧化和抗氧化作用失衡, 氧化作用增强, 进而降低超氧化物歧化酶(superoxide dismutase, SOD) 等激酶活性, 产生丙二醛(malondialdehyde, MDA) 等大量过氧化物, 导致DNA损伤, 造成细胞衰老, 抗氧化酶活性降低, 且由于神经细胞的耗氧量更高, 更易受到自由基的破坏。此外, 在死亡的AD患者的脑组织中也发现, 线粒体膜上存在与电子传输链的破坏有关的Aβ和APP, 这与AD的发生密切相关[7]。
1.2.4 胆碱能假说乙酰胆碱(acetylcholine, ACh) 是大脑中的一种神经递质, 在学习、记忆和认知功能的神经调节中起着重要作用, 其合成主要由胆乙酰转移酶(choline acetyltransferase, ChAT) 负责。有研究指出, AD患者的大脑中ChAT含量偏低。
胆碱能假说指出, 胆碱能神经元在AD早期受损, 致使参与前脑ACh合成的胆碱能功能丧失, 神经信号的传递受阻, 进而导致记忆能力下降及认知功能障碍[8]。目前开发的胆碱酯酶抑制剂只能在一定程度上缓解认知功能障碍, 不能完全阻止AD病理进程, 并且只有在AD晚期以较高的剂量使用才具有优势, 同时还需要控制药量以减轻不良反应。因此, 优化治疗策略, 开发新颖的治疗方法是防治AD的重中之重。
1.2.5 神经炎症假说越来越多的证据表明, 慢性小胶质细胞增生引起的神经炎症是诱发AD的重要原因。AD患者大脑中的淀粉样斑块与多种炎症相关蛋白和活化的小胶质细胞簇相互作用, 引发了脑内的神经炎症, 导致脑组织周围促炎因子的过表达, 进而损害神经元并危害大脑功能。同时, 胶质细胞产生的一氧化氮合酶等物质也会加重机体的氧化应激, 诱导神经炎症的发生。此外, 已有研究发现, 在AD患者和动物模型中, 中枢和外周的白介素-6 (interleukin-6, IL-6) 水平都有显著升高, 且Aβ斑块附近的升高尤为明显[9]。
1.2.6 GSK-3假说GSK-3是一种脯氨酸定向的丝氨酸/苏氨酸激酶, 有α和β两种亚型。两种亚型都在微管的结合中发挥重要作用。其中, GSK-3β在细胞活动中具有重要作用, 有研究发现它不仅能增强Tau蛋白的活性, 使其过度磷酸化, 还有可能促进Aβ的沉积和老年斑的形成。目前, GSK-3已成为多种神经退行性疾病治疗的关键靶点[10]。
1.2.7 线粒体功能障碍线粒体是产生能量的主要场所, 大脑中含有大量的线粒体以满足巨大的能量需求。当线粒体受损时, 能量代谢会产生障碍, 大脑的功能极易受到影响, 引起AD相关病理改变; 此外, 当线粒体内Aβ积累时, 线粒体膜电位异常, 通透性增加, 导致神经细胞凋亡, 进而引发AD患者神经元丢失和认知功能障碍; 同时, 线粒体功能受损还会导致自由基的积累, 加剧脑内氧化应激反应[7]。
1.2.8 肠道菌群失调有研究表明, 肠道菌群多样性的改变可能引发神经炎症、Aβ聚集、Tau蛋白病变等病理改变。短链脂肪酸等肠道细菌代谢产物具有保护神经, 改善学习记忆的功能, 当其缺乏时会加重AD[11]; 而肠道菌群失调时, 促炎菌增加, 促炎产物脂多糖和Aβ等大量生成, 都可能诱发脑内炎症。同时, 益生菌的减少会导致大脑活动水平下降, 加剧认知功能的衰退[12, 13]。因此, 肠道菌群的失调与AD的发生有密切联系。
1.3 中医对老年痴呆的认识 1.3.1 中医学中老年痴呆的类型在中医学中, 有学者将老年痴呆分为5种病证: 肾虚髓亏证、心脾两虚证、心肝阴虚证、痰浊阻窍证以及气滞血瘀证[14]。其中, 肾虚髓亏是指患者肾气不足, 骨髓亏损, 运动能力下降, 思维活动能力衰退; 心脾两虚是指患者心血和脾脏虚弱, 进而出现疲乏无力、失眠腹胀、心悸等病症; 心肝阴虚表现为心烦不宁、肝气郁结、多梦盗汗等症状; 痰浊阻窍是指由于脏器功能失调, 经络阻塞而导致的神经呆滞、头昏胸闷、舌苔白腻等病症; 气滞血瘀则是说患者体内肝气阻滞, 血液淤堵, 表现为气阻胸闷, 咳喘心悸, 舌唇暗紫等。
1.3.2 中医学中AD的病因中医学认为AD发病的根本原因是肾虚[15]。肾精化生脑髓, 脑髓是人类记忆、思维和精神的物质基础。随着年龄的增长, 人体内肾气亏损, 肾精不足, 导致髓海干涸, 精神失常, 进而表现为记忆能力下降和认知功能障碍等痴呆症状, 同时伴有疲乏头晕、腰膝酸软、排泄失衡等病症。
痰浊、瘀血是AD发病的重要原因[15]。老年人因肾气亏虚、肝脏功能减退导致体内津液积聚成痰, 血液堵塞成淤。内生痰浊和血瘀则会使脑络不通, 精神失调, 元神蒙蔽, 进而表现为迟钝健忘、言语不畅和眩晕痴呆等症状。肾精亏虚在不同的病理阶段产生痰浊、血瘀, 而痰浊血瘀又会影响气血运行, 导致肾气亏损更甚, 两者之间形成恶性循环。
综上, 中医学认为AD是一种本虚标实的疾病, 肾虚为根本, 加之痰浊血瘀共同导致患者认知障碍, 精神失调等痴呆症状。
2 改善AD相关认知功能的中药及有效分子 2.1 中药经典方中药经典方通常由多种中药材组成, 含有大量的活性成分, 可对疾病进行多靶点、全方位的治疗。目前, 诸多中医经典药方已被证实对认知障碍及AD具有明确疗效, 其相关改善机制也进行了初步探索, 如表 1[16-22]所示。
| Table 1 Classic prescription of traditional Chinese medicine improves aging related cognitive impairment |
养血培本健脑方由熟地、黄芪、板桥党参、枸杞子等多种中药组成。该方针对“本虚”进行治疗, 通过祛除血瘀、升发精气、恢复脏器功能以达到对认知能力的改善作用。王雨等[16]的研究发现, 该方能显著改善Aβ25-35注射的SD大鼠学习认知障碍, 降低大鼠脑内胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP) 水平, 减少海马CA1区神经细胞的凋亡, 推测其可能是通过抑制星形胶质细胞的增生, 进而减轻神经元的损伤和凋亡, 发挥对AD大鼠认知功能障碍的治疗作用。
加减薯蓣丸中含有山药、制首乌、熟地、白芍和当归等多种补肾益气、通瘀祛病的中药, 并通过诸药并用以达到充盈脑髓、养血通气、开窍益智的目的。谢文婷等[17]利用侧脑室注射Aβ1-42的SD大鼠建立AD模型, 通过实验发现, 与模型组相比, 加减薯蓣丸治疗组大鼠海马中TNF-α、半胱氨酸蛋白酶-3 (cysteinyl aspartate specific proteinase-3, caspase-3) 蛋白和mRNA的水平都显著降低, 指出该药可能是通过减轻神经炎症, 减少神经细胞凋亡, 进而改善认知障碍。
受《内经》的启发, 王晋平等[23]提出了通过增强肺部功能和滋补阳气, 改善老年痴呆患者认知功能障碍的益肺温阳化浊汤, 该药方中含有制附子、淫羊藿、生晒参等多种药材。通过实验发现, 益肺温阳化浊汤可以显著提高Aβ1-40诱导的SD大鼠的学习认知能力, 降低大鼠脑内磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase, PI3K)、蛋白激酶B (protein kinase B, Akt)、重组人自噬效应蛋白(beclin 1, BECN1) 等蛋白含量, 增强哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR) 蛋白的表达, 通过激活PI3K/Akt-mTOR通路, 提高细胞清除Aβ沉积的能力, 进而减轻Aβ的毒害作用[18]。
小柴胡化汤由柴胡、黄芩和人参等药材组成, 是补肾益津、调气养血的代表药方。陈靖等[19]以该方为基础, 化裁后应用于Aβ1-42诱导的SPF小鼠建立的AD模型以探究其对学习记忆能力的改善作用。通过研究发现小柴胡化裁方治疗组的AD小鼠脑内IL-6等炎性因子、p-p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 和核因子-κB (nuclear factor-κB, NF-κB) 含量显著降低, 提示该方可能作用于p38MAPK/NF-κB通路, 进而下调AD小鼠炎症相关蛋白的水平, 减轻Aβ的毒害作用, 发挥保护受损神经元, 提高其学习记忆能力的效能。
好忘方是《备急千金要方》中记载的由续断、肉苁蓉、远志、茯苓等中药材组成的经典方剂, 该方剂通过补肾精、填脑髓、化痰祛瘀以达到治疗痴呆的目的。通过利用SAMP8快速老化痴呆模型小鼠对好忘方作用的分子机制进行研究, 郭小燕等[20]发现好忘方可以上调P8小鼠体内PKA (protein kinase A)/GSK3β/Tau和PKA/CREB (cAMP-response element binding protein) 通路的蛋白水平, 从而减少p-Tau的水平, 改善小鼠的认知功能障碍。
二至丸是由女贞子和旱莲草等药材制成的复方药剂, 具有益肾、保护肝脏的功效。梁梅亭等[21]探索了二至丸对SAMP8小鼠的治疗作用。实验结果表明该药能显著改善P8小鼠的认知障碍, 且与模型组相比, 中浓度治疗组和SAMR1组相同的差异蛋白有20个, 如线粒体顺乌头酸酶(mitochondrial aconitase, m-aconitase, ACO2)、磷酸甘油酸激酶1 (phosphoglycerate kinase 1, PGK1)、细胞色素C (cytochrome C, Cyt-C) 等, 说明二至丸对AD的作用机制涉及多条通路, 其中包括减轻线粒体氧化应激、降低机体炎症损伤和阻止细胞凋亡等。
益智健脑颗粒中的主要成分有黄芪、黄连和西洋参, 该药具有补气益智、调养气血、安神的作用。利用SAMP8模型鼠, 蒋美艳等[22]观察了应用益智健脑颗粒后小鼠海马中有意义的差异蛋白, 实验结果表明该药物可以通过降低小鼠脑内p-Tau水平, 减少神经纤维缠结等对AD小鼠发挥治疗作用。
中药典方大多针对AD模型鼠脑内Aβ的沉积及Tau蛋白的过磷酸化发挥作用, 减轻由其所致的神经炎症及过度氧化应激, 进而达到提高认知功能的目的。除上述经典药方外, 还有一些方剂, 如地黄饮子、还脑益聪方等, 也可能具有一定的认知改善作用[24, 25]。
2.2 中药中的功效分子及作用机制中药方剂是由多种药材按一定比例配制而成, 诸多学者利用AD动物模型对上述典方中的黄芩、黄连、人参、柴胡等药材进行实验与研究, 探索其有效成分及分子机制。本文针对不同的作用机制对部分已有明确疗效的中药单分子物质进行了总结, 如表 2[26-54]所示。
| Table 2 The effective components of traditional Chinese medicine for improving cognitive impairment related to AD |
目前, 已有多种中药活性成分被发现可通过不同分子作用于Aβ沉积或神经炎症, 发挥改善认知功能的作用, 如类叶升麻苷作用于Akt/NF-κB信号通路、白藜芦醇作用于沉默调节蛋白1 (sirtuin 1, SIRT1) 途径、淫羊藿苷降低β-分泌酶1 (beta-secretase 1, BACE1) 蛋白的水平等, 最终都降低了AD模型动物的Aβ沉积或神经炎症水平。下文对部分中药有效成分的作用机制作以简述。
黄芩素是来源于黄芩中的一种化合物, 临床上已被用来治疗小儿急性呼吸道感染、慢性气管炎和肾炎等疾病。有大量研究表明, 黄芩素可以改善AD和糖尿病性认知障碍等多种认知障碍。Li等[26]研究发现, 黄芩素可以抑制SAMP8小鼠皮层中炎症因子的分泌, 抑制酪氨酸激酶2 (Janus kinase 2, JAK2) 信号转导子和转录激活子1 (signal transducer and active of transcription 1, STAT1) 信号通路的激活, 显著降低小鼠皮层Aβ和晚期糖基化终产物特异性受体(receptor for advanced glycation end products, RAGE) 的水平。
黄连素又名小檗碱, 是一种来源于黄连和黄柏等植物的生物碱类物质。有研究发现, 黄连素能显著提高3× Tg AD小鼠的空间学习和记忆保持能力, 促进细胞自噬活性, 可以通过提高脑内细胞自噬微管相关蛋白轻链3-Ⅱ (microtubule-associated proteins light chain 3-II, LC3-II)、BECN1、组织蛋白酶-D的水平, 降低选择性自噬接头蛋白(sequestosome 1, P62)、B淋巴细胞瘤-2 (B-cell lymphoma-2, Bcl-2)、Aβ和APP的水平, 进而减少AD小鼠海马Aβ斑块沉积, 抑制BACE1表达[27]。且另有研究发现, 黄连素可改善APP/PS1小鼠的学习和记忆能力, 降低APP/PS1小鼠海马中过度磷酸化的Tau蛋白, 降低NF-κB信号的活性[28]。
人参皂苷Rg1是由人参中提取得来的一种四环三萜类衍生物, 在预防AD方面具有较为广阔的应用前景。研究结果表明, 在Aβ1-42诱导的AD模型中, 人参皂苷Rg1可显著降低周期蛋白依赖性激酶5 (cyclin-dependent kinase 5, CDK5) 的表达, 抑制丝氨酸273处的过氧化物酶体增殖物激活受体γ (peroxisome proliferators-activated receptors γ, PPARγ) 磷酸化, 提高胰岛素降解酶(insulin degrading enzyme, IDE) 的表达, 下调BACE1和APP的表达, 降低Aβ1-42的水平, 减轻神经元凋亡[30]。
藁本内酯是传统中药柴胡、当归等挥发油的主要活性成分。有研究报道, 藁本内酯通过抑制Bcl-2的表达下调、Bcl-2关联蛋白X (Bcl-2 associated X protein, Bax) 的表达上调、切割型caspase-3和caspase-8的激活和Cyt-C的释放, 抑制Aβ25-35对人神经母细胞瘤SH-SY5Y产生的细胞毒性, 从而减少Aβ引起的细胞凋亡, 减轻Aβ毒害[31]。另有研究表明, 藁本内酯能显著改善APP/PS1小鼠的神经行为缺陷, 降低小鼠脑内聚集的可溶性和不溶性Aβ42水平, 减少Aβ斑块沉积, 显著增强sAPPα的释放, 阻止Aβ的产生[32]。细胞实验和动物实验共同证明了藁本内酯可通过减轻Aβ沉积的毒害达到对AD的治疗目的。
淫羊藿苷是中药淫羊藿中的有效成分, 已被证实具有补肾壮阳、抗衰老、抗肿瘤等功能。Li等[33]发现淫羊藿苷治疗后的SAMP8小鼠空间学习和记忆保持能力显著提高, 海马内BACE1的表达量、Aβ的水平以及Bax/Bcl-2的比例有显著的降低, 提示淫羊藿苷对AD的改善可能通过是降低Bax/Bcl-2的比例, 降低BACE1的表达量, 减轻Aβ的沉积实现的。
类叶升麻苷来源于列当科植物肉苁蓉中, 具有抗疲劳、调节免疫等药理作用。王冬青等[34]利用APP/PS1小鼠对类叶升麻苷的作用机制进行探索, 通过实验发现治疗组小鼠海马及皮层中NF-κB含量显著降低, Akt水平降低, 磷酸化程度加深。说明类叶升麻苷可调节AD小鼠的Akt/NF-κB信号通路, 减少细胞凋亡, 保护神经, 并进一步推测, 该药物可能是通过降低小鼠脑内Akt/NF-κB信号通路活性以减轻Aβ沉积的毒害, 进而发挥对AD认知功能障碍的改善作用。
芦丁又名芸香苷, 来源于芸香科植物和豆科植物等, 是一种广泛存在于植物界的黄酮类物质。有研究表明, 芦丁干预的高脂饲养的SAMP8小鼠脑内海马区的Aβ42蛋白含量减少, 指出Aβ的降解可能主要通过IDE介导。同时该研究也发现高脂饮食结合芦丁干预可降低星型胶质细胞及小胶质细胞的活化, 降低神经炎症, 指出芦丁对于防治AD可能具有重要意义[35]。Pan等[36]也发现给予APP/PS1小鼠芦丁干预后, 能降低小鼠脑内Aβ水平, 降低神经胶质细胞的活化水平, 改善小鼠的学习记忆能力。
白藜芦醇是一种来源于毛叶藜芦中的非黄酮类多酚化合物, 具有多种生物活性。研究表明, 白藜芦醇可有效逆转Aβ25-35诱导的学习能力损伤, 通过减少APP裂解, 抑制Aβ生成并刺激自噬等途径减少Aβ聚集[37]。SIRT1可以通过调节CREB的表达来调节学习和记忆能力, 而在AD患者的大脑中SIRT1和CREB蛋白的水平都显著降低, 且这种降低与患者大脑皮质中Aβ的沉积密切相关。在利用Aβ诱导的AD模型大鼠中, Wang等[38]发现白藜芦醇可防止记忆损伤和Aβ诱导的学习功能衰退, 并恢复大鼠海马中的SIRT1水平和CREB磷酸化, 提示白藜芦醇可能是通过激活SIRT1途径, 保护神经元免受Aβ的毒害。
圣草酚是一种主要存在于柠檬中的天然黄酮类化合物, 具有良好的抗炎、抗氧化及抗癌等生物活性。研究发现圣草酚能显著地预防由脂多糖诱导的记忆障碍, 并且能够通过抑制Toll样受体4 (Toll-like receptors 4, TLR4)、MAPK、PI3K/Akt信号通路以及激活SIRT1途径, 阻断NF-κB的下游转位, 从而降低脂多糖诱导的Aβ沉积。因此, He等[39]认为圣草酚可通过多条信号通路减轻Aβ沉积, 改善记忆功能障碍。
甘草素是从甘草中提取的一种黄酮类化合物, 目前常被用作甜味剂。Du等[41]研究表明, 甘草素可通过调节小胶质细胞M1/M2的转化, 减少Aβ的产生, 降低含NLR家族PYRIN域蛋白3 (recombinant NLR family, pyrin domain containing protein 3, NLRP3) 的表达, 加速Aβ的清除, 从而减轻认知功能障碍。研究发现, 女性AD患者的数量高于男性, 且女性患者的认知功能障碍更为严重。产生该现象的原因可能是女性更年期雌激素水平骤降和卵巢机能衰退。本实验室提出了脑内线粒体雌激素受体β (estrogen receptor β, ERβ) 的降低可能参与AD的发生[55]。杜烨湘等[42]研究发现, 甘草素可激活ERβ, 减少NLRP3、caspase-1、IL-1β、TNF-α及caspase-3、Bax、Bcl-2的表达, 减轻N2A-APP细胞的炎症, 减少APP/PS1小鼠神经细胞的凋亡, 还可通过抑制β-分泌酶和γ-分泌酶来减少老年斑的数量, 提高小鼠学习记忆功能和空间探索能力。此外, 越来越多的证据表明, 线粒体是雌激素作用的重要靶点,
丹酚酸B源于丹参, 目前已发现具有防治动脉粥样硬化和保护脑缺血损伤等药效。Tang等[43]研究发现, 丹酚酸B可通过抑制GSK-3β的丝氨酸9位点磷酸化而抑制BACE1的活性及其表达, 从而降低sAPPβ水平, 减少Aβ40、Aβ42亚型的生成。He等[45]用Aβ诱导原代培养的小鼠神经元建立AD的体外细胞模型, 并指出丹酚酸B通过抑制活性氧(reactive oxygen species, ROS) 的生成、线粒体的脂质过氧化以及促进谷胱甘肽生成, 缓解了Aβ介导的神经元的氧化应激损伤, 减少了神经元突触的变性丢失, 进而发挥保护神经的作用。
连翘脂苷B是一种苯乙醇苷类化合物, 来源于传统中药独一味, 属于非甾体类抗炎药物, 具有抗炎、抗病毒和抗菌等药理活性。研究发现, 连翘脂苷B可通过降低APP/PS1小鼠脑内NF-κB信号通路相关蛋白的磷酸化水平, 抑制NF-κB通路的激活; 还可以降低小鼠脑内JNK相关蛋白3 (JIP3) 含量, 提高c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK) 的水平, 减轻Aβ的沉积, 因此, Kong等[46]推测连翘脂苷B主要是通过调节脑内神经炎症等相关信号通路, 减少Aβ沉积, 从而改善AD的认知功能障碍。
2.2.2 降低GSK-3蛋白含量及Tau蛋白的过度磷酸化水平作为一种具有多种药理作用的中药单分子物质, 黄连素在临床上已有较为广泛的应用, 对其发挥作用的机制也有较为全面的研究。该化合物除了具有降低AD小鼠脑内Aβ沉积和炎性因子的水平等作用外, 周晶等[29]还利用AD模型大鼠发现, 经高剂量黄连素治疗后的大鼠认知能力显著提高, 脑内GSK-3、p-Tau蛋白含量显著降低, 推测黄连素也可以通过降低GSK-3蛋白含量, 抑制Tau磷酸化, 提高AD认知功能。因此, 黄连素是一种很有前途的预防和保护AD的多靶点药物。
金钗石斛是我国传统的中药材, 具有较高的药用价值, 并且内含丰富的生物碱类物质, 其中的石斛碱在抗肿瘤、改善认知障碍和抗炎抗流感等方面具有明显的疗效。Liu等[47]研究发现, 石斛碱不仅能提高AD模型小鼠脑内神经元的含量, 还能减轻神经元内质网的肿胀, 并通过实验发现石斛碱改善小鼠认知功能障碍的作用机制可能是抑制了蛋白激酶R样内质网激酶(PKR-like endoplasmic reticulum kinase, PERK) 信号通路, 进而抑制钙蛋白酶1、GSK-3β、CDK5的活化, 最终降低Tau蛋白的过度磷酸化。
2.2.3 降低氧化应激水平从黄芪和土茯苓中可以提取得到一种二氢黄酮醇糖苷化合物异落新妇苷, 该物质具有抗氧化和抑菌抑癌等药理作用。Yu等[48]实验观察到, 异落新妇苷不仅抑制了Aβ1-42和p-Tau在小鼠大脑中的异常积累, 而且还通过激活核因子E-2-相关因子2 (nuclear factor erythroid-2-relatated factor 2, Nrf2) 通路来调节氧化还原系统。Nrf2被活化后, 活化了SOD1、过氧化氢酶(catalase, CAT)、血红素氧合酶-1 (heme oxygenase-1, HO-1) 和血红素氧合酶-2 (heme oxygenase-2, HO-2) 一系列激酶, 从而消除积累的ROS。因为氧化分子和ROS在细胞中积累会促进Aβ的过量生成[56], 表明异落新妇苷可能是通过激活Nrf2, 降低氧化应激水平, 改善AD小鼠的认知功能障碍。
苦参碱是一种从苦参中提取得到的生物碱, 具有利尿、抗病原体以及抗炎抗过敏等作用。研究表明, 苦参碱不仅可通过降低小鼠脑内Aβ沉积及神经炎症改善认知障碍[57], 也可能通过降低脑内的氧化应激水平发挥作用。当AD小鼠应用苦参碱处理后, 脑内MDA及氧化应激水平显著降低, SOD活性升高, 小鼠的学习记忆功能显著提高[49]。
丹酚酸B是由唇形科植物丹参的根及根茎提取得到的一种化合物。宋虓福等[44]研究发现该物质不仅能减轻Aβ沉积的毒害作用, 而且能降低小鼠的氧化应激水平。APP/PS1小鼠经丹酚酸B治疗后, 海马区神经细胞凋亡减少, SOD及谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px) 活性明显提高, MDA含量下降, 学习记忆能力显著提高。同时, 小鼠脑内Nrf2及HO-1蛋白表达提高, Kelch样ECH关联蛋白1 (Kelch like ECH associated protein 1, Keap 1) 表达降低。因此, 可推断丹酚酸B通过减轻氧化应激并激活Nrf2/HO-1信号通路发挥治疗AD的作用。
天麻素由兰科植物天麻提取得到, 目前已被应用于治疗神经衰弱等疾病。Zhang等[50]研究发现, 天麻素能改善Tg2576小鼠的学习记忆能力, 降低小鼠海马的氧化应激水平, 抑制BACE1的表达; 还能显著降低H2O2诱导的SH-SY5Y细胞中磷酸化蛋白激酶R (protein kinase R, PKR) 和真核翻译起始因子2a (eukaryotic initiation factor 2a, eIF2a) 的水平。即天麻素可能是通过抑制PKR/eIF2a通路, 减轻氧化应激, 降低BACE1的水平, 从而提高AD小鼠的学习记忆能力。
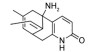
2.2.4 乙酰胆碱抑制剂石杉碱甲是近年来在我国植物石松中发现的一种用于防治AD的药物, 是一种天然、高效、可逆的乙酰胆碱酯酶(acetylcholinesterase, AChE) 抑制剂, 对抑制AChE和改善记忆障碍、提高认知功能具有显著作用。研究表明, 石杉碱甲治疗后可以提高实验组的5-羟色胺、4-氨基丁酸及ACh水平, 增加AD患者神经递质含量, 在无不良反应的同时提高其认知能力[52]。
胆碱能系统功能缺陷是学术界公认的AD的可能病因之一。ACh是中枢胆碱能神经系统参与记忆形成的必需神经递质, 也是长期记忆的生理学基础, 增加ACh合成或减少ACh的分解都会影响学习记忆功能。Gu等[40]研究表明, 圣草酚可逆转ACh及ChAT含量的降低, 同时降低AChE的含量, 调节胆碱能系统相关酶的活性。与圣草酚类似, 天麻素也可通过调节AChE或ChAT活性以发挥胆碱能效应, 增强神经突触兴奋, 从而改善学习记忆功能障碍[51]。
2.2.5 改善线粒体功能近年来, 线粒体功能障碍假说受到广泛关注, 被认为是导致AD的重要原因之一。因此, 诸多学者针对此发病机制进行了深入研究, 并发现中药单分子物质大多可作用于线粒体动力相关蛋白1 (dynamin-related protein 1, Drp1), 以改善线粒体功能障碍, 提高认知能力。
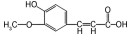
在典方中常见的当归等药材中含有一种有效成分—阿魏酸, 该化合物因其较强的药理活性及低毒性, 广泛应用于医药、化工和食品等多方面。Drp1是参与线粒体分裂的关键蛋白之一, p-Drp1S637具有促进线粒体融合、抑制其分裂的作用, 而p-Drp1蛋白的含量异常会导致线粒体功能受损。Wang等[53]实验表明, 阿魏酸可降低AD小鼠大脑内Drp1的表达, 提高p-Drp1S637的表达, 促进Drp1向p-Drp1S637转变; 还能提高大脑皮层中线粒体融合蛋白2 (mitochondrial fusion protein 2, Mfn2) 蛋白的表达, 说明阿魏酸可以减轻线粒体动力学失衡, 恢复其分裂-融合稳态, 进而改善AD小鼠的认知功能障碍。
实验证明, 藁本内酯不仅能减少Aβ的产生, 还能调控HT22细胞中Drp1与p-Drp1蛋白含量的动态平衡, 降低由H2O2或鱼藤酮诱导的细胞异常增加的p-Drp1含量, 提高线粒体融合蛋白1 (mitochondrial fusion protein 1, Mfn1) 和Mfn2蛋白水平, 同时, 提高腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK) 和腺苷三磷酸(adenosine triphosphate, ATP) 的水平, 说明藁本内酯在减轻Aβ毒害作用的同时, 也能缓解小鼠海马神经元细胞中线粒体融合和分裂的失调, 改善线粒体功能, 减少炎症, 进而改善记忆障碍[32]。此外, He等[45]的研究证明, 丹酚酸B也可抑制神经元线粒体Drp1的过表达及过磷酸化, 改善AD小鼠异常的线粒体膜电位, 促进ATP的生成并且增强线粒体氧化磷酸化相关酶活性。
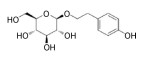
2.2.6 调节微生物肠脑轴红景天苷是植物红景天的提取物, 具有抗疲劳、抗衰老、美白和调节免疫等作用。该物质可通过降低AD动物模型中可溶性和不溶性Aβ水平, 从而发挥改善AD认知障碍的作用[58]。另有研究表明, 红景天苷可通过恢复肠道屏障的完整性, 减少周围微生物产物的积累, 降低炎症水平, 而使肠道微生物群的改变正常化, 提示红景天苷也可能是通过管控肠脑轴微生物群, 调节中枢神经系统和外周循环的炎症反应, 进而减轻SAMP8小鼠的记忆障碍[54]。
2.3 多靶点调节可能是改善AD相关病理症状的有效途径AD的发病原因复杂, 存在多种病理发生假说。Aβ假说多年来主导AD的研究领域, 但大量的Aβ靶向治疗在临床中失败, 因此对AD的防治不可能依赖于单一靶点。目前, 已报道的中药中的功能分子, 大多具有多重效应, 可通过多条途径改善AD相关的病理损伤。
如Chiu等[59]实验表明, 黄山药等植物中提取得到的薯蓣皂苷元有可能通过降低MDA水平, 改善氧化应激水平, 提高AD小鼠的学习和记忆能力; 其次薯蓣皂苷元能显著减少AD小鼠脑内Aβ42沉积和死亡细胞的数量, 同时降低AD模型小鼠磷酸化Tau蛋白的水平, 抑制小鼠大脑神经元的退化[60, 61]。诸多研究表明薯蓣皂苷元对AD具有多靶点的治疗作用, 可能在AD防治中具有重要的临床应用价值。表 2中列举出的大多数中药有效成分也都对AD具有多条的作用通路, 如丹酚酸B在减轻Aβ毒害的同时, 还能改善异常的氧化应激及线粒体功能障碍; 黄连素不仅能针对AD模型鼠脑内的Aβ发挥作用, 还能降低其神经炎症水平和Tau蛋白的异常磷酸化。
2019年我国上市的AD治疗药物GV-971[62]是一种海洋来源的寡聚糖药物, 它可能通过重塑肠道菌群平衡, 降低肠道菌群代谢产物特别是苯丙氨酸和异亮氨酸的产生, 降低外周与神经中枢炎症, 减少脑内Aβ沉积和Tau过度磷酸化, 发挥改善认知功能障碍的作用。GV-971的研发佐证了多靶点治疗复杂疾病的可行性。
综上所述, 同一分子或中药分子合理组方, 通过多靶点干预, 发挥改善氧化损伤、代谢紊乱、线粒体损伤、神经细胞保护等作用, 可能是改善认知障碍的有效策略。
3 总结与展望针对AD等重大慢性疾病, 在深入探索发病机制的基础上, 可以借鉴中医药理论, 基于中药及其功能分子丰富的临床实践积累和药物效应研究基础, 采用多靶点调节思路, 进一步探索各种中药有效成分及其组合在改善认知功能方面的作用机制, 这对AD的防治具有重要意义。
作者贡献: 雷梦瑶撰写了全文; 高佩佩对内容做了修改及补充; 龙建纲审阅了全文并提出了合理的修改意见。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Xu J, Cai HJ. Advances in nursing interventions for Alzheimer's patients[J]. J Nurs Sci (护理学), 2021, 10: 465-470. |
| [2] |
National Bureau of Statistics. The Seventh National Census Bulletin[R]. Beijing: National Bureau of Statistics, 2021. http://www.stats.gov.cn/tjsj/tjgb/rkpcgb/qgrkpcgb/202106/t20210628_1818824.html.
|
| [3] |
Lai LM, Ling CX, Zhang XF, 等. Progress in the pathogenesis of Alzheimer's disease[J]. J Shangqiu Norm Coll (商丘师范学院学报), 2018, 34: 27-29. |
| [4] |
Wang WL, Song CS. Progress in the pathogenesis of Alzheimer's disease and its clinical medication[J]. Chin J Drug Eval (中国药物评价), 2019, 36: 205-209. |
| [5] |
Hu YH, He L. Advances in the association of mitochondrial dysfunction and the onset of Alzheimer's disease[J]. Pharm Res (药学研究), 2020, 2: 101-104. |
| [6] |
Selkoe DJ. Toward a comprehensive theory for Alzheimer's disease. Hypothesis: Alzheimer's disease is caused by the cerebral accumulation and cytotoxicity of amyloid β-protein[J]. Anna N Y Acad Sci, 2000, 924: 17-25. |
| [7] |
Peng Y, Gao P, Shi L, et al. Central and peripheral metabolic defects contribute to the pathogenesis of Alzheimer's disease: targeting mitochondria for diagnosis and prevention[J]. Antioxid Redox Sign, 2020, 32: 1188-1236. DOI:10.1089/ars.2019.7763 |
| [8] |
Ferreira-Vieira TH, Guimaraes IM, Silva FR, et al. Alzheimer's disease: targeting the cholinergic system[J]. Curr Neuropharmacol, 2016, 14: 101-115. DOI:10.2174/1570159X13666150716165726 |
| [9] |
Hansen DV, Hanson JE, Sheng M. Microglia in Alzheimer's disease[J]. J Cell Biol, 2018, 217: 459-472. DOI:10.1083/jcb.201709069 |
| [10] |
Medina M, Avila J. Understanding the relationship between GSK-3 and Alzheimer's disease: a focus on how GSK-3 can modulate synaptic plasticity processes[J]. Expert Rev Neurother, 2013, 13: 495-503. DOI:10.1586/ern.13.39 |
| [11] |
Erny D, Hrabě de Angelis AL, Jaitin D, et al. Host microbiota constantly control maturation and function of microglia in the CNS[J]. Nat Neurosci, 2015, 18: 965-977. DOI:10.1038/nn.4030 |
| [12] |
Aziz Q, Doré J, Emmanuel A, et al. Gut microbiota and gastrointestinal health: current concepts and future directions[J]. Neurogastroenterol Motil, 2013, 25: 4-15. DOI:10.1111/nmo.12046 |
| [13] |
Lukiw WJ, Li W, Bond T, et al. Facilitation of gastrointestinal (GI) tract microbiome-derived lipopolysaccharide (LPS) entry into human neurons by amyloid beta-42 (Aβ42) peptide[J]. Front Cell Neurosci, 2019, 13: 545. DOI:10.3389/fncel.2019.00545 |
| [14] |
Yang CZ, Zhong J, Zhu AH, 等. Study on TCM syndrome of mild cognitive impairment in the elderly[J]. J Beijing Univ Tradit Chin Med (北京中医药大学学报), 2003, 10: 12-16. |
| [15] |
Hou JQ, Guo L, Zhang JL. Analysis of TCM syndrome differentiation and treatment of Alzheimer's disease[J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2017, 44: 262-264. |
| [16] |
Wang Y, Luo N, Chen LJ, 等. Effects of Yangxue Peiben Jiannao Recipe on learning and memory, neuronal apoptosis and GFAP protein expression in AD rats[J]. Lishizhen Med Mat Med Res (时珍国医国药), 2020, 31: 1053-1057. |
| [17] |
Xie WT, Chen Y, Tan ZH, 等. Effects of modified dioscorea pill on behavior and expression of TNF-α and caspase-3 in hippocampus of AD model rats[J]. J Hubei Univ Chin Med (湖北中医药大学学报), 2020, 22: 5-9. |
| [18] |
Wang JP, Wu L, Gu L, 等. Study on the mechanism of Yifei Wenyang Huazhuo Decoction regulating PI3K/Akt-mTOR signal pathway to protect nerve cells in AD rats[J]. Intern Med China (内科), 2019, 14: 381-386. |
| [19] |
Chen J, Han ZF, Fu YJ, 等. Effect of Xiaochaihu Decoction on the expression of inflammatory factors IL-1β, IL-6, p-p38MARK and NF-κB in hippocampus of Alzheimer's disease mice[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2020, 38: 217-220. |
| [20] |
Guo XY, Zhang HL, Xia BM, 等. Improvement of cognitive impairment in AD model mice by Hao Forgetting Formula and its mechanism[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2020, 36: 831-836. |
| [21] |
Liang MT, Zhu H, Ren D, 等. Effects of Erzhi Pill on behavior and hippocampal proteome expression in SAMP8 mice[J]. Chin J Integr Tradit West Med (中国中西医结合杂志), 2019, 39: 1469-1476. |
| [22] |
Jiang MY, Dong KL, Xiao L, 等. Effect of Yizhi Jiannao Granule on protein expression in hippocampus of SAMP8 mice[J]. Chin J Clin Pharmacol (中国老年学杂志), 2009, 29: 33-35. |
| [23] |
Wang JP, Tang N, Liu BG, 等. Discussion on etiology, pathogenesis and treatment of dementia based on the thought of Chongyang in Neijing[J]. Lishizhen Med Mat Med Res (时珍国医国药), 2016, 27: 150-151. |
| [24] |
Song L, Bai XL, Piao ZY, 等. Effects of Dihuang Yinzi on IL-1, TNF-α and NF-κB p65 in APP/PS1 mice[J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2020, 47: 187-190, 225-226. |
| [25] |
Liu MX, Liu JG, Li H, 等. Effect of Huannao Yicong recipe extract on learning and memory ability of APP/PS1 double transgenic dementia model mice and its mechanism[J]. Chin J Pharmacol Toxic (中国药理学与毒理学杂志), 2014, 28: 10-17. |
| [26] |
Li J, Zhou Y, Du G, et al. Integration of transcriptomics and network analysis deciphers the mechanisms of baicalein in improving learning and memory impairment in senescence-accelerated mouse prone 8 (SAMP8)[J]. Eur J Pharmacol, 2019, 865: 172789. DOI:10.1016/j.ejphar.2019.172789 |
| [27] |
Huang M, Jiang X, Liang Y, et al. Berberine improves cognitive impairment by promoting autophagic clearance and inhibiting production of β-amyloid in APP/Tau/PS1 mouse model of Alzheimer's disease[J]. Exp Gerontol, 2017, 91: 25-33. DOI:10.1016/j.exger.2017.02.004 |
| [28] |
He W, Wang C, Chen Y, et al. Berberine attenuates cognitive impairment and ameliorates tau hyperphosphorylation by limiting the self-perpetuating pathogenic cycle between NF-κB signaling, oxidative stress and neuroinflammation[J]. Pharmacol Rep, 2017, 69: 1341-1348. DOI:10.1016/j.pharep.2017.06.006 |
| [29] |
Zhou J, Dong XK, Ma QK, 等. Effects of berberine on the proportion of Th17 and Treg subsets and inflammatory cytokines in brain tissue of Alzheimer's disease rat[J]. Global Tradit Chin Med (环球中医药), 2020, 13: 1304-1308. |
| [30] |
Quan Q, Li X, Feng J, et al. Ginsenoside Rg1 reduces β‑amyloid levels by inhibiting CDΚ5‑induced PPARγ phosphorylation in a neuron model of Alzheimer's disease[J]. Mol Med Rep, 2020, 22: 3277-3288. |
| [31] |
Zhang MX, Yu Y, Du JR. Protective effect of ligustilide pretreatment on SH-SY 5 Y cytotoxicity of human brain neuroblastoma mother cells induced by Aβ 25-35[J]. J Sichuan Univ Med Sci (四川大学学报(医学版)), 2012, 43: 34-37. |
| [32] |
Zhu WL, Zheng JY, Cai WW, et al. Ligustilide improves aging-induced memory deficit by regulating mitochondrial related inflammation in SAMP8 mice[J]. Aging, 2020, 12: 3175-3189. DOI:10.18632/aging.102793 |
| [33] |
Li YY, Huang NQ, Feng F, et al. Icaritin improves memory and learning ability by decreasing BACE-1 expression and the Bax/Bcl-2 ratio in senescence-accelerated mouse prone 8 (SAMP8) mice[J]. Evid Based Complement Alternat Med, 2020, 2020: 8963845. |
| [34] |
Wang DQ, Gao L, Kong Z, 等. Cimicifugin regulates Akt/NF-κB pathway improves cognitive impairment in APP/PS1 double transgenic mice[J]. Chin Pharmacol Bull (中国药理学通报), 2021, 37: 258-263. |
| [35] |
Liang R, Zhou HH, Wan XZ, 等. Effect of rutin on cognitive function of high fat fed Alzheimer's disease model SAMP8 mice[J]. J Zhengzhou Univ Med Sci (郑州大学学报(医学版)), 2020, 55: 607-611. |
| [36] |
Pan RY, Ma J, Kong XX, et al. Sodium rutin ameliorates Alzheimer's disease-like pathology by enhancing microglial amyloid-β clearance[J]. Sci Adv, 2019, 5: eaau6328. DOI:10.1126/sciadv.aau6328 |
| [37] |
Fang YY, Su ZH, Si WX, 等. Mechanism of resveratrol in the treatment of Alzheimer's disease: a network-based pharmacological approach[J]. J South Med Univ (南方医科大学学报), 2021, 41: 10-19. |
| [38] |
Wang R, Zhang Y, Li J, et al. Resveratrol ameliorates spatial learning memory impairment induced by Aβ1-42 in rats[J]. Neuroscience, 2017, 344: 39-47. DOI:10.1016/j.neuroscience.2016.08.051 |
| [39] |
He P, Yan S, Zheng J, et al. Eriodictyol attenuates LPS-induced neuroinflammation, amyloidogenesis, and cognitive impairments via the inhibition of NF-κB in male C57BL/6J mice and BV2 microglial cells[J]. J Agric Food Chem, 2018, 66: 10205-10214. DOI:10.1021/acs.jafc.8b03731 |
| [40] |
Gu T, Yu ZL, Cao L, 等. Protective effect and mechanism of eriodictyol on PC12 cell injury induced by Aβ25-35[J]. Prog Mod Biomed (现代生物医学进展), 2018, 18: 1230-1233. |
| [41] |
Du Y, Luo M, Du Y, et al. Liquiritigenin decreases Aβ levels and ameliorates cognitive decline by regulating microglia M1/M2 transformation in AD mice[J]. Neurotox Res, 2021, 39: 349-358. DOI:10.1007/s12640-020-00284-z |
| [42] |
Du YX, Luo M, Feng M, 等. Glycyrrhizin plays a protective role against Alzheimer's disease through anti-inflammatory[J]. Immunol J (免疫学杂志), 2019, 35: 327-333. |
| [43] |
Tang Y, Huang D, Zhang MH, et al. Salvianolic acid B inhibits Aβ generation by modulating BACE1 activity in SH-SY5Y-APPsw cells[J]. Nutrients, 2016, 8: 333. DOI:10.3390/nu8060333 |
| [44] |
Song TF, Na L, Wang N, 等. Effects of salvianolic acid B on learning and memory and oxidative stress in APP/PS1 mice and its possible mechanism[J]. Prog Anat Sci (解剖科学进展), 2021, 27: 42-45. |
| [45] |
He Y, Jia K, Li L, et al. Salvianolic acid B attenuates mitochondrial stress against Aβ toxicity in primary cultured mouse neurons[J]. Biochem Biophys Res Commun, 2018, 498: 1066-1072. DOI:10.1016/j.bbrc.2018.03.119 |
| [46] |
Kong F, Jiang X, Wang R, et al. Forsythoside B attenuates memory impairment and neuroinflammation via inhibition on NF-κB signaling in Alzheimer's disease[J]. J Neuroinflammation, 2020, 17: 305. DOI:10.1186/s12974-020-01967-2 |
| [47] |
Liu B, Huang B, Liu J, et al. Dendrobium nobile Lindl alkaloid and metformin ameliorate cognitive dysfunction in senescence-accelerated mice via suppression of endoplasmic reticulum stress[J]. Brain Res, 2020, 1741: 146871. DOI:10.1016/j.brainres.2020.146871 |
| [48] |
Yu H, Yuan B, Chu Q, et al. Protective roles of isoastilbin against Alzheimer's disease via Nrf2‑mediated antioxidation and anti‑apoptosis[J]. Int J Mol Med, 2019, 43: 1406-1416. |
| [49] |
Yao Y, Sun N, Zheng P, 等. Effects of matrine on learning and memory function and oxidative stress in brain of Alzheimer's disease mice[J]. J Ningxia Med Univ (宁夏医科大学学报), 2016, 38: 985-988. |
| [50] |
Zhang JS, Zhou SF, Wang Q, et al. Gastrodin suppresses BACE1 expression under oxidative stress condition via inhibition of the PKR/eIF2α pathway in Alzheimer's disease[J]. Neuroscience, 2016, 325: 1-9. DOI:10.1016/j.neuroscience.2016.03.024 |
| [51] |
Han CN, He YF, Tian Y, 等. Effect of Gastrodia elata extract on cholinergic system in memory acquisition disorder model mice[J]. China Pharm (中国药业), 2014, 23: 3-4. |
| [52] |
Dong YH. Effect of huperzine A tablets on patients with Alzheimer's disease[J]. Henan Med Res (河南医学研究), 2020, 29: 5116-5118. |
| [53] |
Wang Q, Qin WW, Zhang JW. Ferulic acid improves learning and memory impairment in AD model mice induced by Aβ by repairing mitochondrial division fusion imbalance[J]. Chin Pharmacol J (中国药学杂志), 2019, 54: 703-710. |
| [54] |
Xie Z, Lu H, Yang S, et al. Salidroside attenuates cognitive dysfunction in senescence-accelerated mouse prone 8 (SAMP8) mice and modulates inflammation of the gut-brain axis[J]. Front Pharmacol, 2020, 11: 568423. DOI:10.3389/fphar.2020.568423 |
| [55] |
Long J, He P, Shen Y, et al. New evidence of mitochondria dysfunction in the female Alzheimer's disease brain: deficiency of estrogen receptor-β[J]. J Alzheimer Dis, 2012, 30: 545-558. DOI:10.3233/JAD-2012-120283 |
| [56] |
Leuner K, Schütt T, Kurz C, et al. Mitochondrion-derived reactive oxygen species lead to enhanced amyloid beta formation[J]. Antioxid Redox Sign, 2012, 16: 1421-1433. DOI:10.1089/ars.2011.4173 |
| [57] |
Dong XQ, Yu WH, Hu YY, et al. Oxymatrine reduces neuronal cell apoptosis by inhibiting Toll-like receptor 4/nuclear factor kappa-B-dependent inflammatory responses in traumatic rat brain injury[J]. Inflamm Res, 2011, 60: 533-539. |
| [58] |
Wang H, Li Q, Sun S, et al. Neuroprotective effects of salidroside in a mouse model of Alzheimer's disease[J]. Cell Mol Neurobiol, 2020, 40: 1133-1142. DOI:10.1007/s10571-020-00801-w |
| [59] |
Chiu CS, Chiu YJ, Wu LY, et al. Diosgenin ameliorates cognition deficit and attenuates oxidative damage in senescent mice induced by D-galactose[J]. Am J Chin Med, 2011, 39: 551-563. DOI:10.1142/S0192415X11009020 |
| [60] |
Koh EK, Yun WB, Kim JE, et al. Beneficial effect of diosgenin as a stimulator of NGF on the brain with neuronal damage induced by Aβ-42 accumulation and neurotoxicant injection[J]. Lab Anim Res, 2016, 32: 105-115. DOI:10.5625/lar.2016.32.2.105 |
| [61] |
Tohda C, Lee YA, Goto Y, et al. Diosgenin-induced cognitive enhancement in normal mice is mediated by 1, 25D3-MARRS[J]. Sci Rep, 2013, 3: 3395. DOI:10.1038/srep03395 |
| [62] |
Poo MM. New light on the horizon of Alzheimer's disease[J]. Natl Sci Rev, 2020, 7: 831. DOI:10.1093/nsr/nwaa008 |
 2022, Vol. 57
2022, Vol. 57