2. 中国中医科学院中药资源中心, 道地药材国家重点实验室培育基地, 北京 100700
2. State Key Laboratory of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
小分子热激蛋白(small heat shock proteins, sHSPs) 是一种在原核和真核生物中普遍存在的蛋白家族, 分子质量在12~25 kDa, 易组装成12~32个亚基的寡聚体, sHSPs会在逆境胁迫下大量表达, 以不依赖ATP的方式作为分子伴侣(molecular chaperones) 去阻止易受胁迫诱导的蛋白的不可逆聚集[1]。在植物中, 小分子热激蛋白的种类和数量特别多, 有些物种可以多达40多个。植物小分子热激蛋白依据是否有特异的膜结合靶向信号, 可以分成两大类, 11个亚家族[1]: 一类是靶向细胞器的, 包括叶绿体(CP)、线粒体(TMII)、内质网(ER)、过氧化物酶体(PX)、细胞核(CⅢ) 和双重靶向线粒体和叶绿体(MTI/CP) 等6种小分子热激蛋白; 另一大类是靶向细胞质的[2], 它们缺乏特异的细胞器靶向信号, 包括cytosolic class (CⅠ)、CⅡ、CⅣ、CⅤ和CⅥ等5种小分子热激蛋白, 而且细胞器靶向的sHSPs是植物所特有的。植物sHSPs由4部分组成: N-端的靶向肽段(targeting peptide)、N-端结构域(N-terminal domain, NTD)、α-晶体结构域(alpha-crystallin domains, ACDs) 和C-端扩展区域(C-terminal extensions, CTEs)。其中, NTDs是植物sHSPs变化最大的区域, 这种变化包括氨基酸序列的长度和组成的变化; 而ACDs是sHSPs的特征结构域, 由90~100个氨基酸组成, 是sHSPs分类的依据[2]。目前, sHSPs工作模型[3]: 首先, 热胁迫使植物自然状态的蛋白质部分变性, 同时使sHSPs寡聚体解离成二聚体; 接着sHSPs二聚体去捕获变性蛋白质, 形成sHSP-底物蛋白复合体; 最后, 在HSP70和共分子伴侣(co-chaperons) 作用下, 利用ATP使底物蛋白重新折叠成有活性的蛋白质, 并释放。大多数sHSPs在高温等非生物胁迫诱导下, 表达量快速增加, 而有些sHSPs在植物生长发育的特定时期(如胚胎发生、种子萌发、果实成熟等) 表达。在拟南芥中, 过表达细胞质sHSPs (CⅠsHSP和CⅡsHSP), 提高了植物对极端热胁迫的忍耐性[4]; 在棉花中, 发现线粒体小分子热激蛋白GhHSP24.7基因参与调控细胞色素C/C1, 激发活性氧(ROS) 产生, 加速胚乳破裂并促进了种子萌发[5]。在植物的生长发育和逆境适应中, 植物激素脱落酸(abscisic acid, ABA) 和吲哚-3-乙酸(indole-3-acetic acid, IAA) 有时会起到协同或拮抗作用, 研究发现拟南芥中, 小分子热激蛋白AtHSP22负调控了ABA信号途径, 同时, 在IAA诱导处理后, AtHSP22促进了跟生长素相关的下胚轴伸长和侧根数量的增加[6]。小分子热激蛋白做为分子伴侣阻止胁迫条件下不可逆、非正确折叠或聚集的蛋白质, 以保持细胞稳态。最近研究发现, 拟南芥叶绿体定位的小分子热激蛋白HSP21在热胁迫下, 通过部分展开中心α-晶体结构域(alpha-crystallin domains, ACDs) 与植物萜类化合物合成代谢中甲基赤藓糖醇4-磷酸途径(methylerythritol 4-phosphate pathway, MEP) 中限速酶1-脱氧-D-木酮糖5-磷酸合酶(1-deoxy-D-xylulose 5-phosphate synthase, DXPS) 形成复合体, 提供热保护作用[7]。这项工作虽然从结构上揭示了sHSP有助于DXPS正确折叠, 但是没有检测sHSP对萜类化合物含量变化的影响, 这提示需要深入挖掘sHSP在植物次生代谢过程中的作用。
中药丹参为唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根和根茎, 具有活血祛瘀、通经止痛、清心除烦等功效[8]。以丹参为模式药用植物, 结合基因组、转录组、蛋白质组和代谢组, 揭示了丹参药用活性成分的生物合成和调控[9]。生物胁迫和非生物胁迫会抑制植物生长、发育, 导致农作物减产, 然而适度的胁迫能促进药用植物中活性成分的积累。茉莉酸甲酯、酵母提取物、银离子等生物和非生物诱导子能够显著促进丹参有效成分的积累[10, 11]。Wang等[12]利用2-D结合质谱对酵母提取物和银离子诱导的丹参毛状根进行蛋白质组学分析, 发现分子伴侣在差异表达蛋白中占比达到22%, 分子伴侣与多种蛋白质底物相互作用, 以协助初始蛋白质的折叠和逆境胁迫中维持细胞蛋白质的正确折叠, 推测这些分子伴侣在丹参应激响应中发挥重要作用。Zhan等[13]对橙色和红色根系的丹参栽培品进行代谢组和转录组分析, 发现丹参的有效成分丹参酮ⅡA和丹参酮Ⅰ在橙色根系丹参中显著降低, 推测是催化从隐丹参酮和二氢丹参酮到丹参酮ⅡA和丹参酮Ⅰ的脱氢酶非正确折叠造成的; 同时发现与红色根系丹参相比, 橙色根系中有4个显著上调基因参与内质网蛋白质加工和运输, 其中分子伴侣SmHSP21.8上调了2.6倍, 推测橙色根系丹参在田间栽培期间, 经历了生物或非生物胁迫, 引起脱氢酶等蛋白非正常折叠, 使得丹参酮类化合物含量下降; 同时, 激活了植物体内蛋白质质量控制体系, 如HSP等参与修复损伤蛋白质, 因此研究HSP等蛋白质在丹参抵御环境胁迫和有效成分积累中的作用将有重要理论价值。
本研究在分析本实验室前期橙根丹参转录组基础之上, 克隆了丹参SmHSP21.8基因, 并进行生物信息学分析; 构建了SmHSP21.8的原核表达载体, 在大肠杆菌中成功诱导表达出重组蛋白; 通过实时荧光定量PCR技术分析SmHSP21.8在不同组织中的表达情况; 以及在高温、PEG6000、外源激素ABA和IAA处理下不同时间点的表达差异, 为研究sHSPs在参与丹参胁迫防御和活性成分积累机制奠定基础。
材料与方法丹参样品采集 丹参样品采自北京市延庆区艾药园, 经中国中医科学院中药资源中心袁庆军研究员鉴定为唇形科丹参Salvia miltiorrhiza。所有样品经鉴定后按不同组织部位分为根、茎、叶、花, 液氮速冻后保存于-80 ℃冰箱。
丹参幼苗的非生物胁迫和激素处理 本实验室保存的紫花丹参种子, 2021年8月播种萌发, 在人工气候室正常生长, 种子萌发后2个月, 进行38 ℃高温处理; 将部分丹参苗转为水培养1周后, 进行15% PEG6000、50 μmol·L-1 ABA和2 μmol·L-1 IAA胁迫处理。取样用液氮速冻后保存于-80 ℃冰箱。
菌株、载体和试剂 RNAPrep Pure多糖多酚植物总RNA提取试剂盒购于天根生化科技(北京) 有限公司, 反转录试剂盒PrimeScript™ Ⅱ 1st Strand cDNA Synthesis Kit、PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time) 及荧光定量试剂盒TB Green® Premix Ex Taq™ II、PrimeSTAR® HS DNA Polymerase高保真酶购自于TaKaRa公司; 切胶回收试剂盒EasyPure Quick Gel Extraction Kit、T载体pEASY-Blunt Zero Cloning Kit、无缝拼接试剂盒pEASY Uni Seamless Cloning and Assembly Kit、大肠杆菌感受态细胞Trans1-T1和BL21购自于北京全式金生物技术有限公司; pMAL-c2X载体为本实验室保存; 限制性内切酶EcoR Ⅰ购自于NEB公司; 异丙基-β-D-硫代半乳糖苷(IPTG) 购自于Sigma公司。所需引物由上海生工生物有限公司合成; 其他试剂均为国产分析纯。
总RNA提取及cDNA合成 按照RNA提取试剂盒说明书提取丹参样品中总RNA, 用1%琼脂糖凝胶电泳检测总RNA完整性。超微量紫外分光光度计Nano Drop ND-1000 Spectrophotometer (Thermo Scientific) 测定总RNA的A260 nm/A280 nm, 选择比值1.8~2.0区间的总RNA反转录成cDNA。以RNA为模板, 采用TaKaRa反转录试剂盒[PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit、PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)] 进行反转录, 得到丹参的cDNA, 保存于-20 ℃冰箱。
SmHSP21.8基因cDNA克隆 根据丹参橙色根系转录组数据库, 用Primer Premier 5.0软件设计基因特异性引物。上游引物SmHSP21.8-F: 5′-ATGGAGAGA GCAAACCTCGCAAT-3′; 下游引物SmHSP21.8-R: 5′-TCAGAGCTCTTTCTTGGTGGCC-3′, 由生工生物工程(上海) 股份有限公司合成。以丹参的cDNA为模板进行PCR扩增, 采用PrimeSTAR® HS DNA Polymerases试剂盒进行PCR扩增, PCR反应条件为98 ℃预变性2 min; 98 ℃变性10 s, 58 ℃退火15 s, 72 ℃延伸40 s, 35个循环; 72 ℃终延伸7 min; 4 ℃保存。PCR产物经1%琼脂糖凝胶电泳检测, 使用EasyPure Quick Gel Extraction Kit试剂盒切胶回收目的条带。将扩增产物连接至克隆载体pEASY-Blunt Zero, 转化至大肠杆菌Trans1-T1感受态细胞中, 选择单克隆菌落并进行菌液PCR验证, 将阳性克隆菌液送至北京睿博兴科生物技术有限公司测序。
SmHSP21.8基因的生物信息学分析 利用NCBI (http://www.ncbi.nlm.nih.gov/) 在线工具BLAST对SmHSP21.8基因核苷酸序列和编码的氨基酸序列进行相似性比对分析; ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/) 查找该基因开放阅读框(ORF)。利用ExPASy (https://web.expasy.org/protparam/) 预测该基因编码的蛋白理化性质; NPS (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_server.html) 进行蛋白质二级结构分析; Swiss Model (http://swissmodel.expasy.org/) 进行三维结构建模, 预测蛋白质的三级结构; CDD (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 进行蛋白质结构域分析; TMHMM (http://www.cbs.dtu.dk/services/TMHMM/) 进行蛋白序列的跨膜结构域分析。运用MEGA7.0和DNAMAN6.0软件, 与其他植物进行同源氨基酸序列比对, 用MEGA7.0软件构建neighbor-joining系统进化树。
SmHSP21.8原核表达载体构建 利用无缝拼接将SmHSP21.8构建到原核表达载体pMAL-c2X, 以EcoR I作为上下游引物的酶切位点, 设计引物, 上游引物pMAL-c2X-SmHSP21.8-F: 5′-GAGGGAAGGATT TCAGAATTCATGGAGAGAGCAAACCTCGCAAT-3′; 下游引物pMAL-c2X-SmHSP21.8-R: 5′-GTCGACTCTA GAGGATCCGAATCAGAGCTCTTTCTTGGTGGCC- 3′。以SmHSP21.8克隆载体质粒为模板, 进行PCR扩增。将扩增后的产物进行1%的琼脂糖凝胶电泳检测, 并对其进行切胶回收; 对表达载体pMAL-c2X质粒进行EcoR I酶切处理, 并切胶回收。将切胶回收后的目的片段与表达载体pMAL-c2X用无缝拼接试剂盒在50 ℃连接30 min, 将连接产物转化至大肠杆菌Trans1-T1感受态细胞中, 挑取单克隆进行菌液PCR阳性检验、测序及提取质粒。
SmHSP21.8原核诱导表达 将原核表达载体质粒转化到BL21表达感受态中, 异源表达重组蛋白。取转化表达菌液按照1∶100加到含Amp抗性的LB培养液中, 37 ℃、220 r·min-1振荡培养至A600 nm为0.4~0.6, 加入终浓度为0.5 mmol·L-1 IPTG于37 ℃、220 r·min-1振荡培养4 h, 以同样条件转化pMAL-c2X空载作为空白对照。取1 mL菌液4 ℃、1 000 ×g离心3 min弃上清, 加入40 μL ddH2O和10 μL的5×SDS-PAGE上样缓冲液, 混匀, 获得含重组SmHSP21.8蛋白的全菌点样液; 将剩余菌液离心去上清以获取菌体, 加入4 mL Tris-HCl (pH 8.5) 重悬菌体, 冰浴下以4 s/6 s超声破碎8 min, 然后4 ℃、1 000 ×g离心20 min后获得SmHSP21.8的蛋白上清, 取40 μL蛋白上清, 加入10 μL的5×SDS-PAGE上样缓冲液, 混匀, 获得SmHSP21.8上清点样液。将上述点样液沸水煮5~10 min后4 ℃保存, 进行10% SDS-PAGE电泳分析。
实时荧光定量PCR 选用TB Green® Premix Ex TaqTM Ⅱ试剂盒, 利用Light Cycler® 480 II实时荧光定量PCR仪(美国罗氏医学仪器公司) 对丹参4个组织和不同诱导处理的SmHSP21.8转录的mRNA丰度进行定量检测。内参基因为丹参Actin7 (GenBank登录号为HM051058.1) 进行校正, 设计内参基因引物, 上游引物SmActin-qF: 5′-GCCCTCGACTATGAACAAGAGC-3′, 下游引物SmActin-qR: 5′-GATGGAGTTGTAGGTGGT TTCGTG-3′。利用Primer Premier 5.0软件设计丹参SmHSP21.8基因荧光定量引物, 上游引物SmHSP21.8-qF: 5′-GCTTCTCCTGCCGCCCGTAA-3′, 下游引物SmHSP21.8-qR: 5′-TGCTCGCCCGCCGTTTCCTT-3′。采用20 μL的反应体系, 其中包括2 μL cDNA模板、10 μL TB Green Premix Ex Taq Ⅱ及0.8 μL引物, 剩余用水补齐。扩增条件为95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 95 ℃ 5 s, 40个循环; 95 ℃ 5 s; 60 ℃ 1 min; 95 ℃持续。每个样品设定3个重复。使用解曲线来判定产物的特异性, 根据定量扩增曲线达到平台期时的Ct值, 以丹参Actin7为内参, 采用2-ΔΔCt方法分析SmHSP21.8转录的mRNA相对表达量。
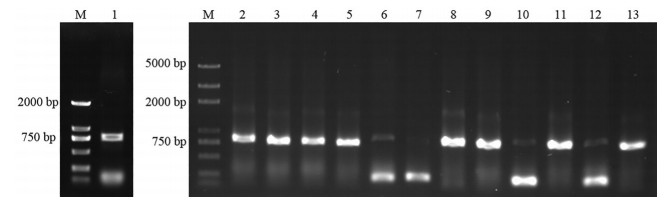
结果与分析 1 SmHSP21.8基因cDNA的克隆根据橙根丹参转录组数据获得SmHSP21.8的cDNA序列信息, 利用DNAMAN软件结合ORF-Finder在线软件对SmHSP21.8基因序列分析, 预测SmHSP21.8含有1个585 bp完整的开放阅读框, 通过设计特异性引物进行RT-PCR扩增, 并将其构建到Blunt-Zero克隆载体中, 挑取单克隆进行PCR鉴定(图 1), 将阳性克隆送至测序公司测序, 测序结果与预测结果一致, 并将序列登录GenBank, 得到序列号为OL539437。
|
Figure 1 Agarose gel electrophoresis of RT-PCR amplification of SmHSP21.8 gene cDNA and colony PCR identification. M: DNA marker; 1: RT-PCR amplification of SmHSP21.8 gene cDNA; 2-13: Colony PCR identification of SmHSP21.8 cDNA |
利用在线工具ExPASy对SmHSP21.8基因编码蛋白进行理化性质分析。结果显示, SmHSP21.8编码194个氨基酸, 蛋白质理论等电点为5.62, 分子质量为21.81 kDa, 化学分子式为C962H1569N275O291S5, 消光系数为23 490, 不稳定系数为53.65, 脂肪指数为88.09。
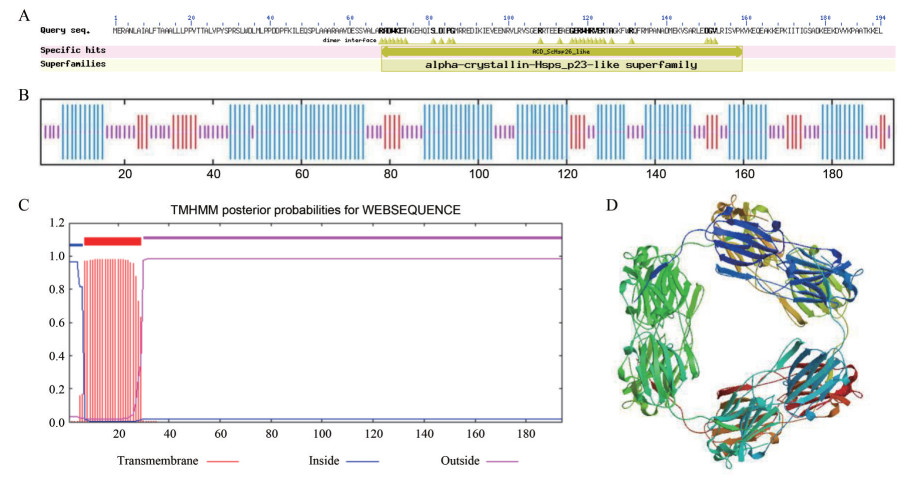
2.2 结构域与跨膜结构分析NCBI的Conserved domains在线工具分析表明, SmHSP21.8编码蛋白具有α-晶体蛋白(ACD) 结构, 属于α-晶体蛋白-HSPs-p23类蛋白超家族(图 2A)。利用TMHMM2.0在线工具对SmHSP21.8进行跨膜结构区域预测, 分析结果表明, SmHSP21.8 N-端氨基酸中有跨膜结构存在, 该蛋白为膜内蛋白(图 2C)。
|
Figure 2 The domain and structure prediction of SmHSP21.8 protein. A: Protein domain of SmHSP21.8 protein with conserved domains; B: Predicted secondary structure of SmHSP21.8 protein with NPSA; C: Prediction of transmembrane helices in SmHSP21.8 protein with TMHMM-2.0; D: The deduced three-dimensional structure of SmHSP21.8 protein |
利用NPS在线生物学工具预测SmHSP21.8氨基酸的二级结构, 结果显示, SmHSP21.8蛋白二级结构主要有α-螺旋组成, 在多肽链中有105个, 占54.12%, 无β-折叠, 延伸链共有26个, 占比为13.40%, 无规则卷曲共有63个, 占32.47%。说明α-螺旋是蛋白多肽链的大量构成元件, 为整个多肽链的主体, 其次是无规则卷曲(图 2B)。
将丹参SmHSP21.8的氨基酸序列通过SWISS-MODEL Workspace在线分析软件建立了SmHSP21.8蛋白的三维结构模型(图 2D), 选择豌豆HSP18.1的结构模型为模板, 对丹参SmHSP21.8蛋白的三维结构进行预测, 结果表明丹参SmHSP21.8蛋白与模板一致性为53.76%, 预测结果具有参考价值。
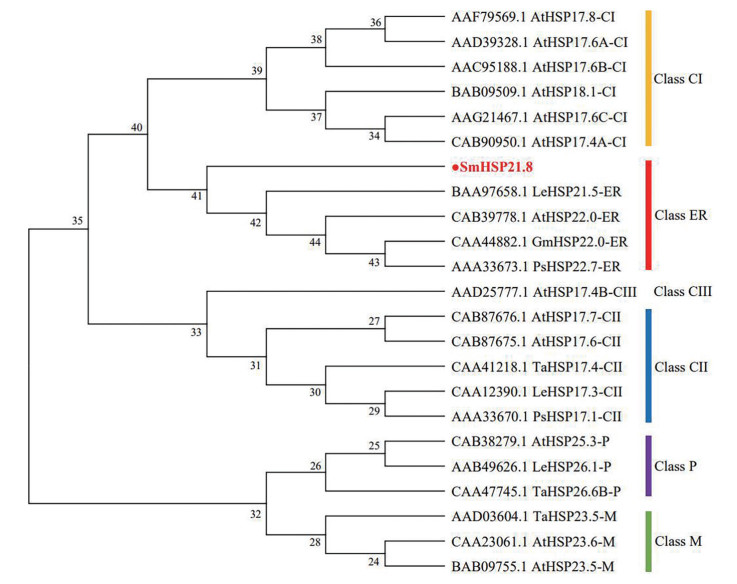
3 SmHSP21.8系统进化树分析选取GenBank中注册的拟南芥、番茄、大豆和豌豆等植物中sHSPs家族基因的氨基酸序列, 用MEGA7.0软件采用邻接法构建sHSPs氨基酸序列的系统进化树(图 3)。结果显示, SmHSP21.8与内质网小分子热激蛋白(ER-sHSPs) 处在同一分支。初步确认SmHSP21.8属于ER亚族。
|
Figure 3 Phylogenetic tree analysis of small heat shock proteins. At: Arabidopsis thaliana; Le: Lycopersicon esculentum; Gm: Glycine max; Ps: Pisum sativum; Ta: Triticum aestivum |
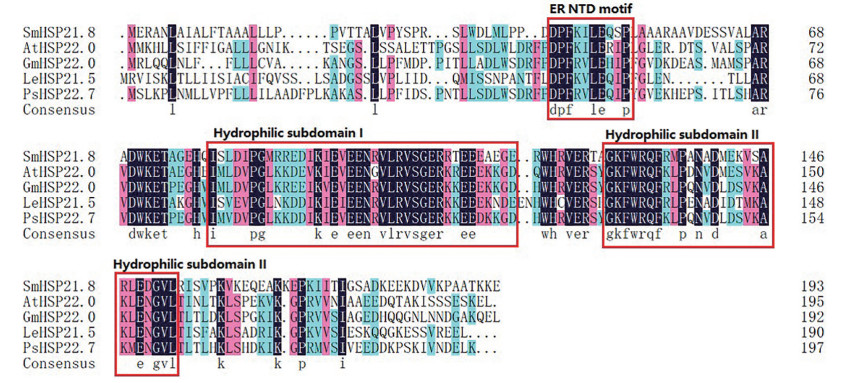
利用该基因编码的蛋白序列在NCBI数据库中进行blastp在线搜索发现, 拟南芥、番茄、大豆和豌豆的基因组中都有与之相似的基因, 通过MEGA 7.0和DNAMAN 6.0软件进行多重序列比对(图 4)。这些基因编码蛋白的氨基酸序列相似度在40%~50%, 分子质量在21.5~22.7 kDa中。蛋白序列的保守程度较低, 在N端有内质网小分子热激蛋白特有的DPFR-I/V-LE-H/Q-x-P基序(如图 4, ER NTD motif), 在SmHSP21.8的80~153氨基酸区域包含两个亲水结构域(图 4, hydrophilic subdomain) 构成保守的ACD结构域(alpha crystallin domain)。进一步验证SmHSP21.8属于ER亚族。
|
Figure 4 Alignment of the deduced amino acid sequence of SmSHP21.8 with sHSPs from other plants. Black shading indicates amino acid identities, red and blue shading indicates amino acid with different similarity. The conserved domain of SmHSP21.8 proteins are shown with red boxes. ER TND motif: Endoplasmic reticulum N-terminal domain motif. At: Arabidopsis thaliana, AtHSP22.0 (CAB39778.1); Le: Lycopersicon esculentum, LeHSP21.5 (BAA97658.1); Gm: Glycine max, GmHSP22 (CAA44882.1); Ps: Pisum sativum, PsHSP22.7 (AAA33673.1) |
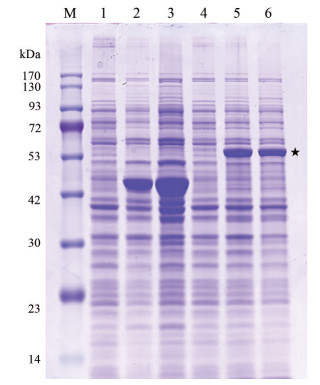
将构建好的重组质粒pMAL-c2X-SmHSP21.8转化至大肠杆菌BL21中, 挑取12个单克隆菌落, 用PCR方法进行阳性克隆鉴定, 测序结果表明目的基因SmHSP21.8成功构建到表达载体中。重组菌株经IPTG诱导表达后收集菌体并裂解, 进行10% SDS-PAGE电泳验证。电泳结果显示, 含有MBP-SmHSP21.8重组蛋白的全菌及上清在62 kDa处有显现的特异蛋白条带, 麦芽糖结合蛋白(maltose-binding protein, MBP) 的分子质量为42.5 kDa, SmHSP21.8蛋白分子质量为21.8 kDa, 符合预期蛋白分子质量大小, 这表明MBP-SmHSP21.8重组蛋白在大肠杆菌中成功表达, 并且重组蛋白是以可溶性形式存在(图 5)。
|
Figure 5 SDS-PAGE electrophoresis of MBP-SmHSP21.8 recombinant protein. M: Protein marker; 1: Uninduced E. coli containing pMAL-c2X; 2: Induced E. coli containing pMAL-c2X; 3: Supernatant from the induced E. coli containing pMAL-c2X; 4: Uninduced E. coli containing MBP-SmHSP21.8; 5: Induced E. coli containing MBP-SmHSP21.8; 6: Supernatant from the induced E. coli containing MBP-SmHSP21.8 |
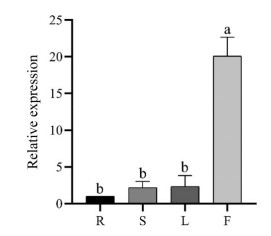
为研究SmHSP21.8在丹参不同组织中的表达模式, 以丹参根、茎、叶、花4个组织样品的cDNA为模板, 以丹参Actin7为内参, 进行实时荧光定量PCR分析, 测定SmHSP21.8基因在丹参不同组织中的转录水平。结果表明, SmHSP21.8基因在花中表达量最高, 是在根中表达的20倍, 其次是叶和茎, 在根中表达量最低(图 6)。由此推测SmHSP21.8基因在花中高表达, 且在不同组织中存在显著差异。
|
Figure 6 Relative expression level of SmHSP21.8 gene in different tissues. R: Root; S: Steam; L: Leaf; F: Flower. The expression level of SmHSP21.8 genes in roots was set to 1, with Actin7 used as the internal standard control. Data are shown as the mean ± SD (n = 3), and the different letters indicate values that vary significantly at P < 0.05 (one-way ANOVA) |
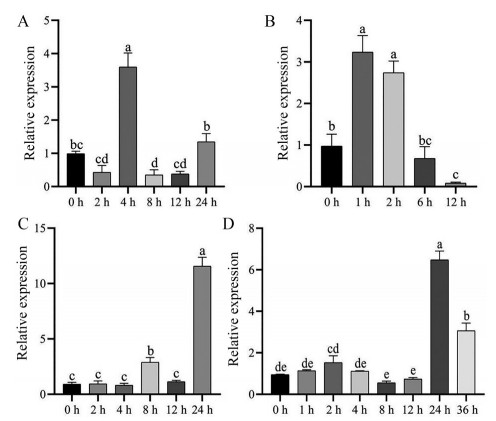
选择人工气候室中正常生长, 长势相近的土培苗, 对其进行38 ℃高温胁迫处理0、1、2、6、12 h; 部分丹参苗转至水培盆培养1周, 对其进行15% PEG6000模拟中度干旱胁迫处理不同时间0、1、2、4、8、12、24、36 h, 取整株提取总RNA, 以0 h的丹参幼苗作为对照, 以丹参Actin7基因作为内参, 进行荧光定量PCR分析。结果表明, 在38 ℃处理后的1~2 h, SmHSP21.8基因表达量有显著提高, 说明该基因能迅速响应高温胁迫(图 7B); 在15% PEG6000处理下, 表达量在24 h到达峰值, 随后表达量开始降低, 说明PEG6000能够成功诱导SmHSP21.8基因的表达(图 7D)。
|
Figure 7 Expression level of SmHSP21.8 gene after abiotic stress and exogenous hormone treatment in Salvia miltiorrhiza seedlings. A, B, C, D: Relative expression level of SmHSP21.8 gene treated with indole-3-acetic acid (IAA) (A), high temperature (B), abscisic acid (ABA) (C), and 15% PEG6000 (D), respectively. The expression level of SmHSP21.8 genes at 0 h was set to 1, with Actin7 used as the internal standard control. Data are shown as the mean ± SD (n = 3), and the different letters indicate values that vary significantly at P < 0.05 (one-way ANOVA) |
选择人工气候室中正常生长, 长势相近的土培苗, 将丹参苗转至水培盆培养1周, 对其分别进行50 μmol·L-1 ABA和2 μmol·L-1 IAA外源激素诱导处理0、2、4、8、12、24 h, 取其根部提取总RNA, 以0 h作为对照, 丹参Actin7基因为内参基因, 进行荧光定量PCR分析。结果表明, 在50 μmol·L-1 ABA诱导下, 24 h表达量突然升高(图 7C); 在2 μmol·L-1 IAA诱导下, 4 h表达量达到高峰, 随后下降(图 7A)。这说明外源激素ABA和IAA都能诱导SmHSP21.8基因的表达。
讨论丹参作为重要的传统中药之一, 在我国最早的药学典籍《神农本草经》中被列为上品, 至今已经沿用千年。丹参的有效成分主要为脂溶性的邻醌类和对醌类化合物以及水溶性的酚酸类化合物[14]。研究表明, 酵母提取物、银离子、高温、干旱等生物和非生物诱导子以及茉莉酸甲酯等外源激素能够促进丹参有效成分的积累[11, 15, 16]。丹参毛状根在酵母提取物和银离子共同诱导后, 药用活性成分丹参酮、丹酚酸积累明显增加, 转录组分析显示丹参酮生物合成相关基因表达量增加[15]。2-D蛋白质组学分析, 发现分子伴侣在差异表达蛋白中占比达到22%, 推测这些分子伴侣在丹参应激响应中发挥重要作用[12]。对橙根丹参代谢组和转录组分析[13], 发现丹参的有效成分丹参酮IIA和丹参酮I在橙色根系丹参中有显著降低, 可能是脱氢酶非正确折叠造成的, 而HSP等分子伴侣大量表达, 可能参与了脱氢酶等丹参酮生物合成相关酶的损伤的修复, 因此研究小分子热激蛋白将有利于揭示丹参抗逆性和有效成分积累的机制。
本研究从丹参cDNA中扩增得到SmHSP21.8基因全长, 并对该基因进行生物信息学分析, 结果表明该基因与已鉴定的拟南芥、番茄、大豆和豌豆中的内质网-sHSPs (ER-sHSPs) 聚在同一个分支, 并有内质网小分子热激蛋白N端保守基序。有研究表明, sHSPs在植物的花、果实和种子中都有表达, 且随高温、冷等胁迫诱导而表达量增加[17]。丹参SmHSP21.8基因组织特异性表达分析结果表明, 花中的表达量是根的20倍, 是茎、叶的8倍, 说明SmHSP21.8在花中特异表达。小分子热激蛋白(sHSPs) 作为植物最重要的应激蛋白家族之一, 在植物响应逆境胁迫中起重要作用[1, 17, 18]。高温38 ℃诱导后, 测定SmHSP21.8基因的相对表达量, 在处理1 h达到高峰, 随后逐步下降, 说明在丹参中SmHSP21.8基因能快速响应高温胁迫, 符合小分子热激蛋白的表达特点。有研究表明[19], 丹参毛状根在聚乙二醇(polyethylene glycol, PEG) 和ABA诱导下, 能提高丹参酮生物合成途径关键酶基因3-羟基-3甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGCR) 和1-脱氧-D-木酮糖5-磷酸合酶(1-deoxy-D-xylulose 5-phosphate synthase, DXPS) 的表达和活性, 从而促进丹参酮的积累。在15% PEG6000胁迫下, 在24 h表达量急剧升高, 随后下降, 这说明SmHSP21.8基因在高温、干旱胁迫下的表达可能存在一个反馈调节机制, 当植物的生长条件发生改变, 各功能蛋白活性受到影响的同时, 非正常折叠的蛋白增加, 从而使SmHSP21.8的表达水平上调, 参与并帮助蛋白再折叠, 使功能蛋白恢复活性, 维持细胞稳态, 错误折叠的蛋白减少后, SmHSP21.8的表达水平也随之减低。植物激素ABA不仅调控了植物生长和发育, 而且作为“胁迫激素”感知干旱、盐、热和冷等逆境胁迫[20, 21]。IAA和ABA信号途径经常会以协同或拮抗形式调控植物的生长发育和对环境适应[22]。在2 μmol·L-1 IAA诱导下, SmHSP21.8基因表达量先快速上升然后下降, 在4 h达到最高, 表明该基因响应生长素信号通路, 而在50 μmol·L-1 ABA胁迫后4 h, SmHSP21.8基因表达量与对照相比较几乎没有变化。ABA诱导24 h之后, SmHSP21.8表达量显著升高近12倍, 而IAA诱导24 h, SmHSP21.8表达量只有略微增加。由此结果推测ABA信号途径和生长素信号途径可能以拮抗的形式调控SmHSP21.8的表达。在拟南芥中, AtHSP22过表达株系在生长素IAA的诱导下, AtHSP22通过影响生长素极性运输来调节生长素应激反应, 同时表现出侧根数量增加[6]。SmHSP21.8与AtHSP22同处于内质网小分子热激蛋白亚家族, SmHSP21.8可能参与丹参的生长素的运输过程, 缓解生长素的应激反应, 促进丹参根部发育, 进而有利于丹参有效成分在根部积累。
综上所述, 丹参SmHSP21.8基因表现出对高温、干旱等非生物胁迫、及施加外源激素ABA和IAA的应激响应, 作者也得到了丹参SmHSP21.8的过表达和干扰的毛状根, 期望通过以后的工作进一步揭示小分子热激蛋白参与丹参非生物胁迫响应和有效成分积累的分子机制。
作者贡献: 王世威、申业和黄璐琦设计本项工作; 王世威执行了本项工作的实验、数据分析和论文初稿的撰写; 屈仁军、王新新和郑汉负责对本研究实验操作进行指导; 彭佳铭、时晨晶参与植物实验材料取样; 申业负责文章修改; 申业负责的课题资助本研究。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Waters ER, Vierling E. Plant small heat shock proteins-evolutionary and functional diversity[J]. New Phytol, 2020, 227: 24-37. DOI:10.1111/nph.16536 |
| [2] |
Haslbeck M, Weinkauf S, Buchner J. Small heat shock proteins: simplicity meets complexity[J]. J Biol Chem, 2019, 294: 2121-2132. DOI:10.1074/jbc.REV118.002809 |
| [3] |
Santhanagopalan I, Basha E, Ballard KN, et al. Model Chaperones: Small Heat Shock Proteins from Plants[M]. Cham: Springer International Publishing, 2015: 119-153.
|
| [4] |
McLoughlin F, Basha E, Fowler ME, et al. Class I and II small heat-shock proteins together with HSP101 protect protein translation factors during heat stress[J]. Plant Physiol, 2016, 172: 1221-1236. |
| [5] |
Ma W, Guan XY, Li J, et al. Mitochondrial small heat shock protein mediates seed germination via thermal sensing[J]. Proc Natl Acad Sci U S A, 2019, 116: 4716-4721. DOI:10.1073/pnas.1815790116 |
| [6] |
Li YL, Li YQ, Liu YC, et al. The sHSP22 heat shock protein requires the ABI1 protein phosphatase to modulate polar auxin transport and downstream responses[J]. Plant Physiol, 2018, 176: 2406-2425. DOI:10.1104/pp.17.01206 |
| [7] |
Yu CY, Leung SKP, Zhang WX, et al. Structural basis of substrate recognition and thermal protection by a small heat shock protein[J]. Nat Commun, 2021, 12: 3007. DOI:10.1038/s41467-021-23338-y |
| [8] |
State Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. Vol 1. Beijing: China Medical Science Press, 2020.
|
| [9] |
Zhan ZG. Advances in biosynthesis and regulation of the active ingredient of Salvia miltiorrhiza based on multi-omics approach[J]. Acta Pharm Sin (药学学报), 2020, 55: 2892-2903. |
| [10] |
Li WY, Gao W, Shao AJ, et al. Effect of elicitors on induction and manipulation of secondary metabolic effective ingredients in Salvia miltiorrhiza[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 258-262. |
| [11] |
Zhan ZG, Li X. Biosynthesis and transcriptional regulation of tanshinones and salvianolic acids[J]. Acta Pharm Sin (药学学报), 2020, 55: 2110-2121. |
| [12] |
Wang YJ, Shen Y, Shen Z, et al. Comparative proteomic analysis of the response to silver ions and yeast extract in Salvia miltiorrhiza hairy root cultures[J]. Plant Physiol Biochem, 2016, 107: 364-373. DOI:10.1016/j.plaphy.2016.06.028 |
| [13] |
Zhan ZL, Fang WT, Ma XH, et al. Metabolome and transcriptome analyses reveal quality change in the orange-rooted Salvia miltiorrhiza (Danshen) from cultivated field[J]. Chin Med, 2019, 14: 42. DOI:10.1186/s13020-019-0265-6 |
| [14] |
Jiang ZQ, Gao W, Huang LQ. Tanshinones, critical pharmacological components in Salvia miltiorrhiza[J]. Front Pharmacol, 2019, 10: 202. DOI:10.3389/fphar.2019.00202 |
| [15] |
Gao W, Sun HX, Xiao HB, et al. Combining metabolomics and transcriptomics to characterize tanshinone biosynthesis in Salvia miltiorrhiza[J]. BMC Genomics, 2014, 15: 73. DOI:10.1186/1471-2164-15-73 |
| [16] |
Ma XH, Ma Y, Tang JF, et al. The biosynthetic pathways of tanshinones and phenolic acids in Salvia miltiorrhiza[J]. Molecules, 2015, 20: 16235-16254. DOI:10.3390/molecules200916235 |
| [17] |
Zhang N, Jiang J. Research advances of small heat shock protein gene family (sHSP) in plants[J]. Plant Physiol J (植物生理学报), 2017, 53: 943-948. |
| [18] |
Wang M, Jiang B, Lin YE, et al. Advances of small shock proteins participating in plant resistance[J]. J Anhui Agric Sci (安徽农业科学), 2018, 46: 29-32. |
| [19] |
Yang DF, Sheng DF, Duan QM, et al. PEG and ABA trigger the burst of reactive oxygen species to increase tanshinone production in Salvia miltiorrhiza hairy roots[J]. J Plant Growth Regul, 2012, 31: 579-587. DOI:10.1007/s00344-012-9268-6 |
| [20] |
Zhu JK. Salt and drought stress signal transduction in plants[J]. Annu Rev Plant Biol, 2002, 53: 247-273. DOI:10.1146/annurev.arplant.53.091401.143329 |
| [21] |
Yoshida T, Fernie AR, Shinozaki K, et al. Long-distance stress and developmental signals associated with abscisic acid signaling in environmental responses[J]. Plant J, 2021, 105: 477-488. DOI:10.1111/tpj.15101 |
| [22] |
Emenecker RJ, Strader LC. Auxin-abscisic acid interactions in plant growth and development[J]. Biomolecules, 2020, 10: 281. DOI:10.3390/biom10020281 |
 2022, Vol. 57
2022, Vol. 57


