《中医药发展战略规划纲要(2016~2030年)》[1]提出要运用现代科学技术和传统中医药研究方法深化中药药性理论、中药复方物质基础等研究, 可见中药物质基础和药性理论现代诠释是制约中药现代化进程的关键问题。中药的性味是构成药物基本性能的要素, 是对中药药效的经典归纳和总结, 是治疗疾病的说理工具。甘草药性和缓, 具有缓急止痛、调和诸药的作用, 可通过“调和”功效与寒热补泻各类药物通用来发挥最佳疗效, 在中药临床使用中最为广泛, 素有“十方九草”之说[2]。黄连性味苦寒, 具有清热燥湿、泻火解毒之效, 但易引起“苦寒败胃”, 误服或过服易耗伤津液、脾阳和胃阴, 助胃寒, 临床多表现为腹泻[3]。甘草-黄连是中医谴药组方过程中的经典药对, 甘草的调和之性可以缓和黄连苦寒, 现代研究也表明甘草-黄连配伍共煎后表现出明显的临床增益, 清热解毒效果有所提升, 已经有学者从共煎煮过程中形成酸碱复合物的角度进行探讨这种“配伍共煎增效减毒机制”[4], 但深入的化学机制尚未解释清楚。有关中药药对的现代研究表明, 很多中药药对在水煎煮过程中形成超分子体系[5], 这一体系会对中药的药性、药味及药效产生重要影响。因此提出假说: 甘草-黄连配伍“增效减毒”物质基础可能与甘草-黄连共煎煮形成超分子体系进而影响黄连“性、味、效”有关。
中医视真菌、细菌感染为外邪, 外邪入内化热属里热证范畴, 中医对于此类由病原菌引起的里热证多施以清热解毒寒凉类的中药予以治疗, 中药的寒凉药性与其抗菌的临床药效之间存在一定的内在规律性[6]。本课题组前期研究发现, 甘草-黄连药对配伍共煎煎煮时, 有效成分相互作用, 在弱键诱导下出现了稳定的分散体系, 致使煎煮液呈浑浊多相态[7]。本实验模拟临床条件煎煮, 采用透析和冷冻干燥的方法对汤剂中的超分子体系进行抽提, 保持汤剂中超分子体系的尺度及形态, 完整还原“一碗汤剂”的真实状态。同时运用扫描电子显微镜及动态光散射法表征超分子体系的形貌特征, 进一步通过小鼠腹泻实验、感官评定及抗菌实验从“性、味、效”三个角度评价, 证实配伍共煎后形成的超分子体系增强黄连抑菌活性的同时减轻了黄连苦寒之性。本实验在甘草黄连配伍的前期大量研究工作的基础上, 进一步利用超分子化学的研究策略深入探究甘草和合黄连“性-味-效”的物质基础来源于甘草-黄连配伍共煎过程中形成的超分子体系, 研究结果为中药复方有效物质基础研究提供一个新的思路。
仪器与材料药品与试剂 甘草、黄连(北京同仁堂); 光谱级溴化钾(北京伊诺凯科技有限公司); 氘代二甲基亚砜(北京伊诺凯科技有限公司); 氢氧化钠、甲醇、2.5%戊二醛液、乙醇、丙酮、锇酸、醋酸铀、枸橼酸铅、葡萄糖(北京化工厂); 甲酸、乙腈(美国Fisher公司); 磷酸盐(PBS) 缓冲液(北京拜尔迪生物技术有限公司); 维生素K (上海阿拉丁试剂有限公司); 金葡菌(S. aureus, ATCC 6538P, 北京中医药大学生命科学学院); 营养肉汤、营养琼脂(北京索莱宝生物科技有限公司)。
实验动物 昆明雄性小鼠(18~22 g), 购自北京维通利华实验动物技术有限公司, 许可证号: SCXK (京) 2016-0011。实验小鼠均饲养于北京中医药大学药物实验动物中心, 所有动物研究均遵循北京中医药大学动物伦理委员会的指导方针。
实验仪器 冷冻干燥机(Beta 2-8 Ldplus, 德国Christ公司); 质谱分析仪(美国安捷伦科技有限公司); 马尔文粒度仪(Zetasizer Nano ZS 90, 英国马尔文仪器有限公司); 场发射扫描电子显微镜(FESEM, ZEISS-SUPRA55, 德国ZEISS公司); 紫外-可见分光光度计(UH5300, 日本HITACHI公司); 多功能酶标仪(Multiskan GO型, 芬兰热电科技仪器有限公司); 恒温生化培养箱(LRH-250型, 广州瑞明仪器有限公司); 激光扫描共聚焦显微镜(Leica TCSSP8型, 德国Leica公司)。
样品制备 分别称取甘草、黄连各5.00 g, 装入无纺布隔渣袋中, 加入8倍量去离子水浸泡10 min, 加热煎煮40 min, 3 000 r·min-1趁热离心取上清液装入截留分子质量为3 000 Da的透析袋中, 置于去离子水中透析6 h, 期间更换透析外液4次, 最后将透析内液冷冻干燥得甘草-黄连药对煎煮液的超分子部位(herbal self-assembly, RC-RG SA)。
按上述方法煎煮药材后, 静置放冷, 超低温冷冻后, 冻干得药对的全方组分(herbal formula, RC-RG)。将两味药材分别单独煎煮, 静置放冷, 超低温冷冻后, 冻干得黄连单煎部位(Rhizoma single decoction, RG) 及甘草单煎部位(Liquorice single decoction, RC)。
动态光散射(DLS) 法观察 将RC-RG SA用去离子水稀释20倍后, 吸取1 mL置于比色皿中, 用马尔文粒度仪测定其粒度, 平行测定3次后, 记录其平均粒径值。
场发射扫描电子显微镜(SEM) 观察 将硅片用无水乙醇和水交替清洗两次, 待其干燥后, 将上述离心水洗得到的RC-RG SA用少量去离子水分散, 用10 μL移液枪吸取2.5 μL滴于单面抛光硅片, 室温自然干燥4 h。
液相色谱-质谱联用(LC-ESI-MSn) 分析 LC-ESI-MSn分析使用Dionex UltiMate 3000和Bruker amazon速度离子阱质谱仪进行。色谱柱为TC-C18 (4.6 mm ×250 mm, 5 μm, Agilent)。柱温保持在30 ℃。流动相为0.1%甲酸水(A) 和甲醇(B)。梯度条件为: 0~60 min, 0~100% B; 流动相流速为0.3 mL·min-1, 进样量为5 μL。在m/z 100~1 000内, 利用ESI源在正负离子模式下采集质谱。ESI-MS的条件为: 流速1.0 mL·min-1, 温度350 ℃。毛细管电压设置为3 500 V。
紫外光谱测定 分别取RC-RG SA、RC以及RG冻干粉充分溶于去离子水中, 装入清洗好的比色皿, 设置紫外-可见分光光度计的检测波长为190~600 nm, 以去离子水为空白溶液, 进行全波长扫描。
红外光谱测定 精密称取5.00 mg RC-RG SA、RC及RG冻干粉于离心管中, 与光谱级溴化钾(KBr) 粉末以适当的质量比混合研磨。在27 MPa的压力下压片2 min, 傅里叶变换红外光谱仪的扫描范围为4 000~400 cm-1, 每个样本平均扫描200次, 光谱分辨率为4 cm-1, 空气为背景。红外光谱记录和存储使用光谱软件(OMNIC 8.2)。
抗腹泻动物实验 将32只雌性昆明小鼠随机分成正常对照组、RC组、RC-RG组及间隔灌胃(先给RC, 再给RG) 组, 每组8只。实验前3天进行适应性培养, 实验动物饲养条件: 温度: 24 ± 1 ℃; 相对湿度: 55%~65%; 12 h的光/暗周期; 自由饮水、进食。实验前禁食不进水10 h。正常对照组每日灌胃生理盐水; RC组每日灌胃26.57 g·kg-1; RC-RG组每日灌胃60.66 g·kg-1; 由于RC和RG物理混合即发生分子间相互作用, 因此设置间隔灌胃组, 每日先灌胃26.57 g·kg-1 RC, 30 min后灌胃25.25 g·kg-1 RG; 小鼠每日灌胃体积均为0.1 mL/10 g (灌胃量以相同含量黄连生药材计)。给药后, 各组小鼠单独放置代谢笼内, 笼底铺有滤纸, 观察腹泻潜伏期时间, 按周干南等[8]方法观察比较各组腹泻指数。重复灌胃3天, 期间灌胃后采集小鼠粪便2~3 g盛于无菌粪便采集管中, 常规采集3次, 30 min内采用涂片法进行检测。粪便标本经革兰染色后分别于荧光倒置显微镜及电镜下观察, 检测优势菌和球杆菌比例。灌胃3天后, 50%墨汁与各组给药溶液制成灌胃浓度混合灌胃液, 按照实验剂量灌胃30 min后以颈椎脱臼法处死。立即剖腹取出上端自幽门, 下端至回盲部的全部小肠肠管, 浸入4%多聚甲醛溶液中用卷尺测量小肠肠道全长以及墨汁在肠道内推进长度, 依公式(1) 计算墨汁推进百分率, 即为肠道传输功能。
| $ \text{墨汁推进率 (%) = 肠管染黑长度 / 小肠肠管总长度 × 100%} $ | (1) |
感官评定 参考Ge等[9]的研究方法, 选取10位感官评价员, 针对苦味度这一因素分别对RC及RC-RG两个样品(样品浓度以相同量黄连生药材计) 进行打分。感官评价人员在评价前应避免接触刺激性强的物品或咀嚼口香糖, 抹去唇膏。感官评价员口含样品溶液15 s并做漱口动作, 使舌根及舌侧的苦味感受区充分感受药物味道, 吐出, 纯净水漱口5次, 每轮样品之间间隔0.5 h。评定结束后收集评价表。
抗S. aureus活性实验 采用微量肉汤稀释法、平板划线法测定RC-RG、RC、RG三个样品的抑菌活性。具体方法如下: 将3个组分的DMSO溶液置于48孔板内, 用培养基稀释其质量浓度为3.99、2.66、1.33 g·mL-1 (给药量以相同含量黄连生药材计), 每个浓度重复5个复孔, 每孔加入20 μL菌悬液, 使终体积为500 μL, 置于37 ℃恒温生化培养箱培养16 h。采用酶标仪测定每孔吸光度, 检测波长为600 nm。在实验中, 所有样品重复3次, 对金葡菌的抑制率按照公式(2) 计算。最小抑菌浓度(MIC) 为抑制率 > 80%的最低浓度[10]。用平板划线法接种3个组分不同浓度下的菌悬液, 将琼脂板置于37 ℃恒温生化培养箱, 培养16 h, 观察菌落数。
| $ \text{抑制率 (%) = [1 - (OD样品 - OD溶剂) / (OD空白菌 - OD溶剂)] × 100%} $ | (2) |
统计分析方法 用IBM SPSS 25.0进行数据统计分析, 方差分析采用ANOVA分析, 运用t检验比较两组数据差异的显著性, 其中“*”表示P < 0.05, “**”表示P < 0.01, “***”表示P < 0.001。
结果 1 甘草-黄连药对煎煮液超分子部位的发现甘草-黄连药对煎煮后, 水煎液呈明显浑浊状态(复杂多相态), 聚集但沉降不明显, 能够较长时间稳定存在; 同时, 两药单独煎煮的汤液状态相对澄清(图 1), 说明在配伍共煎煮汤液中的化学成分不是孤立存在的游离化合物(群), 成分间发生相互作用, 使汤液呈现复杂多相态[11]。

|
Figure 1 Decoction images of the combination and single herbs. A: Liquorice single decoction (RC); B: Herbal formula (RC-RG); C: Rhizoma single decoction (RG) |
将药对煎煮液直接冻干, 得到全方组分; 同时将药对煎煮液透析后冻干, 发现其中超分子部位占全方的比例为33.7%, 说明煎煮液中药物有效成分有大约1/3的组分是以超分子聚集体的形式存在。
2 甘草-黄连药对超分子部位形貌学及代表性化学成分研究如图 2A所示, 丁达尔现象表明, 共煎煮汤液中呈现均一、明显的光路; 同时, 马尔文粒度仪测定超分子部位的平均粒径为179.2 nm, 多分散系数(PDI) 为0.264, 说明药对煎煮液中存在直径大约为179 nm且尺度较集中的纳米粒(图 2B)。经FESEM观察后, 发现共煎超分子部位在FESEM下呈现出尺度均一的类球颗粒(图 2C), 粒径与DLS表征结果相一致, 上述研究结果初步提示甘草-黄连共煎煮会形成超分子。进一步采用LC-MSn对该超分子体系初步分析(图 2D), 通过对比各组分的保留行为、MS数据, 并与文献[12, 13]对照分析表明, 超分子部位的主要物质组成为甘草酸(821.04 [M-H]-) 为代表的酸性成分和以小檗碱(335.67 [M]+) 为代表的生物碱类成分组成。

|
Figure 2 Morphological characterization of the herbal self-assembly. A: Tyndall effect images of herbal self-assembly (RC-RG SA); B: Size distribution of RC-RG SA with polydispersity index (PDI) = 0.264; C: SEM images of RC-RG SA; D: Qualitative analysis of RC-RG SA using LC; E: The LC-MSn of the self-assembly. (a) The molecular ion peak of berberine; (b) The molecular ion peak of glycyrrhizic acid |
分子的紫外可见吸收光谱是由于分子中的某些基团吸收了紫外可见辐射光后, 发生了分子振动能级跃迁和电子能级跃迁而产生吸收光谱, 主要反映了分子中共轭基团的特征[14]。分子发生相互作用后, 会影响共轭基团电子排布, 因此可根据紫外可见光谱的变化推测物质相互作用规律。超分子部位、黄连单煎及甘草单煎的紫外可见吸收光谱见图 3A。黄连单煎的特征吸收峰出现在424、342、264及226 nm处, 甘草单煎的特征吸收峰出现在262 nm处, 超分子部位的特征吸收峰在424、342、264 nm处, 表明超分子部位兼具黄连单煎及甘草单煎的特征峰。

|
Figure 3 A: The UV-vis absorption spectra of RC-RG SA, RC, RG; B: The FT-IR spectra of RC-RG SA, RC, RG |
该超分子部位、黄连单煎及甘草单煎的红外光谱见图 3B。化合物不同官能团或化学键中的原子时刻处于振动状态, 其振动频率与红外光的振动频率相一致, 因此当分子被红外光照射时, 其中的官能团或化学键产生振动吸收, 由于不同官能团的吸收频率不同, 在光谱中处于不同的位置。分子间相互作用后, 可能对分子内化学键的振动频率造成影响, 因此可根据红外光谱的变化, 推测分子间相互作用特点[15]。
黄连单煎部位红外图谱在1 600、1 032、609 cm-1处有尖而强的吸收峰并且在3 223、1 506、1 360、1 271、1 032、609 cm-1有吸收峰。黄连中广泛存在异喹啉类生物碱如小檗碱、黄连碱、巴马汀等, 这些生物碱包含苯环以及-C-O-C等结构。1 600、1 506 cm-1为典型苯环上C-H伸缩振动峰, 1 271 cm-1为AR-O-C-不对称伸缩振动峰, 1 032 cm-1为-C-O-C不对称伸缩振动峰。甘草单煎部位在1 609、990、522cm-1处有尖而强的吸收峰, 在3 270、2 926、1 409、1 019 cm-1存在吸收峰。甘草中主要成分五环三萜类化合物如甘草酸等。3 270 cm-1为羟基伸缩振动峰; 2 926、1 409 cm-1分别为CH伸缩振动与弯曲振动。超分子部位的特征峰既包含甘草黄连单煎液的特征峰如1 506、1 360、1 019 cm-1, 也存在新产生的吸收峰如3 272、579、1 146 cm-1; 这些峰形和峰位的变化说明甘草-黄连药对配伍共煎后化学成分间相互碰撞, 例如甘草酸和小檗碱, 分子的官能团间(羧基与氨基、苯环与苯环等) 形成弱键作用, 提示甘草黄连共煎超分子部位为一种新的物质状态, 并非二者的简单加合。
4 感官评定分析结果从感官评价结果可以看出, 将黄连单煎组(RC) 最终评级为“苦”的人数最多, 为90%, 苦度比较强烈, 甚至可以产生难忍受的恶心感, 漱口后仍有评价员感受到回苦。10%的人将样品评级为“较苦”, 所以最终判定该样品的评级等级为“苦”。配伍共煎组(RC-RG) 的评级等级为“较苦”, 苦度可以忍受, 漱口后苦味消退(表 1)。上述结果表明甘草黄连配伍共煎后明显降低了黄连的“苦”, 这与传统认知的“甘草味甘、调和诸药”记载相一致, 本研究表明产生该结果的主要原因并非全部是甘草味甘, 而与甘草化学成分(甘草酸) 和黄连化学成分(小檗碱) 相互作用, 在弱键诱导下分子重排形成稳定的超分子体系改变了苦味成分的存在状态相关。
| Table 1 Analysis results of sensory evaluation |
给药后, 黄连单煎组出现腹泻情况, 表现为大便次数增多, 大便质地偏稀, 个别小鼠粪便出现黏液。①在腹泻率方面, 与黄连单煎组48%的腹泻率相比, 共煎全方组和正常对照组均为0, 有显著统计学差异(P < 0.01), 而间隔给药组26%有一定统计学差异(P < 0.05); ②在腹泻潜伏期方面, 与黄连单煎组103.33 ± 37.6 min相比, 间隔给药组127.5 ± 27.7 min, 不具有明显的推迟作用; ③在肠道推进率方面, 与黄连单煎组(70.81 ± 17.6) %相比, 共煎全方组(61.18 ± 6.75) %、正常对照组(61.59 ± 5.03) %, 均有显著统计学差异(P < 0.01), 而间隔给药组(65.09 ± 10.4) %不具有统计学意义; 综上实验指标, 共煎组在减缓肠道推进和推迟腹泻方面均作用明显, 实验小鼠不出现腹泻现象; 间隔给药组在减缓肠道推进和延长腹泻潜伏期方面不明显, 实验小鼠表现出与黄连单煎组类似的腹泻现象(表 2)。
|
Table 2 Effect of glycyrrhiza-Rhizoma coptidis on diarrhea in mice ( |
目前临床对于肠道菌群失调最常见的检测方法之一是在粪便中找优势菌[16], 根据革兰阳性球菌比例进行分型, 正常生理状态下肠道中的杆菌比例较大。在图 4中可以看到, 正常组与配伍共煎组杆菌明显多于球菌, 杆菌占据大部分视野。而间隔给药组、黄连单煎组较正常组和配伍共煎煮组球菌数量明显增多。实验结果说明配伍共煎后球杆比失衡现象明显消失, 与此同时间隔给药组仅在一定程度上正向调节了球杆菌群比例; 提示甘草配伍对黄连引起的肠道菌群失调具有调治作用, 与超分子体系密切相关。
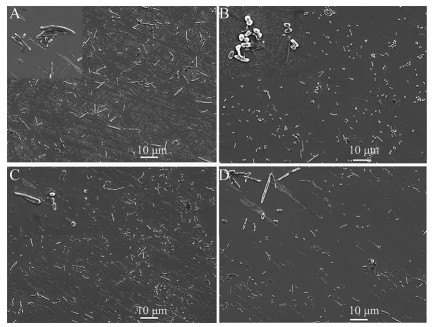
|
Figure 4 Effect of Liquorice and Rhizoma chinensis on intestinal coccobacillus flora group in mice. A: Normal control; B: RG; C: RC/RG; D: RC-RG |
综合以上小鼠腹泻模型的实验结果, 对于黄连大苦大寒药性引起的腹泻不良反应, 甘草配伍共煎后可以明显改善乃至消除, 然而间隔给药却仅是轻微改善的实验现象进一步证明甘草黄连共煎过程中产生超分子体系是缓解腹泻的重要原因, 不是甘草单方面生物拮抗产生的影响, 侧面证实了共煎超分子体系存在及其调和“性-味”发挥的重要角色。
6 甘草-黄连药对煎煮液自组装部位抗S. aureus活性探究预实验发现甘草单煎组分在实验浓度下不存在抑菌活性, 选取金葡菌对RC、RC-RG进行MIC值的测定。如图 5所示, 折合成中药饮片用量, RC组MIC值为3.99 g·mL-1, RC-RG组MIC值为2.66 g·mL-1; 平板划线法显示出在RC-RG组MIC下, 细菌菌落数较少, 而RC组明显多于RC-RG组, 提示二者共煎增强了黄连的药效。进一步通过扫描电镜对S. aureus进行形态学的观察, 发现全方组对细菌的形态、细胞膜破坏较大, 相较于单煎组, 全方组明显破坏了细胞完整性, 使其表面皱缩、凹陷严重, 导致胞质的泄露, 对细菌的生理功能造成严重影响。这一现象与上述的抑菌实验相对应, 共同证明了配伍后具有优良的抗菌作用, 且是通过破坏细胞膜及其完整性导致的[17]。这提示甘草、黄连配伍在共煎煮过程中所形成的超分子部位对甘草-黄连药对发挥药效活性具有重要影响。

|
Figure 5 Antibacterial activity of RC-RG, RC. A: Inhibition rate of RC, RC-RG; B: Photographs of agar plates were treated by RC, RC-RG; C-E: FESEM images of bacterial morphology of control, RC and RC-RG, respectively |
通过对甘草-黄连药对煎煮液中多相态聚集体的抽提及粒径测定, 发现药对共煎液中存在尺度为179 nm左右的颗粒; 经SEM方法进一步观察其微观形貌, 发现煎煮液中聚集体为类球形颗粒, 其尺度分布较集中, 因此证实甘草-黄连药对煎煮液中确实存在尺度为纳米级超分子体系。同时, 通过对煎煮过程的观察, 发现这一聚集过程只有在两种药物共同煎煮时才会出现, 单煎液呈现澄清透明状态。采用液质联用技术(LC-MSn) 对超分子部位的主要物质组成进行了鉴定, 发现其主要成分为以甘草酸为代表皂苷和以小檗碱为代表的生物碱类; 利用紫外可见光谱和红外可见光谱技术表征甘草和黄连配伍发生了分子间相互作用, 分子的官能团间存在弱键作用, 提示汤剂中存在超分子; 通过比较配伍共煎前后的小鼠腹泻现象、苦味度以及对耐药金葡菌的抑菌活性, 发现配伍共煎甘草增强黄连抑菌活性的同时, 明显改善了黄连“苦寒败胃”的不良反应。本研究也实验了间隔给药方式对小鼠腹泻现象的影响, 发现间隔给药在一定程度改善了黄连苦寒引起小鼠腹泻的不良反应, 但效果不稳定并且与共煎煮组在腹泻指数、球杆比等均存在差别。同时, 研究发现RC/RG物理混合无法测定稳定的抗菌活性, 表明物理混合和共煎煮有效成分相互作用存在差异, 与前期研究结果一致[7]。综合实验结果, 得出结论: 甘草“和合”黄连的作用机制不是简单的甘草生物拮抗, 而是共煎形成超分子体系进而“和合”黄连的药性、药效、药味。那么超分子体系的形成又是如何发挥作用的呢?笔者在借鉴前人研究结论的基础上做出猜测[18, 19]: 甘草“和合”黄连增效减毒的机制是超分子体系的形成影响了黄连生物碱的化学结构、空间构型进而影响其在体内的溶解、释放、吸收的过程, 使药效更加持久高效的同时降低了单位时间内的聚集效应, 从而避免了黄连“大苦大寒”所引起的不良反应。本实验利用超分子化学的研究方法从“性-味-效”三个角度初步探究了甘草“和合”黄连的科学内涵, 中药配伍共煎形成超分子的过程不容忽视。
近年来, 有专家学者发现天然小分子具有形成超分子的特性[19, 20], 本课题组聚焦中药复方在配伍共煎煮时产生的超分子体系[21], 本研究丰富了利用超分子化学探究中药复方物质基础的研究方法, 为阐明中药配伍共煎“减毒增效”的科学内涵提供了新的思路。
作者贡献: 李文与王志家共同完成实验内容及论文撰写工作; 林晓钰、刘小靖、韩娜娜、袁枝花和皮雯敏辅助完成部分实验内容; 雷海民提供平台支撑; 王鹏龙设计课题思路和实验方案, 提供研究经费并指导论文的撰写和修改。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Cao C, Feng J, Li L, et al. Recognition of Chinese medicine properties based on the viewpoint of "recognizing the properties by effect"[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2021, 36: 648-653. |
| [2] |
Yang BC, Fang Y. Application of Radix glycyrrhizae in harmonizing Chinese medicine[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2012, 29: 042. |
| [3] |
Chen YC, Zhang L, Lu DX, et al. Exploring the biological basis of Huanglian of "Ku Han Bai Wei" based on TAS2R38[J]. J Hunan Univ Chin Med (湖南中医药大学学报), 2021, 41: 224-229. |
| [4] |
Pei MR, Xuan CS, Duan XS, et al. Studies on chemical structure of complexes compounds by acid and alkaline components of pair medicines in decoction[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 3054-3059. |
| [5] |
Huang XM, Wang PL, Li T, et al. Self-assemblies based on traditional medicine berberine and cinnamic acid for adhesion-induced inhibition multidrug-resistant Staphylococcus aureus[J]. ACS Appl Mater Interfaces, 2020, 12: 227-237. DOI:10.1021/acsami.9b17722 |
| [6] |
Zhang XN, Ma F, Zheng YQ, et al. Current status and prospect of the function and mechanism of bitter cold traditional Chinese medicine toward pathgenic meicroorganism[J]. Chin Foreign Med Res (中外医学研究), 2020, 18: 180-182. |
| [7] |
Li W, Wang ZJ, Liu XJ, et al. Based on weak bond chemistry, the interaction mechanism between glycyrrhiza protein and berberine in water decocting process of Liquorice and Rhizoma coptidis was investigated[J]. Acta Pharm Sin (药学学报), 2021, 56: 2119-2126. |
| [8] |
Zhou GN, Hu HZ, Wang YX, et al. Preparation of mouse diarrhea model and application of diarrhea index[J]. Chin Tradit Herb Drugs (中草药), 1994, 25: 195-196, 199, 223-224. |
| [9] |
Ge XJ, Tang NY, Yang R, et al. Study on effect of sea buckthorn on the flavor and consumer acceptance of Yogurt[J]. Sci Technol Food Ind (食品工业科技), 2021(05): 1-16. |
| [10] |
Tian XH, Wang PL, Li T, et al. Self-assembled natural phytochemicals for synergistically antibacterial application from the enlightenment of traditional Chinese medicine combination[J]. Acta Pharm Sin B, 2020, 10: 1784-1795. DOI:10.1016/j.apsb.2019.12.014 |
| [11] |
Tian XH, Zhang H, Li T, et al. New stragegy on scientific connotation of Chinese madica compatibility enlightened by precipitation from Chinese materia medica formula decoction[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 4778-4783. |
| [12] |
Hatano T, Kagawa H, Yasuhara T, et al. Two new flavonoids and other constituents in licorice root: their relative astringency and radical scavenging effects[J]. Chem Pharm Bull, 1988, 36: 2090-2097. DOI:10.1248/cpb.36.2090 |
| [13] |
Gessler S, Randl S, Blechert S, et al. Synthesis and metathesis reactions of a phosphine-free dihydroimidazole carbene ruthenium complex[J]. Tetrahedron Lett, 2000, 41: 9973-9976. DOI:10.1016/S0040-4039(00)01808-6 |
| [14] |
Han CY, Li YJ. Ultraviolet spectrophotometry and vitamin B and vitamin C content measurement[J]. Light Ind Sci Technol (轻工科技), 2013, 29: 5-6. |
| [15] |
Zhao SQ. Study on the Fourier Transform Infrared Spectrum of Peony and Cortex Moutan (牡丹花和牡丹皮的傅里叶变换红外光谱研究) [D]. Kunming: Yunnan Normal University, 2015.
|
| [16] |
Deng ZY, Feng QS, Song YJ. An analysis of the intestinal dysbacteriosis and clinical diagnosis on the hospitalized patients from 2012 to 2015 in our hospital[J]. Med J Natl Defend Forces Northwest China (西北国防医学杂志), 2015, 36: 660-663. |
| [17] |
Hu D, Li H, Wang B, et al. Surface-adaptive gold nanoparticles with effective adherence and enhanced photothermal ablation of methicillin-resistant Staphylococcus aureus biofilm[J]. ACS Nano, 2017, 11: 9330-9339. DOI:10.1021/acsnano.7b04731 |
| [18] |
Zhu YX, Chen W, Wang ZZ, et al. Spatial heterogeneity and physical structure basis of antibacterial activity of Maxing Shigan Decoction[J]. Acta Phar Sin (药学学报), 2021, 56: 2112-2118. |
| [19] |
Mendes AC, Baran ET, Reis RL, et al. Self-assembly in nature: using the principles of nature to create complex nanobiomaterials[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2013, 5: 582-612. DOI:10.1002/wnan.1238 |
| [20] |
Li T, Wang PL, Guo W, et al. Natural berberine-based Chinese herb medicine assembled nanostructures with modified antibacterial application[J]. ACS Nano, 2019, 13: 6770-6781. DOI:10.1021/acsnano.9b01346 |
| [21] |
Wang PL, Guo WB, Huang GR, et al. Berberine-based heterogeneous linear supramolecules neutralized the acute nephrotoxicity of aristolochic acid by the self-assembly strategy[J]. ACS Appl Mater Interfaces, 2021, 13: 32729-32742. DOI:10.1021/acsami.1c06968 |
 2022, Vol. 57
2022, Vol. 57


