2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850;
3. 山东中医药大学药学院, 山东 济南 250355
2. Beijing Institute of Radiation Medicine, Beijing 100850, China;
3. Pharmaceutical College, Shandong University of Traditional Chinese Medicine, Jinan 250355, China
驱避剂是一种能防止动物接触、叮咬人类的药物制剂。不同于各类杀虫剂, 驱避剂通常并不直接杀死动物, 而是凭借其物理、化学作用迫使动物忌避, 发生转移潜逃[1]。优良驱避剂的标准为安全有效、作用迅速、能有效降低抗药性、且对环境无污染。
水蛭是一种环节动物, 通过肌肉收缩、舒展波浪式在水中游动, 离开水后以尺蠖式爬行[2], 较少传播疾病也不会立刻使人毙命, 但被其叮咬的部位常发生水肿性丘疹, 伤口流血较多, 真皮组织可能被破坏形成终生疤痕, 如进入人体腔道后果更严重[3, 4]。目前驱避水蛭常用方法有化学合成驱蚊剂、植物精油、物理防护等, 如采用驱蚊酯、柠檬桉叶油[5]、烟草[6]和扎紧衣服等措施。
植物对抗有害生物的化学防御机制之一是依赖其次生代谢产物植物精油。与化学驱避剂相比, 植物精油作为驱避剂不易产生抗药性、低残留、易降解, 并具有消炎止痛、广谱抗菌、杀虫驱虫、安全无污染等特点[7], 但其不稳定性、易挥发散失和被氧化变质[8]等缺点大大限制了其广泛应用, 因此将其制备成长效制剂意义重大。天然植物精油茶树油提取自桃金娘科植物互叶白千层(Melaleuca ahemifolia), 对多种节肢动物都具有良好的驱避作用[9], 但直接使用具有致敏性[10]。植物多糖魔芋葡甘聚糖(konjac glucomannan, KGM) 是一种水溶性天然高分子, 可作为缓释辅料[11]、乳化剂等[12], 还具有止血和促伤口愈合的功效[13]。疏水性多糖乙基纤维素(ethyl cellulose, EC) 是常用辅料, 具有生物相容性好、稳定性高、无毒无刺激等优点[14]。
本研究以KGM和EC为主要辅料制备茶树油乳液, 以我国最常见日本医蛭为模型, 通过滤纸圈法和水中驱避法确定其对水蛭的驱避作用。以乙酰胆碱酯酶(acetylcholinesterase, AchE)、谷胱甘肽S-转移酶(glutathione S-transferase, GST) 和羧酸酯酶(carboxylesterase, CarE) 酶活性为评价指标, 阐明茶树油乳液驱避水蛭的作用机制。为类似挥发油用于长效、高效水蛭驱避提供新思路(图 1)。
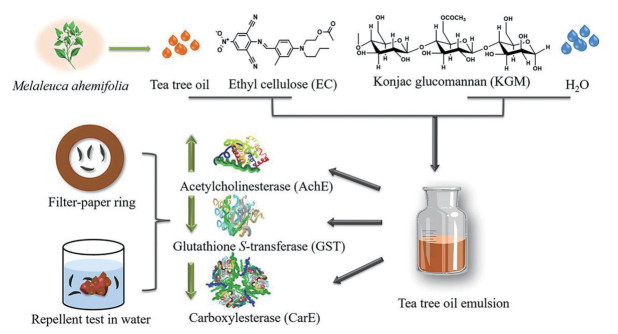
|
Figure 1 The technical diagram of the preparation, evaluations and mechanisms of tea tree oil emulsion to repel leeches |
药物与试剂 茶树油(批号: 20190916, 广东富阳生物科技有限公司); Tween-20 (批号: 001018, 广州天马精细化工厂); KGM (批号: 20200910, 湖北一致魔芋生物科技有限公司); EC (批号: 636061, 上海化学试剂采购供应站); 乙酸乙酯(批号: 10009492, 国药集团化学试剂有限公司); 驱蚂蟥油膏(货号: 20181020, 天津金汇药业集团有限公司); 异氟烷(批号: 2017160701, 深圳市瑞沃德生命科技有限公司); 蛋白定量测定试剂盒(bicinchoninic acid, BCA法)、AchE测定试剂盒、GST测定试剂盒、CarE活性测定试剂盒(南京建成生物工程研究所)。
仪器 BS110S万分之一天平(北京赛多利斯仪器有限公司); 85-2型磁力搅拌器(上海司乐仪器有限公司); Spectrum TWO傅里叶变换红外光谱仪(珀金埃尔默上海有限公司); VS-555高速分散均质匀浆机(无锡沃信仪器制造有限公司); DCAT20表面张力仪(德国Dataphysics公司); EL × 800酶标仪(美国伯腾仪器有限公司); TU-1901紫外分光光度计(北京普析通用仪器有限公司); KI-II高速组织研磨仪(武汉谷歌生物科技有限公司); H2-16KR高速冷冻离心机(湖南可成仪器制造有限公司); ABS小动物气体麻醉机(上海玉研科学仪器有限公司)。
实验动物及分组 日本医蛭(取自天津市宝坻区, 经鉴定为日本医蛭, 体重0.1~0.4 g), 饲养在装有自来水的塑料瓶中(每周换水2~3次, 水瓶用纱布封口)。SD (Sprague-Dawley) 雄性大鼠, SPF级, 8周龄, 购自斯贝福(北京) 生物技术有限公司, 许可证号: SCXK (京) 2019-0010。所有动物实验经军事科学院军事医学研究院伦理委员会批准且实验均按照相关指导原则和规定进行。适应性饲养3天后, 随机分为5组, 分别为生理盐水组(control)、空白乳液组(blank emulsion)、茶树油水溶液组(tea tree oil)、茶树油乳液组(tea tree oil emulsion) 和阳性对照组(驱蚂蟥油膏, leech repellent ointment)。
茶树油水溶液的制备 称取1 g Tween-20加去离子水至100 mL配成1% Tween-20水溶液。取4 mL茶树油加入1% Tween-20水溶液至20 mL, 配成20% (v/v) 茶树油水溶液。
茶树油乳液的制备与评价
茶树油乳液的制备 分别称取0.1、0.2、0.3、0.4 g KGM在搅拌条件下缓慢加入适量水中, 待其完全溶胀后, 作为水相。称取2.5 g茶树油、0.2 g EC加入1 mL无水乙醇和1 mL乙酸乙酯, 待其完全溶胀后, 作为油相。60 ℃水浴加热条件下, 将油相加入水相中, 加水至50 mL, 迅速搅拌混匀, 10 000 r·min-1高速搅拌15 min, 即得一系列含不同浓度KGM的5% (w/v) 茶树油乳液。空白乳液除不加茶树油外, 其余制备过程与茶树油乳液相同。
接触角测量 液体在固体材料表面上的接触角是衡量该液体对材料表面润湿性能的参数[15]。若接触角小于90°, 则液体较易润湿固体, 其角越小, 表示润湿性越好; 若接触角大于90°, 则液体不容易润湿固体, 易在表面上移动。取一定量的空白乳液和茶树油乳液均匀涂布在载玻片上, 待其完全干燥成膜后, 直接滴水到样品表面, 测量其接触角。
傅里叶变换红外光谱测定 分别取茶树油、KGM、EC、茶树油乳液及茶树油、KGM与EC三者的物理混合物(茶树油∶KGM∶EC = 12.5∶2∶1, w/w/w), 在4 000~500 cm-1波数范围内进行红外光谱分析乳液制备过程是否发生化学变化。
滤纸圈法驱避效果评价 取直径为20 cm的圆形滤纸, 剪成内圆直径为12 cm的圆环即为滤纸圈, 滤纸圈用双面胶固定, 并涂抹制剂至饱和(约4 mL)。将10只水蛭放入处理好的滤纸圈中。实验开始后每10 min观察并记录每组水蛭在滤纸圈中的分布情况。若内圈中水蛭没有逃出滤纸圈, 或偶有逃离但途中折回的情况, 表明该驱避药物有驱避作用; 若内圈中水蛭在实验过程中陆续从滤纸圈中逃出, 或出现在有驱避剂的滤纸圈上且无任何异状(如身体蜷曲、抽搐、分泌淡黄绿色体液等), 则该制剂对水蛭没有驱避效果[16]。实验过程中不断向水蛭滴加少量水以保持其活力, 防止其因过度干燥导致死亡, 平行实验3次。记录水蛭逃出数, 并计算驱避率, 如公式(1):
| $ \text{驱避率 (%)} = \frac{\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{逃}\mathrm{出}\mathrm{数}-\mathrm{实}\mathrm{验}\mathrm{组}\mathrm{逃}\mathrm{出}\mathrm{数}}{\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{逃}\mathrm{出}\mathrm{数}+\mathrm{实}\mathrm{验}\mathrm{组}\mathrm{逃}\mathrm{出}\mathrm{数}}\times 100\mathrm{\%} $ | (1) |
水中驱避活性评价 将大鼠放入小动物气体麻醉机, 2%异氟烷麻醉后脱颈椎处死, 取出肝脏, 生理盐水冲洗干净后用滤纸吸干, 备用。在诱饵(大鼠肝脏0.4 g) 上涂抹0.1 mL不同制剂, 静置1 min待药物完全附着在肝脏上。在2 000 mL烧杯中加入1 000 mL水, 放入大鼠肝脏, 将10只水蛭接入至烧杯中, 观察各组诱饵上正在叮咬的水蛭只数, 平行实验3次。记录水蛭叮咬诱饵的只数, 计算驱避率, 见公式(2):
| $ \text{驱避率 (%)} = \frac{\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{叮}\mathrm{咬}\mathrm{数}-\mathrm{实}\mathrm{验}\mathrm{组}\mathrm{叮}\mathrm{咬}\mathrm{数}}{\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{叮}\mathrm{咬}\mathrm{数}+\mathrm{实}\mathrm{验}\mathrm{组}\mathrm{叮}\mathrm{咬}\mathrm{数}}\times 100\mathrm{\%} $ | (2) |
茶树油驱避剂驱避机制探讨
酶活性测定样品的制备 收集并处死经过驱避活性评价的水蛭, 准确称取0.1 g, 用4 ℃预冷生理盐水清洗后, 用滤纸拭干转至加入含0.9 mL预冷生理盐水的离心管中, 放入提前4 ℃预冷的高速组织研磨仪进行研磨, 制备成10% (w/v) 样本组织匀浆液。在4 ℃、2 400 ×g条件下离心组织匀浆液20 min, 取上清液备用。
蛋白质含量、AchE、GST酶活性测定 取上述制备的10% (w/v) 组织匀浆上清液50 μL, 按重量(g)∶体积(mL) = 1∶9加入9倍预冷的生理盐水稀释成1% (w/v) 组织匀浆液, 作为蛋白质含量待测液; 取50 μL上述匀浆上清液, 按重量(g)∶体积(mL) = 1∶19加入19倍4 ℃预冷的生理盐水稀释成0.5% (w/v) 组织匀浆液, 作为AchE待测液; 取上述制备的10%匀浆上清液100 μL作为GST待测液。具体操作方法按照蛋白定量测定试剂盒、AchE及GST测定试剂盒说明书操作进行。分别设置测定管、对照管、标准管和双蒸水空白管。操作结束后, 将各管溶液加入到96孔酶标板中, 每孔加入200 μL待测液, 在波长为562 nm下用酶标仪测定各孔的吸光度A值计算总蛋白含量(mgprotein, mgprot), 在波长为405 nm下用酶标仪测定各孔的吸光度值(A), 并计算组织匀浆液中AchE、GST活性, 见公式(3)。
| $ \text{GST活性} = \frac{{A}_{\mathrm{对}\mathrm{照}}-{A}_{\mathrm{测}\mathrm{定}}}{{A}_{\mathrm{标}\mathrm{准}}-{A}_{\mathrm{空}\mathrm{白}}} ×C_{标准品} × 稀释倍数÷ T ÷ (V_{取样} × C_{蛋白}) $ | (3) |
CarE活性测定 取上述制备好的10% (w/v) 样本组织匀浆液在4 ℃条件下以4 800 ×g离心30 min, 取上清液待测。实验设置双蒸水空白管和样品测定管, 具体操作方法按照CarE测定试剂盒说明书进行操作, 于450 nm下用紫外
| $ \text{CarE活性} = (\Delta A_{测定管} - \Delta A_{空白管}) × V_{总体积} ÷ (C_{pr} × V_{样}) ÷ T $ | (4) |
△A = △A190 s - △A10 s; V总体积: 反应体系总体积(mL), 为1.005 mL; Cpr: 上清液蛋白质浓度(mg·mL-1); V样: 加入反应体系中上清液体积(mL), 为0.005 mL; T: 催化反应时间(min), 为3 min。
统计学分析 数据以
以KGM水溶液作为水相, 茶树油与EC混合溶液作为油相, 在高剪切力作用下制备得到稳定均一的O/W型乳液。通过接触角测量表明茶树油乳液和空白乳液亲水性较强, 亲水性并未因加入茶树油而发生较大变化。红外光谱表明乳液中KGM、EC和茶树油三者只是简单物理混合, 并未发生化学反应, 不会影响抗菌驱虫的效果。
1.1 茶树油乳液均一稳定茶树油乳液外观为白色黏稠状液体。天然多糖KGM作为乳化剂易溶于水[17], 其水溶液为假塑性流体, 具有剪切稀化的性质。EC是热塑性非离子型纤维素烷基醚, 不溶于水, 具有良好的成膜性[18]。二者联用有利于形成稳定乳液, 其中KGM用量对乳液稳定性和流变性至关重要[19]。处方用量为0.8% (w/v) KGM制备得到的乳液放置10天后仍为均一体系, 没有发生相分离, 说明该乳液稳定性良好(图 2A)。
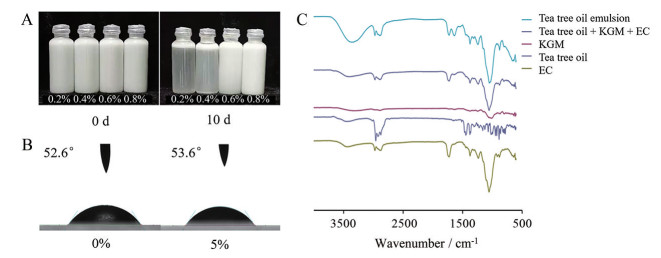
|
Figure 2 Characteristics of the tea tree oil emulsion. A: Appearance of the tea tree oil emulsion; B: Contact angle of the tea tree oil emulsion; C: Fourier transform infrared spectroscopy (FT-IR) spectra |
润湿性是固液界面分子间相互作用的宏观体现[20], 茶树油乳液成膜后的润湿性可根据接触角大小来确定。当θ < 90°, 表明部分润湿或润湿; θ = 90°是润湿与否的分界线; 当θ > 90°, 说明不易润湿。本研究中所有样品接触角均 < 90° (图 2B), 接触角并没有随茶树油加入而增加, 说明乳液亲水性较好, 为O/W型乳液, 应用时与皮肤亲和性较好。
1.3 傅里叶变换红外光谱证明乳液为简单混合在红外图谱中, 3 311 cm-1处特征吸收峰是多糖类化合物的羟基(-OH), 1 748 cm-1处是为多糖乙酰基团中羰基的吸收峰, 880 cm-1处是β-D糖苷键构型的特征吸收峰, 806 cm-1处是吡喃环振动峰, 均为KGM特征吸收峰。3 436 cm-1处为-OH伸缩振动峰, 2 877~2 974 cm-1为-C2H5伸缩振动峰, 1 727 cm-1是羰基(C = O) 伸缩振动峰, 1 375 cm-1为-CH2伸缩振动峰, 均为EC特征吸收峰[21]。茶树油、KGM和EC三者物理混合物既包括了KGM特征峰, 又包括了EC特征峰, 茶树油乳液图谱与物理混合物图谱相似, 表明3种原料只是简单混合, 并未发生化学变化, 不会影响茶树油结构及性质(图 2C)。
2 茶树油乳液对水蛭驱避活性效果评价 2.1 驱避效果良好首先采用滤纸圈法评价各组水蛭驱避效果。与对照组相比, 茶树油水溶液及茶树油乳液组均具有良好驱避效果。茶树油乳液组2 h内各时间点驱避率均为100%, 茶树油水溶液短时间内也具有较好驱避效果, 但随时间延长, 驱避效果下降。在给药后2 h, 茶树油水溶液组与茶树油乳液组二者差异显著(P < 0.01), 说明茶树油乳液驱避效果及驱避时长明显优于其他组(图 3A)。
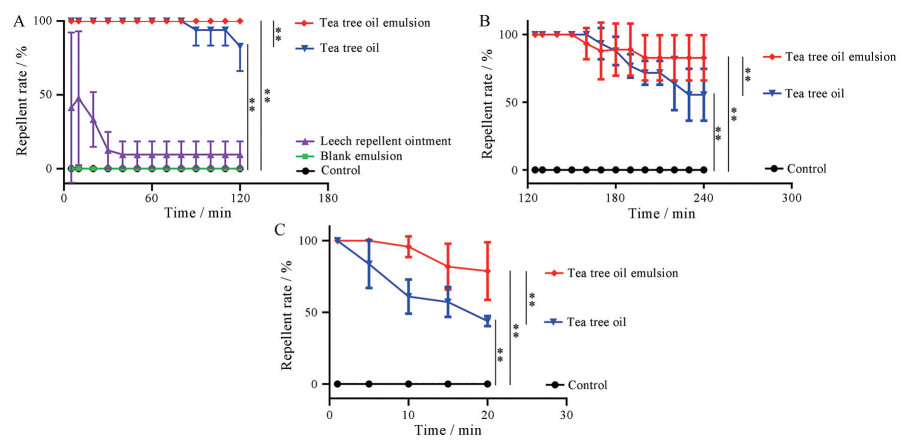
|
Figure 3 The repellent rate of different preparations on leeches at 2 h (A), 4 h (B), and 20 min in water (C). n = 10, |
因水蛭离开水后体表会逐渐变得干燥, 即使实验中不断向其滴加少量水, 仍不能保持其活力, 可能造成其没有能力爬出圈外, 因此先将涂有不同药物的滤纸圈在空气中挥发一段时间, 再将水蛭放入圈内, 以评价长时间驱避效果。结果表明茶树油乳液组3 h内驱避率 > 90%, 驱避效果优于茶树油水溶液组。4 h时, 茶树油乳液组与茶树油水溶液组的驱避率具有显著性差异(P < 0.01), 说明茶树油乳液驱避效果明显优于茶树油水溶液(图 3B)。两组茶树油制剂驱避效果具有时间依赖性, 随时间延长驱避效果降低。
2.3 水中驱避水蛭效果明显水蛭在水中和陆地上运动状态及方式、敏捷程度完全不同, 在水中运动活跃, 且易被诱饵吸引, 因此本实验以肝脏为诱饵评价水中驱避效果。茶树油乳液组10 min内水中驱避率 > 90%, 20 min内水中驱避率 > 80% (图 3C)。随时间延长, 诱饵上驱避剂逐渐扩散到水中, 药物浓度减小, 驱避效果逐渐减弱。20 min时, 茶树油乳液组水中水蛭驱避率显著高于茶树油水溶液组(P < 0.01)。
3 茶树油乳液通过调节酶活性发挥驱避作用 3.1 AchE活性提高AchE是生物神经传导的关键酶, 在胆碱能突触间降解乙酰胆碱, 终止神经递质对突触后膜的兴奋作用, 过高或过低均会引起机体异常反应[22]。茶树油会使水蛭体内AchE的酶活力增强, 促进乙酰胆碱降解, 影响正常神经信号传导, 导致水蛭中毒, 从而发挥驱避效果[23]。相比于空白对照组, 阳性对照组和茶树油水溶液、乳液组水蛭体内AchE活力均增强, 但仅阳性对照组具有显著性差异, 茶树油水溶液组及茶树油乳液组具有增强趋势(图 4A)。茶树油能使水蛭产生应激反应导致体内AchE活性增强[24], 乙酰胆碱含量减少, 从而对水蛭造成损伤。
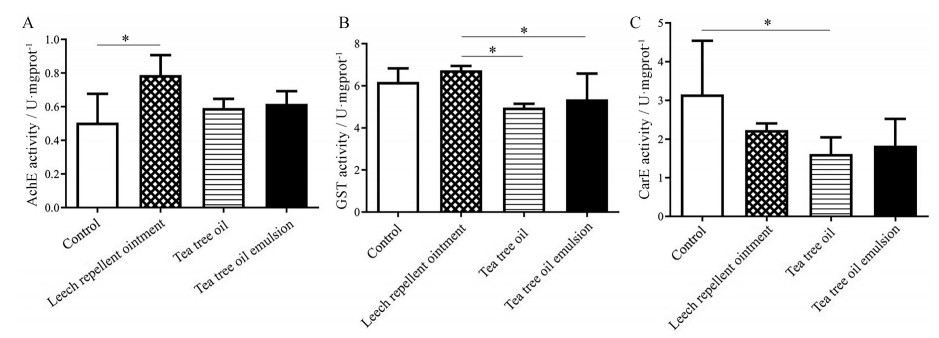
|
Figure 4 The activities of AchE (A), GST (B) and CarE (C) in vivo. n = 10, |
GST是动物体内与代谢相关的解毒酶, 该酶催化谷胱甘肽与外源性有毒物质的结合反应, 竞争性抑制生物大分子等重要成分与有毒物质的共价结合, 在许多脊椎动物和无脊椎动物体内参与代谢过程和免疫防御, 具有抗氧化、解毒等保护细胞的作用[25]。当生物受到有毒物质侵害后, 体内GST表达量会发生相应变化, 解毒酶的活力增强是昆虫对杀虫剂产生抗性的主要原因之一[26]。阳性对照药驱蚂蟥油膏主要成分为苯酚、甲酚等, 主要依靠气味驱避, 可刺激水蛭产生GST, 水蛭解毒能力代偿性升高, 不利于水蛭驱避。含茶树油各组GST活力低于空白对照组及阳性对照组, 但与对照组相比, 茶树油制剂组GST降低没有显著性差异, 具有明显降低趋势(图 4B), 说明茶树油可能抑制水蛭体内GST活性, 降低水蛭解毒能力从而产生毒性。
3.3 CarE活性降低CarE广泛分布于植物、动物和微生物体内, 通过螯合作用阻止有毒物质与体内大分子结合, 从而保护自身细胞免受损伤[27]。CarE通过改变自身与底物的亲和力增强昆虫对杀虫剂阻隔以及增强昆虫对含酯键杀虫剂的水解作用等多种方式增强昆虫抗药性, 该酶活性的提高是产生抗药性的重要标志之一[28]。相比对照组, 茶树油水溶液组和乳液组CarE的活性均降低, 仅有茶树油水溶液组具有显著性差异, 茶树油乳液组具有明显降低趋势, 说明茶树油对水蛭体内CarE活力表现为抑制作用(图 4C), 可降低水蛭抗药性。
因此, 茶树油乳剂驱避水蛭的作用可能是通过上调神经传导关键酶AchE、下调解毒代谢酶GST及CarE活性而实现的[29]。
结论本研究将亲水性KGM和疏水性EC在剪切力作用下混合后加入茶树油, 制备出亲水性好、稳定均一的乳液以有效驱避水蛭。采用滤纸圈法、水中驱避等实验证明茶树油乳液具有良好的驱避效果, 且驱避时间延长, 驱避效率提高。茶树油主要通过增强体内AchE活性, 抑制GST及CarE活性发挥驱避作用。本研究中茶树油乳液制备工艺简单, 刺激性较小, 易于涂抹, 使用依从性高; 可作为一种驱避剂新剂型为水蛭驱避提供新思路。
作者贡献: 胡静璐和刘一婧负责文献检索、具体实验和论文写作; 杜丽娜和金义光负责实验设计、指导及论文修改。
利益冲突: 本文作者声明无利益冲突。
| [1] |
Solomon B, Sahle FF, Gebre-Mariam T, et al. Microencapsulation of citronella oil for mosquito-repellent application: formulation and in vitro permeation studies[J]. Eur J Pharm Biopharm, 2012, 80: 61-66. DOI:10.1016/j.ejpb.2011.08.003 |
| [2] |
Kristan WB, Calabrese RL, Friesen WO. Neuronal control of leech behavior[J]. Prog Neurobiol, 2005, 76: 279-327. DOI:10.1016/j.pneurobio.2005.09.004 |
| [3] |
Askari N, Eshaghian A. Otorrhagia bleeding due to leech bite[J]. Adv Biomed Res, 2012, 1: 23210074. |
| [4] |
Wang X, Gan QC, Li X. Measurement of antiplatelet aggregation and potency of hirudo[J]. Acta Pharm Sin (药学学报), 2019, 54: 2178-2183. |
| [5] |
Kirton LG. Laboratory and field tests of the effectiveness of the lemon-eucalyptus extract, citridiol, as a repellent against land leeches of the genus Haemadipsa (Haemadipsidae)[J]. Annal Trop Med Parasi, 2005, 99: 695-714. DOI:10.1179/136485905X51517 |
| [6] |
Bahmani M, Farkhondeh T, Sadighara P. The anti-parasitic effects of nicotina tabacum on leeches[J]. Compar Clin Pathol, 2012, 21: 357-359. DOI:10.1007/s00580-012-1413-x |
| [7] |
Titouhi F, Amri M, Messaoud C, et al. Protective effects of three artemisia essential oils against Callosobruchus maculatus and Bruchus rufimanus (Coleoptera: Chrysomelidae) and the extended side-effects on their natural enemies[J]. J Stored Prod Res, 2017, 72: 11-20. DOI:10.1016/j.jspr.2017.02.007 |
| [8] |
Lee MY. Essential oils as repellents against arthropods[J]. Biomed Res Int, 2018, 2018: 6860271. |
| [9] |
Yuan J, Huang J, Shan M. Repellent activity of essential oils on haematophagous arthropods[J]. Chin J Vector Biol Control (中国媒介生物学及控制杂志), 2013, 24: 370-373. |
| [10] |
Di Vito M, Mattarelli P, Modesto M, et al. In vitro activity of tea tree oil vaginal suppositories against Candida spp. and probiotic vaginal microbiota[J]. Phytother Res, 2015, 29: 1628-1633. DOI:10.1002/ptr.5422 |
| [11] |
Liu Y, Zhang Y, Lan J, et al. Structure characterization of konjac glucomannan fatty acid ester hydrophobic films[J]. Polym Mater Sci Eng (高分子材料科学与工程), 2012, 28: 88-91, 96. |
| [12] |
Zhang YQ, Xie BJ, Gan X. Advance in the applications of konjac glucomannan and its derivatives[J]. Carbohyd Polym, 2005, 60: 27-31. DOI:10.1016/j.carbpol.2004.11.003 |
| [13] |
Jayakumar R, Prabaharan M, Sudheesh Kumar PT, et al. Biomaterials based on chitin and chitosan in wound dressing applications[J]. Biotechnol Adv, 2011, 29: 322-337. DOI:10.1016/j.biotechadv.2011.01.005 |
| [14] |
Melzer E, Kreuter J, Daniels R. Ethylcellulose: a new type of emulsion stabilizer[J]. Eur J Pharm Biopharm, 2003, 56: 23-27. DOI:10.1016/S0939-6411(03)00025-0 |
| [15] |
Hua DD, Li B, Yang BX, et al. Determination of contact angle of pharmaceutical excipients and regulating effect of surfactants on their wettability[J]. Acta Pharm Sin (药学学报), 2015, 50: 1342-1345. |
| [16] |
Zhao SC, Wang P, Huang ZD, et al. Effect of six commonly used pet repellents on haemaphysalis longicornis[J]. Chin J Hyg Insectic Equip (中华卫生杀虫药械), 2018, 24: 527-529, 533. |
| [17] |
Zhu F. Modifications of konjac glucomannan for diverse applications[J]. Food Chem, 2018, 256: 419-426. DOI:10.1016/j.foodchem.2018.02.151 |
| [18] |
Lin JD, Wang J, Zhang XY, et al. Structure and properties of polyacrylate latex stabilized by cellulose ether[J]. J South China Univ Technol (Nat Sci Ed) (华南理工大学学报(自然科学版)), 2006, 34: 77-81. |
| [19] |
Ni XW, Chen WJ, Xiao M, et al. Physical stability and rheological properties of konjac glucomannan-ethyl cellulose mixed emulsions[J]. Int J Biol Macromol, 2016, 92: 423-430. DOI:10.1016/j.ijbiomac.2016.07.018 |
| [20] |
Huang X, Gates I. Apparent contact angle around the periphery of a liquid drop on roughened surfaces[J]. Sci Rep, 2020, 10: 8220. DOI:10.1038/s41598-020-65122-w |
| [21] |
Li X, Jiang FT, Ni XW, et al. Preparation and characterization of konjac glucomannan and ethyl cellulose blend films[J]. Food Hydrocoll, 2015, 44: 229-236. DOI:10.1016/j.foodhyd.2014.09.027 |
| [22] |
Guo DH, Luo JP, Zhou YN, et al. ACE: an efficient and sensitive tool to detect insecticide resistance-associated mutations in insect acetylcholinesterase from RNA-Seq data[J]. BMC Bioinformatics, 2017, 18: 330. DOI:10.1186/s12859-017-1741-6 |
| [23] |
dos Santos Miron D, Crestani M, Rosa Shettinger M, et al. Effects of the herbicides clomazone, quinclorac, and metsulfuron methyl on acetylcholinesterase activity in the silver catfish (Rhamdia quelen) (Heptapteridae)[J]. Ecotoxicol Environ Saf, 2005, 61: 398-403. DOI:10.1016/j.ecoenv.2004.12.019 |
| [24] |
Tsakiris S, Kontopoulos AN. Time changes in Na+, K+-ATPase, Mg++-ATPase, and acetylcholinesterase activities in the rat cerebrum and cerebellum caused by stress[J]. Pharmacol Biochem Behav, 1993, 44: 339-342. DOI:10.1016/0091-3057(93)90471-5 |
| [25] |
Yang J, Wei X, Xu J, et al. A sigma-class glutathione S-transferase from Solen grandis that responded to microorganism glycan and organic contaminants[J]. Fish Shellfish Immun, 2012, 32: 1198-1204. DOI:10.1016/j.fsi.2012.03.010 |
| [26] |
Zhang HY, Chi GT, Zhang JL. The progress of detoxification enzyme systems and resistance of insecticide[J]. J Agric Univ Hebei (河北农业大学学报), 2002, 25: 193-195. |
| [27] |
Wang R, Jiang JW, Li Y. Role of carboxylesterase in drug metabolism[J]. Acta Pharm Sin (药学学报), 2018, 53: 186-191. |
| [28] |
Zhang JQ, Ge PT, Li DQ, et al. Two homologous carboxylesterase genes from Locusta migratoria with different tissue expression patterns and roles in insecticide detoxification[J]. J Insect Physiol, 2015, 77: 1-8. DOI:10.1016/j.jinsphys.2015.03.013 |
| [29] |
Hatfield MJ, Potter PM. Carboxylesterase inhibitors[J]. Expert Opin Ther Pat, 2011, 21: 1159-1171. DOI:10.1517/13543776.2011.586339 |
 2022, Vol. 57
2022, Vol. 57


