2. 沈阳药科大学生命科学与生物制药学院, 辽宁 沈阳 110016
2. Life Science and Biological Pharmacy Academy, Shenyang Pharmaceutical University, Shenyang 110016, China
在肾脏中, 葡萄糖在肾小球中自由滤过, 滤过后的大部分葡萄糖通过主动转运在近端小管被重吸收回体内[1], 近端小管中钠葡萄糖协同转运蛋白(sodium-glucose cotransporter, SGLT1s) 和SGLT2s负责肾脏中葡萄糖的重吸收, 维持体内血糖稳态。SGLT2s是一种低亲和力、高转运能力的转运蛋白, 位于肾近端小管的1段和2段, 借助葡萄糖转运和电化学梯度负责近端小管约90%~97%的葡萄糖重吸收。SGLT1s是一种高亲和力、低转运能力的转运蛋白, 大部分位于小肠刷状缘主要负责膳食纤维、半乳糖及葡萄糖的吸收, 小部分位于肾脏近端小管的第3段, 该处蛋白可发挥补偿作用, 负责肾脏约3%~10%的残留葡萄糖重吸收[2]。
达格列净是一种钠葡萄糖协同转运蛋白2抑制剂(sodium-glucose co-transporter 2 inhibitor, SGLT2i), 其代表一种不依赖胰岛素的全新的降糖机制类药物, 可以抑制肾脏近端小管中SGLT2s和SGLT1s, 诱导轻度渗透性利尿增加葡萄糖排泄进而发挥降糖作用。口服达格列净后, 药物经过肠道吸收, 血浆中未结合的部分对肾脏近端小管处SGLTs发挥抑制作用, 估算该类药物在肾脏近端小管对SGLT1s和SGLT2s的抑制率是理解该类药物干预葡萄糖重吸收调控机制的关键。此外, 研究显示, 同类药物卡格列净对SGLT2s选择性是SGLT1s的160倍, 300 mg剂量下可通过升高肠道中药物浓度抑制SGLT1s, 延缓肠道葡萄糖吸收, 发挥降低餐后血糖作用[3]。而达格列净对SGLT2s的选择性比SGLT1s选择性高1 400倍[4], 是否也会对肠道SGLT1s发挥抑制作用仍需要探索。通过临床试验直接测定人体组织内的药物浓度是困难的, 这使得量化达格列净对肾脏葡萄糖吸收/重吸收的贡献具有挑战性。为了解其具体作用机制, 建立PBPK模型结合Gastro PlusTM软件内嵌的高级房室吸收和转运(advanced compartmental absorption and transit, ACAT) 模型以及肾脏机制模型对药物在组织的分布浓度进行预测, 量化达格列净对小肠以及肾脏近端小管处SGLTs的抑制情况。
基于生理的药代动力学(physiologically based pharmacokinetics, PBPK) 模型是一种借助血液动力学将体内各组织连接起来的数学模型, 可以对药物在体内的吸收、分布、代谢和排泄的过程进行评估。Gastro PlusTM软件内嵌的PBPKplus版块将目标物种相关的生理和解剖信息涵盖在内, 包含了药物相关的理化性质及PK参数, 可以预测临床研究难以测量的肺、心脏、肝、肾、脾脏、肌肉、脂肪、骨骼等组织药物浓度分布, 如图 1所示。肾组织的血流灌注限速型模型定义药物进入组织中的速率主要受到组织血流灌注速率的控制, 模型假设药物在组织内瞬时平衡并均匀分布, 药物分配到肾脏室, 部分药物可能通过滤过转移到肾小管, 在肾小管内药物重吸收到肾细胞或随尿液排出。基于以上理论机制利用软件分别建立达格列净欧洲人和亚洲人的PBPK模型, 预测小肠肠段和近端小管内达格列净的药物浓度, 计算该浓度对肠道SGLT1s和近端小管SGLTs的抑制率, 有助于引导更精确的药物作用机制探索和毒性预测。
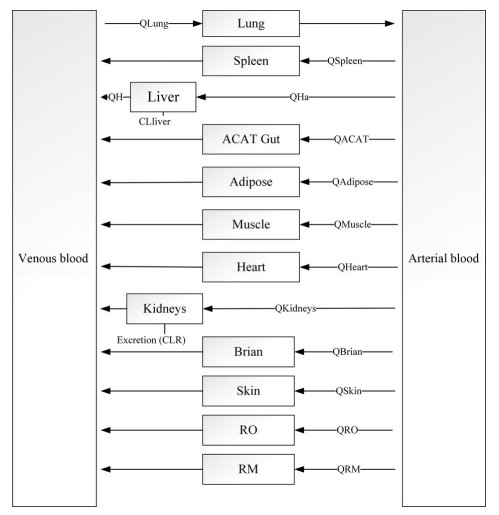
|
Figure 1 Structural overview of the whole-body physiologically based pharmacokinetics (PBPK) model developed to describe disposition of dapagliflozin following oral administration. Q: Plasma flow rate to tissue; CL: Clearance; QH: Blood flows in the hepatic vein; QHa: Blood flows in the hepatic artery; ACAT: Advanced compartmental absorption and transit; RO: Reproductive organ; RM: Red marrow |
材料 利用Gastro PlusTM软件(Version 9.8.2, 美国Simulation-Plus公司) 进行PBPK模型构建, 借助GetDate Graph Digitizer 2.25.0.32 (S.Fedorov) 获取已发表文献中的血浆浓度-时间曲线数据。
药物依赖的体外和理化参数达格列净建模需要的药物理化参数以及生物药动学参数见表 1[5-9]。药物分子量、logP/logD、pKa和不同pH下药物溶解度的参数来自于对应的文献和DrugBank数据库。人血浆浓度分配比、组织渗透性等通过软件ADMET预测或优化得到。
| Table 1 Parameters for the PBPK modeling of dapagliflozin in Asian and European. B/P: Blood/plasma concentration ratio; Fup: The percent of drug that is not bound to plasma proteins; Peff: Effective permeability coefficient; CL: Clearance; Vmaxreabs: SGLTs maximum reabsorption rate for healthy subjects; Ki: Dapagliflozin inhibition constant for SGLTs; Kmreabs: Michaelis constant of glucose affinity for SGLTs; SGLTs: Sodium glucose co-transporter; ADMET: Absorption, distribution, metabolism, excretion, toxicity |
建立达格列净口服模型 64名欧洲人分别口服单剂量达格列净2.5、10、20、50和100 mg, 受试者平均年龄为28~37岁, 平均体重为74~84 kg[10]。32名健康亚洲人分别口服单剂量达格列净2.5、10和20 mg, 受试者平均年龄为21~24岁, BMI为20.0~21.9 kg·m-2 [11]。收集上述不同剂量下健康人药物血浆浓度-时间曲线数据、24 h尿中药物排泄数据以及测定时间内的累积葡萄糖排泄量。分别建立健康欧洲人和亚洲人达格列净口服吸收模型。将模型预测的亚洲人和欧洲人血浆药物浓度-时间曲线和24 h尿中药物的排泄量与实测值进行比较, 同时对相关参数进行优化。达格列净的药效学指标为葡萄糖排泄量, 为了进一步验证PBPK模型预测组织浓度分布的准确性, 在上述欧洲人和亚洲人口服2.5 mg达格列净后建立的PBPK模型基础上搭建了达格列净的PD模型。
模型验证 为验证上述模型可靠性, 分别对欧洲人10、20和100 mg以及亚洲人10和20 mg的剂量进行预测并与实测的PK数据以及24 h尿中药物排出量进行比较。将达格列净的血浆药物浓度与药效指标联系起来, 在PBPK模型建立的基础上搭建达格列净的PD模型, 利用建立的PD模型预测欧洲健康人口服10、50 mg达格列净后120 h的尿葡萄糖排泄量(urine glucose excretion, UGE), 以及亚洲健康人口服达格列净20 mg后24 h的UGE。将预测值与实测值进行比较进一步验证模型预测组织药物浓度分布的可靠性。
模型评价标准 将软件预测的达格列净血药-浓度时间曲线与实测数据的曲线特征进行比较。此外, 为进一步验证模型有效性, 引入折叠误差(fold error, 预测值/实测值) 评价达格列净的PBPK模型。折叠误差广泛用于评估模型的精度, 主要PK参数的预测值与实测值(AUC、Cmax、tmax) 比值在0.5~2倍误差范围内则模型可被接受[12-14]。
预测小肠管腔内药物浓度 ACAT模型将胃肠道从胃到结肠分为9个解剖段, 肠段中十二指肠和空肠段(模型中空肠Ⅰ段) 主要参与体内葡萄糖的吸收, 达格列净对SGLT1s的抑制作用主要发生在该段。PBPK模型验证成功后, 借助ACAT模型分别预测欧洲人和亚洲人小肠肠腔内药物的浓度。
预测肾脏近端小管管腔药物浓度 为研究近端小管腔内的药物浓度是否可以抑制SGLT1s和SGLT2s, 使用PBPK模型结合内嵌的肾脏血流灌注渗透性限速模型预测亚洲人10和20 mg以及欧洲人10、50和100 mg剂量下近端小管中达格列净的药物浓度。
计算小肠和肾脏近端小管处SGLT1s和SGLT2s的抑制率 葡萄糖的吸收/重吸收速率用以下公式1计算:
| $ {V}_{0}=\frac{{V}_{\mathrm{m}\mathrm{a}\mathrm{x}}\times \left[S\right]}{{K}_{m}+\left[S\right]} $ | (1) |
Km是葡萄糖与SGLTs的米氏常数, Vmax是SGLTs介导的葡萄糖重吸收最大速度, S是靶部位葡萄糖浓度。小肠腔内, V0用报道的Km值进行计算, 肠腔内定义葡萄糖S为1 670 mmol·L-1。肾脏中, S是根据葡萄糖浓度140 mg·dL-1模拟[2, 10]。
服用达格列净后, 葡萄糖吸收/重吸收速率如公式2:
| $ {V}_{\mathrm{i}}=\frac{{V}_{\mathrm{m}\mathrm{a}\mathrm{x}}\times \left[S\right]}{{K}_{\mathrm{m}}\times (1+\frac{\left[I\right]}{{K}_{\mathrm{i}}})+\left[S\right]} $ | (2) |
I是软件预测的药物在靶部位的浓度(十二指肠和空肠Ⅰ段以及肾近端小管)。SGLT1s和SGLT2s的抑制常数Ki如上表 1[7]。给药后SGLT1和SGLT2的抑制率计算公式如公式3:
| $ 抑制率\left( \% \right) = \left( {1 - \frac{{{V_{\rm{i}}}}}{{{V_0}}}} \right) \times 100\% $ | (3) |
结合预测的小肠肠段内和肾脏近端小管管腔药物浓度, 采用上述公式计算达格列净对小肠和肾脏近端小管处SGLTs的抑制率。
结果 1 模型验证为了验证所建立的达格列净的PBPK模型, 分别预测亚洲人10和20 mg以及欧洲人10、20和100 mg的血药浓度-时间曲线以及24 h尿中药物排出量。利用临床研究获得的实测值与上述预测值进行比较, 通过折叠误差对模型进行评价。如图 2所示, 预测的血药浓度-时间曲线与实测血药浓度-时间曲线的趋势相似。如表 2, 主要PK参数的预测值与实测值比值在2倍范围内。如图 3所示, 不同剂量下24 h尿中药物排出量的实测值均落在群体模拟值的90%的置信区间内。因此, 通过Gastro PlusTM软件建立的达格列净的PBPK模型可以较好地预测药物的药动学特征。
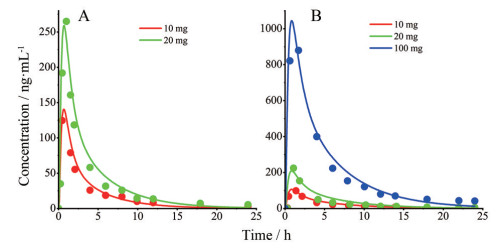
|
Figure 2 The time curves of plasma drug concentration (A: Asian; B: European) were predicted by software in two clinical studies at different doses |
| Table 2 The predicted and observed data and their folding error values of Asian and European. AUC: Area under the plasma concentration time curve for time zero to the last time; Cmax: Maximum concentration; tmax: Time corresponding to Cmax |
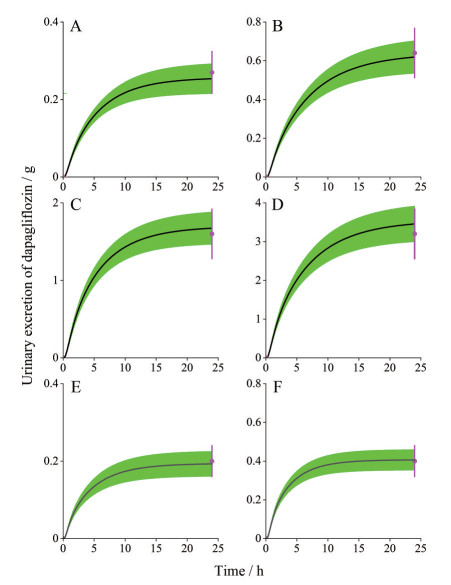
|
Figure 3 Observed urinary excretion (pink) of dapagliflozin 24 h after administrate oral (European: A: 10 mg; B: 20 mg; C: 50 mg; D: 100 mg; Asian: E: 10 mg; F: 20 mg) and the 90th confidence interval of the virtual population simulation (green shadow) |
为了验证上述模型对药物在组织浓度分布预测的准确性, 建立了欧洲健康人口服达格列净2.5 mg的PK/PD模型后, 用该PK/PD模型对口服10和50 mg达格列净后120 h的UGE进行预测。建立亚洲健康人口服达格列净2.5 mg的PK/PD模型后, 用该模型预测口服10和20 mg达格列净后24 h的UGE。达格列净的PD模型采用间接模型中ClassⅢ模型进行分析, 模型是基于Gastro PlusTM软件中PDplus版块自动优化。PDplus版块预测曲线与实测曲线基本吻合, 预测值与实测值UGE及其误差如下表 3。
| Table 3 Urine glucose excretion (UGE) prediction error determined using the predicted/observed data for single oral administration of 10 mg (a) and 20 mg (b) in Asian and single oral administration of 10 mg (a) and 50 mg (b) in European |
采用建立的PBPK模型预测小肠肠段内药物浓度并计算欧洲人和亚洲人在不同剂量下药物对肠段SGLT1s的抑制率。如图 4所示, 亚洲受试者中, 10 mg达格列净在20 min内对十二指肠和空肠最大抑制率为1.7%~5.9%, 亚洲人最大临床剂量20 mg下, 达格列净在20 min内对十二指肠和空肠最大抑制率为3.2%~10%。对于欧洲人, 10 mg达格列净20 min内对十二指肠和空肠最大抑制率为1.6%~4.7%, 20 mg时在20 min内在十二指肠达到最大抑制率为3.1%~6.5%, 在临床研究最大剂量100 mg下, 20 min内在十二指肠和空肠处最大抑制率为14%~33%。亚洲人肠道达格列净药物浓度对SGLT1s的抑制率略高于欧洲人。但在临床常用剂量10 mg下, 药物对肠道SGLT1s的抑制率很低, 不足以降低糖尿病患者的餐后血糖。
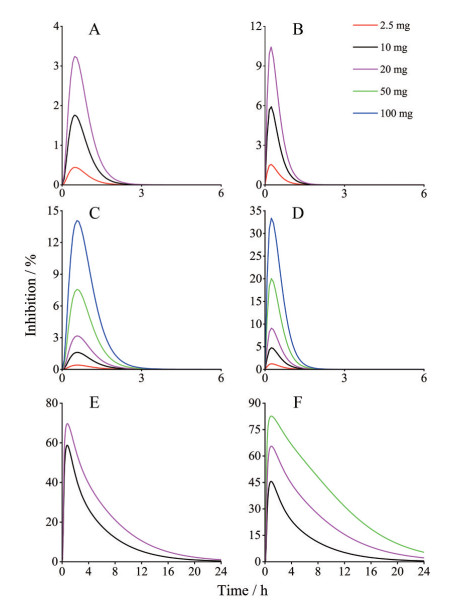
|
Figure 4 Simulation of inhibitory effects on sodium-glucose cotransporter 1 (SGLT1s) in upper intestine and proximal tubules after single oral administration of dapagliflozin 2.5 mg, 10 mg, 20 mg in Asian and 2.5 mg, 10 mg, 20 mg, 50 mg, 100 mg in European. A: Jejunum I segment in Asian; B: Duodenum in Asian; C: Jejunum I segment in European; D: Duodenum in European; E: Proximal tubules in Asian; F: Proximal tubules in European |
采用建立的PBPK模型预测药物在近端小管的浓度, 计算该浓度下药物对近端小管SGLTs的抑制率。在亚洲人和欧洲人模拟浓度下, 临床常用10 mg剂量达格列净对SGLT2s最大抑制率达到99.9%, 这与临床研究报道一致[3], 如图 4所示, 对SGLT1s的最大抑制率仅为10%, 表明10 mg剂量下, SGLT2s几乎被药物完全抑制达到饱和状态。由图 4可以发现, 随着药物剂量增大, 药物对SGLT1s的抑制率逐渐增大, SGLT1s对葡萄糖重吸收的补偿作用被抑制, 进而引起更多的葡萄糖从尿液中被排出, 更大程度降低血糖水平。
讨论PBPK模型结合药物和生理学解剖特征可以很好地预测药物在血浆以及其他靶器官、靶组织的药代动力学特征, 为探索药物药理作用和药物毒性提供帮助, 因其能够预测临床试验中难以测量的组织药物浓度, 故可对复杂的药物作用机制进行解释。对模型的优化和验证是增加模型准确性和可靠性的方法。PBPK模型建立过程中, 文献[5, 9]报道亚洲人和欧洲人的血浆游离药物分数(Fup) 分别为9%和8.6%, 建模过程中欧洲人预测的和实测的药物分布曲线存在较小差异, 故对该值进行优化, 并通过其他剂量对优化后的参数进行验证。达格列净PD模型优化后的结果显示欧洲人10和50 mg剂量下预测的120 h的UGE被低估。查阅相关文献[15], 肾小球滤过率以及体内血糖水平是影响UGE的关键因素, 不同的肾小球滤过率影响药物在肾脏中的暴露量, 模型建立过程中只考虑了对应剂量患者的平均肾小球滤过率, 同时, 模型建立过程中未纳入血糖变化的影响, 考虑基于以上原因造成药效模型中UGE的低估。
生理条件下, 87.5%~100%的SGLT2s功能被抑制时会导致32%~49%的肾葡萄糖重吸收受影响, 但已报道的在健康或者T2DM患者中模型预测发现肾脏葡萄糖重吸收的最大抑制率可达到50%~70%, 可能是由于SGLT2s被抑制后, 随着葡萄糖沿近端小管进入S3段, SGLT1s介导的葡萄糖重吸收增加, 药物对SGLT1s参与的葡萄糖重吸收过程发挥抑制作用[2]。但肠段和肾脏近端小管的药物浓度无法直接测量, 进而导致无法量化药物对小肠以及近端小管S3段处SGLT1s葡萄糖吸收/重吸收的抑制潜力。
通过借助数学模型发现, 10 mg达格列净对SGLT2s的最大抑制率为99.9%, 药物结合位于上游的SGLT2s的大部分位点, 抑制其介导的肾脏葡萄糖重吸收的活性, SGLT2s被饱和抑制后, 随剂量升高药物对SGLT1s的抑制率逐渐升高, 由SGLT1s介导的葡萄糖重吸收能力下降, 促进葡萄糖的排泄。尽管SGLT1s存在于肠道和肾脏组织, 在肠道主要负责吸收膳食纤维和半乳糖, 对葡萄糖吸收没有特异性, 这种转运蛋白的抑制可能导致吸收不良和腹泻, 然而, 可以通过建立药物的PBPK模型与临床研究结合观察药物在肠道不良反应出现时的抑制率与肠道对SGLT1s的抑制率之间的平衡点, 对联合抑制SGLT2/SGLT1s的药物进行优化选择仍然是一个很好的开发途径。
作者贡献: 张瑜负责模型构建与文章撰写; 谢潘潘负责指导撰写思路及文章修改; 李亚梅参与文章架构讨论及文章修改; 何雪梅和刘岳负责文章修改及校对; 史爱欣负责拟定研究方向和文章审阅。
利益冲突: 所有作者声明本文无任何利益冲突。
| [1] |
Lee YJ, Lee YJ, Han HJ. Regulatory mechanisms of Na+/glucose cotransporters in renal proximal tubule cells[J]. Kidney Int Suppl, 2007(106): S27-S35. |
| [2] |
Lu Y, Griffen SC, Boulton DW, et al. Use of systems pharmacology modeling to elucidate the operating characteristics of SGLT1 and SGLT2 in renal glucose reabsorption in humans[J]. Front Pharmacol, 2014, 5: 274. |
| [3] |
Polidori D, Sha S, Mudaliar S, et al. Canagliflozin lowers postprandial glucose and insulin by delaying intestinal glucose absorption in addition to increasing urinary glucose excretion: results of a randomized, placebo-controlled study[J]. Diabetes Care, 2013, 36: 2154-2161. DOI:10.2337/dc12-2391 |
| [4] |
Plosker GL. Dapagliflozin: a review of its use in patients with type 2 diabetes[J]. Drugs, 2014, 74: 2191-2209. DOI:10.1007/s40265-014-0324-3 |
| [5] |
Mori K, Saito R, Nakamaru Y, et al. Physiologically based pharmacokinetic-pharmacodynamic modeling to predict concentrations and actions of sodium-dependent glucose transporter 2 inhibitor canagliflozin in human intestines and renal tubules[J]. Biopharm Drug Dispos, 2016, 37: 491-506. DOI:10.1002/bdd.2040 |
| [6] |
Cho S, Lee J, Yoo Y, et al. Improved manufacturability and in vivo comparative pharmacokinetics of dapagliflozin cocrystals in Beagle dogs and human volunteers[J]. Pharmaceutics, 2021, 13: 70. DOI:10.3390/pharmaceutics13010070 |
| [7] |
Yakovleva T, Sokolov V, Chu L, et al. Comparison of the urinary glucose excretion contributions of SGLT2 and SGLT1: a quantitative systems pharmacology analysis in healthy individuals and patients with type 2 diabetes treated with SGLT2 inhibitors[J]. Diabetes Obes Metab, 2019, 21: 2684-2693. DOI:10.1111/dom.13858 |
| [8] |
Vallon V, Rose M, Gerasimova M, et al. Knockout of Na-glucose transporter SGLT2 attenuates hyperglycemia and glomerular hyperfiltration but not kidney growth or injury in diabetes mellitus[J]. Am J Physiol Renal Physiol, 2013, 304: 156-167. DOI:10.1152/ajprenal.00409.2012 |
| [9] |
Jo H, Reddy VP, Parkinson J, et al. Model-informed pediatric dose selection for dapagliflozin by incorporating developmental changes[J]. CPT Pharmacometrics Syst Pharmacol, 2021, 10: 108-118. DOI:10.1002/psp4.12577 |
| [10] |
Komoroski B, Vachharajani N, Boulton D, et al. Dapagliflozin, a novel SGLT2 inhibitor, induces dose-dependent glucosuria in healthy subjects[J]. Clin Pharmacol Ther, 2009, 85: 520-526. DOI:10.1038/clpt.2008.251 |
| [11] |
Kasichayanula S, Liu X, Lacreta F, et al. Clinical pharmacokinetics and pharmacodynamics of dapagliflozin, a selective inhibitor of sodium-glucose co-transporter type 2[J]. Clin Pharmacokinet, 2014, 53: 17-27. DOI:10.1007/s40262-013-0104-3 |
| [12] |
Van Den Bergh A, Sinha V, Gilissen R, et al. Prediction of human oral plasma concentration-time profiles using preclinical data: comparative evaluation of prediction approaches in early pharmaceutical discovery[J]. Clin Pharmacokinet, 2011, 50: 505-517. DOI:10.2165/11587230-000000000-00000 |
| [13] |
Zhang T, Heimbach T, Lin W, et al. Prospective predictions of human pharmacokinetics for eighteen compounds[J]. J Pharm Sci, 2015, 104: 2795-2806. DOI:10.1002/jps.24373 |
| [14] |
Jones HM, Parrott N, Jorga K, et al. A novel strategy for physiologically based predictions of human pharmacokinetics[J]. Clin Pharmacokinet, 2006, 45: 511-542. DOI:10.2165/00003088-200645050-00006 |
| [15] |
Sokolov V, Yakovleva T, Chu L, et al. Differentiating the sodium-glucose cotransporter 1 inhibition capacity of canagliflozin vs. dapagliflozin and empagliflozin using quantitative systems pharmacology modeling[J]. CPT Pharmacometrics Syst Pharmacol, 2020, 9: 222-229. DOI:10.1002/psp4.12498 |
 2022, Vol. 57
2022, Vol. 57


