2. 上海中药标准化研究中心, 上海 201203;
3. 河南省中医药研究院河南省道地药材综合开发工程技术研究中心, 河南 郑州 450004
2. Shanghai R & D Center for Standardization of Chinese Medicines, Shanghai 201203, China;
3. Henan Engineering Center for Development of Genuine Medicinal Materials, Henan Academy of Traditional Chinese Medicine, Zhengzhou 450004, China
牛膝始载于《神农本草经》, 列为上品[1], 来源于苋科植物牛膝Achyranthes bidentata Bl.的干燥根。其性苦、酸、平, 具有逐瘀通经、补肝肾、强筋骨、利尿通淋、引血下行的传统功效[2]。牛膝主产于河南省焦作地区(古怀庆府), 故又称怀牛膝, 为“四大怀药”之一。其化学成分主要为齐墩果烷型皂苷类(牛膝皂苷A~D及微量的人参皂苷Ro、竹节参皂苷IVa等) 和甾酮类(β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮等), 以及少量生物碱、黄酮和有机酸类成分[3-6]。其中皂苷类与甾酮类为其特征性成分, 具有抗炎、抗骨质疏松、抗肿瘤等作用[7-10]。
牛膝为常用中药, 广泛应用于临床方剂、制剂。牛膝药材的质量标准[2]中, 定性鉴别指标成分为β-蜕皮甾酮和人参皂苷Ro, 含量测定仅有β-蜕皮甾酮单一指标成分, 不仅专属性不强, 且含量很低, 难以反映牛膝的内在质量。虽有同时测定甾酮类和人参皂苷Ro、竹节参皂苷IVa的研究报道, 但其分析方法并不完善[11-13]。结合文献报道和本课题组前期研究, 发现牛膝皂苷C、D为牛膝中的主要药效成分, 且专属性强, 但因同系物较多, 分离制备困难。
本论文基于牛膝中甾酮和皂苷两类成分的理化性质, 运用双外标校准法(双外标加校正因子), 采用2种对照品, 实现同步定量牛膝中5种目标成分(2种皂苷和3种甾酮类成分), 完成系统的方法学考察, 并应用于20批不同来源牛膝样品的测定, 为牛膝药材、饮片、制剂的质量标准提升提供新的依据。
材料与方法仪器与试剂 安捷伦公司Agilent1260Infinity Ⅱ高效液相色谱仪(四元泵1260 Quat Pump, 进样器1260Vialsampler, 柱温箱1260 MCT, 检测器1260 DAD HS); 安捷伦公司Agilent1260Infinity (1290Thermostat四元泵, 1260HiPALS进样器, 柱温箱1260TCC, 检测器1260DADVL+); BT124S型电子分析天平、BT25S型电子分析天平(北京赛多利斯科学仪器有限公司); 数控超声波清洗器(Branson, 美国); 色谱柱Agilent Poroshell 120 EC-C18 (150 mm × 4.6 mm, 2.7 μm) (安捷伦科技有限公司, 美国), CAPCELL CORE C18 (150 mm × 4.6 mm, 2.7 μm) (资生堂, 日本), Waters CORTECS C18 (150 mm × 4.6 mm, 2.7 μm) (沃特世科技有限公司, 美国)。分析级甲醇、乙醇(国药集团化学试剂有限公司); 色谱级乙腈(Fisher Scientific, 加拿大); 色谱级磷酸(批号: 2C127470312, 柯灵斯有限公司); 超纯水由MILLI-Q超纯水制备仪制备(Millipore, 美国)。β-蜕皮甾酮对照品(β-ecdysterone, 批号: ST02800120, 纯度≥ 98.0%)、25R-牛膝甾酮(25R-inokosterone, 批号: ST20270305, 纯度≥ 90.0%) 和25S-牛膝甾酮(25S-inokosterone, 批号: ST20260105, 纯度≥ 98.0%) 购自上海诗丹德标准技术服务有限公司; 牛膝皂苷C (achyranthoside C, 批号: J05GB144089, 纯度≥ 95.0%) 和牛膝皂苷D (achyranthoside D, 批号: J05GB144090, 纯度≥ 94.0%) 购自上海源叶生物科技有限公司。
实验材料 供研究的20批牛膝样品, 编号1~13为药材, 18~20为饮片, 产地为河南省武陟县大封镇, 采集时间为2019年11月~2020年1月; 14~16为饮片, 收集于安徽亳州药材市场; 17为饮片, 收集于河北安国药材市场。经上海中药标准化研究中心王峥涛教授鉴定为苋科植物牛膝Achyranthes bidentata Bl.的干燥根, 凭证标本存放于上海中药标准化研究中心标本库。
HPLC色谱条件 色谱柱: Agilent Poroshell 120 EC-C18 (150 mm × 4.6 mm, 2.7 μm); 流动相为0.1%磷酸乙腈(A)-0.1%磷酸水溶液(B), 梯度洗脱: 0~5 min, 18% A; 5~10 min, 18%~34% A; 10~30 min, 34%~36% A; 检测波长: 0~14 min为248 nm, 14~30 min为203 nm; 流速0.8 mL·min-1; 柱温35 ℃; 进样量5 μL。
对照品溶液制备 取各对照品适量, 精密称定, 用50%乙醇制成每1 mL含0.012 6 mg的β-蜕皮甾酮、0.002 26 mg的25R-牛膝甾酮、0.003 52 mg的25S-牛膝甾酮、0.097 3 mg的牛膝皂苷C和0.179 mg的牛膝皂苷D的混合溶液, 作为牛膝对照品溶液。
供试品溶液制备 取牛膝药材粉末(过3号筛) 约0.5 g, 精密称定, 置具塞锥形瓶中, 精密加入50%乙醇25 mL, 密塞, 称定重量, 超声处理(功率300 W, 频率40 kHz) 30 min, 取出, 放冷, 再称定重量, 用50%乙醇补足减失的重量, 摇匀, 离心(5 000 r·min-1) 10 min, 取上清液过0.22 μm微孔滤膜, 即得。
方法学考察
专属性 取空白溶液、牛膝对照品溶液2、牛膝供试品溶液分别进样测定, 比较色谱图。
线性范围、检测限和定量限 分别取β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、牛膝皂苷C、牛膝皂苷D对照品各适量, 精密称定, 加50%乙醇溶解并制成质量浓度分别为0.050 2、0.009 02、0.014 1、0.389和0.716 mg·mL-1的混合母液, 用50%乙醇稀释得到6个不同浓度对照品溶液。浓度由低到高依次进样测定。分别以对照品溶液的浓度为横坐标(x), 峰面积为纵坐标(y), 绘制标准曲线, 并得到回归方程、线性范围和相关系数。将混合对照品溶液逐级稀释, 以信噪比为10∶1确定定量限(LOQ), 以信噪比为3∶1确定检测限(LOD)。
日内精密度 精密吸取高、中、低3个浓度对照品溶液, 按“HPLC色谱条件”于一天内连续进样6次, 记录色谱图和峰面积, 计算各待测物峰面积的RSD值。
日间精密度 精密吸取高、中、低3个浓度对照品溶液, 按“HPLC色谱条件”3天内连续进样, 记录色谱图和峰面积, 计算各待测物峰面积的RSD值。
重复性 取同一批牛膝按“供试品溶液制备”项下方法平行制备6份供试品溶液, 按“HPLC色谱条件”进样测定, 计算各待测物含量的RSD值。
稳定性 取同一供试品溶液, 在室温下, 于0、2、4、6、8、12、16、18、20、24和48 h进样, 记录峰面积并计算各化合物含量和RSD值。
加样回收率 取牛膝样品约0.125 g, 精密称定, 分别按照各成分已知含量的50%、100%和150%加入各对照品适量。按“供试品溶液制备”项下方法制备供试品溶液, 每个浓度水平平行3份, 并按“HPLC色谱条件”项下方法进样测定。
双外标校准法
RCF的计算 按照相对校正因子计算公式[14]。将“线性范围、定量限和检测限”项下6个不同浓度系列混合对照品溶液进样并记录峰面积, 分别以β-蜕皮甾酮为对照S1, 计算不同浓度点下25R-牛膝甾酮、25S-牛膝甾酮的RCF的平均值; 以牛膝皂苷D为对照S2, 计算不同浓度点下牛膝皂苷C的RCF的平均值, 比较RSD值。
RCF耐用性考察 取牛膝混合对照品溶液, 分别考察在不同型号高效液相色谱仪(Agilent 1260 Infinity Ⅱ、Agilent 1260 Infinity) 上使用3根不同厂家的C18色谱柱(Agilent Poroshell 120 EC-C18、CAPCELL CORE C18、Waters CORTECS C18) 对RCF稳定性的影响, 记录峰面积, 按照“RCF计算公式”计算待测成分RCF的平均值及RSD值; 采用Agilent Poroshell 120 EC-C18色谱柱进行色谱分离, 考察温度(30、35和40 ℃)、流速(0.7、0.8和0.9 mL·min-1) 和磷酸浓度(0.1%磷酸水、0.2%磷酸水和0.1%磷酸乙腈-0.1%磷酸水) 对RCF稳定性的影响, 分别记录各化合物的峰面积, 计算RCF的平均值和RSD值。
色谱峰定位 取牛膝混合对照品溶液, 在两台液相色谱仪Agilent 1260 Infinity Ⅱ、Agilent 1260 Infinity用不同厂家C18色谱柱Agilent Poroshell 120 EC-C18、Shiseido CAPCELL CORE C18、Waters CORTECS C18进样测定。以β-蜕皮甾酮为对照S1, 计算25R-牛膝甾酮和25S-牛膝甾酮的相对保留时间以及RSD值; 以牛膝皂苷D为对照S2, 计算牛膝皂苷C的相对保留时间以及RSD值。
含量测定 将收集得到的20批牛膝药材样品按“供试品溶液制备”项下方法制备得供试品溶液, 并按“HPLC色谱条件”进样测定, 分别以β-蜕皮甾酮为对照S1, 计算25R-牛膝甾酮和25S-牛膝甾酮的含量; 以牛膝皂苷D为对照S2, 计算牛膝皂苷C的含量, 与外标法测得的含量结果进行比较, 计算相对误差值(RE)。
结果 1 方法学考察 1.1 专属性对比空白溶液、混合对照品溶液和供试品溶液色谱图(图 1), 空白溶液对牛膝中5种有效成分无干扰, 且样品溶液中5个有效成分的分离度、对称性均良好, 表明该方法专属性较好。
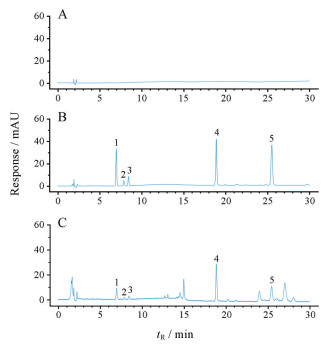
|
Figure 1 HPLC profiles of blank solvent (A), mixed references (B) and Achyranthis Bidentatae Radix sample (C). 1: β-Ecdysterone; 2: 25R-Inokosterone; 3: 25S-Inokosterone; 4: Achyranthoside D; 5: Achyranthoside C |
5种成分的线性回归方程、相关系数、线性范围、检测限和定量限结果见表 1, 5种成分在线性范围内均显示出良好的线性关系。
| Table 1 The calibration equation, correlation coefficient, linear range, LODs, and LOQs of 5 compounds |
测得高浓度混合对照品中5种化合物β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、牛膝皂苷D和牛膝皂苷C峰面积的RSD分别为0.12%、0.17%、0.19%、0.34%和0.10%; 中浓度混合对照品的RSD分别为0.45%、0.38%、0.77%、0.69%和0.88%; 低浓度混合对照品的RSD分别为0.36%、1.2%、0.76%、1.5%和1.6%, 均小于2%, 表明仪器精密度良好。
1.3.2 日间精密度测得高浓度混合对照品中5种化合物β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、牛膝皂苷D和牛膝皂苷C峰面积的RSD分别为0.27%、0.40%、0.21%、0.23%和0.068%; 中浓度混合对照品的RSD分别为0.34%、1.2%、0.84%、1.4%和0.54%; 低浓度混合对照品的RSD分别为1.1%、1.6%、0.20%、0.61%和1.3%, 均小于2%, 表明仪器精密度良好。
1.4 重复性6份样品中β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、牛膝皂苷D和牛膝皂苷C含量(mg·g-1) 的RSD分别为0.53%、1.1%、0.34%、0.78%和1.1%, 均小于2%, 表明方法重复性良好。
1.5 稳定性不同时间点测得样品中β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、牛膝皂苷D和牛膝皂苷C含量(mg·g-1) 的RSD分别为0.80%、0.79%、0.61%、0.19%和0.54%, 均小于2%, 表明供试品溶液在48 h内稳定性良好。
1.6 加样回收率样品中5种成分β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、牛膝皂苷D和牛膝皂苷C的平均回收率分别为99.8%、92.9%、100.8%、99.0%和100.3%, RSD均小于3%, 该方法回收率良好。
2 双外标校准RCF的计算与验证 2.1 RCF的计算按多点校正法, 以β-蜕皮甾酮为对照S1, 计算不同浓度点的25R-牛膝甾酮和25S-牛膝甾酮的RCF的平均值分别为1.116和1.056; 以牛膝皂苷D为对照S2, 计算不同浓度点的牛膝皂苷C的RCF的平均值为0.888 1, RSD均小于2%。
2.2 RCF的耐用性不同高效液相色谱仪及色谱柱条件下, 25R-牛膝甾酮、25S-牛膝甾酮和牛膝皂苷C的RCF计算结果见表 2, 平均值分别为1.111、1.014和0.894 0。不同柱温下, 25R-牛膝甾酮和25S-牛膝甾酮的RCF平均值分别为1.100和1.013, 牛膝皂苷C的RCF平均值为0.895 3; 不同流速条件下, 25R-牛膝甾酮和25S-牛膝甾酮的RCF平均值分别为1.108和1.015, 牛膝皂苷C的RCF平均值为0.881 1; 在不同磷酸浓度条件下, 25R-牛膝甾酮和25S-牛膝甾酮的RCF平均值分别为1.117和1.004, 牛膝皂苷C的RCF平均值为0.895 3。RSD值均小于2%, 表明RCF的耐受性良好。
| Table 2 Relative retention time (RRT) and relative correction factors (RCF) of different instruments and different columns |
以β-蜕皮甾酮作为25R-牛膝甾酮和25S-牛膝甾酮的对照S1, 以牛膝皂苷D作为牛膝皂苷C的对照S2, 以相对保留时间法定位对应色谱峰, 相对保留时间的RSD值均小于5%。各化合物在不同色谱柱和不同仪器系统测得的相对保留时间值以及相对校正因子值见表 2。
3 外标法和双外标校准法含量测定比较分别采用双外标校准法(DESCM) 与外标法(ESM) 测得牛膝样品的含量结果见表 3。两种方法测得的5种成分含量相对误差(RE) 小于5%, 表明所建立的双外标法测定结果准确度较高。
| Table 3 Contents of 5 compounds in Achyranthis Bidentatae Radix samples determined by two methods (mg·g-1). ESM: External standard method; DESCM: Double external standards calibration method |
牛膝成分研究中常用指标成分人参皂苷Ro和竹节参皂苷IVa在牛膝中的含量甚微, 但由于人参皂苷Ro和牛膝皂苷D结构相近, 竹节参皂苷IVa和牛膝皂苷C结构相近, 给成分分离及鉴定带来困难。本实验条件能够将两对成分成功分开, 为牛膝皂苷C和牛膝皂苷D的准确定量奠定了基础。
实验针对5种被测成分, 以单位峰面积值(峰面积与称样量的比值) 为评价依据, 分别对提取溶剂(25%乙醇、50%乙醇、75%乙醇、50%甲醇和甲醇)、提取方法(超声法和回流法)、料液比(1∶20、1∶50和1∶80) 和提取时间(15、30和45 min) 进行了系统考察, 最终确定了本实验提取方案。光谱分析结果显示3种甾酮的紫外最大吸收均为248 nm, 两种皂苷最大吸收均在203 nm, 为保证分析结果准确性, 对各成分采用最大吸收波长检测。0~14 min的检测波长为248 nm, 用于检测甾酮类成分; 14~30 min的检测波长为203 nm, 用于检测皂苷类成分。
20批不同来源牛膝样品中皂苷和甾酮的含量测定数据显示2种皂苷含量之和约为3种甾酮含量之和的10倍, 表明皂苷类成分是牛膝中的主要成分, 特别是牛膝皂苷C和牛膝皂苷D, 是牛膝质量评价不应忽视的成分。牛膝中3种甾酮类成分的含量呈现正相关, 2种皂苷类成分含量基本呈现正相关, 甾酮与皂苷含量无明显相关性, 表明两类成分生物合成途径可能不相关, 仅采用一类成分评价牛膝质量不够全面。
综上, 本实验采用双外标法结合校正因子同时测定牛膝中5种有效成分, 选择的指标成分具有专属性, 并与外标法测得结果的相对误差(RE) 值均小于5%。该方法节约了检测成本与时间, 避免了单一指标的局限性, 研究结果为牛膝药材提供了科学可行的整体质量评价方法。
作者贡献: 王峥涛、张留记和谷丽华进行药材采集和设计实验; 吴冰筱进行实验数据采集; 金武燮参与数据分析; 吴冰筱、谷丽华、李林楠、杨莉和王峥涛撰写和修改论文。
利益冲突: 无利益冲突。
| [1] |
Weng QQ, Zhao JC, Jin Y, et al. Herbal textual research on classical prescription of of "Niuxi"[J]. Mod Chin Med (中国现代中药), 2020, 22: 1261-1268. |
| [2] |
Chinese Pharmacopeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020: 72-73.
|
| [3] |
Fu GH, Chen SQ, Liu J, et al. Studies on chemical constituents and classification of Achyranthes bidentata Bl.[J]. Strait Pharm J (海峡药学), 2018, 30: 29-32. |
| [4] |
Luo YF, Ou YW, Tang DF, et al. Research progress of material basis and pharmacological effects of saponins and sterones in Achyranthes[J]. Mod Chin Med (中国现代中药), 2020, 22: 2122-2136. |
| [5] |
Wang QH, Yang L, Jiang H, et al. Isolation and identification of inokosterone from Achyranthes bidentata Bl.[J]. Acta Chin Med Pharmacol (中医药学报), 2012, 40: 69-71. |
| [6] |
He XR, Wang XX, Fang JC, et al. The genus Achyranthes: a review on traditional uses, phytochemistry, and pharmacological activities[J]. J Ethnopharmacol, 2017, 203: 260-278. DOI:10.1016/j.jep.2017.03.035 |
| [7] |
Huang JJ, Yang JX, Chen HX. Progress in pharmacological research on total saponins of Achyranthes bidentata in the treatment of knee osteoarthritis[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2021, 32: 592-595. |
| [8] |
Yang L, Friedemann T, Pan J. Ecdysterone attenuates the development of radiation-induced oral mucositis in rats at early stage[J]. Radiat Res, 2021, 196: 366-374. |
| [9] |
Jiang YN, Zhang YQ, Chen WH, et al. Correction to: Achyranthes bidentata extract exerts osteoprotective effects on steroid-induced osteonecrosis of the femoral head in rats by regulating RANKL/RANK/OPG signaling[J]. J Transl Med, 2021, 19: 18. DOI:10.1186/s12967-020-02689-y |
| [10] |
Ju Y, Liang H, Du KC, et al. Isolation of triterpenoids and phytosterones from Achyranthes bidentata Bl. to treat breast cancer based on network pharmacology[J]. Nat Prod Res, 2021, 35: 5939-5942. DOI:10.1080/14786419.2020.1805603 |
| [11] |
Yang L, Jiang H, Su XL, et al. Simultaneous determination of β-ecdysterone, ginsenoside Ro and chikusetsusaponin IVa in radix Achyranthis Bidentatae by HPLC-DAD-ELSD[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2019, 36: 87-91. |
| [12] |
Wang XY, Chang JM, Guo CR, et al. Study on the quality standard and fingerprint of Achyranthes bidentata decoction pieces[J]. J China Pharm (中国药房), 2020, 31: 3000-3006. |
| [13] |
Li JP, Wang YZ, Li MQ, et al. Quantitative study of 8 components of Achyranthes bidentata based on UHPLC-Q-Trap-MS/MS[J]. J Chin Med Mater (中药材), 2021, 44: 1433-1438. |
| [14] |
Wang ZM, Qian ZZ, Zhang QW, et al. Technical guidelines established by the 18 quantitative analysis of multi-components by single marker method[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 657-658. |
 2022, Vol. 57
2022, Vol. 57


