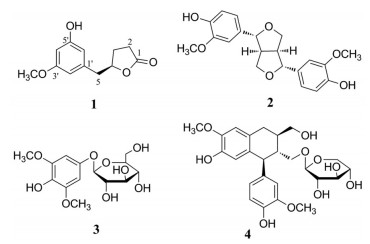
百两金为报春花科紫金牛属植物百两金(Ardisia crispa) 的根及根茎, 产于长江流域以南各省, 其中在四川、贵州、湖南等省分布较为广泛, 药用历史悠久[1]。据《中药大辞典》记载, 百两金性凉, 具有清热、祛痰、利湿之功效, 主治咽喉肿痛、湿热黄疸、跌打损伤等疾病[2]。现代药理学研究表明, 百两金具有抗肿瘤、抗炎及抑制血管生成等作用[3-11]。目前, 国内外学者对于百两金的研究主要以药理作用为主, 其化学成分研究甚少。为进一步阐明百两金的化学成分, 本研究从70%乙醇提取物的乙酸乙酯部位分离鉴定出4个单体化合物(图 1), 分别为: 百两金内酯A (1)、(+)-pinoresinol (2)、3, 5-二甲氧基-4羟苯基-1-O-β-D-吡喃葡萄糖苷(3) 和(+)-schizandriside (4), 其中化合物1为新化合物, 化合物2~4为首次从该植物中分离得到。
|
Figure 1 Chemical structures of compounds 1-4 |
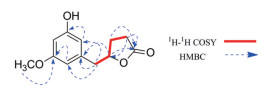
化合物1 白色无定形粉末, HR-ESI-MS m/z: 245.078 6 [M+Na]+ (C18H21ONa计算值245.078 4), 提示化合物的分子式为C12H14O4。在化合物1的1H NMR中, 观察到3组芳香质子信号[δH 6.31 (1H, dd, J = 2.2, 1.5 Hz, H-2′)、δH 6.29 (1H, dd, J = 2.2, 1.5 Hz, H-6′)、δH 6.24 (1H, t like, J = 2.2 Hz, H-4′)], 提示该化合物存在一个1, 3, 5三取代苯环。此外还可观察到一组次甲基质子信号[δH 4.76 (1H, m, H-4)]、一组甲氧基质子信号[δH 3.72 (3H, s), 3′-OCH3]、3组亚甲基质子信号[δH 2.91 (1H, dd, J = 13.9, 6.4 Hz, H-5a)、2.82 (1H, dd, J = 13.9, 6.0 Hz, H-5b)、δH 2.50 (1H, ddd, J = 17.8, 9.7, 9.0 Hz, H-2a)、δH 2.36 (1H, ddd, J = 17.8, 9.5, 4.8 Hz, H-2b)、δH 2.26 (1H, m, H-3a)、δH 1.96 (1H, m, H-3b)]。通过分析13C NMR及DEPT-135谱可确定化合物1中含有12个碳, 其中包括一组苯环碳信号δC 162.4 (C-3′)、159.7 (C-5′)、139.9 (C-1′)、110.0 (C-6′)、107.5 (C-2′)、100.7 (C-4′); 1个酯羰基碳信号δC 180.2 (C-1); 1个次甲基碳信号δC 82.9 (C-4); 1个甲氧基碳信号δC 55.6 (3′-OCH3); 3个亚甲基碳信号δC 42.2 (C-5)、29.5 (C-2)、28.0 (C-3)。通过对比化合物1与已知化合物(4R)-5-(3′, 5′-dihydroxyphenyl)-γ-valerolactone的NMR数据[12], 两者数据非常接近, 其γ-戊内酯环的碳氢数据基本一致, 最主要的区别在于苯环上的碳信号。通过进一步分析两者13C NMR数据, 发现已知化合物(4R)-5-(3′, 5′-dihydroxyphenyl)-γ-valerolactone的3′位及5′位均连有羟基, 侧链内酯环连接在1′位上, 导致该化合物苯环呈现出两组对称重叠的碳信号[(C-2′, 6′) 和(C-3′, 5′)], 因此在低场区仅出现4个芳香碳信号; 而化合物1中出现6个芳香碳信号, 同时还多出一组甲氧基碳氢信号, 由此推测该甲氧基可能连接在化合物1的C-3′或C-5′位上。在HMBC谱中可以明显观察到甲氧基质子δH 3.72 (3H, s, 3′-OCH3) 与δC 162.4 (C-3′) 存在相关信号(图 2), 由此可确定甲氧基连接在C-3′上。在CD谱中, 观察到化合物1在280 nm处出现正Cotton效应, 同时结合其比旋光度[α]D24-12 (c 0.1, MeOH) [已知化合物(4R)-5-(3′, 5′-dihydroxyphenyl)-γ-valerolactone比旋光度[α]D27-12.9 (c 0.4, MeOH)], 可确定C-4位的绝对构型为R。最后, 通过1H NMR、13C NMR、DEPT-135、HSQC、1H-1H COSY、HMBC对化合物1的碳氢数据进行了准确的归属(表 1)。
|
Figure 2 Key HMBC and 1H-1H COSY correlations of compound 1 |
| Table 1 1H NMR (400 MHz in CD3OD) and 13C NMR (100 MHz in CD3OD) spectral data of compound 1 |
综上所述, 确定化合物1的结构为: (4R)-5-(3′-methoxy-5′-hydroxyphenyl)-γ-valerolactone, 经Scifinder检索为未见文献报道的新化合物, 命名为: 百两金内酯A (crispalactone A), 结构见图 1。
实验部分DPX-400型核磁共振波谱仪(德国Bruker公司); Shimadzu LC-16D半制备型高效液相色谱仪(日本岛津公司); RID-20A示差检测器(日本岛津公司); ODS色谱填料(日本YMC公司); 柱色谱硅胶(200~300目, 300~400目, 青岛海洋化工厂); 提取分离所用二氯甲烷、甲醇、乙醇等有机试剂均为天津富宇精细化工有限公司生产, 均为分析纯; 高效液相所用甲醇为色谱纯。
百两金于2019年5月从贵州省凯里市采集, 由贵州中医药大学魏升华教授鉴定为植物百两金Ardisia crispa的根, 样品标本(No. 20190502) 存放于贵州中医药大学药学院标本馆。
1 提取分离干燥的百两金根7.0 kg, 粉碎后经70%乙醇加热回流提取(10倍量溶剂, 提取3次, 每次2 h), 过滤合并滤液, 减压回收溶剂得浸膏。浸膏经水分散, 依次用石油醚、乙酸乙酯、正丁醇萃取, 分别得石油醚萃取部位7.9 g, 乙酸乙酯萃取部位72.2 g, 正丁醇萃取部位566.7 g。取乙酸乙酯萃取部位(70 g), 经硅胶柱色谱(200~300目) 分离, 二氯甲烷与甲醇(体积比为100∶0至0∶100) 梯度洗脱, 得8个流分(Fr. A~H)。Fr. B (7.1 g) 经ODS柱色谱, 依次用甲醇与水(体积比为0∶100至100∶0) 梯度洗脱, 后经HPLC高效液相色谱分离, 流动相甲醇-水(53∶47) 得到化合物1 (3.5 mg, tR = 11.2 min) 与化合物2 (4.5 mg, tR = 18.8 min)。Fr. F (11.2 g) 经ODS柱色谱, 依次用甲醇与水(体积比为0∶100至100∶0) 梯度洗脱, 后经HPLC高效液相色谱分离, 流动相甲醇-水(42∶58) 得到化合物4 (3.5 mg, tR = 15.9 min) 和化合物3 (2.7 mg, tR = 18.6 min)。
2 结构鉴定化合物1 白色无定形粉末, [α]D24-12 (c 0.1, MeOH); HR-ESI-MS m/z: 245.078 6 [M+Na]+ (C18H21ONa计算值245.078 4); UV λmax (MeOH) nm (log ε): 201 (2.5)、230 (1.1)、275 (0.3); CD (c 4.08×10-3 mol·L-1 MeOH): λmax (Δε) 210 (-2.5)、250 (+1.9)、280 (+2.8) nm; IR (KBr): 3 443、2 922、2 359、1 600、1 475、668 cm-1; 1H NMR (400 MHz, CD3OD) 和13C NMR (100 MHz, CD3OD) 数据见表 1。
化合物2 白色粉末, 易溶于甲醇、吡啶。[α]D25+58 (c 0.1, MeOH); 1H NMR (400 MHz, CD3OD) δ: 6.93 (2H, d, J = 2.0 Hz, H-2, 2′), 6.80 (2H, dd, J = 8.0, 2.0 Hz, H-6, 6′), 6.76 (2H, d, J = 8.0 Hz, H-5, 5′), 4.70 (2H, d, J = 4.4 Hz, H-7, 7′), 4.23 (2H, dd, J = 9.0, 6.9 Hz, H-9a, 9′a), 3.85 (6H, s, OCH3), 3.82 (2H, dd, J = 9.0, 3.7 Hz, H-9b, 9′b), 3.13 (2H, m, H-8, 8′); 13C NMR (100 MHz, CD3OD) δ: 149.1 (C-3, 3′), 147.3 (C-4, 4′), 133.8 (C-1, 1′), 120.1 (C-6, 6′), 116.1 (C-5, 5′), 111.0 (C-2, 2′), 87.5 (C-7, 7′), 72.6 (C-9, 9′), 56.4 (3, 3′-OCH3), 55.4 (C-8, 8′)。以上核磁数据与文献报道基本一致[13, 14], 故鉴定化合物2为(+)-pinoresinol。
化合物3 白色粉末, 易溶于甲醇、吡啶。1H NMR (400 MHz, CD3OD) δ: 6.13 (2H, s, H-2, 6), 4.66 (1H, d, J = 7.3 Hz, H-1′), 3.78 (6H, s, -OCH3), 3.78 (1H, dd, J = 11.8, 2.4 Hz, H-6′a), 3.66 (1H, dd, J = 11.8, 5.2 Hz, H-6′b); 13C NMR (100 MHz, CD3OD) δ: 156.0 (C-1), 154.8 (C-3, 5), 129.6 (C-4), 106.2 (C-1′), 94.5 (C-2, 6), 78.2 (C-3′), 77.8 (C-5′), 75.7 (C-2′), 71.3 (C-4′), 62.6 (C-6′), 56.8 (3, 5-OCH3)。以上核磁数据与文献报道基本一致[15], 故鉴定化合物3为3, 5-二甲氧基-4羟苯基-1-O-β-D-吡喃葡萄糖苷。
化合物4 白色无定形粉末, 易溶于甲醇、吡啶。[α]D25+12 (c 0.1, MeOH); 1H NMR (400 MHz, CD3OD) δ: 6.77 (1H, d, J = 1.8 Hz, H-2), 6.73 (1H, d, J = 8.0 Hz, H-5), 6.64 (1H, s, H-2′), 6.62 (1H, dd, J = 8.0, 1.8 Hz, H-6), 6.16 (1H, s, H-5′), 4.05 (1H, d, J = 10.1 Hz, H-7), 4.04 (1H, d, J = 7.5 Hz, H-1′′), 3.97 (1H, dd, J = 11.3, 2.8 Hz, H-9a), 3.80 (3H, s, 3′-OCH3), 3.79 (3H, s, 3-OCH3), 3.79 (1H, dd, J = 11.3, 5.4 Hz, H-9b), 3.75 (1H, dd, J = 10.9, 4.4 Hz, H-9′a), 3.69 (1H, dd, J = 10.9, 6.0 Hz, H-9′b), 2.82 (2H, m, H-7′), 2.05 (1H, m, H-8′), 1.84 (1H, m, H-8); 13C NMR (100 MHz, CD3OD) δ: 148.9 (C-3), 147.1 (C-3′), 145.8 (C-4), 145.1 (C-4′), 138.6 (C-1), 134.3 (C-6′), 129.1 (C-1′), 123.1 (C-6), 117.4 (C-5′), 116.1 (C-5), 114.2 (C-2), 112.4 (C-2′), 105.8 (C-1′′), 77.8 (C-3′′), 75.0 (C-2′′), 71.3 (C-4′′), 69.3 (C-9), 66.9 (C-5′′), 65.1 (C-9′), 56.4 (3′-OCH3), 56.3 (3-OCH3), 47.9 (C-7), 45.9 (C-8), 39.6 (C-8′), 33.8 (C-7′)。以上核磁数据与文献报道基本一致[16], 故鉴定化合物4为(+)-schizandriside。
作者贡献: 周英负责课题的选题与设计; 殷鑫负责数据的分析处理及文章的撰写; 胡瑞航负责实验实施; 周永强、魏鑫、俸婷婷负责文章的审阅及实验指导; 朱蔚芊参与实验实施。
利益冲突: 作者声明无利益冲突。
| [1] |
Kobayashi H, Mejía E. The genus Ardisia: a novel source of health-promoting compounds and phytopharmaceuticals[J]. J Ethnopharmacol, 2005, 96: 347-354. DOI:10.1016/j.jep.2004.09.037 |
| [2] |
Editorial Committee of Nan Jing University of Chinese Medicine. Chinese Materia Medica (中药大辞典). Vol 1[M]. Shanghai: Shanghai Science and Technology Press, 2014: 1181.
|
| [3] |
Nordin ML, Kadir AA, Zakaria ZA, et al. In vitro investigation of cytotoxic and antioxidative activities of Ardisia crispa against breast cancer cell lines, MCF-7 and MDA-MB-231[J]. BMC Complement Altern Med, 2018, 18: 87. DOI:10.1186/s12906-018-2153-5 |
| [4] |
Yeong LT, Hamid RA, Yazan LS, et al. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion[J]. BMC Complement Altern Med, 2015, 15: 431. DOI:10.1186/s12906-015-0954-3 |
| [5] |
Jun LW, Foong CP, Hamid RA, et al. Ardisia crispa root hexane fraction suppressed angiogenesis in human umbilical vein endothelial cells (HUVECs) and in vivo zebrafish embryo model[J]. Biomed Pharmacother, 2019, 118: 109221. DOI:10.1016/j.biopha.2019.109221 |
| [6] |
Yeong LT, Hamid RA, Yazan LS, et al. Synergistic action of compounds isolated from the hexane extract of Ardisia crispa root against tumour-promoting effect, in vitro[J]. Nat Prod Res, 2014, 28: 2026-2030. DOI:10.1080/14786419.2014.917415 |
| [7] |
Hamid RA, Othman F, Anthony JJ, et al. Chemopreventive effect of Ardisia crispa hexane fraction on the peri-initiation phase of mouse skin tumorigenesis[J]. Med Princ Pract, 2013, 22: 357-361. DOI:10.1159/000346622 |
| [8] |
Nordin ML, Kadir AA, Zakaria ZA, et al. Cytotoxicity and apoptosis induction of Ardisia crispa and its solvent partitions against Mus musculus mammary carcinoma cell line (4T1)[J]. Evid Based Complement Altern Med, 2017, 2017: 9368079. |
| [9] |
Hamsin D, Hamid RA, Yazan LS, et al. Ardisia crispa roots inhibit cyclooxygenase and suppress angiogenesis[J]. BMC Complement Altern Med, 2014, 14: 102. DOI:10.1186/1472-6882-14-102 |
| [10] |
Hamsin D, Hamid RA, Yazan LS, et al. The hexane fraction of Ardisia crispa Thunb. A. DC. roots inhibits inflammation-induced angiogenesis[J]. BMC Complement Altern Med, 2013, 13: 5. DOI:10.1186/1472-6882-13-5 |
| [11] |
Sulaiman H, Hamid RA, Yeong LT, et al. Anti-tumor effect of Ardisia crispa hexane fraction on 7, 12-dimethylbenz[α]anthracene-induced mouse skin papillomagenesis[J]. J Cancer Res Ther, 2012, 8: 404-410. DOI:10.4103/0973-1482.103521 |
| [12] |
In SJ, Seo KH, Song NY, et al. Lignans and neolignans from the stems of Vibrunum erosum and their neuroprotective and anti-inflammatory activity[J]. Arch Pharm Res, 2015, 38: 26-34. DOI:10.1007/s12272-014-0358-9 |
| [13] |
Li SN, Yang YY, Xu L, et al. Simultaneous determination of three chemical compounds in embryonic parenchyma cells and endocarp stone cells of Arctii Fructus at five different growth stages by UFLC-MS/MS[J]. Acta Pharm Sin (药学学报), 2019, 54: 1265-1270. |
| [14] |
Diao YL, Re-Zeng CD, Wang RF, et al. Phenolic compounds from stems of Rubus amabilis focke[J]. Nat Prod Res Devel (天然产物研究与开发), 2014, 26: 11-14, 49. |
| [15] |
Xu JF, Li FS, Feng ZM, et al. A new sesquiterpenoid from Mallotus apelta[J]. Chem Nat Compd, 2011, 47: 218-219. DOI:10.1007/s10600-011-9886-4 |
| [16] |
Kohri T, Matsumoto N, Yamakawa M, et al. Metabolic fate of (-)-[4-3H] epigallocatechin gallate in rats after oral administration[J]. J Agric Food Chem, 2001, 49: 4102-4112. DOI:10.1021/jf001491+ |
 2022, Vol. 57
2022, Vol. 57


