钩藤Uncaria rhynchophylla (Miq.) Jacks.为茜草科(Rubiaceae) 植物, 是传统中药钩藤的主要基原植物之一, 药用部位是带钩的茎枝, 用于治疗高血压、头晕、头痛、抽搐、癫痫等疾病[1]。以往研究显示药用钩藤及同属植物的主要活性成分为生物碱、三萜和黄酮等[2-8], 但是绝大多数是从醇提取物中分离得到。由于钩藤等传统中药多以水煎使用, 因此作者开展了U. rhynchophylla药用部位水煎煮提取物的研究。在研究中, 重点围绕微量成分的系统分离鉴定, 期望通过进一步深入阐明钩藤化学成分组成及其结构的多样性特点, 为更全面地揭示其药效物质奠定基础。前期作者课题组已报道了钩藤水煎煮液中的30个生物碱、30个五环三萜和2个叶酸衍生物[9-12]。本文继续报道同一提取物中5个微量megastigmane类成分(1~5, 图 1) 的分离和结构鉴定。
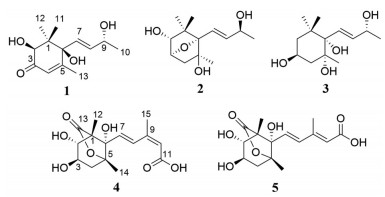
|
Figure 1 Structures of compounds 1-5 |
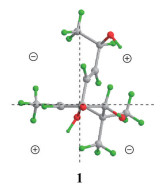
化合物1为无色胶状物, [α]D20 +102.8 (c 0.18, MeOH)。根据HR-ESI-MS m/z 263.125 2 [M+Na]+ (C13H20O4Na, 计算值263.125 4) 和NMR谱数据(表 1), 确定其分子式为C13H20O4。IR谱显示该化合物结构中含有羟基(3 371 cm-1) 和共轭羰基(1 674 cm-1)。比较1与吐叶醇(vomifoliol/blumenol A[13-22]) 的NMR谱数据, 显示二者的主要差别是1的一个连氧次甲基[δH 4.04 (s) 和δC 78.9 (d)] 取代了vomifoliol/blumenol A的一个亚甲基。据此推断化合物1为羟基取代的vomifoliol衍生物, 并通过1的2D NMR图谱解析得到进一步确定。在1的HMBC谱中, H-2与C-3, H3-11和H3-12与C-1、C-2和C-6, 以及H3-13与C-4、C-5和C-6的远程异核相关信号(图 2), 结合它们的化学位移, 确证结构中存在6-取代的1, 1, 5-三甲基-2, 6-二羟基环己-4-烯-3-酮结构单元。另外, H-7和H-8同时与C-6和C-9及H3-10与C-8和C-9的HMBC信号, 结合它们的化学位移, 确证结构中含有丁-8-烯-9-醇单元, 且通过C-7与以上结构单元的C-6相连。在1的NOESY谱中, 可观察到H-7与H-2和H3-12的NOE交叉峰(图 3), 由此确定了环上取代基的相对构型。化合物1分别与(R)-和(S)-MPA反应, 得到1的9-羟基酯化衍生物(R)-和(S)-MPA-1, 测得它们的1H NMR谱数据, 计算得到ΔδHRS (图 4), 利用Mosher's模型[23], 确定C-9的构型为R。化合物1的CD谱中, 分别在λmax 245和316 nm处分别显示(+)-和(-)-Cotton效应, 应用平面环己烯酮的八区律[24] (图 5), 结合前述相对构型, 确定C-2和C-6均为S构型。比较1的实测CD与理论计算ECD谱(图 6), 二者的匹配程度良好, 进一步支持上述指定的绝对构型。因此, 化合物1的结构确定为如图 1所示, 命名为钩藤紫罗酮A (uncarphyllonone A)。
| Table 1 NMR spectroscopic data of compounds 1-3 in CD3OD. Data were measured at 600 MHz for 1H and at 150 MHz for 13C. Proton coupling constants (J) in Hz are given in parentheses. The assignments were based on 1H-1H COSY, HSQC, and HMBC experiments |
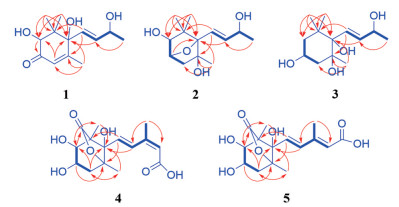
|
Figure 2 The 1H-1H COSY (thick lines), key HMBC (arrows) correlations of compounds 1-5 |
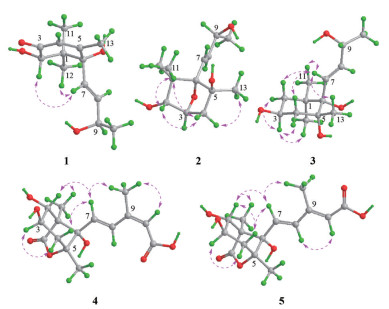
|
Figure 3 The NOESY correlations (pink double arrows) of compounds 1-5 |
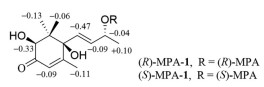
|
Figure 4 ΔδHRS values (δHR-δHS) for (R)- and (S)-MPA-1 |
|
Figure 5 Application of the octant rule of planar cyclohexanone for 1 |
|
Figure 6 (a) The overlaid experimental CD spectrum of 1 and calculated ECD spectra of (2S, 6S, 9R)-1 (red), and (2R, 6R, 9R)-1 (blue). (b) The overlaid experimental UV spectrum of 1 and calculated UV spectra of (2S, 6S, 9R)-1 (red), and (2R, 6R, 9R)-1 (blue). (Blue-shifted by 19.5 nm) |
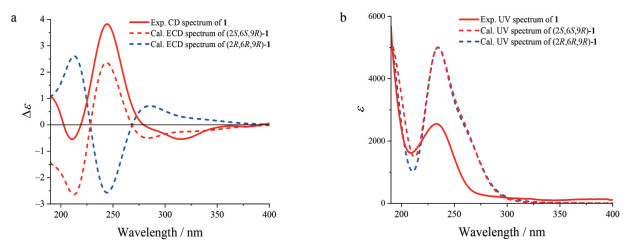
化合物2为无色胶状物, [α]D20 +23.4 (c 0.08, MeOH)。根据HR-ESI-MS m/z 265.140 2 [M+Na]+ (C13H22O4Na, 计算值265.141 0) 和NMR谱数据(表 1), 确定其分子式为C13H22O4, 较1多两个氢原子、少一个不饱和度。比较2与1的NMR数据发现, 2的结构中无共轭酮羰基和双键, 而多一个连氧的次甲基、一个连氧的季碳和一个脂肪族亚甲基。由此推断2是1的共轭酮羰基和双键还原后的羟基化和环氧化衍生物, 并得到2的2D NMR实验数据分析(图 2) 的进一步证实。尤其是在2的HMBC谱中, H-3与C-6的远程相关信号及其化学位移, 证明C-3与C-6之间通过共享一个氧原子形成氧桥环结构。因此, 推定化合物2是1的4, 5-二氢5-羟基-3, 6-环氧化衍生物。在化合物2的NOESY谱中, H-2与H-4b和H3-11以及H-4b和H3-11的NOE相关信号, 证明它们位于环的同侧; 而H-4a与H3-13的NOE相关信号表明它们位于环的另一侧。由此确定环上取代基的相对构型如图 3所示。由于样品量所限, 在尝试用Mosher's法确定C-9绝对构型中, 化合物2与(R)-和(S)-MPA反应后, 未能得到酯化物。因此, 通过实测CD与计算ECD谱比较法[25], 结合NMR计算法[26, 27], 对该化合物的绝对构型进行了确定。在保持环上构型不变而改变C-9构型的情况下, 计算(2R, 3S, 5S, 6S, 7E, 9R)-2和(2R, 3S, 5S, 6S, 7E, 9S)-2得到的CD谱均与实测谱图匹配良好(图 7)。由此可见, 2的ECD谱Cotton效应主要取决于结构中六元环部分的构型2R, 3S, 5S, 6S, C-9的构型对其影响很小。进一步计算(2R, 3S, 5S, 6S, 9R)-2和(2R, 3S, 5S, 6S, 9S)-2的1H和13C NMR数据, 经DP4+概率分析显示, 后者的可能性达99.65%而前者仅为0.35% (表 2), 故指定C-9的构型为S。因此, 化合物2的结构得到确定, 取名为钩藤紫罗醇A (uncarphyllonol A)。
|
Figure 7 (a) The overlaid experimental CD spectrum of 2 (red line) and calculated ECD spectra of (2R, 3S, 5S, 6S, 7E, 9S)-2 (red dot), (2R, 3S, 5S, 6S, 7E, 9R)-2 (red dash), (2S, 3R, 5R, 6R, 7E, 9S)-2 (blue dot), and (2S, 3R, 5R, 6R, 7E, 9R)-2 (blue dash). (b) The overlaid experimental UV spectrum of 2 (red line) and calculated UV spectra of (2R, 3S, 5S, 6S, 7E, 9R)-2 (red dash) and (2R, 3S, 5S, 6S, 7E, 9S)-2 (red dot). (Blue-shifted by 20 nm) |
| Table 2 DP4+ analysis of (2R, 3S, 5S, 6S, 7E, 9R)/(2R, 3S, 5S, 6S, 7E, 9S)-2, (3S, 5R, 6S, 7E, 9R)/(3S, 5R, 6S, 7E, 9S)-3 |
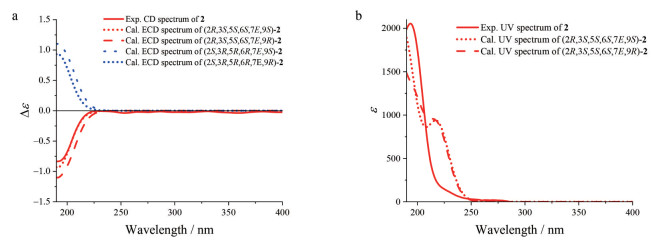
化合物3为无色胶状物, [α]D20 -14.7 (c 0.11, MeOH)。通过HR-ESI-MS m/z 267.155 7 [M+Na]+ (C13H24O4Na, 计算值267.156 7), 结合NMR谱数据(表 1), 确定其分子式为C13H24O4。该化合物的NMR谱数据与文献报道(3S, 5R, 6R, 7E, 9R)-megastigman-7-ene-3, 5, 6, 9-tetrol[28] (aripuanin[29, 30]/kiwiionol[31]) 和(3S, 5R, 6R, 7E, 9S)-megastigman-7-ene-3, 5, 6, 9-tetrol[30, 32]的相似。通过3的2D NMR谱数据解析(图 2、3), 确证化合物3与文献报道化合物拥有完全相同的平面结构。根据偶合常数分析(表 1), H-2a和H-4a处于六元环椅式构象的e-键, 而H-3、H-2b和H-4b处于a-键。在化合物3的NOESY谱中, 处于a-键的H-3与e-键的H-2a和H-4a及a-键的H3-12有NOE相关信号, 确证它们趋向于六元环的同侧; 同时, H-7与处于a-键的H-2b和H-4b以及e-键的H3-11和H3-13均有NOE相关信号, 证明这些氢处于六元环的另一侧, 并且丁烯基单元位于六元环椅式优势构象的a-键。由此确定3的相对构型如图 3所示, 与文献报道合成的外消旋体rel-(3S, 5R, 6S, 9R/9S)-megastigman-7-ene-3, 5, 6, 9-tetrol[30]的相对构型完全相同, 然而二者在相同溶剂中的个别1H NMR谱数据差别显著, 如H3-12的化学位移相差达到ΔδH = ±0.14, 超出了实验误差; 而13C NMR谱数据相差在实验误差之内。因此认为文献[30]中相应化合物的1H NMR数据有误, 且以外消旋体获得。化合物3与2的CD谱相似, 在λmax 196 nm显示源于双键发色团π-π*跃迁的(-)-Cotton效应, 据此初步指定它们结构中与发色团接近的C-6具有相同的绝对构型, 并得到3的实测CD与计算ECD谱(图 8) 一致性良好的支持。进一步计算(3S, 5R, 6S, 7E, 9R)-3和(3S, 5R, 6S, 7E, 9S)-3的1H和13C NMR数据, 结合DP4+概率分析(表 3) 显示前者的可能性远远高于后者, 故指定C-9的构型为R。因此, 化合物3的结构确定为如图 1所示, 命名为钩藤紫罗醇B (uncarphyllonol B)。
|
Figure 8 (a) The overlaid experimental CD spectrum of 3 (red line) and calculated ECD spectra of (3S, 5R, 6S, 7E, 9R)-3 (red dot), (3S, 5R, 6S, 7E, 9S)-3 (red dash), (3R, 5S, 6R, 7E, 9R)-3 (blue dash), and (3R, 5S, 6R, 7E, 9S)-3 (blue dot). (b) The overlaid experimental UV spectrum of 3 (red line) and calculated UV spectra of (3S, 5R, 6S, 7E, 9S)-3 (red dot) and (3S, 5R, 6S, 7E, 9R)-3 (red dash). (Blue-shifted by 6.0 nm) |
| Table 3 NMR spectroscopic data of compounds 4 and 5 in D2O. Data were measured at 600 MHz for 1H and at 150 MHz for 13C. Proton coupling constants (J) in Hz are given in parentheses. The assignments were based on 1H-1H COSY, HSQC, and HMBC experiments |
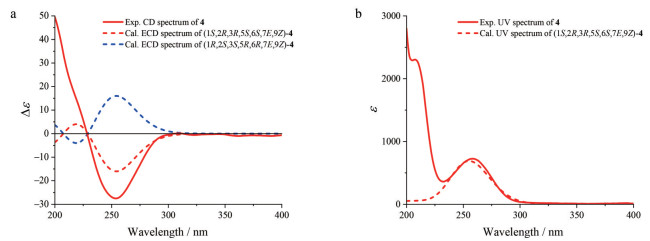
化合物4为无色胶状物, [α]D20 -91.5 (c 0.07, MeOH)。根据HR-ESI-MS m/z 335.109 7 [M+Na]+ (C15H20O7Na, 计算值335.110 1) 和NMR谱数据(表 3), 确定其分子组成为C15H20O7。其红外光谱显示分子结构中存在羟基(3 370 cm-1)、五元内酯羰基(1 762 cm-1) 和共轭羰基(1 679 cm-1)。经2D NMR谱数据解析(图 2、3), 确证4的平面结构和相对构型与文献[33]报道的rel-5-(1R, 5S-dimethyl-3R, 4R, 8S-trihydroxy-7-oxa-6-oxobicyclo[3, 2, 1]oct-8-yl)-3-methyl-2Z, 4E-pentadienoic acid相同。尤其是, 在4的NOESY中, 观测到H-7与H-2、H-4b和H3-15的NOE相关信号, 结合H-2与H-3 (J2, 3 = 9.0 Hz) 以及H-3与H-4b (J3, 4b = 9.6 Hz) 的偶合常数, 确定结构中环己烷具有比较典型的椅式优势构象, H-2和H-4b以及戊二烯酸单元均处于环的准a-键, 且三取代双键具有顺式构型(9Z)。然而, 4与文献[33]报道化合物在相同溶剂CD3OD中的NMR谱数据的差别超出了实验误差, 例如H-7和H-8的化学位移相差达到ΔδH ≥ ±0.10, C-7和C-8的差别ΔδC ≥ ±0.5, 且缺少H3-15和C-15的NMR数据。另外, 尽管二者的比旋光值符号相同, 但数值大小差别也较大。因此, 认为文献[33]中报道化合物的结构鉴定或NMR数据有误。化合物4的实测CD与计算ECD谱吻合良好(图 9), 据此确定其绝对构型为1S, 2R, 3R, 5S, 6S。因此, 化合物4的结构得以确定, 命名为钩藤脱落酸A (uncarphabscisic acid A)。
|
Figure 9 (a) The overlaid experimental CD spectrum of 4 (red line), and calculated ECD spectra of (1S, 2R, 3R, 5S, 6S, 7E, 9Z)-4 (red dash) and (1R, 2S, 3S, 5R, 6R, 7E, 9Z)-4 (blue dash). (b) The overlaid experimental UV spectrum of 4 and calculated UV spectrum of (1S, 2R, 3R, 5S, 6S, 7E, 9Z)-4 |
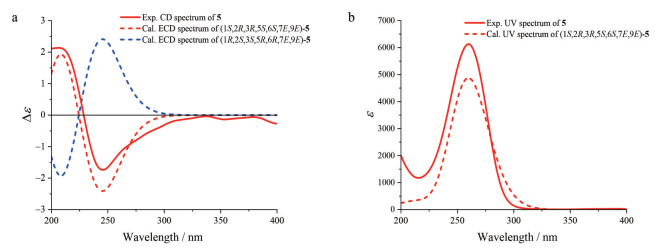
化合物5为白色无定形粉末, 其UV、IR和NMR谱与化合物4非常相似, 且HR-ESI-MS给出完全相同的分子组成。因此, 推断5是4的同分异构体。比较二者的NMR谱数据(表 3), 发现5的H-7、H-8、H-10和H3-15共振信号分别位移了ΔδH -0.06、-1.10、+0.09和+0.11, 而C-7、C-8、C-10和C-15分别位移ΔδC +9.7、-5.7、+4.5和-6.7; 然而H-7与H-8的偶合常数未发生明显改变。根据以上差异, 推断4中C-9和C-10之间的顺式双键在5中变成了反式。通过5的2D NMR实验数据分析(图 2、3), 进一步确证了以上推断。特别是, 在5的NOESY谱中, H-8与H-10的NOE交叉峰, 确证其具有9E-构型。进一步通过实测CD与计算ECD对比(图 10), 确定5的绝对构型与4的相同。因此, 化合物5的结构得以确定, 命名为钩藤脱落酸B (uncarphabscisic acid B)。
|
Figure 10 (a) The overlaid experimental CD spectrum of 5 (red line), and calculated ECD spectra of (1S, 2R, 3R, 5S, 6S, 7E, 9E)-5 (red dash) and (1R, 2S, 3S, 5R, 6R, 7E, 9E)-5 (blue dash). (b) The overlaid experimental UV spectrum of 5 and calculated UV spectrum of (1S, 2R, 3R, 5S, 6S, 7E, 9E)-5 |
尽管紫罗兰酮类或megastigmane类化合物是植物界普遍存在、具有重要生物活性的一类天然产物, 并且钩藤属植物的化学成分研究也已有近一个世纪之久, 然而近期仅从钩藤及其一种内生菌发酵提取物中发现了植物界分布比较广泛的吐叶醇[34, 35]。化合物1~5是钩藤属植物中megastigmane类新天然产物的首例报道, 增添了该属植物化学成分和megastigmane类天然产物的结构多样性。尤其是3和4的分子结构曾有报道, 然而在文献[30, 33]中报道的波谱数据, 与3和4的相应数据差异显著, 不能用实验误差解释, 因此文献[30, 33]中化合物的结构值得商榷。另外, 由于1~5在钩藤水提取物中属于微量成分、分离得到的样品量有限, 因此仅在抑制RAW 264.7细胞分泌TNF-α和保护APAP引起HepG2细胞损伤作用等体外模型上, 对1~3进行了初步筛选, 均未发现明显的活性, 但是不能排除在其他模型上的潜在活性或作用。
实验部分AUTOPOL V型旋光测定仪(美国Rudolph公司), Nicolet impact 5700型傅立叶变换红外光谱仪(美国Thermo Electron Corporation公司), JASCO V-650型紫外光谱仪(日本JASCO公司), JASCO J-815型CD测定仪(日本JASCO公司), Mercury-400、SYS-600、Bruker 600 (美国Varian公司, 以溶剂峰信号为参照), Q Exactive Focus型质谱仪(美国Thermo Fisher Scientific公司)。LC3000型高效液相色谱仪(北京创新通恒科技有限公司), RI2000型示差折光检测器(德国Schambeck)。Sephadex LH-20 (瑞典Amersham Pharmacia公司), Toyopearl HW-40F凝胶树脂、Toyopearl HW-40S凝胶树脂(日本TOSOH公司), YMC苯基柱(日本YMC公司), C18 MGII、C18 AQ反相色谱柱(日本大阪曹達株式会社), 柱色谱硅胶(200~300目)、薄层色谱用硅胶GF254 (青岛海洋化工厂生产)。所有试剂若无特别说明, 均购自北京化工厂, 级别为分析纯或色谱纯。
钩藤(带钩茎枝) 购于河北安国药材市场, 于2016年8月从中国湖南省衡东县采集, 由马林副研究员(中国医学科学院药物研究所) 验证, 标本现存于中国医学科学院药物研究所植物标本室, 标本号为NO. ID-S-2753。
1 提取与分离干燥钩藤(97.0 kg) 粉碎后, 用水加热回流提取3次, 减压浓缩至干, 得到浸膏。浸膏经HP-20大孔树脂柱色谱分离, 依次用水、50%乙醇和95%乙醇洗脱, 回收溶剂后得到A~C三部分。B流分(2.6 kg) 经MCI分离, 依次用水(20 L)、30%乙醇(20 L)、50%乙醇(20 L)、95%乙醇(18 L) 和丙酮(5 L) 洗脱, 得到5个流分B1~B5, B1 (680.0 g) 用反相硅胶进行分离, 经薄层色谱检测, 减压干燥后得到9个亚组分B1-1~B1-9。B1-1 (30.0 g) 用Toyopearl HW-40F凝胶柱色谱分离, 得到6个亚组分B1-1-1~B1-1-6。B1-1-3用Sephadex LH-20凝胶柱色谱进行分离, 得到B1-1-3-1~B1-1-3-3三个组分, B1-1-3-1 (2.56 g) 再经Sephadex LH-20凝胶柱色谱进行分离得到B1-1-3-1-1~B1-1-3-1-3三个流分, 对B1-1-3-1-2 (120 mg) 进行制备(YMC苯基柱, 6%乙腈) 得到化合物5 (1.1 mg, tR = 24.0 min)。B1-1-3-2 (800 mg) 进行薄层制备(乙酸乙酯∶乙醇∶水14∶2∶1) 得到带1。带1经过液相制备(C18 MGⅡ, 40%甲醇, 0.5‰甲酸) 得化合物4 (1.3 mg, tR = 12.0 min)。流分B1-2 (120.2 g) 在Sephadex LH-20凝胶柱色谱上进行分离, 依次用H2O、H2O-CH3OH (1∶1 v/v) 和CH3OH洗脱, 得到B1-2-1~B1-2-10。其中, B1-2-7 (12.3 g) 通过正相硅胶进行进一步分离(EtOAc-EtOH, 0%~100%, v/v), 得到B1-2-7-1~B1-2-7-10。在Toyopearl HW-40S凝胶(CH3OH) 上分离B1-2-7-1 (894.5 mg) 得到B1-2-7-1-1~B1-2-7-1-6。B1-2-7-1-2 (57.3 mg) 经过液相制备(C18 MGⅡ, 20%甲醇) 得化合物1 (3.5 mg, tR = 46.2 min), B1-2-7-4 (85.6 mg) 进行制备(C18 MGⅡ, 20%甲醇) 得到化合物2 (1.0 mg, tR = 52.1 min) 和化合物3 (2.3 mg, tR = 48.0 min)。
2 结构鉴定化合物1: 无色胶状固体; [α]D20 +102.8 (c 0.18, MeOH); UV (MeOH) λmax (log ε) 202 (2.87), 233 (3.10) nm; CD (MeCN): 211 (Δε -0.55), 245 (Δε +3.82), 316 (Δε -0.54) nm; IR νmax 3 371, 2 974, 2 937, 2 879, 1 674, 1 626, 1 373, 1 277, 1 220, 1 200, 1 130, 1 070, 1 047, 1 028, 984, 957, 895, 671 cm-1; 1H NMR (CD3OD, 600 MHz)、13C NMR (CD3OD, 150 MHz) 数据见表 1。(+)-HR-ESI-MS m/z 263.125 2 [M+H]+ (C13H20O4Na计算值, 263.125 4)。
化合物2: 无色胶状固体; [α]D20 +23.4 (c 0.08, MeOH); UV (MeOH) λmax (log ε) 204 (2.97), 283 (1.70) nm; CD (MeCN): 191 (Δε -0.83) nm; IR νmax 3 382, 2 963, 2 924, 2 874, 2 853, 1 575, 1 413, 1 370, 1 260, 1 143, 1 111, 1 057, 1 020, 973, 801 cm-1; 1H NMR (CD3OD, 600 MHz)、13C NMR (CD3OD, 150 MHz) 数据见表 1。(+)-HR-ESI-MS m/z 265.140 2 [M+Na]+ (C13H22O4Na计算值, 265.141 0)。
化合物3: 无色胶状固体; [α]D20 -14.7 (c 0.11, MeOH); UV (MeOH) λmax (log ε) 203 (2.03) nm; CD (MeCN): 196 (Δε -5.97) nm; IR νmax 3 375, 2 969, 2 929, 2 867, 1 461, 1 370, 1 118, 1 071, 1 045, 1 032, 981, 958, 937, 742, 642 cm-1; 1H NMR (CD3OD, 600 MHz)、13C NMR (CD3OD, 150 MHz) 数据见表 1; (+)-HR-ESI-MS m/z 267.155 7 [M+Na]+ (C13H24O4Na计算值, 267.156 7)。
化合物4: 无色胶状固体; [α]D20 -91.5 (c 0.07, MeOH); UV (MeOH) λmax (log ε) 194 (2.59), 258 (3.01) nm; CD (MeCN): 254 (Δε -2.41) nm; IR νmax 3 370, 2 982, 2 940, 1 762, 1 679, 1 604, 1 452, 1 403, 1 382, 1 337, 1 248, 1 182, 1 139, 1 059, 1 021, 944, 900, 877 cm-1; 1H NMR (D2O, 600 MHz)、13C NMR (D2O, 150 MHz) 数据见表 3; (+)-HR-ESI-MS m/z 335.109 7 [M+Na]+ (C15H20O7Na计算值, 335.110 1)。
化合物5: 白色无定形粉末; [α]D20 -60.0 (c 0.05, H2O); UV (H2O) λmax (log ε) 205 (3.84), 254 (sh, 3.48), 313 (sh, 3.15) nm; CD (MeOH): 208 (Δε +2.13), 246 (Δε -1.74) nm; IR νmax 3 355, 2 935, 2 858, 1 760, 1 611, 1 569, 1 452, 1 405, 1 379, 1 358, 1 258, 1 204, 1 184, 1 135, 1 059, 1 025, 946, 898, 848, 774, 702, 675, 625, 584 cm-1; 1H NMR (D2O, 600 MHz)、13C NMR (D2O, 150 MHz) 数据见表 3; (+)-HR-ESI-MS m/z 311.113 9 [M-H]- (C15H19O7计算值, 311.113 6)。
3 ECD、UV和NMR谱计算应用Gaussian 16软件的GMMX模块, 在MMFF94分子力场中采用蒙特卡洛方式对化合物的构象进行搜索, 得到相对能量小于3.0 kcal·mol-1的优势构象。应用Gaussian 16程序、密度泛函算法和CPCM模型(conductor-like polarizable continuum model) 模拟溶剂效应, 在B3LYP/6-31+G(d, p) 水平上, 对搜索获得的构象进一步优化得到优化构象及其玻尔兹曼分布。在B3LYP/6-311+G(d, p) 水平上, 计算Gibbs自由能在3.0 kcal·mol-1以内的优化构象的各激发态能量、振子强度和转子强度。根据优化构象的玻尔兹曼分布概率, 通过加权平均化, 拟合得到理论计算的ECD和UV谱图(σ = 0.30 eV)。在MPW1PW91/6-311+G(d, p) 水平上, 用GIAO算法[25, 26]计算Gibbs自由能在3.0 kcal·mol-1以内的优化构象的NMR, 再通过加权平均化, 拟合得到理论计算的1H和13C NMR数据, 再经DP4+概率分析, 进行确证。
作者贡献: 石建功负责实验设计、数据分析, 以及文章的修改及定稿; 郭庆兰负责计算化学、数据分析及文章的修改; 宋乐苓负责化学实验实施及文章初稿的撰写; 王岳和李若斐参与了药材的初步分离实验; 朱承根辅助开展化学实验。
利益冲突: 作者声明无利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (2020) (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020: 268.
|
| [2] |
Heitzman ME, Neto CC, Winiarz E, et al. Ethnobotany, phytochemistry and pharmacology of Uncaria (Rubiaceae)[J]. Phytochemistry, 2005, 66: 5-29. DOI:10.1016/j.phytochem.2004.10.022 |
| [3] |
Ndagijimana A, Wang XM, Pan GX, et al. A review on indole alkaloids isolated from Uncaria rhynchophylla and their pharmacological studies[J]. Fitoterapia, 2013, 86: 35-47. DOI:10.1016/j.fitote.2013.01.018 |
| [4] |
Zhang Q, Zhao JJ, Xu J, et al. Medicinal uses, phytochemistry and pharmacology of the genus Uncaria[J]. J Ethnopharm, 2015, 173: 48-80. DOI:10.1016/j.jep.2015.06.011 |
| [5] |
Zhang JG, Chen JJ, Geng CA. Advances in indole alkaloids from traditional Chinese medicine of Uncariae Ramulus Cum Uncis documented in Chinese Pharmacopoeia[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 685-695. |
| [6] |
Liang JH, Wang C, Huo XK, et al. The genus Uncaria: a review on phytochemical metabolites and biological aspects[J]. Fitoterapia, 2020, 147: 104772. DOI:10.1016/j.fitote.2020.104772 |
| [7] |
Yang W, Ip SP, Liu L, et al. Uncaria rhynchophylla and its major constituents on central nervous system: a review on their pharmacological actions[J]. Curr Vasc Pharmacol, 2020, 18: 346-357. DOI:10.2174/1570161117666190704092841 |
| [8] |
Qin N, Lu X, Liu Y, et al. Recent research progress of Uncaria spp. based on alkaloids: phytochemistry, pharmacology and structural chemistry[J]. Eur J Med Chem, 2021, 210: 112960. DOI:10.1016/j.ejmech.2020.112960 |
| [9] |
Wang Y, Guo QL, Li RF, et al. Two folate-derived analogues from an aqueous decoction of Uncaria rhynchophylla[J]. Chin J Nat Med, 2019, 17: 928-934. |
| [10] |
Cai J, Guo QL, Li RF, et al. Alkaloids from an aqueous extract of Uncaria rhynchophylla[J]. Acta Pharm Sin (药学学报), 2019, 54: 1075-1081. |
| [11] |
Li RF, Guo QL, Zhu CG, et al. Minor triterpenes from an aqueous extract of the hook-bearing stem of Uncaria rhynchophylla[J]. J Asian Nat Prod Res, 2021, 23: 307-317. DOI:10.1080/10286020.2020.1870961 |
| [12] |
Li RF, Zhu CG, Xu CB, et al. Minor alkaloids from an aqueous extract of the hook-bearing stem of Uncaria rhynchophylla[J]. J Asian Nat Prod Res, 2021, 23: 513-526. DOI:10.1080/10286020.2021.1906658 |
| [13] |
Galbraith MN, Horn DHS. Structures of the natural products blumenols A, B, and C[J]. J Chem Soc Chem Commun, 1972, 113-114. |
| [14] |
Weiss G, Koreeda M, Nakanishi K. Stereochemistry of theaspirone and the blumenols[J]. J Chem Soc Chem Commun, 1973, 565-566. |
| [15] |
Galbraith MN, Horn DHS. Stereochemistry of the blumenols: conversion of blumenol A into (S)-(+)-abscisic acid[J]. J Chem Soc Chem Commun, 1973, 566-567. |
| [16] |
Bhakuni DS, Joshi PP, Uprety H, et al. Roseoside-A C13 glycoside from Vinca Rosea[J]. Phytochemistry, 1974, 13: 2541-2543. DOI:10.1016/S0031-9422(00)86933-2 |
| [17] |
Achenbach H, Waibel R, Raffelsberger B, et al. Iridoid and other constituents of Canthium subcordatum[J]. Phytochemistry, 1981, 20: 1591-1595. DOI:10.1016/S0031-9422(00)98538-8 |
| [18] |
González AG, Guillermo JA, Ravelo AG, et al. 4, 5-Dihydroblumenol A, a new nor-isoprenoid from Perrottetia multiflora[J]. J Nat Prod, 1994, 57: 400-402. DOI:10.1021/np50105a013 |
| [19] |
Otsuka H, Yao M, Kamada K, et al. Alangionosides G-M: glycosides of megastigmane derivatives from the leaves of Alangium premnifolium[J]. Chem Pharm Bull, 1995, 43: 754-759. DOI:10.1248/cpb.43.754 |
| [20] |
Yoshikawa M, Shimada H, Saka M, et al. Medicinal foodstuffs. V. Moroheiya. (1): absolute stereostructures of corchoionosides A, B, and C, histamine release inhibitors from the leaves of Vietnamese Corchorus olitorius L. (Tiliaceae)[J]. Chem Pharm Bull, 1997, 45: 464-469. DOI:10.1248/cpb.45.464 |
| [21] |
Murai Y, Kashimura S, Tamezawa S, et al. Absolute configuration of (6S, 9S)-roseoside from Polygonum hydropiper[J]. Planta Med, 2001, 67: 480-481. DOI:10.1055/s-2001-15812 |
| [22] |
Yamano Y, Ito M. Synthesis of optically active vomifoliol and roseoside stereoisomers[J]. Chem Pharm Bull, 2005, 53: 541-546. DOI:10.1248/cpb.53.541 |
| [23] |
Seco JM, Quinñoá E, Riguera R. The assignment of absolute configuration by NMR[J]. Chem Rev, 2004, 104: 17-117. DOI:10.1021/cr000665j |
| [24] |
Ye XL. Stereochemistry (立体化学)[M]. Beijing: Peking University Press, 1999: 242-259.
|
| [25] |
Helgaker T, Jørgensen P. An electronic Hamiltonian for origin independent calculations of magnetic properties[J]. J Chem Phys, 1991, 95: 2595-2601. |
| [26] |
Lodewyk MW, Siebert MR, Tantillo DJ, et al. Computational prediction of 1H and 13C chemical shifts: a useful tool for natural product, mechanistic, and synthetic organic chemistry[J]. Chem Rev, 2012, 112: 1839-1862. DOI:10.1021/cr200106v |
| [27] |
Grimblat N, Zanardi MM, Sarotti AM. Beyond DP4: an improved probability for the stereochemical assignment of isomeric compounds using quantum chemical calculations of NMR shifts[J]. J Org Chem, 2015, 80: 12526-12534. DOI:10.1021/acs.joc.5b02396 |
| [28] |
Takeda Y, Okada Y, Masuda T, et al. New megastigmane and tetraketide from the leaves of Euscaphis japonica[J]. Chem Pharm Bull, 2000, 48: 752-754. DOI:10.1248/cpb.48.752 |
| [29] |
Nascimento M, Arruda AC, Arruda MSP, et al. Aripuanin, a megastigmane skeleton from Ficus aripuanensis[J]. Fitoterapia, 1999, 70: 628-629. DOI:10.1016/S0367-326X(99)00096-9 |
| [30] |
Nascimento AF, Constantino MG, Donate PM. Total synthesis of aripuanin, a megastigmane from Ficus aripuanensis[J]. Orbit Electron J Chem, 2012, 4: 253-262. |
| [31] |
Otsuka H, Hirata E, Shinzato T, et al. Stereochemistry of megastigmane glucosides from Glochidion zeylanicum and Alangium premnifolium[J]. Phytochemistry, 2003, 62: 763-768. DOI:10.1016/S0031-9422(02)00614-3 |
| [32] |
Forino M, Stiuso P, Lama S, et al. Bioassay-guided identification of the antihyperglycaemic constituents of walnut (Juglans regia) leaves[J]. J Funct Foods, 2016, 26: 731-738. DOI:10.1016/j.jff.2016.08.053 |
| [33] |
Kikuzaki H, Kayano S, Fukutsuka N, et al. Abscisic acid related compounds and lignans in Prunes (Prunus domestica L.) and their oxygen radical absorbance capacity (ORAC)[J]. J Agric Food Chem, 2004, 52: 344-349. DOI:10.1021/jf034954v |
| [34] |
Wang YL, Dong PP, Liang JH, et al. Phytochemical constituents from Uncaria rhynchophylla in human carboxylesterase 2 inhibition: kinetics and interaction mechanism merged with docking simulations[J]. Phytomedicine, 2018, 51: 120-127. DOI:10.1016/j.phymed.2018.10.006 |
| [35] |
Wei B, Yang ZD, Chen XW, et al. Colletotrilactam A-D, novel lactams from Colletotrichum gloeosporioides GT-7, a fungal endophyte from Uncaria rhynchophylla[J]. Fitoterapia, 2016, 113: 158-163. DOI:10.1016/j.fitote.2016.08.005 |
 2022, Vol. 57
2022, Vol. 57


