2. 南京大学生命科学学院, 医药生物技术国家重点实验室, 江苏 南京 210023;
3. 江苏大学食品与生物工程学院, 江苏 镇江 212013;
4. 常州南京大学高新技术研究院和江苏靶标生物医药研究所有限公司, 江苏 常州 213164
2. The State Key Laboratory of Pharmaceutical Biotechnology, School of Life Sciences, Nanjing University, Nanjing 210023, China;
3. School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China;
4. High-tech Research Institute of Nanjing University at Changzhou and Jiangsu Target Pharma Laboratories Inc., Changzhou 213164, China
溃疡性结肠炎(ulcerative colitis, UC) 是一种易复发的自身免疫性疾病, 属于炎症性肠病(inflammatory bowel disease, IBD) 的一种。溃疡性结肠炎通常会影响患者结肠和直肠的最内层黏膜, 症状表现为持续的炎症和溃疡[1]。在世界范围内, 主要是在发展中国家包括中国, UC的发病率和发生率仍在增加[2]。UC的致病机制尚不明确, 遗传、免疫和环境因素, 如饮食、压力、吸烟、肠道菌群和自由基等, 都参与了其发展[3, 4]。对于UC的治疗, 除了传统的皮质类固醇、免疫抑制剂等外, 各种生物制剂逐渐成为热点, 例如TNF-α阻断剂、JAK抑制剂、IL-12/IL-23p40单克隆抗体和细胞黏附分子抑制剂等[5, 6]。然而, 这些生物制剂也存在成本高、质控难度大、不良反应明显等缺点。因此, 开发新型、高效、低毒的治疗药物成为需求。
硫氧还蛋白(thioredoxin, TXN) 又称成人T细胞白血病来源因子(adult T cell leukemia-derived factor, ADF)[7], 是控制氧化还原调节系统的最重要的分子之一, 在保守的活性位点序列Cys32-Gly-Pro-Cys35中含有一个具有氧化还原活性的二硫醚/二硫醇[8]。硫氧还蛋白具有多种生物学功能, 包括抗炎、抗氧化、抗凋亡等作用[9, 10]。已有文献报道, UC患者结肠黏膜中硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein, TXNIP) 的表达水平降低[11], 并且UC炎症部位TXN表达水平显著降低[12], 这提示着TXN与UC存在密切联系。
然而, 人硫氧还蛋白(human thioredoxin, hTXN) 对溃疡性结肠炎的作用如何, 文献鲜有报道。本实验首先通过基因克隆技术表达重组人TXN, 在体外鉴定其活性, 继而利用葡聚糖硫酸钠(dextran sulfate sodium, DSS) 诱导小鼠溃疡性结肠炎模型研究重组人硫氧还蛋白的治疗效果。并利用GEO中的数据集GSE107499研究UC炎症部位TXN基因(即人硫氧还基因) 与枢纽基因的相关性, 为重组人硫氧还蛋白在溃疡性结肠炎治疗中的应用提供理论依据。
材料与方法菌株与细胞 E. coli BL21 (DE3) 菌株、pCold TF载体质粒、Jurkat细胞均由本实验室冻存。
主要试剂 胰岛素购自MCE公司; 葡聚糖硫酸钠购自YEASEN公司; ClonExpress® II One Step Cloning Kit购自Vazyme公司; 英夫利昔单抗(infliximab) 购自Sigma-Aldrich公司。
重组质粒pCold TF-rhTXN的构建 在NCBI中获得人硫氧还蛋白的序列(NM_003329.4)。设计引物, 从Jurkat细胞中提取总RNA, 反转录反应合成cDNA, PCR扩增出hTXN基因编码区片段。利用ClonExpress® II One Step Cloning Kit试剂将hTXN序列连入pCold TF载体, 转入E. coli BL21(DE3) 细胞。筛选阳性克隆, 进行菌落PCR及测序鉴定。
rhTXN的诱导表达和纯化 取阳性克隆涂布于LB (Amp+) 平板, 接种于LB (Amp+) 液体培养基中, 37 ℃振荡过夜培养, 次日按1:100比例转接于新鲜LB (Amp+) 中, 37 ℃继续培养, 至细菌密度达到(A600: 0.6~0.8), 加入终浓度为5 mmol·L-1异丙基-β-硫代丙糖苷(isopropyl-β-D-thiogalactoside, IPTG), 在15 ℃下诱导20 h, 得到可溶性表达。通过离心(4 000 r·min-1, 20 min, 4 ℃) 收取大肠杆菌沉淀, 在缓冲液(20 mmol·L-1 Tris, pH 7.8, 150 mol·L-1 NaCl) 中重悬菌液。使用高压均质匀浆器破碎大肠杆菌, 离心后(12 000 r·min-1, 30 min, 4 ℃) 吸取上清。用Ni-NTA柱纯化目标蛋白, 用80 mmol·L-1咪唑洗脱。随后用HRV 3C酶从纯化的蛋白中去除TF标签(4 ℃, 12 h)。然后使用Ni-NTA柱收集不含TF标签的完整的rhTXN。用PBS过夜透析后, 将纯化的rhTXN浓缩并在-80 ℃下保存。
rhTXN的体外活性检测 在1 000 μL反应混合物中含有50 mmol·L-1 Tris·HCl (pH 7.5)、1 mmol·L-1乙二胺四乙酸(EDTA)、0.17 mmol·L-1胰岛素和5 μmol·L-1 rhTXN。加入二硫苏糖醇(DTT) 至终浓度2 mmol·L-1启动反应, 室温下在650 nm处每隔l min测定1次吸光度(A) 值, 绘制反应曲线。
DSS结肠炎小鼠模型的诱导和治疗 雌性SPF级C57BL/6小鼠[17~19 g, 6~8周龄, 实验动物使用许可证: SYXK (苏) 2019-0056] 购自南京大学生命科学学院实验动物中心。小鼠被饲养在25 ± 2 ℃的恒温条件下, 保持12 h的光-暗循环, 自由饮用食物和水。动物实验按照南京大学实验动物福利伦理审查委员会的伦理指导方针进行。
将36只小鼠随机分为6组: 对照组、DSS组、rhTXN (10 μg·kg-1) 组、rhTXN (100 μg·kg-1) 组、rhTXN (1 mg·kg-1) 组和infliximab (10 mg·kg-1) 组。除了对照组外, 其余组小鼠自由饮用含3% DSS (w/v) 的无菌饮用水, 诱导实验性结肠炎。从造模第2天开始腹腔注射不同浓度的rhTXN和infliximab, 直到其被处死。每天检测小鼠体重和粪便出血等情况。
结肠HE染色 取小鼠结肠组织, 在4%多聚甲醛中固定24 h。用梯度浓度的酒精脱去结肠中的水分, 再将其浸入二甲苯中。将组织块浸入石蜡块中包埋, 冷却。将蜡块固定在切片机上, 切成薄片, 用热水烫平后贴在载玻片上, 烘干。用苏木精溶液染色数分钟, 再用0.5%盐酸乙醇或氨水将组织切片过多结合的染色剂洗脱, 再用流水冲洗1 h, 用蒸馏水清洗片刻, 分别在70%和90%的酒精中脱水10 min, 最后用酒精伊红染色液染色3 min。用树胶滴在切片上封片, 显微镜观察。
rhTXN对结肠的靶向性 取造模5天的DSS小鼠, 尾静脉注射rhTXN-mCherry (1 mg·kg-1), 1 h后用10%水合氯醛(3 mL·kg-1) 腹腔注射麻醉小鼠, 然后将小鼠放入成像暗箱平台, 软件控制平台的升降到一个合适的视野, 自动开启照明灯(明场) 拍摄第一次背景图。下一步自动关闭照明灯, 选择合适的激发和发射滤片, 在没有外界光源的条件下(暗场) 拍摄由小鼠体内发出的特异光子。明场与暗场的背景图叠加后可以直观地显示动物体内特异光子的部位和强度, 完成成像操作。
GEO数据库中UC炎症部位的枢纽基因与TXN的相关性分析 在GEO数据库中下载数据集GSE107499, 下载数据格式为MINiML (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE107499), 该数据采用的芯片平台是GPL15207。GSE107499数据集包含119个样本, 其中有75个UC患者炎症部位结肠组织样本和44个UC患者非炎症部位结肠组织样本。首先使用R软件的Limma软件包对数据进行整理、规范化、数据合并及注释转换。通过Limma分别筛选差异表达基因(DEGs), 筛选条件为: 表达变化倍数大于2 (|log2(flod change)| > 1)。
STRING数据库(https://string-db.org/cgi/input.pl) 用于预测蛋白质及研究蛋白质间的相互作用关系。将DEGs导入STRING数据库, 构建蛋白质相互作用(protein protein interaction, PPI) 网络图, 筛选条件为combine score ≥ 0.4。并利用Cytoscape (3.9.0) 软件中的插件cytoHubba基于Closeness算法筛选出排名前20的枢纽基因。利用Wilcoxon秩和检验对样本中TXN的表达进行分析, 箱线图通过R软件包ggplot2进行绘制。对TXN和筛选出的枢纽基因做Spearman相关性分析, 相关性图通过R软件包pheatmap进行绘制。
统计学分析 所有实验数据均采用GraphPad Prism 8.0分析处理, 计量数据以平均值±标准误[mean ± SEM (standard error of mean)]表示, 两组数据比较采用student's t test, P < 0.05为显著差异, P < 0.01为极显著差异。
结果 1 重组质粒pCold TF-rhTXN的鉴定首先构建重组质粒pCold TF-rhTXN, 用1%琼脂糖电泳检测rhTXN基因的PCR产物, 在约315 bp处可见特异性条带(图 1A), 与序列的实际大小一致。用限制性内切酶Nde I和EcoR I双酶切pCold TF质粒(图 1B)。将目的基因和酶切质粒同源重组后的产物转入BL21菌, 挑选重组菌落进行PCR鉴定, 发现所挑的8个菌落皆为阳性(图 1C), 菌落经Sangon公司测序鉴定正确, 说明重组质粒pCold TF-rhTXN构建成功。
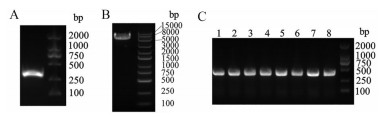
|
Figure 1 Construction and identification of the recombinant plasmid pCold TF-rhTXN. A: PCR products of rhTXN; B: pCold TF plasmid after restriction enzyme digestion (Nde I and EcoR I); C: PCR results of recombinant plasmids. rhTXN: Recombinant human thioredoxin; TF: Trigger factor |
在诱导前后和纯化过程中取样, 用12% SDS-PAGE凝胶电泳检测蛋白的表达, TXN含105个氨基酸, 相对分子质量(Mr) 为12 000 Da。pCold TF载体是一种融合表达可溶性的标签“触发因子(trigger factor, TF) 伴侣”的冷休克载体。“触发因子”是原核核糖体相关的分子伴侣蛋白, 有利于新表达的多肽的共翻译折叠, 分子质量为52 000 Da。如图 2A所示, 经过IPTG诱导后, 所表达的rhTXN含有TF标签, 加上His标签等, 总共大小为66 000 Da左右。
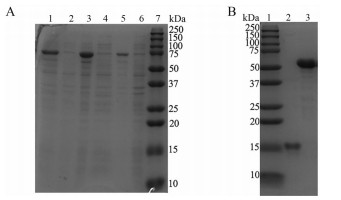
|
Figure 2 Expression and purification of rhTXN in E. coli. A: SDS-PAGE analysis of protein expression induced by 5 mmol·L-1 isopropyl-β-D-thiogalactoside (IPTG). 1: Total cellular protein after IPTG induction; 2: Total cellular protein before IPTG induction; 3: Cellular supernatant after induction; 4: Cellular supernatant before induction; 5: Cellular precipitation after induction; 6: Cellular precipitation before induction; 7: Protein marker; B: SDS-PAGE analysis of rhTXN purification. 1: Protein marker; 2: rhTXN; 3: TF-tag |
在TF标签与rhTXN之间有一个人鼻病毒3C蛋白酶(human rhinovirus 3C, HRV 3C) 的酶切位点, 可用HRV 3C酶切除TF标签和His标签。如图 2B所示, 切割下的rhTXN大约为12 000 Da, 其余部分为52 000 Da左右, 提示切割完全。
3 rhTXN的体外活性检测对于纯化后的rhTXN, 可以使用胰岛素还原法检测其活性。在DTT的作用下, rhTXN被还原成还原型的rhTXN, 具有二硫键还原酶的活性。可以使得胰岛素AB链间二硫键打开, 变成游离的AB链, B链在650 nm处有强烈吸光度。如图 3所示, 同PBS组相比, rhTXN组650 nm处的吸光度在十几分钟时明显升高, 并在40 min左右达到平台期。表明纯化的rhTXN具有二硫键还原酶的活性。
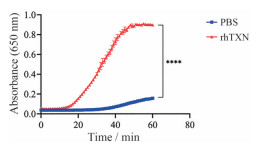
|
Figure 3 Analysis of disulfide reductase activity of rhTXN. n = 3, |
使C57BL/6雌性小鼠自由饮用3% DSS水诱导结肠炎。设置了3个剂量的rhTXN (10、100 μg·kg-1和1 mg·kg-1), 以infliximab作为阳性对照。在造模的第2天和第5天给药, 以寻找有效的剂量(图 4A)。rhTXN组100 μg·kg-1 [(17.25 ± 0.24) g, P = 0.000 5)] 和1 mg·kg-1 [(16.77 ± 0.35) g, P = 0.021 2)] 小鼠的体重显著高于DSS组(15.68 ± 0.19) g, 并且rhTXN (100 μg·kg-1) 组更显著, 与infliximab (10 mg·kg-1) 组在维持小鼠体重上的效果没有显著差异(图 4B)。
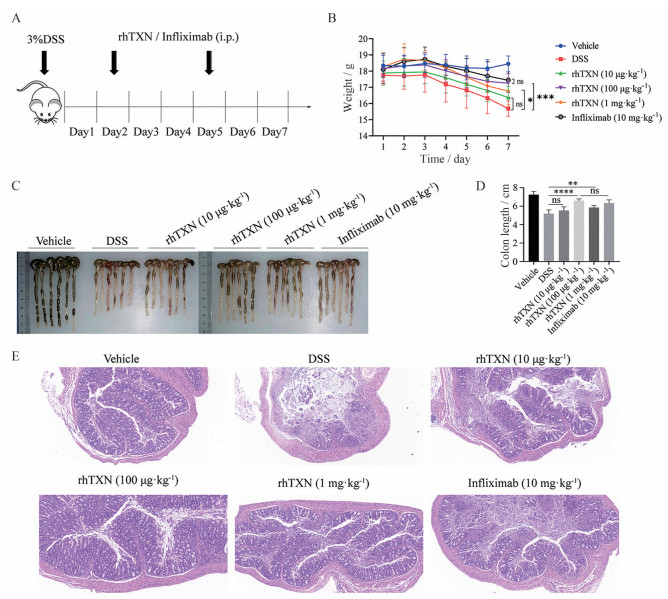
|
Figure 4 Therapeutic effect of rhTXN on colitis in dextran sulfate sodium (DSS) mice. A: Administration protocol of rhTXN; B: Weight changes of mice; C: Colon morphology of mice; D: Colon length of mice; E: Serial sections of colon tissues were stained with hematoxylin and eosin (HE). n = 6, |
解剖后取小鼠结肠观察, 与DSS组(5.18 ± 0.17) cm相比, rhTXN组在100 μg·kg-1 [(6.60 ± 0.08) cm, P < 0.000 1)] 和1 mg·kg-1 [(5.85 ± 0.09) cm, P = 0.005 6) 时的结肠形态更为完整(图 4C), 长度也显著增长, 并且rhTXN (100 μg·kg-1) 组与infliximab (10 mg·kg-1) 在维持结肠长度和形态上有近似的效果(图 4D)。
通过对小鼠的结肠HE染色切片分析, 观察到经过DSS造模后的小鼠肠壁增厚, 腺管排列不齐, 有明显的隐窝受损和组织坏死的情况, 并伴随着大量炎性细胞的浸润。而在经过rhTXN与infliximab治疗后有明显改善。其中rhTXN (100 μg·kg-1) 治疗后肠壁趋于正常厚度, 腺管排列整齐, 炎性细胞浸润的情况有显著改善, 与正常对照组最为接近(图 4E)。上述结论表明, rhTXN在100 μg·kg-1时对DSS小鼠有良好的治疗效果。
5 rhTXN对DSS小鼠的靶向研究在证明了rhTXN对DSS小鼠的治疗效果后, 为了探究rhTXN对DSS小鼠的靶向性, 在大肠杆菌中表达了带荧光标签的rhTXN-mCherry融合蛋白。取造模5天的DSS小鼠, 将rhTXN-mCherry (1 mg·kg-1) 尾注射到DSS小鼠和对照组体内, 1 h后麻醉小鼠, 用活体成像装置(mCherry) 观察, 并取小鼠结肠、肾脏和脾脏观察。结果显示, rhTXN-mCherry在结肠近端积累(图 5A), 而在肾脏和脾脏中无明显蓄积(图 5B)。以上结果证实, rhTXN-mCherry对DSS小鼠具有结肠靶向定位的作用。

|
Figure 5 Targeting effect of rhTXN on colon of DSS mice. A: rhTXN-mCherry in living DSS mice; B: rhTXN-mCherry in colon, kidney and spleen of DSS mice |
上述研究结果证明: ① rhTXN对DSS小鼠有良好的治疗效果; ② rhTXN对DSS小鼠具有结肠靶向定位的作用。然而, hTXN与人溃疡性结肠炎的关系究竟怎样, 目前尚未可知。为了研究TXN基因在UC患者中的表达水平变化和与枢纽基因相关性, 在GEO数据库中选取了数据集GSE107499, 包含着75个UC炎症部位结肠组织样本, 44个UC非炎症部位结肠组织样品。首先, 对数据集中的微阵列数据进行了标准化后, 在FDR < 0.05和|log2(FC)| > 1的条件下, 共筛选出859个差异表达基因, 其中包括545个上调基因, 314个下调基因。在|log2(FC)| > 3和FDR < 0.005的条件下从差异基因中筛选出26个显著差异表达的基因(图 6A、B)。利用STRING数据库和Cytoscape, 构建了一个PPI网络。基于closeness算法, 使用cytohubba插件识别排名前20位枢纽基因(图 6C), 包括肿瘤坏死因子(tumor necrosis factor, TNF)、白细胞介素-6 (interleukin-6, IL-6)、白细胞介素-1β (interleukin-1β, IL-1β)、蛋白酪氨酸磷酸酶受体C (protein tyrosine phosphatase receptor type C, PTPRC/CD45)、纤连蛋白1 (fibronectin 1, FN1)、分化簇44 (clusters of differentiation 44, CD44)、白细胞介素-8 (interleukin-8, CXCL8/IL-8)、Toll样受体2 (Toll-like receptor 2, TLR2)、基质金属蛋白酶9 (matrix metalloproteinase-9, MMP9)、趋化因子2 (C-C motif chemokine 2, CCL2)、分化簇86 (clusters of differentiation 86, CD86)、细胞间黏附分子1 (intercellular cell adhesion molecule-1, ICAM1)、趋化因子受体4 (C-X-C chemokine receptor 4, CXCR4)、干扰素-γ (interferon-γ, IFN-γ)、趋化因子4 (C-C motif chemokine 4, CCL4)、细胞毒性T淋巴细胞相关蛋白4 (cytotoxic T lymphocyte-associated protein-4, CTLA4)、分化簇16 (clusters of differentiation 16, FCGR3A/CD16)、选择素-L (selectin L, SELL)、分化簇40 (clusters of differentiation 40, CD40) 和血管细胞黏附因子(vascular cell adhesion molecule 1, VCAM1), 并且均为表达上调基因(图 6D)。
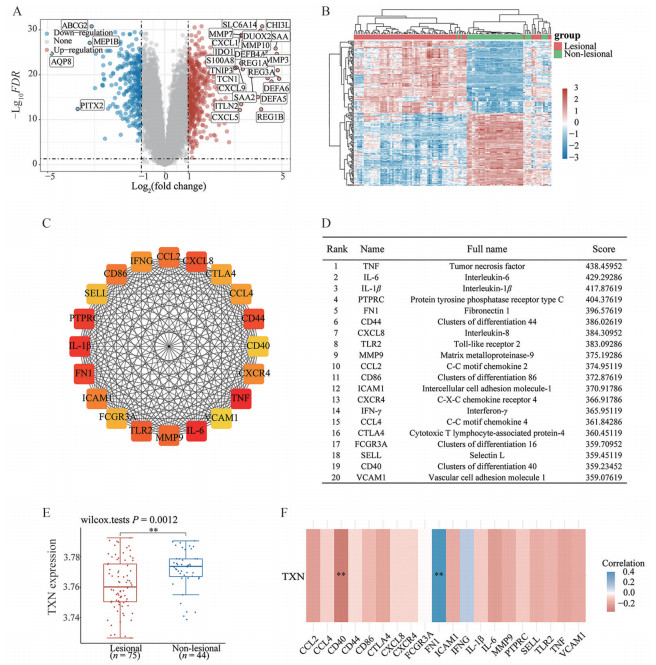
|
Figure 6 Correlation between TXN and hub gene of lesional sites in ulcerative colitis (UC). A: Volcano plots of differentially expressed genes (DGEs) between lesional sites and non-lesional sites in the GSE107499 dataset. Red, blue, and grey dots represent upregulated, downregulated, and unchanged genes, respectively; B: Heatmap of the top 50 DEGs from GSE107499; C: The protein protein interaction (PPI) network of top 20 DEGs based on the closeness algorithm analysis in Cytoscape; D: Top 20 DEGs based on closeness score ranking; E: The expression level of TXN in lesional and non-lesional sites of UC patients; F: Heat map of the correlation between TXN and hub genes in lesional sites. Blue represents positive correlation, red represents negative correlation, and the darker the color represents the two stronger correlation. Lesional (n = 75), non-lesional (n = 44), |
以上基因也在文献中被报道与UC的发生发展密切相关。TNF-α、IL-6、IL-1β、IL-8等是由活化的单核-巨噬细胞和淋巴细胞所分泌的促炎细胞因子, 参与了肠黏膜炎症反应的起始和发展过程, 血清中的IL-6和IL-8反映了UC患者的疾病活动性[13]。黏附因子CD44、ICAM1、VCAM1通过介导细胞间的黏附、细胞与基质间的黏附和促进淋巴细胞归巢等作用参与UC的发病过程, VCAM-1与ICAM1介导白细胞募集到发炎的结肠[14]。MMP9与FN1参与UC中的黏膜损伤和修复, 粪便中的MMP9可以作为一种鉴别诊断UC的标志物[15]。CD40/CD40L相互作用激活与炎症相关的免疫细胞和非免疫细胞中的各种途径, 并被证明对IBD的发展至关重要, 肠炎症黏膜中CD40+和CD40L+细胞数量显著增加, 分别为B细胞/巨噬细胞和CD4+ T细胞, 肠固有层T细胞诱导单核细胞产生促炎细胞因子的过程依赖于CD40L[16]。
在数据集中, 相对于非炎症部位, 炎症部位中TXN有着显著的下调(图 6E)。对炎症部位样本中的TXN基因与筛选出的20个枢纽基因做Spearman相关性分析, 发现TXN的表达与CD40的表达呈现出显著的负相关(P < 0.01), 与FN1的表达呈现出显著的正相关(P < 0.01) (图 6F)。
讨论TXN系统蛋白的表达已被发现在许多疾病中发生改变, 包括癌症、糖尿病、心血管和神经退行性疾病或类风湿性关节炎[17]。也有一些应用重组TXN进行治疗的研究, 如发现rhTXN通过抑制小鼠趋化因子的表达和白细胞趋化性来改善肌凝蛋白诱导的自身免疫性心肌炎[18]; rhTXN可降低小鼠中与年龄相关的高血压[19]; rhTXN可防止促炎细胞因子或博莱霉素诱导的肺损伤等[20]。由于重组TXN在疾病治疗方面的潜力, 因此通过简便易行的方式获得具有活性的重组TXN至关重要。本研究先利用基因工程技术构建重组质粒, 在大肠杆菌中表达和纯化人源的TXN。而对于载体的选择, 一开始选择了pET系列载体, 然而却发现不能正常诱导TXN的表达。在多次尝试之后选择了pCold TF载体, 该载体所具有的TF是一种原核的核糖体结合伴侣蛋白质, 能够促进新生肽链的翻译折叠, 并且可以利用HRV 3C酶将其剪切。对于纯化后的rhTXN的活性检测, 利用了其还原状态下具有二硫键还原酶的特性, 采用胰岛素还原法检测了其活性。
本文利用3% DSS诱导的结肠炎小鼠模型研究了纯化的rhTXN的治疗效果。DSS是化学诱导UC最佳的药物, 给予DSS的小鼠表现出体重减轻和粪便松散或腹泻的症状, 有时还伴有直肠出血的迹象。在解剖小鼠取结肠观察后, 可以发现明显的结肠充血和缩短。而rhTXN治疗组小鼠从体重变化、结肠长度和完整性及结肠HE染色切片的评估上均优于DSS组, 其中100 μg·kg-1具有最佳的治疗效果, 与infliximab在10 mg·kg-1的剂量下效果相当。rhTXN在1 mg·kg-1时的疗效不及100 μg·kg-1, 有可能是因为高剂量的蛋白所带来的不良反应, 后续将继续摸索最适的剂量范围。为了验证rhTXN对UC的靶向性, 纯化带有荧光标签的rhTXN-mCherry, 利用活体成像技术, 确定了rhTXN靶向定位结肠的作用, 为溃疡性结肠炎的治疗提出了一个新的可能靶点。
在验证了rhTXN在DSS小鼠模型上的疗效和结肠靶向性后, 为了研究TXN基因在UC患者中的表达水平和与枢纽基因的相关性, 在GEO数据库中, 选择了数据集GSE107499, 筛选出20个枢纽基因, 发现TXN在UC患者炎症部位有显著下调, 并且TXN的表达与FN1的表达呈现出极显著的正相关, 与CD40的表达呈现极显著的负相关。
纤连蛋白1 (FN1) 本身是促进伤口损伤修复的重要蛋白, 在活动性UC患者中纤连蛋白显著高表达[21], 而TXN的相互作用蛋白TXNIP则参与了介导着纤连蛋白的分泌[22], 这可能是TXN与FN1在表达上呈正相关的原因。CD40是一种与T细胞和B细胞功能有关的表面抗原, 是肿瘤坏死因子受体超家族(TNFRSF) 的成员。CD40通过与其同源配体CD40L的连接产生细胞内信号并产生表面和分泌分子, 影响体液和细胞免疫, 并最终影响炎症。在UC中CD40/CD40L系统被激活, CD40的过表达与疾病活动成正比[23], 结肠组织中CD40L+单核细胞显著增加[24], 肠上皮细胞的促炎功能依赖于CD40的分泌和调节[25]。由于CD40/C040L系统的激活在免疫反应的启动和放大的重要性, 针对CD40/CD40L通路的一些抗体已经在克罗恩病、系统性红斑狼疮和原发免疫性血小板减少症等自身免疫性疾病上进行临床试验并展现出初步的疗效[26-28]。
氧化应激是UC的一个发病特征[29], CD40/CD40L也与氧化应激密切相关。CD40参与了小鼠B淋巴细胞活性氧中间体的产生[30]; 人重组CD40L通过CD40的激活增加氧化应激来抑制内皮细胞迁移[31]; CD40/CD40L缺陷小鼠消除了高胆固醇血症诱导的氧化应激[32]; 在人膀胱癌细胞和人结肠癌细胞中, CD40介导的细胞凋亡伴随着ROS释放和下调的硫氧还蛋白[33]。而重组TXN蛋白具有氧化还原的能力, 通过维持Treg表面硫醇的数量, 从而增加Treg对氧化应激的耐受性[34]。使用重组TXN可以在大鼠肺移植时抑制CD40+树突状细胞, 增加免疫耐受性[35]。以上结果提示, 在UC患者炎症部位, TXN与CD40在表达上的负相关性可能与氧化应激相关, 为重组人硫氧还蛋白在溃疡性结肠炎中的应用和更深入的机制研究奠定了基础。
作者贡献: 华子春进行项目设计、总体规划和实验方案审核及评估; 刘兴负责实验设计和指导实验研究; 周露露进行具体实验、数据分析和文章撰写; 丁杨帮助统计学分析; 林琳提供实验试剂; 华子春和刘兴完成了稿件修改。
利益冲突: 本文的研究内容不涉及任何利益冲突。
| [1] |
Abraham C, Cho JH. Inflammatory bowel disease[J]. N Engl J Med, 2009, 361: 2066-2078. DOI:10.1056/NEJMra0804647 |
| [2] |
Kaplan GG. The global burden of IBD: from 2015 to 2025[J]. Nat Rev Gastroenterol Hepatol, 2015, 12: 720-727. DOI:10.1038/nrgastro.2015.150 |
| [3] |
Pereira C, Gracio D, Teixeira JP, et al. Oxidative stress and DNA damage: implications in inflammatory bowel disease[J]. Inflamm Bowel Dis, 2015, 21: 2403-2417. |
| [4] |
Tao ZP, Long Y, Li CW, et al. Role of gut microbiota in the treatment of ulcerative colitis with traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 391-401. |
| [5] |
Danese S, Vuitton L, Peyrin-Biroulet L. Biologic agents for IBD: practical insights[J]. Nat Rev Gastroenterol Hepatol, 2015, 12: 537-545. DOI:10.1038/nrgastro.2015.135 |
| [6] |
Li M, Miao JZ, Xu S. Recent advances in research and development of new small molecule immunosuppressants for inflammatory bowel disease[J]. Acta Pharm Sin (药学学报), 2018, 53: 1289-1301. |
| [7] |
Nakamura H, Matsuda M, Furuke K, et al. Adult T cell leukemia-derived factor/human thioredoxin protects endothelial F-2 cell injury caused by activated neutrophils or hydrogen peroxide[J]. Immunol Lett, 1994, 42: 75-80. DOI:10.1016/0165-2478(94)90038-8 |
| [8] |
Holmgren A, Lu J. Thioredoxin and thioredoxin reductase: current research with special reference to human disease[J]. Biochem Biophys Res Commun, 2010, 396: 120-124. DOI:10.1016/j.bbrc.2010.03.083 |
| [9] |
Saitoh M, Nishitoh H, Fujii M, et al. Mammalian thioredoxin is a direct inhibitor of apoptosis signal-regulating kinase (ASK) 1[J]. EMBO J, 1998, 17: 2596-2606. DOI:10.1093/emboj/17.9.2596 |
| [10] |
Watanabe R, Nakamura H, Masutani H, et al. Anti-oxidative, anti-cancer and anti-inflammatory actions by thioredoxin 1 and thioredoxin-binding protein-2[J]. Pharmacol Ther, 2010, 127: 261-270. DOI:10.1016/j.pharmthera.2010.04.004 |
| [11] |
Takahashi Y, Masuda H, Ishii Y, et al. Decreased expression of thioredoxin interacting protein mRNA in inflamed colonic mucosa in patients with ulcerative colitis[J]. Oncol Rep, 2007, 18: 531. |
| [12] |
Jaeger S, Beisner J, Schroeder B, et al. Reduced thioredoxin-1 (TRX) expression might compromise luminal innate immunity in colonic inflammatory bowel diseases[J]. Gastroenterology, 2011, 148: S-495-S-496. |
| [13] |
Umehara Y, Kudo M, Nakaoka R, et al. Serum proinflammatory cytokines and adhesion molecules in ulcerative colitis[J]. Hepatogastroenterology, 2006, 53: 879-882. |
| [14] |
Thomas S, Baumgart DC. Targeting leukocyte migration and adhesion in Crohn's disease and ulcerative colitis[J]. Inflammopharmacology, 2012, 20: 1-18. DOI:10.1007/s10787-011-0104-6 |
| [15] |
Annaházi A, Molnár T, Farkas K, et al. Fecal MMP-9: a new noninvasive differential diagnostic and activity marker in ulcerative colitis[J]. Inflamm Bowel Dis, 2013, 19: 316-320. DOI:10.1002/ibd.22996 |
| [16] |
Liu Z, Colpaert S, D'haens G, et al. Hyperexpression of CD40 ligand and its role in pathogenic cytokine producton in inflammatory bowel disease[J]. Acta Gastro-Enterologica Belgica, 1999, 163: 4049. |
| [17] |
Lillig CH, Holmgren A. Thioredoxin and related molecules-from biology to health and disease[J]. Antioxid Redox Signal, 2007, 9: 25-47. DOI:10.1089/ars.2007.9.25 |
| [18] |
Liu W, Nakamura H, Shioji K, et al. Thioredoxin-1 ameliorates myosin-induced autoimmune myocarditis by suppressing chemokine expressions and leukocyte chemotaxis in mice[J]. Circulation, 2004, 110: 1276-1283. DOI:10.1161/01.CIR.0000141803.41217.B6 |
| [19] |
Hilgers RH, Kundumani-Sridharan V, Subramani J, et al. Thioredoxin reverses age-related hypertension by chronically improving vascular redox and restoring eNOS function[J]. Sci Transl Med, 2017, 9: eaaf6094. DOI:10.1126/scitranslmed.aaf6094 |
| [20] |
Hoshino T, Nakamura H, Okamoto M, et al. Redox-active protein thioredoxin prevents proinflammatory cytokine- or bleomycin-induced lung injury[J]. Am J Respir Crit Care Med, 2003, 168: 1075-1083. DOI:10.1164/rccm.200209-982OC |
| [21] |
Ippolito C, Colucci R, Segnani C, et al. Fibrotic and vascular remodelling of colonic wall in patients with active ulcerative colitis[J]. J Crohns Colitis, 2016, 10: 1194-1204. DOI:10.1093/ecco-jcc/jjw076 |
| [22] |
Perrone L, Devi TS, Hosoya KI, et al. Inhibition of TXNIP expression in vivo blocks early pathologies of diabetic retinopathy[J]. Cell Death Dis, 2010, 1: e65. DOI:10.1038/cddis.2010.42 |
| [23] |
Polese L, Angriman I, Cecchetto A, et al. The role of CD40 in ulcerative colitis: histochemical analysis and clinical correlation[J]. Eur J Gastroenterol Hepatol, 2002, 14: 237-241. DOI:10.1097/00042737-200203000-00006 |
| [24] |
Liu Z, Colpaert S, D'haens GR, et al. Hyperexpression of CD40 ligand (CD154) in inflammatory bowel disease and its contribution to pathogenic cytokine production[J]. J Immunol, 1999, 163: 4049-4057. |
| [25] |
Borcherding F, Nitschke M, Hundorfean G, et al. The CD40-CD40L pathway contributes to the proinflammatory function of intestinal epithelial cells in inflammatory bowel disease[J]. Am J Pathol, 2010, 176: 1816-1827. DOI:10.2353/ajpath.2010.090461 |
| [26] |
Kasran A, Boon L, Wortel CH, et al. Safety and tolerability of antagonist anti-human CD40 Mab ch5D12 in patients with mode-rate to severe Crohn's disease[J]. Aliment Pharmacol Ther, 2005, 22: 111-122. DOI:10.1111/j.1365-2036.2005.02526.x |
| [27] |
Chamberlain C, Colman PJ, Ranger AM, et al. Repeated administration of dapirolizumab pegol in a randomised phase I study is well tolerated and accompanied by improvements in several composite measures of systemic lupus erythematosus disease activity and changes in whole blood transcriptomic profiles[J]. Ann Rheum Dis, 2017, 76: 1837-1844. DOI:10.1136/annrheumdis-2017-211388 |
| [28] |
Kuwana M, Nomura S, Fujimura K, et al. Effect of a single injection of humanized anti-CD154 monoclonal antibody on the platelet-specific autoimmune response in patients with immune thrombocytopenic purpura[J]. Blood, 2004, 103: 1229-1236. |
| [29] |
Kruidenier L, Verspaget HW. Review article: oxidative stress as a pathogenic factor in inflammatory bowel disease-radicals or ridiculous?[J]. Aliment Pharmacol Ther, 2002, 16: 1997-2015. DOI:10.1046/j.1365-2036.2002.01378.x |
| [30] |
Lee JR, Koretzky GA. Production of reactive oxygen intermediates following CD40 ligation correlates with c-Jun N-terminal kinase activation and IL-6 secretion in murine B lymphocytes[J]. Eur J Immunol, 2015, 28: 4188-4197. |
| [31] |
Urbich C, Dernbach E, Aicher A, et al. CD40 ligand inhibits endothelial cell migration by increasing production of endothelial reactive oxygen species[J]. Circulation, 2002, 106: 981-986. DOI:10.1161/01.CIR.0000027107.54614.1A |
| [32] |
Stokes KY, Calahan LS, Hamric CM, et al. CD40/CD40L contributes to hypercholesterolemia-induced microvascular inflammation[J]. Am J Physiol Heart Circ Physiol, 2009, 65: H689-H697. |
| [33] |
Dunnill CJ, Ibraheem K, Mohamed A, et al. A redox state-dictated signalling pathway deciphers the malignant cell specificity of CD40-mediated apoptosis[J]. Oncogene, 2017, 36: 2515-2528. DOI:10.1038/onc.2016.401 |
| [34] |
Mougiakakos D, Johansson CC, Jitschin R, et al. Increased thioredoxin-1 production in human naturally occurring regulatory T cells confers enhanced tolerance to oxidative stress[J]. Blood, 2011, 117: 857-861. DOI:10.1182/blood-2010-09-307041 |
| [35] |
Hu H, Patel JM. Thioredoxin-1 priming: a novel strategy to induce tolerance in a rat model of lung transplantation[J]. J Heart Lung Transplant, 2014, 33: S259. |
 2022, Vol. 57
2022, Vol. 57


