2. 扬州大学, 江苏省人兽共患病重点实验室, 江苏 扬州 225009;
3. 中国医学科学院、北京协和医学院医药生物技术研究所, 中国医学科学院抗病毒药物研究重点实验室, 北京 100050;
4. 亿帆医药股份有限公司, 浙江 杭州 310000
2. Jiangsu Key Laboratory of Zoonosis, Yangzhou University, Yangzhou 225009, China;
3. CAMS Key Laboratory of Antiviral Drug Research, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
4. Yifan Pharmaceutical Co., Ltd., Hangzhou 310000, China
冠状病毒(coronavirus, CoV) 是一种具有囊膜的正链RNA病毒, 因其囊膜表面的棒状凸起形如花冠, 故名冠状病毒[1]。根据血清学特性和遗传学差异, 冠状病毒主要分为α、β、γ和δ属, 其中β属中的严重急性呼吸系统综合征冠状病毒(severe acute respiratory syndrome corona-virus, SARS-CoV)、中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus, MERS-CoV) 和2019新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2) 均能引起严重的呼吸系统疾病[2, 3]。如2002年11月突然出现在我国南方SARS-CoV, 曾导致8 000多人感染, 数百人死亡[4]; 2012年6月中东沙特阿拉伯首次暴发的MERS-CoV迄今全球确诊病例已超2 000例[5]; 2019年12月由SARS-CoV-2感染引起的新型冠状病毒肺炎(coronavirus disease 2019, COVID-19) 流行至今, 已致全球近4.5亿多人感染, 600多万人死亡[6, 7]。针对此类冠状病毒引起的急性传染性疾病, 尤其是由其感染引起的急性肺损伤并发急性呼吸窘迫综合征(acute respiratory distress syndromes, ARDS)[8, 9], 虽然有一些治疗选择, 但仍然缺乏有效的治疗药物。因此, 开展抗新冠病毒创新药物的研发迫在眉睫。
目前, 针对病毒聚合酶保守靶点的抗新冠病毒药物如remdesvir、molnupiravir (EIDD-2801)、paxlovid、AT-527和VV116等已经进入II/III期临床研究, 初步结果显示此类药物早期预防给药或对轻症具有一定疗效[10-13]。此外, 针对新冠病毒的抗体生物制剂也可降低新冠肺炎患者的住院率和死亡率[14, 15]。但上述药物针对新冠病毒引起的过激炎症因子风暴导致的重症疗效有限。与靶向抗病毒西药研发策略不同, 中医将呼吸道病毒感染引起的传染性疾病统称为“时行瘟疫”, 并经过长期的发展逐渐形成了较为完善的辨证论治体系[16]。对于此类外感风邪的温病, 中医理论以疏风解表、清热宣肺为主, 同时扶正祛邪, 因此多以清热解毒类中药为主, 其中银翘散就是经典的清热解毒类方剂。此类方剂因其具有多成分、多靶点的综合药效优势, 不仅可直接抑制病毒复制, 而且可有效缓解相关症状和抑制过激的炎症因子风暴引起的次级损伤。我国的临床实践表明, 来源于上述的中药方剂对新冠病毒肺炎均具有一定的防治效果。复方银花解毒方(FFYH) 就是从经典“银翘散”加减优化而来, 由青蒿、山银花、连翘、荆芥、薄荷、野菊花、大青叶、鸭跖草、前胡和淡豆豉组成, 现已广泛应用于临床治疗由流感病毒等感染引起的流行性感冒, 且曾在2003年被推荐用于SARS的预防和治疗, 2020年也被推荐用于安徽省COVID-19的治疗, 但其是否具有直接抗冠状病毒的作用尚不清楚。鉴于此, 本文就FFYH抗冠状病毒的药效作用及其机制进行初步探讨, 以期为该药临床治疗冠状病毒肺炎提供理论依据。
材料与方法细胞和病毒 Huh7、Huh7.5、C3A人肝癌细胞和H460人肺癌细胞由中国医学科学院医药生物技术研究所传代保存; HCoV-229E病毒和HCoV-OC43病毒由中国医学科学院医药生物技术研究所引进复苏传代冻存。Huh7、Huh7.5及H460细胞采用含10%胎牛血清和1%青霉素和链霉素溶液(penicillin-streptomycin) 的DMEM细胞培养基培养; C3A细胞采用含10%胎牛血清和1%青霉素和链霉素溶液的MEM培养基培养。所有细胞均培养至对数生长期后才开始使用。
药物和试剂 复方银花解毒颗粒干膏粉(批号: 20190301) 由天长亿帆制药有限公司提供, 用灭菌的超纯水制备100 mg·mL-1 FFYH作为储备溶液, 用0.22 µm滤器过滤除菌储存在-20 ℃冰箱用于进一步研究。为了进一步确定其成分, 依据参考文献[17]采用高效液相色谱法对其主要成分进行了检测分析, 其指纹图谱与参考文献基本一致, 主要含有新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、4, 5-二-O-咖啡酰奎宁、连翘苷A、连翘酯苷、蒙花苷和白花前胡甲素等10余种活性成分。阳性药利巴韦林注射液(ribavirin, RBV) 购自天津金耀集团湖北天药药业股份有限公司(批号31712252); DMEM、MEM细胞培养基、胎牛血清(fetal bovine serum, FBS)、青霉素和链霉素溶液、磷酸盐缓冲液(PBS) 和0.25% trypsin-EDTA均购自Invitrogen公司。
实验仪器 二氧化碳孵箱(美国Thermo公司); 生物安全柜(美国NUAIRE公司); 倒置显微镜和荧光倒置显微镜(奥林巴斯公司); 真空泵(INTEGRA Biosciences公司)。
细胞毒性测定方法 将处于对数生长期的Huh7、Huh7.5、C3A及H460细胞用胰酶消化成单个细胞后, 按照1.5×104个/孔细胞数接种到96孔板, 37 ℃培养过夜。将受试药FFYH用仅含2% FBS的DMEM培养基按3倍梯度稀释6~8个浓度后加入至细胞板中继续培养72 h, 每剂量设置3个平行孔。72 h后, 利用倒置显微镜观察各孔细胞的生长状态, 根据细胞病变效应(cell pathogenic effect, CPE) 评价标准标记各组细胞病变效应(4+, 细胞死亡比例75%~100%; 3+, 细胞死亡比例50%~75%; 2+, 细胞死亡比例25%~50%; 1+, 细胞死亡比例0~25%; 0+, 细胞全部存活), 并用Reed-Muench法[18]计算FFYH对细胞的半数毒性浓度(50% toxic concentration, TC50)。
体外药效评价测定方法 同“细胞毒性测定方法”, 将处于对数生长期的Huh7、Huh7.5及H460细胞接种细胞于96孔板中培养过夜, 待细胞丰度达到80%时, Huh7及Huh7.5细胞感染含100半数组织培养感染剂量(50% tissue culture infective dose, TCID50) 的HCoV-229E病毒[MOI (multiplicity of infection) = 0.5], H460细胞感染含100TCID50的HCoV-OC43病毒(MOI = 0.5), 同时加入含不同浓度FFYH的培养基处理48或72 h (3倍稀释, 8个剂量), 每个剂量设3个平行孔, 待病毒对照组病变达4+时观察记录结果, 计算药物对病毒的半数抑制浓度(50% inhibitory concentration, IC50) 并计算治疗指数[SI (safety index) = TC50/IC50]。
实时荧光定量qRT-PCR检测方法 将处于对数生长期的Huh7、Huh7.5、H460及C3A细胞, 分别按照2×105个/孔细胞接种到12孔培养板, 培养过夜后Huh7和Huh7.5细胞感染含100TCID50的HCoV-229E病毒(MOI = 0.5), H460和C3A细胞感染含100TCID50的HCoV-OC43病毒(MOI = 0.5), 感染同时加入含不同浓度的FFYH处理24 h后提取细胞RNA。参照TransGen Biotech公司荧光定量qRT-PCR试剂盒TransScript® II Probe One-Step qRT-PCR SuperMix及TransScript® II Green One-Step qRT-PCR SuperMix进行荧光定量PCR检测。qRT-PCR引物由上海生工生物工程(上海) 股份有限公司合成(表 1)。
| Table 1 Primers used for quantitive reverse transcription PCR (qRT-PCR). GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; NP: Nucleoprotein; IL-6: Interleukin-6; TNF-α: Tumor necrosis factor α; IL-8: Interleukin-8 |
Western blot检测方法 将处于对数生长期的H460及C3A细胞, 分别按照2×105个/孔细胞接种到12孔培养板, 过夜后感染含100TCID50的HCoV-OC43病毒(MOI = 0.5), 感染同时加入含不同浓度的FFYH处理24 h后收细胞提取蛋白质, 通过Western blot方法测定病毒核蛋白(nucleoprotein, NP) 表达水平。预防给药方案为H460细胞经FFYH预处理4 h后感染HCoV-OC43, 孵育15 min提取蛋白检测, 或感染后立即用FFYH处理, 孵育30 min, 收集细胞, 将细胞核从细胞质中分离, 然后分别提取蛋白。
免疫荧光测定方法 将处于对数生长期的C3A细胞采用同“细胞毒性测定方法”接种细胞到96孔培养板中过夜培养, 待细胞丰度达到80%时分别感染含100TCID50的HCoV-OC43病毒(MOI = 0.5), 感染同时加入含不同浓度的FFYH处理24 h后弃去培养基, 将培养板中处理好的细胞用预冷的PBS洗涤3次, 每次3 min。加入4%多聚甲醛室温孵育15 min固定, 固定结束后, 用预冷的PBS洗涤3次, 每次5 min。加入含0.5% Triton X-100的PBS室温孵育透化1 h, 透化结束后PBS洗涤3次, 每次5 min。加入含1%牛血清白蛋白(bovine albumin, BSA) 的TBST室温封闭1 h; 加入识别病毒NP蛋白的一抗4 ℃孵育过夜; 次日恢复室温后PBST洗涤3次, 每次5 min; 加入荧光二抗, 室温避光孵育1 h, PBST洗3次, 每次5 min。加入Hoechst 33342室温孵育10~30 min, 荧光显微镜拍照。
统计学方法 采用GraphPad 7.0分析实验数据, 且所有实验结果均以平均值±标准差(
为了确定FFYH的体外细胞毒性及其是否具有抗冠状病毒活性, 本研究首先采用CPE法对FFYH在Huh7、Huh7.5、H460及C3A细胞上的细胞毒性及其对冠状病毒HCoV-229E感染的Huh7、Huh7.5细胞和冠状病毒HCoV-OC43感染的H460细胞的抑制作用进行观察。如表 2所示, 在药物安全剂量条件下的Huh7细胞和Huh7.5细胞模型中, FFYH抗冠状病毒HCoV-229E的IC50分别为438.16 ± 166.04 µg·mL-1和238.54 ± 118.53 µg·mL-1, SI分别为4.64和21.99; 在H460细胞模型中FFYH抗冠状病毒HCoV-OC43的IC50为165.13 ± 28.37 µg·mL-1, SI为17.78。从以上结果可以看出, FFYH在Huh7、Huh7.5和H460的SI指数均大于2, 不属于美国FDA定义的窄治疗指数药物[19], 表明其具有较好的安全性。综上, 体外CPE药效研究结果表明FFYH在不同细胞模型中均对冠状病毒HCoV-229E和HCoV-OC43具有较好的抑制活性。
| Table 2 Antiviral effect of Fufang yinhua jiedu (FFYH) against coronavirus. TC50: 50% toxic concentration; TCID50: 50% tissue culture infective dose; IC50: 50% inhibitory concentration; SI: Safety index; N/A: Absence of cell pathogenic effect (CPE) in C3A cell infected with HCoV-OC43; RBV: Ribavirin |
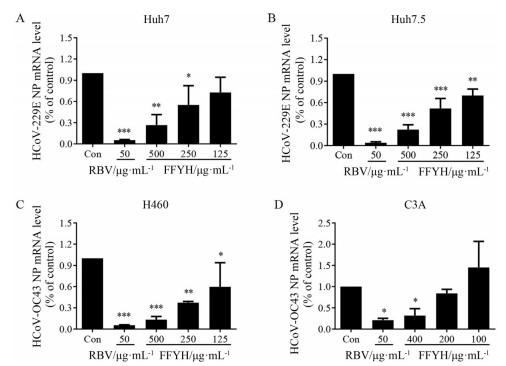
为了探究FFYH抗冠状病毒的作用机制, 本研究首先在冠状病毒HCoV-229E感染的Huh7和Huh7.5两种细胞模型中对FFYH抑制冠状病毒RNA复制的作用进行了研究。结果如图 1A和B所示, 在Huh7与Huh7.5细胞模型中, FFYH均能剂量依赖性地抑制HCoV-229E病毒NP基因的复制, 其500 µg·mL-1时对HCoV-229E NP基因的RNA复制抑制率超过70%, 提示FFYH可抑制冠状病毒HCoV-229E RNA的复制。为了进一步确证上述结果, 在冠状病毒HCoV-OC43感染H460和C3A细胞的两种模型中, 对FFYH抑制冠状病毒RNA复制的作用再次进行了验证。结果如图 1C和D所示, 在这两种细胞模型中FFYH也能剂量依赖性地抑制HCoV-OC43病毒核蛋白基因NP的复制, 再次表明FFYH可抑制冠状病毒RNA的复制。
|
Figure 1 Inhibitory effect of FFYH on the transcription of coronavirus RNA. Huh7 (A) or Huh7.5 (B) cells infected with HCoV-229E, and H460 (C) or C3A (D) cells infected with HCoV-OC43 were treated with the indicated concentrations of FFYH for 24 h with RBV as the positive drug. Viral RNA was extracted and quantified by qRT-PCR |
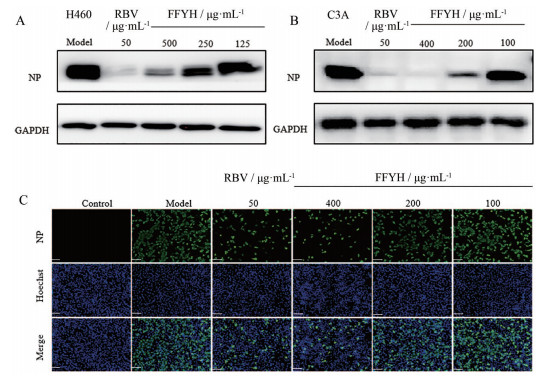
鉴于前述结果证实FFYH可抑制冠状病毒RNA的复制, 理论上推测FFYH可能对RNA复制形成的病毒蛋白表达有影响。为验证上述推测, 本研究以HCoV-OC43分别感染H460和C3A细胞为体外模型, 采用Western blot法对FFYH抑制冠状病毒蛋白表达的作用进行了分析。结果如图 2A和B所示, 在HCoV-OC43感染H460和C3A细胞模型中, FFYH均能剂量依赖性地抑制HCoV-OC43病毒核蛋白NP的表达。为了确证上述结果, 本研究采用免疫荧光染色方法在HCoV-OC43感染的C3A细胞模型中对FFYH抑制HCoV-OC43核蛋白NP表达的作用进行了验证。结果如图 2C所示, FFYH能剂量依赖性降低表达NP蛋白阳性细胞的数量, 这与Western blot检测结果完全一致, 表明FFYH具有抑制冠状病毒蛋白表达的药效作用。
|
Figure 2 Inhibitory effect of FFYH on the expression of coronavirus protein. H460 (A) and C3A (B) cells were infected with HCoV-OC43 and treated with FFYH for 48 h or 24 h incubation, the expression level of HCoV-OC43 NP protein were determined by Western blot (A and B) or immunofluorescence staining (C). Representative pictures were photographed (200×). Scale bar: 20 μm |
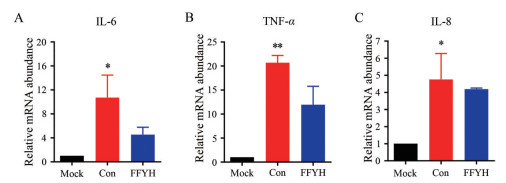
冠状病毒感染诱发的机体过激炎症反应在其感染引起的急性肺损伤中扮演关键作用。鉴于前述结果证实FFYH具有较好的抗冠状病毒活性, 本研究采用qRT-PCR方法对FFYH是否具有抑制冠状病毒感染所致炎症因子释放进行了探讨。结果如图 3所示, 与正常对照组相比, HCoV-OC43感染的H460细胞内炎症因子IL-6、IL-8、TNF-α的mRNA水平显著上调, 而FFYH可有效抑制上述炎症因子mRNA的复制表达, 尤其是对介导冠状病毒病理损伤的关键炎症因子IL-6和TNF-α的抑制作用尤为显著, 提示FFYH可有效抑制冠状病毒感染引起的炎症因子表达。但FFYH是直接通过靶向抑制还是通过抑制冠状病毒的复制间接抑制了上述炎症因子的表达或者是通过两种机制协同抑制炎症因子产生从而发挥抗炎效应还有待深入探讨。
|
Figure 3 Inhibitory effect of FFYH on inflammatory factors caused by HCoV-OC43. H460 cell was pre-treated with FFYH for 4 h and infected with HCoV-OC43, and then incubated for 24 h, inflammatory factors IL-6 (A), TNF-α (B) and IL-8 (C) mRNA levels were determined by qRT-PCR |
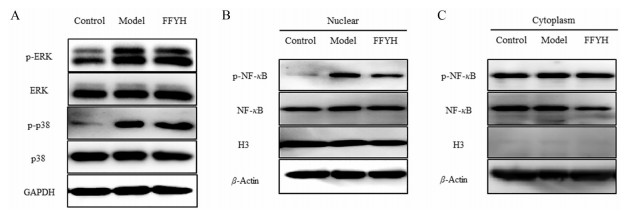
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 信号通路是进化过程中保守的丝氨酸/苏氨酸信号通路, 可通过调控多种细胞内生理活动(如免疫调控、凋亡等) 来应对外界刺激[20]。有研究报道, MAPK信号通路的组分之一的胞外信号调控激酶(extracellular signal-regulated kinase, ERK)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK) 及c-jun N末端激酶(c-jun N-terminal kinase, JNK) 在多种冠状病毒(如SARS-CoV、SARS-CoV-2等) 感染的细胞中均处于激活状态。因此, 本研究采用冠状病毒HCoV-OC43感染H460细胞对其MAPK通路相关蛋白的表达进行了检测, 结果表明p38 MAPK及ERK蛋白在感染HCoV-OC43后磷酸化活化水平均显著上调, 而FFYH预防给药可有效抑制p-p38 MAPK的表达, 而对p-ERK的表达无明显抑制效应, 提示FFYH可能通过抑制p-p38 MAPK的磷酸化而非p-ERK的磷酸化, 发挥其抑制冠状病毒复制的药效作用(图 4A)。除MAPK信号通路外, 核转录因子κB (nuclear transcription factor-κB, NF-κB) 通路在病原微生物入侵过程中扮演重要作用。有研究发现在感染SARS-CoV小鼠的肺组织中NF-κB活化水平显著提升。此外, 在HCoV-229E感染的外周血单个核细胞(peripheral blood mononuclear cell, PBMC) 细胞模型中也观察到NF-κB参与调控IL-8的表达, 表明NF-κB通路在冠状病毒感染过程中也发挥着重要的调控作用[21]。因此, 本研究对FFYH是否具有抑制HCoV-OC43感染所致NF-κB的转录活化水平进行了检测, 结果表明与正常对照组相比, HCoV-OC43病毒感染可促进NF-κB磷酸化水平与入核, 而FFYH处理能显著抑制NF-κB的磷酸化, 降低其入核水平, 在500 µg·mL-1浓度时具有显著的抑制效应(图 4B、C)。以上结果表明, FFYH有可能通过抑制NF-κB活性而发挥其抗冠状病毒的药效作用。鉴于NF-κB信号通路的活化与调节是一个精细而复杂的过程, 在炎症反应、免疫应答及凋亡中都发挥重要作用, 因此仍需要更进一步实验以阐述药物与NF-κB信号通路之间的内在联系。
|
Figure 4 Inhibitory effect of FFYH on the activation of mitogen-activated protein kinase (MAPK) and nuclear transcription factor-κB (NF-κB) pathways caused by HCoV-OC43. H460 cell was pre-treated with FFYH for 4 h and infected with HCoV-OC43, extracellular signal-regulated kinase (ERK/p-ERK) and p38 mitogen-activated protein kinase (p38/p-p38) (A) were examined by Western blot. H460 cell was infected with HCoV-OC43 and treated with FFYH for 30 min, cells were collected and the nuclear and cytoplasm was separated and NF-κB/p-NF-κB in nuclear (B) and cytoplasm (C) were examined by Western blot |
近20年来以冠状病毒SARS-CoV、MERS-CoV、SARS-CoV-2为代表的新型呼吸道病毒性传染病给人类的健康带来了极大的威胁[22], 尤其是2019年暴发的COVID-19流行至今, 仍未得到有效控制。虽然疫苗是防控此类疾病的有效手段, 但由于冠状病毒易快速突变而导致疫苗失效。因此, 药物治疗是人类防控呼吸道传染病的必要手段。然而针对此类冠状病毒感染引起的呼吸道传染病的有效治疗药物有限, 不能满足临床需求。而我国的临床实践表明, 基于临床病症的中药复方治疗此类疾病具有明确临床疗效。由冠状病毒引起的呼吸道传染病属于古代中医认定的外感“疫病”范畴, 治疗多以清热解毒为主, 如治疗新冠病毒肺炎的“三方三药”基本都是清热解毒类中药组成的方剂[23]。本文的研究对象FFYH也是清热解毒类代表性方剂银翘散优化而来, 方中山银花、连翘为君药, 疏散风热、清热解毒; 薄荷、青蒿、淡豆豉和荆芥为臣药, 解表散邪、清利头目、解毒利咽; 野菊花、大青叶和鸭跖草为佐药, 清热解毒、泻火、凉血消斑[24, 25], 临床主要用于治疗上呼吸道感染与流行性感冒风热证。本课题组前期研究发现, 此方对流感病毒性肺炎有很好保护效应, 但其是否具有抗冠状病毒作用尚不清楚。本研究发现FFYH不仅具有直接抑制冠状病毒复制的作用, 而且可有效抑制此类病毒感染引起的炎症因子表达, 其机制可能与抑制冠状病毒的RNA复制和蛋白表达及抑制MAPK信号通路降低炎症因子表达有关。现代药理学研究也表明, 此方中的许多活性化合物具有抗炎、抗病毒和抗氧化等作用[26], 如山银花中绿原酸、槲皮素、山柰酚和木犀草苷可以通过降低IL-6、IL-8和TNF-α等炎症因子的释放来改善肺部炎症[27, 28]; 连翘中连翘酯苷A、连翘脂素、牛蒡子苷具有免疫调节作用, 可以通过诱生干扰素-α起到抑制MAPK通路[29, 30]; 青蒿中青蒿素、蒿甲醚、蒿乙醚等衍生物具有抗炎、免疫调节、抗肺纤维化、抗菌和抗病毒作用, 其中青蒿素可通过干扰早期蛋白和NF-κB途径来抑制冠状病毒复制[31-33], 这些以往研究结果也提示FFYH可能通过上述类似机制发挥抗冠状病毒的作用。
大量的药理学研究证实, 冠状病毒在宿主中的复制和致病都必须依靠激活MAPK信号通路[34], 该通路被激活后将促使炎症因子的分泌量增加, 从而加剧炎症反应[35]。基于这个致病机制, 发现FFYH处理后能显著抑制p38 MAPK的磷酸化, 降低NF-κB入核水平, 抑制IL-6、IL-8、TNF-α的炎症因子mRNA水平上调。因此推测FFYH可能是通过抑制MAPK信号通路, 来阻止病毒的复制, 从而降低宿主体内炎症因子的水平, 而发挥其抗冠状病毒的药效作用。
综上, 根据中药多成分、多靶点及多药效的特点猜测FFYH具有潜在的抗冠状病毒的作用, 这为其临床用于抗新冠病毒肺炎的治疗提供了理论依据, 但还需对其体内抗病毒作用的机制进行深入研究, 为其提供理论支撑。
作者贡献: 郑志慧、王琨和卫海琳主要负责实验数据的收集与整理及初稿的撰写; 王雯蕾和吴建雄负责药物的提取、制备及质控分析; 王荣花和苏勤协助实验数据的收集与样本的制备; 李玉环与张评浒主要负责实验设计与方案及文稿的撰写与审阅。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Fung TS, Liu DX. Coronavirus infection, ER stress, apoptosis and innate immunity[J]. Front Microbiol, 2014, 5: 296. |
| [2] |
Woo PC, Lau SK, Huang Y, et al. Coronavirus diversity, phylogeny and interspecies jumping[J]. Exp Biol Med, 2009, 234: 1117-1127. DOI:10.3181/0903-MR-94 |
| [3] |
Wang RH, Zheng ZH, Zhang YQ, et al. Progress of research on immune escape mechanism of coronavirus[J]. J China Pharm Univ (中国药科大学学报), 2021, 52: 1-9. |
| [4] |
Miller K, Mcgrath ME, Hu Z, et al. Coronavirus interactions with the cellular autophagy machinery[J]. Autophagy, 2020, 16: 2131-2139. DOI:10.1080/15548627.2020.1817280 |
| [5] |
Chen X, Han W, Wang G, et al. Application prospect of polysaccharides in the development of anti-novel coronavirus drugs and vaccines[J]. Int J Biol Macromol, 2020, 164: 331-343. DOI:10.1016/j.ijbiomac.2020.07.106 |
| [6] |
Shyr ZA, Gorshkov K, Chen CZ, et al. Drug discovery strategies for SARS-CoV-2[J]. J Pharmacol Exp Ther, 2020, 375: 127-138. DOI:10.1124/jpet.120.000123 |
| [7] |
Zhang YQ, Wang RH, Chen X, et al. Research progress of TLR-4 signaling pathway mediated acute lung injury and ARDS caused by viral infection[J]. Chin J Virol (病毒学报), 2021, 37: 1234-1243. |
| [8] |
Heng ZP, Qi T, Xu SY, et al. A comparative study of acute lung injury induced by lipopolysaccharide tracheal instillation or cecal ligation and puncture in mice[J]. J Yangzhou Univ (Agricult life Sci Ed) (扬州大学学报(农业与生命科学版)), 2021, 42: 39-44. |
| [9] |
McCreary EK, Angus DC. Efficacy of remdesivir in COVID-19[J]. JAMA, 2020, 324: 1041-1042. DOI:10.1001/jama.2020.16337 |
| [10] |
Cox RM, Wolf JD, Plemper RK. Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV-2 transmission in ferrets[J]. Nat Microbiol, 2021, 6: 11-18. DOI:10.1038/s41564-020-00835-2 |
| [11] |
Good SS, Westover J, Jung KH, et al. AT-527, a double prodrug of a guanosine nucleotide analog, is a potent inhibitor of SARS-CoV-2 in vitro and a promising oral antiviral for treatment of COVID-19[J]. Antimicrob Agents Chemother, 2021, 65: e02479-20. |
| [12] |
Xie Y, Yin W, Zhang Y, et al. Design and development of an oral remdesivir derivative VV116 against SARS-CoV-2[J]. Cell Res, 2021, 31: 1212-1214. DOI:10.1038/s41422-021-00570-1 |
| [13] |
Wang Z, Yang L. In the age of Omicron variant: paxlovid raises new hopes of COVID-19 recovery[J]. J Med Virol, 2021. DOI:10.1002/jmv.27540 |
| [14] |
Becker RC. COVID-19 update: Covid-19-associated coagulo-pathy[J]. J Thromb Thrombolysis, 2020, 50: 54-67. DOI:10.1007/s11239-020-02134-3 |
| [15] |
Favalli EG, Ingegnoli F, De Lucia O, et al. COVID-19 infection and rheumatoid arthritis: faraway, so close![J]. Autoimmun Rev, 2020, 19: 102523. DOI:10.1016/j.autrev.2020.102523 |
| [16] |
Zhang YQ, Wang RH, Shi WQ, et al. Antiviral effect of Fufang yinhua jiedu (FFYH) granules against influenza A virus through regulating the inflammatory responses by TLR7/MyD88 signaling pathway[J]. J Ethnopharmacol, 2021, 275: 114063. DOI:10.1016/j.jep.2021.114063 |
| [17] |
Westover JB, Ferrer G, Vazquez H, et al. In vitro virucidal effect of intranasally delivered chlorpheniramine maleate compound against severe acute respiratory syndrome coronavirus 2[J]. Cureus, 2020, 12: e10501. |
| [18] |
Wang J, Sun k, Zheng H, et al. Effects of DON, ZEA and their combination on T lymphocyte activation and MAPK signaling pathway in mice[J]. J Yangzhou Univ (Agricult life Sci Ed) (扬州大学学报(农业与生命科学版)), 2020, 41: 7-15. |
| [19] |
Liu D, Han HC, Wang J. Consideration of in vivo bioequivalence research for narrow therapeutic index drugs[J]. Drug Eval Res (药物评价研究), 2021, 44: 2262-2267. |
| [20] |
Lu L, Cai GD, Sun K, et al. Effects of zearalenone on the ultrastructure and NFAT, NF-κB signaling pathway during T lymphocyte activation in mice[J]. J Yangzhou Univ (Agricult life Sci Ed) (扬州大学学报(农业与生命科学版)), 2019, 40: 33-39. |
| [21] |
Shereen MA, Khan S, Kazmi A, et al. COVID-19 infection: origin, transmission, and characteristics of human coronaviruses[J]. J Adv Res, 2020, 24: 91-98. DOI:10.1016/j.jare.2020.03.005 |
| [22] |
Cai Y, Zeng M, Chen YZ. Staged treatment analysis of the network pharmacology based traditional Chinese medicine compound "three Chinese patent medicines, three traditional Chinese medicine formula" in the treatment of COVID-19[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2021, 23: 358-384. |
| [23] |
Yuan LC, Ma X, Zhu L, et al. Randomized controlled clinical study on the treatment of wind-heat syndrome of influenza with compound Yinhua Jiedu Granules[J]. Beijing J Tradit Chin Med (北京中医药), 2021, 40: 532-535. |
| [24] |
Xu Y, Wang S, Qin TT, et al. Anti-inflammatory effect of compound Yinhua Jiedu Granules on LPS induced acute pneumonia in juvenile rats and its effect on TLR4/NF-κB/NLRP3 signaling pathway[J]. Chin Tradit Herb Drugs (中草药), 2021, 52: 203-210. |
| [25] |
Zhang DL, He SH, Wu JX, et al. Study on the potential mechanism of Fufang Yinhua Jiedu Granules based on network pharmacology in the treatment of novel coronavirus[J]. Northwest Pharm J (西北药学杂志), 2021, 36: 568-575. |
| [26] |
Li Y, Li W, Fu C, et al. Lonicerae japonicae flos and Lonicerae flos: a systematic review of ethnopharmacology, phytochemistry and pharmacology[J]. Phytochem Rev, 2019. DOI:10.1007/s11101-019-09655-7 |
| [27] |
Peng S, Huo XQ, Huo MQ, et al. Study on efficacy markers of heat-clearing and detoxifying effect of Lonicerae Japonicae Flos based on systematic traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 3275-3281. |
| [28] |
Hu N, Wang C, Dai X, et al. Phillygenin inhibits LPS-induced activation and inflammation of LX2 cells by TLR4/MyD88/NF-κB signaling pathway[J]. J Ethnopharmacol, 2020, 248: 112361. DOI:10.1016/j.jep.2019.112361 |
| [29] |
Gong LH, Yu LY, Hu NH, et al. Advances on the anti-inflammatory material basis of Lianqiao and its action mechanism[J]. Pharm Clin Chin Mater Med (中药药理与临床), 2019, 10: 43-49. |
| [30] |
Efferth T, Marschall M, Wang X, et al. Antiviral activity of artesunate towards wild-type, recombinant, and ganciclovir-resistant human cytomegaloviruses[J]. J Mol Med, 2002, 80: 233-242. DOI:10.1007/s00109-001-0300-8 |
| [31] |
He R, Park K, Cai H, et al. Artemisinin-derived dimer diphenyl phosphate is an irreversible inhibitor of human cytomegalovirus replication[J]. Antimicrob Agents Chemother, 2012, 56: 3508-3515. DOI:10.1128/AAC.00519-12 |
| [32] |
Liu GM, Cai N, Xie J, et al. Discussion on artemisinin and its derivatives for treatment of COVID-19[J]. Drug Eval Res (药物评价研究), 2020, 43: 606-612. |
| [33] |
Younis NS. D-Limonene mitigate myocardial injury in rats through MAPK/ERK/NF-kappaB pathway inhibition[J]. Korean J Physiol Pharmacol, 2020, 24: 259-266. DOI:10.4196/kjpp.2020.24.3.259 |
| [34] |
Yang M, Wang Y, Fan Z, et al. Chemical constituents and anti-inflammatory activity of the total alkaloid extract from Melodinus cochinchinensis (Lour.) Merr. and its inhibition of the NF-κB and MAPK signaling pathways[J]. Phytomedicine, 2021, 91: 153684. DOI:10.1016/j.phymed.2021.153684 |
| [35] |
Guo YJ, Pan WW, Liu SB, et al. ERK/MAPK signalling pathway and tumorigenesis[J]. Exp Ther Med, 2020, 19: 1997-2007. |
 2022, Vol. 57
2022, Vol. 57


