谷氨酰胺是人体内丰度最高的氨基酸, 是细胞生命活动重要的碳源和氮源。谷氨酰胺不仅通过糖回补途径为细胞的三羧酸循环提供物质来源, 同时也是氨基酸和谷胱甘肽合成的原料[1]。谷氨酰胺分解生成的谷氨酸可在谷氨酸脱氢酶(glutamate dehydrogenase, GDH) 或者谷氨酸转氨酶的作用下生成α-酮戊二酸, 从而进入三羧酸循环参与中心碳代谢。同时, 谷氨酸在转氨酶的作用下产生包括丙氨酸和天冬氨酸在内的非必需氨基酸[2]。谷胱甘肽是维持细胞内氧化还原平衡的重要物质, 谷氨酸与甘氨酸、半胱氨酸一同参与了谷胱甘肽的合成。不仅如此, 谷氨酰胺代谢还与嘌呤、嘧啶和脂肪酸的合成密切相关[2]。
多种类型的肿瘤细胞表现出对谷氨酰胺需求和利用增加, 更加依靠谷氨酰胺分解维持其快速无限增殖, 显示出谷氨酰胺依赖的代谢特性[3, 4]。细胞内谷氨酰胺分解的首步和限速步骤是由谷氨酰胺酶(glutaminase, GLS) 催化的谷氨酰胺生成谷氨酸和氨的生化反应。人类细胞中存在GLS1和GLS2两种亚型。GLS2又称肝型谷氨酰胺酶, 仅在肝脏中表达[5]。GLS1也称肾型谷氨酰胺酶(kidney-type glutaminase, KGA), 不仅存在于肾脏, 同时也在小肠、大脑、淋巴细胞和肿瘤细胞中表达。研究表明, GLS1存在转录剪切变体谷氨酰胺酶C (glutaminase C, GAC), 主要在线粒体分布, 且于胶质瘤、结直肠癌、前列腺癌和乳腺癌等肿瘤中高表达[6-10]。在磷酸盐缓冲液的条件下, GAC的活性是所有谷氨酰胺酶中最高的[6]。结构生物学研究通过比较GAC结合或非结合配体(谷氨酸或磷酸基团) 的结构发现, 四聚体是GAC发挥酶催化作用的活性形式, 通过门控环结构开关控制底物谷氨酰胺能否进入活性部位[11]。研究表明, 相比于正常细胞, ε型蛋白激酶C促进的GAC磷酸化和活性升高对于肿瘤细胞的增殖更加关键, 因此GAC是非常理想的抗肿瘤靶点[12]。
除谷氨酰胺类似物6-重氮-5-氧代-L-正亮氨酸外, 目前发现的GAC抑制剂大多是以CB-839为代表的变构调节剂, 以发卡型结构结合于GAC四聚体的中心, 通过影响四聚体结构的调节从而抑制蛋白功能[11]。作为唯一处于临床研究阶段的GAC抑制剂, CB-839的临床前和临床研究结果表明, GAC抑制剂可增敏放疗和化疗的效果, 对特定基因突变的肿瘤效果显著[13, 14]。然而, 目前新结构GAC抑制剂与CB-839具有相似的结构骨架, 呈现对称性的基本结构, 主要差别集中在取代基团和连接结构上的差异[15]。新结构骨架特征的先导化合物的发现可能为GAC抑制剂的研发带来新的突破。因此, 开发更多具有结构多样性的GAC抑制剂是目前的研究热点。
Cederkvist等[16]通过对Enamine化合物库中的28 000个化合物进行筛选, 发现化合物C19 (图 1) 剂量依赖性降低GAC酶催化活性, 是潜在的GAC抑制剂。与大多数具有对称结构特征、结构相对复杂的GAC抑制剂不同, C19呈非对称结构, 分子量较小, 可能具有与现有化合物不同的理化性质和药理作用特性。然而, 目前对C19与GAC相互作用的研究仅限于检测其对非全长GAC蛋白酶活性的影响, 缺乏系统的蛋白-分子间相互作用验证, 也未进行其对谷氨酰胺依赖肿瘤的药理作用研究[16]。
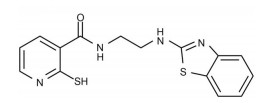
|
Figure 1 Structure of compound C19 |
为了新结构骨架GAC抑制剂的发现和确证, 本研究围绕化合物C19进行研究, 通过大肠杆菌原核表达体系得到高纯度的人全长GAC蛋白, 结合热漂移检测(thermal shift assay, TSA)、药物亲和反应的靶点稳定性(drug affinity responsive target stability, DARTS) 分析、蛋白质交联和GAC酶活性检测方法, 发现C19与GAC蛋白具有直接的相互作用, 显著抑制GAC四聚体形成和酶催化活性。同时, C19剂量依赖性抑制非小细胞肺癌A549和NCI-H1299细胞增殖, 可能成为GAC抑制剂研发的先导化合物。
材料与方法细胞 A549和NCI-H1299细胞均购自中国医学科学院基础医学研究所细胞资源中心。
化合物 C19购自Enamine公司, 溶解于二甲基亚砜中配置成50 mmol·L-1储液。
材料与试剂 大肠杆菌E. coli (DE3) 购自北京全式金生物技术有限公司; 胰蛋白胨、酵母提取物、琼脂糖购自OXIDE公司; 限制性内切酶和T4连接酶购自New England Biolabs公司; GLS活性检测试剂盒购自Biovision公司; 哺乳动物蛋白提取试剂(mammalian protein extraction reagent, M-PER) 缓冲液和双琥珀酰亚胺辛二酸酯(disuccinimidyl suberate, DSS) 购自Invitrogen公司; 链霉蛋白酶Pronase购自上海罗氏制药有限公司; 异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG)、溶菌酶、脱氧核糖核酸酶I、苯甲基磺酰氟、咪唑、脱氧胆酸钠和β-巯基乙醇均购自北京索莱宝科技有限公司; 预染蛋白质分子量标准、化学发光显色试剂盒购自上海天能科技有限公司; 钴离子磁珠和磁性分离器购自苏州海狸生物医学工程有限公司; 细胞RPMI-1640培养基购自赛默飞世尔科技(中国) 有限公司; 胎牛血清购自Gemini Bio公司; 胰酶、磷酸盐缓冲盐溶液(phosphate buffered saline, PBS) 和青链霉素购自北京利维宁生物科技有限公司; SDS-PAGE快速凝胶配制试剂盒购自北京达科为生物技术有限公司; 考马斯亮蓝快速染色液购自北京聚德安泰科技有限公司; 脱脂奶粉购自BD Biosciences公司; PVDF膜和超滤管购自Millipore公司; GAC抗体购自Proteintech公司; 山羊抗兔抗体购自北京中杉金桥生物技术有限公司; 其余分析纯试剂均购自北京化学工业集团有限公司或中国医药集团有限公司。
仪器 电子天平购自赛多利斯(上海) 贸易有限公司; 超纯水系统购自美国Millipore公司; Biotek Synergy H1全波长酶标仪购自BioTek Instruments公司; 微量台式离心机购自Eppendorf公司; PCR仪购自Applied Biosystems公司; 电泳和转膜仪器设备购自Bio-Rad公司。
细胞培养 A549和NCI-H1299培养于含有10%灭活胎牛血清和青链霉素的RPMI-1640培养基中, 置于37 ℃、5%二氧化碳的培养箱中培养和传代。
质粒构建 通过全合成的方法获得编码成熟GAC蛋白(NP_001106854.1, 73~598位氨基酸) 的片段, 使用Xba I和Xho I对pET28a质粒载体进行双酶切, 并通过T4连接酶进行连接。通过PCR和质粒酶切鉴定后, 获得编码人源GAC蛋白融合组蛋白标签的pET28a重组表达载体。
GAC蛋白诱导 将获得的pET28a-GAC重组表达载体转化至E. coli (DE3)。取阳性单菌落过夜扩增后, 培养至吸光度(OD) 值达0.6。在18 ℃的条件下, 加入0、0.05、0.1、0.5和1 mmol·L-1 IPTG进行诱导, 以确定最佳诱导浓度。取诱导后的菌液1 mL, 14 000 r·min-1离心收集菌体。将沉淀用SDS上样缓冲液进行煮沸裂解, 用于SDS-PAGE检测。
GAC分离纯化 4 000 × g离心20 min收集菌体, 并通过超声或溶菌酶的方法进行裂解。4 ℃、12 000 r·min-1离心后取上清, 与钴离子磁珠4 ℃孵育30 min后, 利用含有梯度浓度咪唑的缓冲液通过磁性分离器进行洗脱。合并纯度较高的洗脱液, 并同15 kDa的超滤管进行超滤浓缩。
Western blot 配制SDS-PAGE凝胶, 将样本逐一加至相应的样品孔中。设置恒压85 V、20 min, 120 V、1 h的电泳条件。将电泳完毕的PAGE胶进行湿法转膜, 恒流200 mA条件下电转1 h。转膜完成后的PVDF膜用5%脱脂牛奶进行室温封闭。4 ℃过夜孵育一抗, 次日TBST洗脱后室温孵育山羊抗兔二抗45 min。最后采用化学发光显色试剂盒及天能凝胶成像系统获取免疫印迹结果。对于需要考马斯亮蓝染色的样本, 将电泳完毕的凝胶取出后水洗, 再用考马斯亮蓝快速染色液室温染色20 min即可。
TSA 纯化后的hGAC蛋白分散至50 mmol·L-1 Tris、500 mmol·L-1 NaCl、pH 7.4的溶液中。将加入或不加入C19化合物的蛋白样品分别置于PCR八联管中, 通过PCR仪分别于55、60、65和70 ℃的条件下加热5 min, 再于室温放置3 min后, 2 000 r·min-1离心20 min。取上清, 加入SDS上样缓冲液煮沸裂解后上样, 通过Western blot检测C19对hGAC蛋白热稳定性的影响。
DARTS 将A549细胞用预冷PBS洗两次, 然后加入预冷的M-PER缓冲液裂解, 4 ℃、12 000 r·min-1离心后取上清。将细胞裂解液调节至1 mg·mL-1蛋白浓度, 并按比例加入10×缓冲液(500 mmol·L-1 Tris, 500 mmol·L-1 NaCl, 100 mmol·L-1 CaCl2, pH 8.0)。向管中分别加入C19或等量二甲基亚砜(dimethyl sulfoxide, DMSO), 于4 ℃孵育1 h。将Pronase储液稀释至合适浓度, 加入样品中, 室温孵育20 min进行蛋白酶水解。最后, 加入SDS上样缓冲液终止反应, 煮沸变性制备电泳样品。
GAC活性检测 将纯化的hGAC蛋白分别与CB-839、C19和等量DMSO于室温孵育20 min。将hGAC蛋白与化合物混合溶液加入黑色96孔平底板中, 并按照Biovision谷氨酰胺酶活性检测试剂盒的说明书, 向反应体系中加入谷氨酰胺、酶混合液和探针, 持续在激发光535 nm和发射光587 nm的条件下检测荧光值。
蛋白多聚体检测 将收集的A549细胞重悬于PBS中, 液氮反复冻融3次裂解。4 ℃、12 000 r·min-1离心后取上清。将细胞裂解液的蛋白浓度调节至1 mg·mL-1, 加入C19冰上孵育1 h。孵育完成后, 加入DSS室温交联20 min, 终止反应后用SDS上样缓冲液煮沸制备样本, 进行Western blot检测。
细胞内谷氨酸的含量测定 将1×106个A549细胞铺至60 mm培养皿中, 次日加入不同浓度C19处理24 h。收集细胞后, 按照谷氨酸检测试剂盒(Sigma公司, MAK004) 的说明书进行实验, 用于检测肿瘤细胞内谷氨酸含量。
结晶紫染色法检测细胞增殖 将A549或HCI-H1299细胞以5 000个/孔的密度接种至24孔板中, 24 h后加入0、5和10 μmol·L-1化合物C19。每48 h重新换一次含化合物的培养基。6天后, PBS洗两次细胞并用多聚甲醛进行固定。加入0.1%结晶紫溶液染色30 min, 用水洗脱后进行拍摄获取图像。定量统计时, 用10%醋酸溶解结晶紫沉积, 并于590 nm波长条件下测定OD值。
统计学方法 每组样本均设置3次重复, 定量数据以平均值±标准差(
GAC是人谷氨酰胺酶的转录剪切变体之一, 由编码GLS1的第1~15外显子组成, 与KGA的主要差异存在于羧基端。翻译完成后的GAC前体转入线粒体中, 在线粒体加工肽酶作用下于72~73位氨基酸中间水解去掉转运肽, 形成成熟具有功能的GAC蛋白。全合成编码73~598位氨基酸GAC全长蛋白的片段, 并在其两端添加6× his片段, 构建至pET28a原核表达载体中(图 2A)。对构建完成的质粒进行PCR测序和酶切验证后, 将其转入E. coli (DE3) 中, 加入不同剂量的IPTG在低温条件下进行蛋白诱导表达。诱导完成后, 通过超声破碎的方法裂解菌体分别制备上清和沉淀样本, 利用SDS-PAGE和Western blot的方法对GAC的表达进行检测(图 2B、C)。实验结果表明, 0.1 mmol·L-1 IPTG诱导前后的样本中GAC含量最多。然而, 大多GAC蛋白分布于裂解后的沉淀中, 可能与蛋白表达聚集形成包涵体有关。
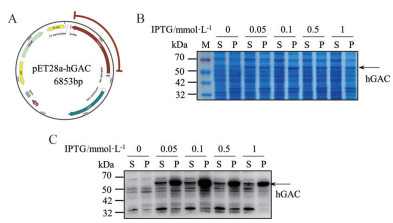
|
Figure 2 Construction of human glutaminase C (GAC) prokaryotic expression system. A: The diagram of recombinant plasmid pET28a-hGAC; B: GAC induction by isopropyl-beta-D-thiogalactopyranoside (IPTG). SDS-PAGE gel was stained with Coomassie brilliant blue; C: GAC expression in IPTG-induced bacteria was detected by Western blot. M: Protein marker ladder; S: Supernatant; P: Pellet |
有研究表明, 利用溶菌酶裂解菌体的方法能够更多地获得包涵体中的蛋白。收集诱导表达的菌体后分别利用超声、溶菌酶、溶菌酶合并超声3种方式进行裂解。结果显示, 溶菌酶加超声破碎的方案能够使更多GAC蛋白溶解至上清中(图 3A、B)。对菌株进行扩大培养, 并利用优化后的方法裂解菌体, 得到更多上清中可溶性GAC蛋白。通过固定化金属离子亲和层析的方法能够利用金属离子吸附表面带组氨酸残基的蛋白的原理对融合表达his标签的GAC蛋白进行分离和纯化。研究发现, 琼脂糖磁珠固相载体螯合钴离子比镍离子对GAC融合蛋白具有更强的亲和力, 因而选用钴离子螯合磁珠进行下一步的蛋白纯化。用梯度浓度含咪唑的洗脱液对结合于钴离子磁珠的GAC蛋白进行洗脱, 发现低浓度咪唑的洗脱液能够洗脱非特异性结合至磁珠的杂蛋白, 随着咪唑浓度逐渐升高, 洗脱液中GAC蛋白的纯度和含量显著增加(图 3C、D)。合并200和300 mmol·L-1咪唑洗脱液, 并使用超滤管去除咪唑更换缓冲溶液, 同时对蛋白进行浓缩。利用考马斯亮蓝染色对浓缩后的蛋白进行检测发现, 其仅在58 kDa处显示出单一条带, 提示分离纯化GAC蛋白纯度较高, 可用于体外检测化合物对GAC酶活性的影响及二者相互作用的研究(图 3E)。
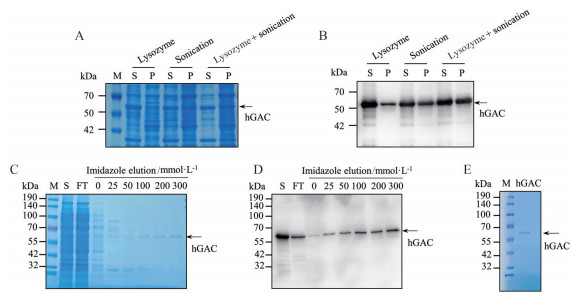
|
Figure 3 GAC protein isolation and purification. A, B: GAC-expressing bacteria were lysed by lysozyme, sonication or both. Separated supernatant (S) and pellet (P) were detected by SDS-PAGE (A) and Western blot (B); C, D: GAC protein in bacteria was isolated by BeaverBeadsTM IDA-Cobalt enrichment and eluted with imidazole. Flow-through and elution were detected by SDS-PAGE (C) and Western blot (D). FT: Flow through; E: GAC protein was concentrated from 200 and 300 mmol·L-1 imidazole elution, following by SDS-PAGE and Coomassie brilliant blue staining |
TSA是基于小分子与蛋白相互作用时会改变蛋白热稳定性的原理, 通过检测小分子作用后蛋白的稳定性随温度升高的变化反映两者是否有相互作用的研究方法。自55 ℃开始, GAC蛋白随着温度的升高稳定性逐渐降低。化合物C19的加入使得GAC蛋白在65和70 ℃的较高温度条件下仍相对稳定(图 4A)。DARTS技术是近年来发展的一项用于小分子药物与靶点相互作用分析的技术, 其原理是结合了小分子的蛋白稳定性提高, 更不易被蛋白酶降解。这种方法能够利用细胞裂解液进行小分子结合鉴定实验, 在较为复杂的体系中检测分子与蛋白是否存在相互作用。收集NCI-H1299细胞制备裂解液样本, 实验结果表明, 化合物C19在一定程度上使得GAC蛋白在2.5和5 μg·mL-1链霉菌蛋白酶作用下免于被酶解(图 4B)。在2.5 μg·mL-1链霉菌蛋白酶的条件下, C19可剂量依赖性增加细胞中GAC蛋白的稳定性, 减少其由于链霉菌蛋白酶导致的水解(图 4C)。化合物C19对KGA的稳定性也有一定改善作用, 但GAC的稳定性增加更为显著, 提示C19对GAC的亲和力很可能强于KGA。
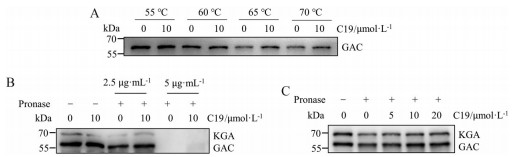
|
Figure 4 Analysis of the binding of C19 to GAC. A: Thermostable GAC under indicated heat shocks in the presence of 10 μmol·L-1 C19; B: C19 protected GAC from proteolysis by pronase in native NCI-H1299 cell lysates; C: Increasing concentrations of C19 were test to study its interaction with GAC in the treatment of 2.5 μg·mL-1 pronase by DARTS. KGA: Kidney-type glutaminase |
DSS能够与氨基酸中的伯胺分子迅速反应, 实现细胞内或细胞裂解液系统中蛋白质化学的交联, 方便识别蛋白质多聚体和蛋白相互作用。对NCI-H1299细胞裂解液交联样本进行检测, 发现0.5 mmol·L-1 DSS能够较好地偶联GAC蛋白, 形成易于检测的多聚体偶联物(图 5A)。以CB-839、BPTES为代表的GAC抑制剂通过结合于GAC四聚体, 使其形成稳定非催化构象而调节GAC酶促反应活性[11]。而进一步研究发现, 与现有的GAC抑制剂不同, C19具有减少GAC二聚体和四聚体、增加GAC单体的作用特点。以上结果提示, 化合物C19可能并不通过变构效应降低GAC酶活性, 而是通过调节单体、二聚体和四聚体的动态变化发挥抑制作用(图 5B)。
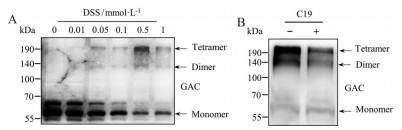
|
Figure 5 C19 bound to GAC and inhibited its tetramer formation. A: Disuccinimidyl suberate (DSS) cross-linked GAC dimer and tetramer of NCI-H1299 cell lysates; B: 10 μmol·L-1 C19 significantly suppressed GAC tetramer and increased monomer |
借助GAC具有催化谷氨酰胺反应生成谷氨酸的作用特性, 在加入GDH及烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH) 特异性的荧光探针的反应体系中, 能够通过探针荧光值间接反映谷氨酸的生成量, 进而表征GAC的酶催化活性。实验结果表明, C19与GAC蛋白的结合显著降低了其酶催化活性, 但其作用强度相对CB-839较低(图 6A、B)。通过影响肿瘤细胞中GAC酶活性, C19还显著降低了细胞内谷氨酸的含量(图 6C)。
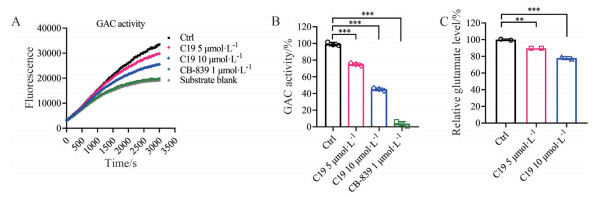
|
Figure 6 GAC activity was reduced by C19. A: GAC activity was determined after CB-839 or C19 incubation; B: CB-839 and C19 treated GAC activities were calculated; C: Glutamate level in A549 cells was reduced by C19 treatment. n = 3, |
通过直接结合于GAC蛋白, C19影响其多聚体的形成而达到降低GAC酶催化活性的作用。对C19处理的细胞固定后进行结晶紫染色, C19显著抑制非小细胞肺癌细胞A549和NCI-H1299肿瘤细胞增殖(图 7A)。将结晶紫溶解于10%醋酸中, 通过检测590 nm处的OD值, 能够定量统计化合物对肿瘤细胞增殖的影响。结果显示, C19处理对A549的影响更为明显, 可使其增殖比例降低约40% (图 7B、C)。
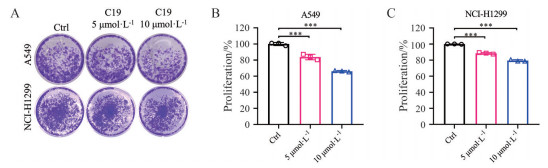
|
Figure 7 C19 suppressed the proliferation of A549 and NCI-H1299 non-small cell lung cancer cells. A: Crystal violet staining of C19-treated A549 and NCI-H1299 cells; B, C: Crystal violet staining of proliferated A549 (B) and NCI-H1299 (C) cells was dissolved in 10% acetic acid. n = 3, |
肿瘤代谢是抗肿瘤药物的研究热点, 而GAC是谷氨酰胺代谢中至关重要的限速酶, 因此靶向GAC的候选化合物是强有力的肿瘤代谢干预手段。然而, 作用于GAC的化合物筛选和验证难度较高。首先, 高通量GAC抑制剂筛选的最佳方法基于酶活性检测体系进行。该检测体系采用两步法, 第一步反应是GAC催化底物谷氨酰胺产生谷氨酸; 第二步反应是GDH催化谷氨酸产生α-酮戊二酸的同时产生NADH。最终, 通过NADH的特征性吸收或特异性探针信号来反映GAC的酶活性[17]。这一体系成分复杂, 不仅有谷氨酰胺、腺苷二磷酸、NADH等参与反应的重要物质, 而且有GAC和GDH两种催化酶, 可能产生干扰的因素较多。其次, 初步筛选得到GAC抑制剂的验证方法有限。目前, 大多数细胞水平验证方法仅进行肿瘤细胞增殖抑制或谷氨酰胺消耗量的变化检测, 难以在体外实验阶段迅速确定化合物对于GAC蛋白的直接相互作用和靶点特异性[17, 18]。本论文探索了TSA、DARTS和蛋白质交联等方法, 进一步确证了化合物C19与GAC蛋白之间的相互作用, 更好地补充了GAC抑制剂的验证体系, 为后续研发新结构类型的候选化合物提供有力支持。
肿瘤细胞内的GAC表达和谷氨酰胺依赖程度与驱动基因密切相关。有研究表明, 细胞原癌基因v型髓细胞瘤病毒同源癌基因(cellular proto-oncogene v-Myc myelocytomatosis viral oncogene homolog, c-myc) 扩增可通过miR-23a/b促进GAC在前列腺癌和B淋巴瘤中的表达[9]。相比较消耗葡萄糖, c-myc驱动的肿瘤更多地倾向于依赖谷氨酰胺分解回补三羧酸循环, 进而促进肿瘤增殖[19]。鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene, KRAS) 是突变率最高的致癌基因之一, 有研究表明KRAS突变合并Kelch样环氧氯丙烷相关蛋白1 (Kelch-1ike ECH- associated protein l, KEAP1) 基因突变、丝氨酸-苏氨酸蛋白激酶11 (serine-threonine kinase 11, STK11) 基因缺失的肺腺癌表现出更强的能量代谢和氧化还原压力, 主要表现为活性氧(reactive oxygen species, ROS) 增加、三磷酸腺苷降低、还原型与非还原型烟酰胺腺嘌呤二核苷酸磷酸比值降低[20]。这类肿瘤类型更加依靠谷氨酰胺维持能量和氧化还原平衡, 也对GAC抑制剂的作用更敏感[20]。A549肺腺癌细胞具有KRAS、KEAP1基因突变的同时, 也存在STK11缺失, 是研究谷氨酰胺代谢和GAC抑制剂药理学作用的合适细胞系。相比较同为非小细胞肺癌的NCI-H1299细胞, C19对A549细胞的增殖抑制作用更为明显, 也从侧面验证了该化合物通过作用于GAC调节谷氨酰胺代谢的特点。
本研究以探索GAC蛋白与小分子抑制剂直接相互作用的验证方法为侧重点。然而, 在实际的研究过程中, 还应该关注化合物降低GAC酶催化功能带来的肿瘤细胞谷氨酰胺代谢降低和氧化还原状态失衡[21]。值得注意的是, 联合用药是GAC抑制剂未来的发展方向。肿瘤具有代谢可塑性的特征, 能够根据不同的营养状况调整能源物质利用的能力。有研究表明, 在转氨酶和糖代谢的补偿作用下, 由GLS/GAC抑制带来的谷氨酰胺来源的代谢物降低程度减弱[22, 23]。在抑制GLS/GAC的同时, 通过化学手段干预转氨酶和糖代谢关键酶己糖激酶2都显著增加肿瘤抑制效果[22]。同样地, 也有报道指出, 通过抑制丙氨酸-丝氨酸-半胱氨酸转运载体2降低肿瘤细胞对谷氨酰胺的摄取, 也能够起到增敏GLS1抑制剂的作用[24]。因此, 在GAC抑制剂的临床前研究过程中, 应该从多个维度考虑化合物的靶点验证和应用策略。
作者贡献: 杜婷婷负责主要的实验设计、部分实验操作和论文撰写; 刘羿晨负责部分实验操作; 张智慧和王伟达负责文献检索和数据统计分析; 季鸣和陈晓光负责指导实验设计、论文撰写与修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Krall AS, Christofk HR. Rethinking glutamine addiction[J]. Nat Cell Biol, 2015, 17: 1515-1517. DOI:10.1038/ncb3278 |
| [2] |
Yang L, Venneti S, Nagrath D. Glutaminolysis: a hallmark of cancer metabolism[J]. Annu Rev Biomed Eng, 2017, 19: 163-194. DOI:10.1146/annurev-bioeng-071516-044546 |
| [3] |
Tong Y, Guo D, Lin SH, et al. SUCLA2-coupled regulation of GLS succinylation and activity counteracts oxidative stress in tumor cells[J]. Mol Cell, 2021, 81: 2303-2316.e8. DOI:10.1016/j.molcel.2021.04.002 |
| [4] |
Bolzoni M, Chiu M, Accardi F, et al. Dependence on glutamine uptake and glutamine addiction characterize myeloma cells: a new attractive target[J]. Blood, 2016, 128: 667-679. |
| [5] |
Curthoys NP, Watford M. Regulation of glutaminase activity and glutamine metabolism[J]. Annu Rev Nutr, 1995, 15: 133-159. DOI:10.1146/annurev.nu.15.070195.001025 |
| [6] |
Cassago A, Ferreira AP, Ferreira IM, et al. Mitochondrial locali-zation and structure-based phosphate activation mechanism of glutaminase C with implications for cancer metabolism[J]. Proc Natl Acad Sci U S A, 2012, 109: 1092-1097. DOI:10.1073/pnas.1112495109 |
| [7] |
Xu L, Yin Y, Li Y, et al. A glutaminase isoform switch drives therapeutic resistance and disease progression of prostate cancer[J]. Proc Natl Acad Sci U S A, 2021, 118: e2012748118. DOI:10.1073/pnas.2012748118 |
| [8] |
Wang JB, Erickson JW, Fuji R, et al. Targeting mitochondrial glutaminase activity inhibits oncogenic transformation[J]. Cancer Cell, 2010, 18: 207-219. DOI:10.1016/j.ccr.2010.08.009 |
| [9] |
Gao P, Tchernyshyov I, Chang TC, et al. c-Myc suppression of miR-23a/b enhances mitochondrial glutaminase expression and glutamine metabolism[J]. Nature, 2009, 458: 762-765. DOI:10.1038/nature07823 |
| [10] |
Ascencao CFR, Nagampalli RSK, Islam Z, et al. N-terminal phosphorylation of glutaminase C decreases its enzymatic activity and cancer cell migration[J]. Biochimie, 2018, 154: 69-76. DOI:10.1016/j.biochi.2018.07.022 |
| [11] |
Stalnecker CA, Ulrich SM, Li Y, et al. Mechanism by which a recently discovered allosteric inhibitor blocks glutamine metabolism in transformed cells[J]. Proc Natl Acad Sci U S A, 2015, 112: 394-399. DOI:10.1073/pnas.1414056112 |
| [12] |
Han T, Zhan W, Gan M, et al. Phosphorylation of glutaminase by PKCε is essential for its enzymatic activity and critically contri-butes to tumorigenesis[J]. Cell Res, 2018, 28: 655-669. DOI:10.1038/s41422-018-0021-y |
| [13] |
Riess JW, Frankel P, Shackelford D, et al. Phase 1 trial of MLN0128 (sapanisertib) and CB-839 HCl (telaglenastat) in patients with advanced NSCLC (NCI 10327): rationale and study design[J]. Clin Lung Cancer, 2021, 22: 67-70. DOI:10.1016/j.cllc.2020.10.006 |
| [14] |
Chakrabarti G, Moore ZR, Luo X, et al. Targeting glutamine metabolism sensitizes pancreatic cancer to PARP-driven metabolic catastrophe induced by β-lapachone[J]. Cancer Metab, 2015, 3: 12. DOI:10.1186/s40170-015-0137-1 |
| [15] |
Xu X, Meng Y, Li L, et al. Overview of the development of glutaminase inhibitors: achievements and future directions[J]. J Med Chem, 2019, 62: 1096-1115. DOI:10.1021/acs.jmedchem.8b00961 |
| [16] |
Cederkvist H, Kolan SS, Wik JA, et al. Identification and characterization of a novel glutaminase inhibitor[J]. FEBS Open Bio, 2022, 12: 163-174. DOI:10.1002/2211-5463.13319 |
| [17] |
Costa RKE, Rodrigues CT, Campos JCH, et al. High-throughput screening reveals new glutaminase inhibitor molecules[J]. ACS Pharmacol Transl Sci, 2021, 4: 1849-1866. DOI:10.1021/acsptsci.1c00226 |
| [18] |
Soth MJ, Le K, Di Francesco ME, et al. Discovery of IPN60090, a clinical stage selective glutaminase-1 (GLS-1) inhibitor with excellent pharmacokinetic and physicochemical properties[J]. J Med Chem, 2020, 63: 12957-12977. DOI:10.1021/acs.jmedchem.0c01398 |
| [19] |
Wise DR, DeBerardinis RJ, Mancuso A, et al. Myc regulates a transcriptional program that stimulates mitochondrial glutamino-lysis and leads to glutamine addiction[J]. Proc Natl Acad Sci U S A, 2008, 105: 18782-18787. DOI:10.1073/pnas.0810199105 |
| [20] |
Galan-Cobo A, Sitthideatphaiboon P, Qu X, et al. LKB1 and KEAP1/NRF2 pathways cooperatively promote metabolic reprogramming with enhanced glutamine dependence in KRAS-mutant lung adenocarcinoma[J]. Cancer Res, 2019, 79: 3251-3267. |
| [21] |
Zhang T, Liu J, Ding Y. Research advances of glutamine metabolism-related targets in tumor treatment[J]. Acta Pharm Sin (药学学报), 2020, 55: 813-820. |
| [22] |
Mendez-Lucas A, Lin W, Driscoll PC, et al. Identifying stra-tegies to target the metabolic flexibility of tumours[J]. Nat Metab, 2020, 2: 335-350. DOI:10.1038/s42255-020-0195-8 |
| [23] |
Cheng T, Sudderth J, Yang C, et al. Pyruvate carboxylase is required for glutamine-independent growth of tumor cells[J]. Proc Natl Acad Sci U S A, 2011, 108: 8674-8679. DOI:10.1073/pnas.1016627108 |
| [24] |
Feng Y, Pathria G, Heynen-Genel S, et al. Identification and characterization of IMD-0354 as a glutamine carrier protein inhibitor in melanoma[J]. Mol Cancer Ther, 2021, 20: 816-832. DOI:10.1158/1535-7163.MCT-20-0354 |
 2022, Vol. 57
2022, Vol. 57


