药物递送系统的快速发展使得对药物有效性的评价不仅基于其治疗效率还需考虑其带来的不良反应[1, 2], 疾病治疗更需生物利用度高、能缓慢长期释放、较少或没有不良反应的制剂[3]。纳米递送系统可增加药物的溶解度和稳定性, 选择性增加细胞摄取, 控制药物释放, 减少不良反应等, 提高药物治疗效果[4]。
载体类纳米药物是纳米递送系统重要的组成部分, 指以无机、脂质或高分子材料等为载体, 将原料药包裹、分散、共价或非共价结合形成的具有纳米尺度的微粒。其中无机材料最大的不足是会在器官中大量累积, 引起免疫系统的永久刺激, 对机体造成长期毒性反应[5]; 脂质材料虽是生物相容的, 但成分复杂, 会影响纳米粒稳定性[6]; 高分子材料不仅生物相容性和稳定性好, 且易于制备, 成本合理, 已受到越来越多关注。
高分子材料可分为合成和天然两类, 合成高分子材料如聚酯、聚酸酐等已被广泛使用, 其中聚乳酸(PLA)、乳酸-羟基乙酸共聚物(PLGA) 等生物相容性较好, 但会产生酸性降解产物影响局部pH, 造成包封药物变性, 降低药物治疗效率[7]。相比之下, 各种天然高分子材料如丝素蛋白(silk fibroin, SF)[3]、壳聚糖[8]、玉米蛋白[9]等同时具有良好的生物相容性和生物降解性, 是更值得选择的纳米药物载体材料。其中SF是经美国食品和药品监督管理局(FDA) 批准的广泛用于缝合、组织再生和药物递送系统的生物材料[10], 除安全可降解外, 还具有来源广泛、制备灵活、药物包封率高等优点[11], 其经各种方法制成的载药纳米粒具有多种理化及生物学新功能。本综述对SF的基本特征、SF载药纳米粒的制备方法和SF在纳米粒药物递送系统的应用进行了总结。
1 SF的提取、结构和性质 1.1 SF的提取SF主要从家蚕蚕丝中提取, 蚕丝由约75% SF和25%丝胶蛋白组成。丝胶蛋白是水溶性胶状蛋白, 在蚕丝中作为外层包裹SF, 以维持结构完整性[11]。一般认为丝胶蛋白的存在会引起过敏反应, 故需去除丝胶蛋白[12], 也有研究发现单纯的丝胶蛋白可作为一种具有良好生物相容性的材料使用[13], 所以可能SF和丝胶蛋白同时存在才会导致免疫反应[10]。
SF的完整提取过程是首先通过脱胶处理(degumming process) 去除丝胶蛋白, 脱胶工艺是一种热化学处理, 主要利用丝胶蛋白的水溶性, 合适的脱胶剂和脱胶条件可充分彻底除去丝胶蛋白, 脱胶剂一般选择碱性试剂如碳酸钠, 脱胶条件为100 ℃、30~60 min[14]。脱胶后得到的SF晶体结构为不溶性的silk II, 通过转化剂如溴化锂、氯化钙等可使其转化为可溶性的silk I, 再经透析离心除去转化剂, 形成再生SF (regenerated silk fibroin) 溶液, 后续可冻干以长期保存[14]。
1.2 SF的结构SF由重(H) 链、轻(L) 链和P25糖蛋白单元组成, 三者摩尔比为6∶6∶1[15]。重链约为390 kDa[11], 含有亲水和疏水结构域, 短的亲水结构域散布在疏水结构域之间, 疏水结构域主要包含了高度保守的甘氨酸-丙氨酸-甘氨酸-丙氨酸-甘氨酸-丝氨酸重复单元[15]。轻链约为26 kDa, 没有重复氨基酸单元, 具有亲水性和一定弹性[11]。重链和轻链单元间以二硫键相连, 形成H-L复合物, P25糖蛋白单元与复合物非共价连接, 约为25 kDa[16]。
SF主要含有silk I和silk II两种结晶态, 二者晶体结构的差异源于二级结构的不同。Silk I为含无规则卷曲、α-螺旋和β-折叠结构的混合物[11], 具有水溶性和热力学不稳定性[17]; 而在氨基酸分子内和分子间氢键及范德华力作用下, 重链的重复单元能形成反平行β-折叠结构, 使SF中出现高度有序的晶体区域[15], 这种晶体结构是silk II, 具有疏水性和热力学稳定性[16]。此外, 再生SF溶液在气/水界面中存在少量不稳定的silk III[11], 为三重螺旋晶体结构[14]。通过改变离子溶液、有机溶剂、温度等条件, 可调节SF中β-折叠结构含量, 使silk I和silk II发生相互转化[14]。
1.3 SF的性质SF具有一定的水溶性、结构修饰性、良好的生物相容性和生物降解性等, 使其成为纳米粒药物递送系统的理想载体材料。
1.3.1 水溶性SF的水溶性与结晶态和环境pH显著相关。由于silk I比silk II更易溶解, 故使得难溶性的silk II转变为silk I的方法都可增加SF的水溶性[14], 如再生SF的晶体结构为silk I, 水溶性较好, 可制备成SF水溶液。此外, SF的理论等电点pI是4.53[18], 当环境pH在等电点附近时, SF的水溶性会下降。基于SF有一定水溶性的特点, 在制备时可减少有机溶剂的使用, 从而减少对包封药物的影响。
1.3.2 结构修饰性具有化学和基因修饰其固有结构的能力对生物材料至关重要。化学修饰是对SF结构中的活性基团如氨基和羧基进行修饰, 增加材料的功能性。基因修饰是从源头改变SF结构, 获得性能优化的新材料品种。
由于SF具有一定的生物活性, 不载药的SF纳米粒有抗炎和修复作用, 而RGD肽(精氨酸-甘氨酸-天冬氨酸) 能靶向细胞表面的整合素受体, 减少免疫细胞浸润[19]。以戊二醛作交联剂, 两端分别连接RGD肽的氨基和SF纳米粒表面的氨基, 可得到RGD肽修饰的SF纳米粒(RGD-SFNs), 其明显减少了结肠炎中促炎细胞因子(IL-6、IL-12等) 和诱导型一氧化氮合酶的表达, 可改善结肠上皮层损伤, 治疗结肠炎[19]。除RGD肽外, SP5-52肿瘤靶向肽[20]、叶酸[21]、硫酸软骨素[22]、透明质酸[23]等都能对SF进行修饰, 用于药物的靶向递送, 聚乙二醇(PEG)[24]也能修饰SF, 延长药物在体内的循环时间。此外, 1-乙基-3 (3-二甲氨丙基) 碳二亚胺盐酸盐(EDC) 或带正电的聚合物聚乙烯亚胺(PEI) 可作为交联剂与SF的羧基等带电基团发生离子相互作用, 能在-15~+30 mV内调节SF纳米粒的表面电势, EDC还能增加silk II的含量[25], 有利于增加载药量和包封率, 提高治疗效果[26]。
在基因修饰方面, 调节蚕的饮食可将甲硫氨酸(Met) 类似物整合到SF中, 这些类似物被甲硫氨酰tRNA合成酶识别, 与tRNAMet结合, 竞争性翻译腺嘌呤-尿嘧啶-鸟嘌呤(AUG) 密码子, 诱导氨基酸突变, 可用于开发高性能生物材料[27]。
1.3.3 良好的生物相容性和生物降解性作为一种来源于大自然的物质, SF由天然氨基酸组成, 其在体外和动物及至人类体内都具有良好的生物相容性。体外研究表明, SF可依附成纤维细胞L-929并促进其生长[28], 对免疫系统的黏附和激活有限[29]; 体内实验则发现SF在大鼠中只引起可忽略不计的炎症反应[30]。
SF能在体内生物降解且降解产物没有细胞毒性[31], 可被多种酶如蛋白酶XIV、胶原酶IA等降解, 生物降解速率受降解酶的类型影响[32]。此外, SF的结晶度和提取来源也影响降解速率, 由于silk II比silk I结晶度高, 故silk II含量多时, 会延长降解时间[33], 控制SF的晶体结构, 可实现缓释给药。而非家蚕蚕丝提取的SF有高α-螺旋和β-折叠结构, 晶体结构更紧凑, 和蚕丝提取的SF相比, 降解会更缓慢[34]。
对SF生物相容性和生物降解性的研究表明, SF是安全无毒的天然高分子材料, 解决了药物载体安全性的问题, 使其在纳米粒药物递送系统的应用中具有一定优势。
2 SF载药纳米粒的制备方法和影响因素 2.1 制备方法一般将制备SF载药纳米粒的方法分为两类, 即自上而下法和自下而上法[14]。自上而下法指通过研磨或均质等机械过程制备纳米粒, 将大颗粒分散为小颗粒, 制备时不需加入有机溶剂, 但较长的操作时间可能会引入杂质, 且粒径分布大[35], 不适用于载药纳米粒的制备。自下而上法则通过SF的相分离或自组装制备纳米粒, 通过增加反平行β-折叠结构, 经疏水作用使溶液中的SF浓集并形成纳米粒[14], 相比于自上而下法, 自下而上法的应用更广泛。自下而上法进一步可分为化学法、仪器法和其他方法。其中, 化学法有去溶剂化法[36]、盐析法[18]、反微乳液法[37]等, 仪器法包括超临界流体法[38]、电喷雾法[39]、毛细管法[40]等, 其他方法有聚合物共混法[41]等, 常用的制备方法和主要特点如表 1[14, 35]所示。
| Table 1 Common preparation methods and main features of silk fibroin (SF) |
去溶剂化法是制备SF载药纳米粒的最常见方法, 是将SF水溶液和与水混溶的有机溶剂混合后自发形成不溶性纳米粒的过程。Zhang等[36]将5.0%的再生SF溶液加入与水混溶的有机溶剂如丙酮、乙醇中, 有机溶剂体积至少占终体积的70%, SF悬浮在水和有机溶剂的混合物中, 形成有良好结晶度的微小球状粒子, 纳米粒自发聚集产生缓慢的沉降, 最后通过离心和过滤等操作可从混合物中收集并纯化沉淀, 得到粒径范围在35~125 nm的粒子。
盐析法则通过加入盐溶液与SF竞争水分子, 使纳米粒形成。Lammel等[18]通过向SF水溶液中加入磷酸钾溶液, 诱导相分离制备纳米粒, SF溶液和磷酸钾溶液的体积比为1∶5, 得到的纳米粒冷冻保存并离心, 使用前需重新分散并洗涤3次, 通过改变SF浓度, 可得到486 nm~2 μm粒径范围的粒子。
超临界流体法(SCF) 指SF溶液在可控高压下被超临界二氧化碳雾化, 二氧化碳蒸发后纳米粒形成的过程。Zhao等[38]采用超临界二氧化碳(scCO2) 作为溶液增强分散剂的工艺(SEDS) 制备载有吲哚美辛的SF纳米粒。当溶液接触scCO2时, 高速的scCO2将溶液分解成非常小的液滴, 诱导SF的相分离, 出现超饱和现象, 从而导致聚合物颗粒的成核和沉淀。获得的纳米粒表面光滑, 粒径分布狭窄, 平均粒径约为50 nm, 使药物以稳定方式释放, 减少了突释。
2.2 影响因素许多因素如SF的浓度和结晶度、包封药物性质、制备和贮存条件、生理病理环境等会对纳米粒的粒径和粒径分布、表面电势、包封率和载药量、稳定性、药物释放速率等性质有很大影响, 在制备时要进行合理的设计和选择。
2.2.1 SF的浓度和结晶度制备时SF的浓度会影响纳米粒的粒径和粒径分布, 浓度增加, 粒径和粒径分布增加, 过大浓度还会形成团簇和无定形聚集体[18]。而SF的结晶度对药物释放有重要作用, 高含量的silk II可形成更加紧实的颗粒[25], 同时减慢SF的降解速率[33], 从而显著延长药物释放时间, 利于药物缓慢释放。
2.2.2 包封药物的性质稳定性较好的药物可先溶解或混合于SF溶液中, 再制备载药纳米粒, 这是最常用且直接的方式, 但需温和的制备方法, 以确保制备过程不会影响药物活性[42]; 药物也可在SF制成纳米粒后, 再通过透析等方法与其共价偶联或吸附, 形成载药纳米粒, 该方式能维持药物的稳定性[42], 但药物与SF结合或形成偶联物的能力取决于药物的物理化学性质, 由于在生理环境下SF表面带负电, 故带正电或疏水性药物可与SF紧密结合, 表现出更缓慢的释放[43]。
不论何种加入方式, 药物一般与SF都存在静电相互作用、氢键作用或疏水作用, 这可能会破坏SF反平行β-折叠结构的氢键作用, 使结晶度下降, 影响药物的包封率和释放速率[26]。此外, 药物的溶解度和pKa值会影响SF的包封率和载药量[26]。
2.2.3 制备和贮存条件不同制备方法会产生不同粒径范围的纳米粒, 同一制备方法中条件的变化也会对纳米粒的形态、表面电势、粒径等有影响。去溶剂化法中, 极性有机溶剂如甲醇、乙醇、丙酮等都可从SF水溶液中诱导球状纳米粒产生, 但选用丙酮为溶剂时纳米粒的形态较好, 而乙腈只能聚集SF分子, 不产生细小颗粒, 形成没有特定形状的丝素团块[36]; 当采用EDC或PEI修饰SF时, 能对纳米粒的表面电势进行调节[25]。盐析法中, 盐析效率随盐溶液离子强度的变化而变化, 只有当离子强度到达某一值后才能形成颗粒[18]。
纳米粒的贮存温度也会显著影响其稳定性, 包括以冻干粉末贮存时。25 ℃时纳米粒碰撞过多, 分子内和分子间相互作用增大, 会引起粒子聚集; 而较低温度(如4 ℃) 接触减少, 纳米粒能在6个月内保持稳定[26]。
2.2.4 生理病理环境SF结构的特殊性如二硫键、β-折叠结构中的氢键等, 使得SF纳米粒具有多种刺激响应性释放药物的能力。
许多研究表明SF纳米粒对pH变化有响应性, 其中SF包封的药物多是弱碱性药物, 如多柔比星(DOX)[24, 44, 45]、普萘洛尔[24]、喜树碱[22]等, 在模拟溶酶体环境即pH 4.5时药物的释放速率显著高于其他pH条件(pH 6.0的核内体环境和pH 7.4的血浆环境), 可能是酸性环境下SF β-折叠结构的破坏[22]和弱碱性药物与SF间静电作用力减弱[45]造成的, 此外, 溶酶体酶还能降解SF, 可进一步加快药物释放[45]。
SF纳米粒对谷胱甘肽(GSH) 和活性氧(ROS) 的增加也具有响应性, GSH对SF分子中连接轻链和重链的二硫键具有还原性, ROS则会破坏SF纳米粒的β-折叠结构, 加速药物释放[22]。有研究发现温度也会影响SF纳米粒中药物的释放, 高温能增加分子的运动, 促进药物扩散, 不过一般需要外加刺激[23]。
总之, SF纳米粒对生理病理环境中pH/溶酶体酶/GSH/ROS的内在刺激具有选择性响应能力, 可用于设计靶向病灶部位按需释放药物的纳米粒药物递送系统[46]。
3 SF在纳米粒药物递送系统的应用SF具有与各种类型化合物结合的能力, 如小分子、蛋白及多肽类和核酸类药物等。以SF为载体包封这些药物形成的纳米粒, 借助增强渗透与滞留(EPR) 效应有一定的被动靶向性, 且若SF经结构修饰, 还具有主动靶向性, 从而能降低全身毒性。而SF的降解速率决定着药物的释放速率, 可控制药物释放, 提高药物生物利用度, 在多种疾病的治疗中有着广泛研究。此外, SF可与其他高分子材料共同制备复合载药纳米粒, 改善对药物的包封, 维持药物稳定性, 促进吸收。
3.1 小分子药物一些小分子化合物存在低渗透性、快速代谢、无特异性靶向和分布、不良反应大等不足, 纳米粒药物递送系统可有效改善这些问题。SF能对多种小分子药物如化学合成药物、天然来源药物单体、荧光试剂等进行递送, 主要用于癌症、炎症的治疗及粒子追踪。
3.1.1 化学合成药物SF作为载体递送的化学合成药物常用于癌症的治疗。目前, 可与SF制备纳米粒的化学合成药物包括DOX[47]、甲氨蝶呤[48]、吉西他滨[20]、5-氟尿嘧啶[49]、顺铂[41]、氟尿苷[50]、普萘洛尔[24]等。
DOX是广泛使用的抗癌药物, 毒性大, 易引起肿瘤的多药耐药性。Tian等[47]通过盐析法制备了DOX磁性SF纳米粒即DMSs, 形成机制如图 1所示, 带正电的DOX与带负电的Fe3O4磁性纳米粒(MNPs) 结合后再被SF包封, 形成带负电的DMSs, 在雌性BALB/c裸鼠的毒理学研究表明, DMSs对肝、脾、肺、肾没有明显毒性, 而心脏切片出现心肌纤维撕裂现象, 这可能是DOX引起的。小鼠尾静脉注射DMSs和载有DOX的SF纳米粒(DOX-SFNs) 后, 当磁体附着在肿瘤处时, DMSs可在肿瘤处积累, DOX-SFNs则主要聚集在肝脏, 与游离DOX相比, DMSs治疗的小鼠乳腺癌耐药肿瘤体积显著减少, 肿瘤的生长抑制效果更好, 第30天小鼠的生存率仍为100%, 且DMSs治疗的小鼠和对照组的小鼠体重变化相似, 而DOX治疗的小鼠体重有明显波动。通过外加磁场的刺激, DMSs能聚集到肿瘤处, 增强对肿瘤的抑制并减小不良反应, 还能对抗肿瘤多药耐药性, 是一种治疗肿瘤的有效方法。
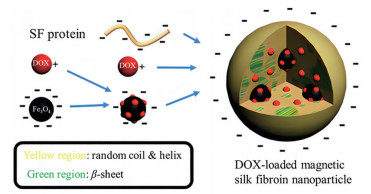
|
Figure 1 Schematic illustration of the formation of doxorubicin-loaded magnetic silk fibroin-based nanoparticles (DMSs): doxorubicin (DOX) is partly adsorbed on the surface of magnetic Fe3O4 nanoparticles (MNPs) and then capsulated in the silk fibroin-based nanoparticles (SFNs) during the salting-out generation process. (Adapted from Ref. 47 with permission. Copyright © 2014 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim) |
SF还可用于改善亲水性高分子材料如白蛋白对疏水性药物的包封。Subia等[48]通过去溶剂化法和戊二醛交联法制备了SF-白蛋白(SF-Alb) 纳米粒, 然后通过超声透析将甲氨蝶呤(MTX) 偶联到SF-Alb纳米粒上, 得到平均大小为140~300 nm的MTX-SF-Alb纳米粒。由于SF的羧基和白蛋白的氨基之间存在较强的静电相互作用, 改善了对药物的包封, 避免药物泄漏。测试浓度下, SF-Alb纳米粒很少或几乎不引起溶血反应, 可很好地进入成纤维细胞(AH927) 且不影响细胞生存率, 这些都表明SF-Alb纳米粒有很好的生物相容性。而在MTX-SF-Alb纳米粒的体外细胞毒性评价中, 其可缓慢释放MTX, 比游离的MTX更有效地抑制乳腺癌细胞MDA-MB-231, 半数抑制浓度(IC50) 更低, 可提高疗效。
3.1.2 天然来源药物单体天然来源药物单体对多种疾病有治疗作用, SF可成功递送不同的天然来源药物单体, 典型的有紫杉醇(PTX)[51]、姜黄素(CUR)[22]、雷公藤内酯[52]、南蛇藤醇[52]、槲皮素[53]、白藜芦醇[54]、α-倒捻子素[26]等, 提高这些药物的治疗效果。
PTX已被证明能对抗多种实体瘤, 但其治疗往往伴随严重的不良反应, 如与骨髓抑制相关的中性粒细胞减少等。Wu等[51]用去溶剂化法制备了PTXSF纳米粒(PTX-SF-NPs), 其粒径为195~210 nm。体外摄取实验发现PTX-SF-NPs能迅速被人胃癌细胞BGC-823和SGC-7901摄取, 多集中在细胞质和核周空间。体内抗肿瘤活性研究表明, 相比游离PTX, PTX-SF-NPs更能减慢肿瘤生长, 且其局部治疗优于全身治疗, 有极好的抗癌活性, 还能降低PTX的全身毒性。此外, 对重要器官的病理研究发现SF-NPs处理的小鼠器官形态无明显变化, 具有良好的体内安全性。故SF作为递送载体的局部给药可能是一种潜在的临床癌症治疗方案。
CUR是从姜黄中提取的酚类色素, 具有许多药理作用, 包括抗氧化、抗炎和抗癌活性。Gou等[22]用去溶剂化法制得CUR-SF纳米粒(CUR-SFNPs) 后, 再用硫酸软骨素(CS) 对其进行表面功能化得到了CS-CUR-SFNPs, 制得的粒子平均粒径是175.4 nm。体外细胞摄取实验发现各种SF纳米粒作用时, 随时间延长, 巨噬细胞对CUR的吸收都有所增加, 说明都具有一定的缓释性, 但CS-CUR-SFNPs作用时巨噬细胞中CUR含量最高, 靶向性最强。体内治疗溃疡性结肠炎疗效研究表明CS-CUR-SFNPs通过巨噬细胞的特异性内化作用在结肠炎组织积累, 巨噬细胞的内在刺激(pH/GSH/ROS) 控制着CUR的释放, 增强抗炎活性。口服和静脉注射CS-CUR-SFNPs后, 都有较好的血液和组织相容性, 不引起免疫反应, 给药后无明显毒性。该研究设计的能按需释放药物的SF载药纳米粒是一种有前景的天然多反应性药物递送系统。
从雷公藤中分离到的雷公藤内酯(TPL) 和南蛇藤醇(CL) 具有广泛的生物活性, 可用于治疗胰腺癌, 但水溶性不好且有较大毒性。Ding等[52]通过去溶剂化法制备了TPLSF纳米粒(TPL-SFNPs) 和CLSF纳米粒(CL-SFNPs), 纳米粒的EPR效应可使药物在癌组织被动聚集, 降低毒性。在凋亡实验中发现TPL-SFNPs和CL-SFNPs均比各自的游离型更能有效地抑制胰腺癌细胞MIA PaCa-2和PANC-1, 且联合使用时细胞抑制增加, 具有协同作用。
3.1.3 荧光试剂许多亲水性或疏水性荧光试剂都可被SF递送, 用于追踪粒子或光热治疗, 如吲哚菁绿(ICG)[55]、罗丹明B[18]、阿尔辛蓝[18]、结晶紫[18]等。
ICG是一种近红外荧光染料, 由于光热转化效率显著, 生物相容性好, 广泛应用于生物医学成像、诊断和治疗, 但存在着水稳定性差、肠道吸收能力差、缺乏靶向性等不足。如图 2所示, Chen等[55]采取单步环保的超临界反溶剂(SAS) 工艺制备了包封ICG的SF纳米粒(ICG-SFNPs), 再将纳米粒尾静脉注射进小鼠, 利用pH响应性释放和近红外诱导, 对癌症进行光热治疗。ICG-SFNPs可有效减少ICG的降解并维持其光学活性, 且其比游离ICG在MCF-7细胞的细胞核附近累积量增多, 呈时间依赖性。体内光热治疗(PTT) 效率实验表明ICG-SFNPs在光的存在下能显著减小肿瘤体积, 破坏肿瘤细胞, 优于游离的ICG。
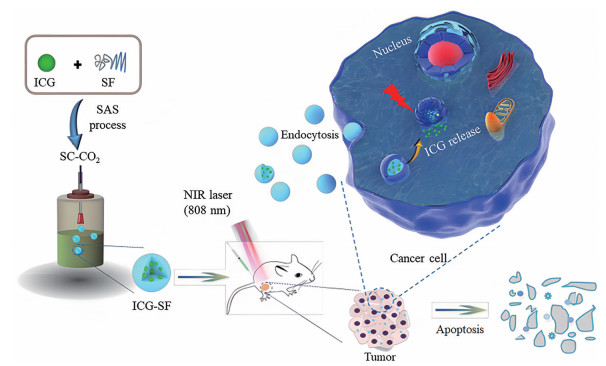
|
Figure 2 Schematic illustration showing the outline of preparation of indocyanine green-silk fibroin (ICG-SF) nanoparticles by the supercritical anti-solvent (SAS) process and dual-triggered cancer therapeutics. NIR: Near-infrared; SC: Supercritical. (Adapted from Ref. 55 with permission. Copyright © 2018 American Chemical Society) |
蛋白及多肽类药物主要包括生长因子、酶和其他蛋白及多肽类, 用于组织再生、催化反应或疾病治疗, 作用十分重要, 但在临床应用中面临许多问题, 如半衰期短、稳定性差、组织渗透有限、潜在毒性等。SF可安全有效地递送这些大分子化合物, 但目前研究多集中在体外实验, 有待于进一步研究[14]。
3.2.1 生长因子生长因子可刺激细胞生长和分化, 多用于组织再生领域。SF已在血管内皮生长因子(VEGF)[56]、血小板源性生长因子[57]、骨形态发生蛋白2[58]等有所应用。
VEGF能促进血管内皮细胞生长, Kundu等[56]使用去溶剂化法制备了SF纳米粒, 得到稳定、球形、带负电、平均粒径在150~170 nm的纳米粒, 且大部分呈β-折叠的结晶结构, 再将重组人源VEGF (rhVEGF) 溶液与SF纳米粒溶液过夜搅拌, 后经透析得到VEGF-SFNPs, VEGF和SF纳米粒间存在静电相互作用。不同浓度纳米粒与小鼠成纤维细胞L929孵育24 h后, 发现当浓度不超过100 mg·mL-1时, 细胞生存率较好, 不会引起细胞毒性。体外释放实验中, 纳米粒能在至少3周内缓慢释放VEGF, 且无突释现象, 延长了作用时间, 表明SF纳米粒用于生长因子的递送有一定前景。
3.2.2 酶大多数酶是有生物催化作用的一类蛋白质, 酶的缺乏可能会引起机体的严重失常。SF可用于酶的递送和固定化, 常见的有溶菌酶[59]、L-天冬酰胺酶[60]、Pin1异构酶[61]等, 增加这些酶的稳定性。
将重组蜘蛛丝蛋白eADF4 (C16) 用于酶的递送, 可减少天然SF的质量差异性。Hofer等[59]以溶菌酶为模型药物, 制备了载有溶菌酶的eADF4 (C16) 纳米粒, 在生理条件下, 带负电的该纳米粒与带正电的溶菌酶通过静电相互作用结合, 溶菌酶的装载效率能达到100%, 通过荧光标记发现溶菌酶不仅吸附在纳米粒表面, 还会扩散到基质中。溶菌酶的释放程度取决于释放介质的离子强度和pH值, pH减少或离子强度增加会削弱溶菌酶和eADF4 (C16) 纳米粒间的静电相互作用, 使溶菌酶从纳米粒中释放。该研究说明eADF4 (C16) 作为大分子药物载体有一定适用性, 可用于其他酶类递送的研究。
3.2.3 其他蛋白及多肽类SF还能用于递送胰岛素[62]、牛血清白蛋白[63]、抗原[64]等其他蛋白及多肽类药物, 维持其稳定性, 提高治疗效果。
胰岛素是治疗糖尿病常用的药物, 一般通过皮下注射给药, 但该药物易被蛋白酶水解, 且在血液中很短时间内活性就会丧失, 需频繁给药。SF可作为胰岛素生物偶联的载体, 能减少蛋白酶对水溶性胰岛素的水解。Yan等[62]通过加入0.7%戊二醇溶液使胰岛素和SF纳米粒发生交联反应, 再经甘氨酸溶液终止反应, 离心过滤后得到胰岛素SF生物偶联物(Ins-SFN)。酶联免疫分析(ELISA) 显示Ins-SFN的回收率为90%~115%, 体外实验表明, Ins-SFN可显著提高胰岛素在人血清和胰蛋白酶溶液中的稳定性, 在人血浆中的半衰期是胰岛素的2.5倍。
3.3 核酸类药物核酸类药物如质粒基因(pDNA)[65]、寡脱氧核苷酸[66, 67]、小干扰RNA (siRNA)[68]等主要用于基因治疗, 但其稳定性差、降解快且吸收少, 有效且成本合理的基因传递方法的缺乏显著阻碍了基因治疗的发展。SF作为载体可使基因穿过细胞或核内体膜等细胞内屏障并保护其免于降解, 还有高转染效率和DNA酶耐性, 可作为基因递送系统的载体。
PEI是一种转染效率高, 但具有细胞毒性的阳离子递送载体。Ma等[65]使用柞蚕中的SF (ASF) 与PEI结合使用, 作为可同时表达VEGF165和血管生成素-1 (Ang-1) 双基因的质粒的传递载体, 通过混合涡旋制备了ASF/PEI/pDNA复合物, ASF载体可保护pDNA不被核酸酶降解, 还显著改善了PEI对小鼠成纤维细胞L929的毒性, 提高细胞生存率。而与PEI/pDNA相比, 用ASF/PEI/pDNA转染时, 小鼠成纤维细胞L929和中国仓鼠肺成纤维细胞CHL的基因转染效率更高, VEGF的分泌也有所增加, 更有利于血管生成。
Song等[66]使用盐析法制备SFPEI纳米粒(SPPs) 和磁性SFPEI纳米粒(MSPPs), 再将纳米粒与c-myc反义寡脱氧核苷酸(ODN) 结合, 二者可能的结合机制是ODN包裹纳米粒形成球形复合物。细胞毒性结果发现SPPs和MSPPs作用时, 对人真皮成纤维细胞HDF的细胞毒性都远低于乳腺癌细胞MDA-MB-231。此外, 体外细胞摄取研究发现, SPP-ODN和MSPP-ODN均能将ODN递送进入乳腺癌细胞MDA-MB-231并显著抑制细胞生长, MSPP-ODN还可通过磁转染实现药物快速有效的吸收。
Shahbazi等[68]将壳寡糖(OC) 和SF结合, 作为递送siRNA的复合载体, 通过去溶剂化法制备了SF/OC/siRNA纳米粒。复合纳米粒的载药量、稳定性、细胞摄取和转染效率均优于OC单独作为载体的纳米粒, siRNA具有更好的基因沉默作用, 且细胞毒性也有所降低, 使得SF/OC成为一种具有强大潜力的基因载体。
4 总结与展望以去溶剂化法为代表的自下而上法是制备SF载药纳米粒的主要方法。目前已有广泛研究证明SF可用于递送小分子、蛋白及多肽类和核酸类药物, 可提高药物包封率、减少药物降解、控制药物释放、降低不良反应。此外, 利用SF纳米粒对pH/溶酶体酶/GSH/ROS内在刺激的选择性响应, 可设计靶向病灶部位按需释放药物的智能纳米粒药物递送系统。总之, 基于SF的纳米粒药物递送系统有着广阔的应用前景。
对于SF载药纳米粒的研究主要集中在癌症治疗上, 而目前临床上抗肿瘤药物纳米粒的首选载体材料之一是白蛋白。白蛋白是蛋白质类天然高分子材料, 人血清白蛋白(HSA) 稳定性高、生物相容性和生物降解性良好、无免疫原性、能进行结构修饰[69]。值得注意的是SF的基本性质和白蛋白相似, 还具有pH/溶酶体酶/GSH/ROS的内在刺激响应性, 且来源广泛, 获取成本远低于人血来源的白蛋白。但另一方面, 不同来源的SF存在差异性[70], silk II结晶结构的缓慢降解还使得SF不适合需快速完全从体内清除的情况[69], 这些可能是SF在药物递送系统应用的阻碍。转基因SF可实现质量一致性[71], 通过调整分子结构还能改变SF的降解速率, 也有作为药物递送载体材料的研究[59, 72], 是一种很有前景的解决策略。此外, 目前通常是实验室自行对SF进行提取和制备, 成熟的SF工业化分离、精制方法与产品仍较少见, 且尚无发达国家药典标准或有影响力的行业标准收载本品种; SF载药纳米粒的相容性和安全性试验也未见有全面的探讨。因此, 仍有大量基础与应用研究有待开展。
作者贡献: 陈智洋、叶军、王洪亮、杨艳芳、程佳玲、周航、刘玉玲共同参与了文章的撰写及修改。
利益冲突: 所有作者声明没有利益冲突。
| [1] |
Li C, Wang J, Wang Y, et al. Recent progress in drug delivery[J]. Acta Pharm Sin B, 2019, 9: 1145-1162. DOI:10.1016/j.apsb.2019.08.003 |
| [2] |
Su H, Wang Y, Liu S, et al. Emerging transporter-targeted nanoparticulate drug delivery systems[J]. Acta Pharm Sin B, 2019, 9: 49-58. DOI:10.1016/j.apsb.2018.10.005 |
| [3] |
Mathur AB, Gupta V. Silk fibroin-derived nanoparticles for biomedical applications[J]. Nanomedicine, 2010, 5: 807-820. DOI:10.2217/nnm.10.51 |
| [4] |
Date AA, Hanes J, Ensign LM. Nanoparticles for oral delivery: design, evaluation and state-of-the-art[J]. J Control Release, 2016, 240: 504-526. DOI:10.1016/j.jconrel.2016.06.016 |
| [5] |
Matteis VD. Exposure to inorganic nanoparticles: routes of entry, immune response, biodistribution and in vitro/in vivo toxicity evaluation[J]. Toxics, 2017, 5: 29. DOI:10.3390/toxics5040029 |
| [6] |
Mehnert W, Mader K. Solid lipid nanoparticles: production, characterization and applications[J]. Adv Drug Deliv Rev, 2001, 47: 165-196. DOI:10.1016/S0169-409X(01)00105-3 |
| [7] |
Estey T, Kang J, Schwendeman SP, et al. BSA degradation under acidic conditions: a model for protein instability during release from PLGA delivery systems[J]. J Pharm Sci, 2006, 95: 1626-1639. DOI:10.1002/jps.20625 |
| [8] |
Mohammed MA, Syeda JTM, Wasan KM, et al. An overview of chitosan nanoparticles and its application in non-parenteral drug delivery[J]. Pharmaceutics, 2017, 9: 53. DOI:10.3390/pharmaceutics9040053 |
| [9] |
Pascoli M, de Lima R, Fraceto LF. Zein nanoparticles and strategies to improve colloidal stability: a mini-review[J]. Front Chem, 2018, 6: 6. DOI:10.3389/fchem.2018.00006 |
| [10] |
Melke J, Midha S, Ghosh S, et al. Silk fibroin as biomaterial for bone tissue engineering[J]. Acta Biomater, 2016, 31: 1-16. DOI:10.1016/j.actbio.2015.09.005 |
| [11] |
Qi Y, Wang H, Wei K, et al. A review of structure construction of silk fibroin biomaterials from single structures to multi-level structures[J]. Int J Mol Sci, 2017, 18: 237. DOI:10.3390/ijms18030237 |
| [12] |
Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials[J]. Biomaterials, 2003, 24: 401-416. DOI:10.1016/S0142-9612(02)00353-8 |
| [13] |
Chirila TV, Suzuki S, Bray LJ, et al. Evaluation of silk sericin as a biomaterial: in vitro growth of human corneal limbal epithelial cells on Bombyx mori sericin membranes[J]. Prog Biomater, 2013, 2: 14. DOI:10.1186/2194-0517-2-14 |
| [14] |
Pham DT, Tiyaboonchai W. Fibroin nanoparticles: a promising drug delivery system[J]. Drug Deliv, 2020, 27: 431-448. DOI:10.1080/10717544.2020.1736208 |
| [15] |
Koh LD, Cheng Y, Teng CP, et al. Structures, mechanical properties and applications of silk fibroin materials[J]. Prog Polym Sci, 2015, 46: 86-110. DOI:10.1016/j.progpolymsci.2015.02.001 |
| [16] |
Vepari C, Kaplan DL. Silk as a biomaterial[J]. Prog Polym Sci, 2007, 32: 991-1007. DOI:10.1016/j.progpolymsci.2007.05.013 |
| [17] |
Mottaghitalab F, Farokhi M, Shokrgozar MA, et al. Silk fibroin nanoparticle as a novel drug delivery system[J]. J Control Release, 2015, 206: 161-176. DOI:10.1016/j.jconrel.2015.03.020 |
| [18] |
Lammel AS, Hu X, Park SH, et al. Controlling silk fibroin particle features for drug delivery[J]. Biomaterials, 2010, 31: 4583-4591. DOI:10.1016/j.biomaterials.2010.02.024 |
| [19] |
Rodriguez-Nogales A, Algieri F, Matteis LD, et al. Intestinal anti-inflammatory effects of RGD-functionalized silk fibroin nanoparticles in trinitrobenzenesulfonic acid-induced experimental colitis in rats[J]. Int J Nanomed, 2016, 11: 5945-5958. DOI:10.2147/IJN.S116479 |
| [20] |
Mottaghitalab F, Kiani M, Farokhi M, et al. Targeted delivery system based on gemcitabine-loaded silk fibroin nanoparticles for lung cancer therapy[J]. ACS Appl Mater Inter, 2017, 9: 31600-31611. DOI:10.1021/acsami.7b10408 |
| [21] |
Subia B, Chandra S, Talukdar S, et al. Folate conjugated silk fibroin nanocarriers for targeted drug delivery[J]. Integr Biol, 2014, 6: 203-214. DOI:10.1039/C3IB40184G |
| [22] |
Gou S, Huang Y, Wan Y, et al. Multi-bioresponsive silk fibroin-based nanoparticles with on-demand cytoplasmic drug release capacity for CD44-targeted alleviation of ulcerative colitis[J]. Biomaterials, 2019, 212: 39-54. DOI:10.1016/j.biomaterials.2019.05.012 |
| [23] |
Gou S, Yang J, Ma Y, et al. Multi-responsive nanococktails with programmable targeting capacity for imaging-guided mitochondrial phototherapy combined with chemotherapy[J]. J Control Release, 2020, 327: 371-383. DOI:10.1016/j.jconrel.2020.08.014 |
| [24] |
Wongpinyochit T, Uhlmann P, Urquhart AJ, et al. PEGylated silk nanoparticles for anticancer drug delivery[J]. Biomacromolecules, 2015, 16: 3712-3722. DOI:10.1021/acs.biomac.5b01003 |
| [25] |
Pham DT, Saelim N, Tiyaboonchai W. Crosslinked fibroin nanoparticles using EDC or PEI for drug delivery: physicochemical properties, crystallinity and structure[J]. J Mater Sci, 2018, 53: 14087-14103. DOI:10.1007/s10853-018-2635-3 |
| [26] |
Pham DT, Saelim N, Tiyaboonchai W. Alpha mangostin loaded crosslinked silk fibroin-based nanoparticles for cancer chemotherapy[J]. Colloids Surf B Biointerfaces, 2019, 181: 705-713. DOI:10.1016/j.colsurfb.2019.06.011 |
| [27] |
Teramoto H, Kojima K. Incorporation of methionine analogues into Bombyx mori silk fibroin for click modifications[J]. Macromol Biosci, 2015, 15: 719-727. DOI:10.1002/mabi.201400482 |
| [28] |
Minoura N, Aiba SI, Higuchi M, et al. Attachment and growth of fibroblast cells on silk fibroin[J]. Biochem Biophys Res Commun, 1995, 208: 511-516. DOI:10.1006/bbrc.1995.1368 |
| [29] |
Santin M, Motta A, Freddi G, et al. In vitro evaluation of the inflammatory potential of the silk fibroin[J]. J Biomed Mater Res, 1999, 46: 382-389. DOI:10.1002/(SICI)1097-4636(19990905)46:3<382::AID-JBM11>3.0.CO;2-R |
| [30] |
Meinel L, Hofmann S, Karageorgiou V, et al. The inflammatory responses to silk films in vitro and in vivo[J]. Biomaterials, 2005, 26: 147-155. DOI:10.1016/j.biomaterials.2004.02.047 |
| [31] |
Numata K, Cebe P, Kaplan DL. Mechanism of enzymatic degradation of beta-sheet crystals[J]. Biomaterials, 2010, 31: 2926-2933. DOI:10.1016/j.biomaterials.2009.12.026 |
| [32] |
Li MZ, Ogiso M, Minoura N. Enzymatic degradation behavior of porous silk fibroin sheets[J]. Biomaterials, 2003, 24: 357-365. DOI:10.1016/S0142-9612(02)00326-5 |
| [33] |
Lu Q, Hu X, Wang X, et al. Water-insoluble silk films with silk I structure[J]. Acta Biomater, 2010, 6: 1380-1387. DOI:10.1016/j.actbio.2009.10.041 |
| [34] |
You R, Xu Y, Liu Y, et al. Comparison of the in vitro and in vivo degradations of silk fibroin scaffolds from mulberry and nonmulberry silkworms[J]. Biomed Mater, 2015, 10: 15003. |
| [35] |
Zhao Z, Li Y, Xie MB. Silk fibroin-based nanoparticles for drug delivery[J]. Int J Mol Sci, 2015, 16: 4880-4903. DOI:10.3390/ijms16034880 |
| [36] |
Zhang YQ, Shen WD, Xiang RL, et al. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization[J]. J Nanopart Res, 2007, 9: 885-900. DOI:10.1007/s11051-006-9162-x |
| [37] |
Myung SJ, Kim HS, Kim Y, et al. Fluorescent silk fibroin nanoparticles prepared using a reverse microemulsion[J]. Macromol Res, 2008, 16: 604-608. DOI:10.1007/BF03218567 |
| [38] |
Zhao Z, Chen A, Li Y, et al. Fabrication of silk fibroin nanoparticles for controlled drug delivery[J]. J Nanopart Res, 2012, 14: 736. DOI:10.1007/s11051-012-0736-5 |
| [39] |
Qu J, Liu Y, Yu Y, et al. Silk fibroin nanoparticles prepared by electrospray as controlled release carriers of cisplatin[J]. Mater Sci Eng C Mater Biol Appl, 2014, 44: 166-174. DOI:10.1016/j.msec.2014.08.034 |
| [40] |
Gupta V, Aseh A, Rios CN, et al. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy[J]. Int J Nanomed, 2009, 4: 115-122. |
| [41] |
Wang X, Yucel T, Lu Q, et al. Silk nanospheres and microspheres from silk/PVA blend films for drug delivery[J]. Biomaterials, 2010, 31: 1025-1035. DOI:10.1016/j.biomaterials.2009.11.002 |
| [42] |
Wenk E, Merkle HP, Meinel L. Silk fibroin as a vehicle for drug delivery applications[J]. J Control Release, 2011, 150: 128-141. DOI:10.1016/j.jconrel.2010.11.007 |
| [43] |
Wenk E, Wandrey AJ, Merkle HP, et al. Silk fibroin spheres as a platform for controlled drug delivery[J]. J Control Release, 2008, 132: 26-34. DOI:10.1016/j.jconrel.2008.08.005 |
| [44] |
Seib FP, Jones GT, Rnjak-Kovacina J, et al. pH-dependent anticancer drug release from silk nanoparticles[J]. Adv Healthc Mater, 2013, 2: 1606-1611. DOI:10.1002/adhm.201300034 |
| [45] |
Totten JD, Wongpinyochit T, Seib FP. Silk nanoparticles: proof of lysosomotropic anticancer drug delivery at single-cell resolution[J]. J Drug Target, 2017, 25: 865-872. DOI:10.1080/1061186X.2017.1363212 |
| [46] |
Ma Y, Canup BSB, Tong X, et al. Multi-responsive silk fibroin-based nanoparticles for drug delivery[J]. Front Chem, 2020, 8: 585077. DOI:10.3389/fchem.2020.585077 |
| [47] |
Tian Y, Jiang X, Chen X, et al. Doxorubicin-loaded magnetic silk fibroin nanoparticles for targeted therapy of multidrug-resistant cancer[J]. Adv Mater, 2014, 26: 7393-7398. DOI:10.1002/adma.201403562 |
| [48] |
Subia B, Kundu SC. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers[J]. Nanotechnology, 2013, 24: 35103. DOI:10.1088/0957-4484/24/3/035103 |
| [49] |
Mao B, Liu C, Zheng W, et al. Cyclic cRGDfk peptide and Chlorin e6 functionalized silk fibroin nanoparticles for targeted drug delivery and photodynamic therapy[J]. Biomaterials, 2018, 161: 306-320. DOI:10.1016/j.biomaterials.2018.01.045 |
| [50] |
Yu S, Yang W, Chen S, et al. Floxuridine-loaded silk fibroin nanospheres[J]. RSC Adv, 2014, 4: 18171-18177. DOI:10.1039/C4RA02113D |
| [51] |
Wu P, Liu Q, Li R, et al. Facile Preparation of paclitaxel loaded silk fibroin nanoparticles for enhanced antitumor efficacy by locoregional drug delivery[J]. ACS Appl Mater Inter, 2013, 5: 12638-12645. DOI:10.1021/am403992b |
| [52] |
Ding B, Wahid MA, Wang Z, et al. Triptolide and celastrol loaded silk fibroin nanoparticles show synergistic effect against human pancreatic cancer cells[J]. Nanoscale, 2017, 9: 11739-11753. DOI:10.1039/C7NR03016A |
| [53] |
Lozano-Perez AA, Rivero HC, del Carmen Perez Hernandez M, et al. Silk fibroin nanoparticles: efficient vehicles for the natural antioxidant quercetin[J]. Int J Pharm, 2017, 518: 11-19. DOI:10.1016/j.ijpharm.2016.12.046 |
| [54] |
Lozano-Perez AA, Rodriguez-Nogales A, Ortiz-Cullera V, et al. Silk fibroin nanoparticles constitute a vector for controlled release of resveratrol in an experimental model of inflammatory bowel disease in rats[J]. Int J Nanomed, 2014, 9: 4507-4520. |
| [55] |
Chen BQ, Kankala RK, He GY, et al. Supercritical fluid-assisted fabrication of indocyanine green-encapsulated silk fibroin nanoparticles for dual-triggered cancer therapy[J]. ACS Biomater Sci Eng, 2018, 4: 3487-3497. DOI:10.1021/acsbiomaterials.8b00705 |
| [56] |
Kundu J, Chung YI, Kim YH, et al. Silk fibroin nanoparticles for cellular uptake and control release[J]. Int J Pharm, 2010, 388: 242-250. DOI:10.1016/j.ijpharm.2009.12.052 |
| [57] |
Farokhi M, Mottaghitalab F, Ai J, et al. Sustained release of platelet-derived growth factor and vascular endothelial growth factor from silk/calcium phosphate/PLGA based nanocomposite scaffold[J]. Int J Pharm, 2013, 454: 216-225. DOI:10.1016/j.ijpharm.2013.06.080 |
| [58] |
Shi P, Abbah SA, Saran K, et al. Silk fibroin-based complex particles with bioactive encrustation for bone morphogenetic protein 2 delivery[J]. Biomacromolecules, 2013, 14: 4465-4474. DOI:10.1021/bm401381s |
| [59] |
Hofer M, Winter G, Myschik J. Recombinant spider silk particles for controlled delivery of protein drugs[J]. Biomaterials, 2012, 33: 1554-1562. DOI:10.1016/j.biomaterials.2011.10.053 |
| [60] |
Zhang YQ, Wang YJ, Wang HY, et al. Highly efficient processing of silk fibroin nanoparticle-L-asparaginase bioconjugates and their characterization as a drug delivery system[J]. Soft Matter, 2011, 7: 9728-9736. DOI:10.1039/c0sm01332c |
| [61] |
Kim WJ, Islam R, Kim BS, et al. Direct delivery of recombinant Pin1 protein rescued osteoblast differentiation of Pin1-deficient cells[J]. J Cell Physiol, 2017, 232: 2798-2805. DOI:10.1002/jcp.25673 |
| [62] |
Yan HB, Zhang YQ, Ma YL, et al. Biosynthesis of insulin-silk fibroin nanoparticles conjugates and in vitro evaluation of a drug delivery system[J]. J Nanopart Res, 2009, 11: 1937-1946. DOI:10.1007/s11051-008-9549-y |
| [63] |
Huang D, Wang L, Dong Y, et al. A novel technology using transscleral ultrasound to deliver protein loaded nanoparticles[J]. Eur J Pharm Biopharm, 2014, 88: 104-115. DOI:10.1016/j.ejpb.2014.04.011 |
| [64] |
Hasanzadeh S, Farokhi M, Habibi M, et al. Silk fibroin nanoadjuvant as a promising vaccine carrier to deliver the FimH-lutA antigen for urinary tract infection[J]. ACS Biomater Sci Eng, 2020, 6: 4573-4582. DOI:10.1021/acsbiomaterials.0c00736 |
| [65] |
Ma C, Lv L, Liu Y, et al. Antheraea pernyi silk fibroin for targeted gene delivery of VEGF165-Ang-1 with PEI[J]. Biomed Mater, 2014, 9: 35015. DOI:10.1088/1748-6041/9/3/035015 |
| [66] |
Song W, Gregory DA, Al-Janabi H, et al. Magnetic-silk/polyethyleneimine core-shell nanoparticles for targeted gene delivery into human breast cancer cells[J]. Int J Pharm, 2019, 555: 322-336. DOI:10.1016/j.ijpharm.2018.11.030 |
| [67] |
Zhang H, Lai L, Wang Y, et al. Silk fibroin for CpG oligodeoxynucleotide delivery[J]. ACS Biomater Sci Eng, 2019, 5: 6082-6088. DOI:10.1021/acsbiomaterials.9b01413 |
| [68] |
Shahbazi B, Taghipour M, Rahmani H, et al. Preparation and characterization of silk fibroin/oligochitosan nanoparticles for siRNA delivery[J]. Colloids Surf B Biointerfaces, 2015, 136: 867-877. DOI:10.1016/j.colsurfb.2015.10.044 |
| [69] |
Hong S, Choi DW, Kim HN, et al. Protein-based nanoparticles as drug delivery systems[J]. Pharmaceutics, 2020, 12: 604. DOI:10.3390/pharmaceutics12070604 |
| [70] |
Gao SY, Xu YY, Li X. Advances in silk fibroin-based novel drug delivery systems[J]. Pharm Clin Res (药学与临床研究), 2021, 29: 371-376. |
| [71] |
Gou S, Huang Y, Sung J, et al. Silk fibroin-based nanotherapeutics: application in the treatment of colonic diseases[J]. Nanomedicine, 2019, 14: 2373-2378. DOI:10.2217/nnm-2019-0058 |
| [72] |
Xia XX, Xu Q, Hu X, et al. Tunable self-assembly of genetically engineered silk-elastin-like protein polymers[J]. Biomacromolecules, 2011, 12: 3844-3850. DOI:10.1021/bm201165h |
 2022, Vol. 57
2022, Vol. 57


