2. 江中药业股份有限公司, 江西 南昌 330049
2. Jiangzhong Pharmaceutical Co. Ltd., Nanchang 330049, China
粉体改性是指用物理或化学方法对微粒进行处理, 有目的地改变粉体的功能性质[1]。中药粉体改性是在质量源于设计理念的指导下, 基于粒子设计原理, 在粒子或分子水平进行结构设计, 以达到改善中药粉体功能性质的目的[2]。粉体的粉体学性质通常分为基本性质和功能性质。基本性质包括粒子密度、粒径及粒径分布、比表面积和孔隙率等; 功能性质包括流动性、润滑敏感性、压缩性、吸湿性、润湿性、崩解和溶出等。研究表明[3], 粉体的功能性质由基本性质所决定, 而基本性质主要由粒子结构决定。因此, 对中药粒子结构进行一定的修饰, 可在粒子水平显著改善粉体的功能性质, 为解决中药粉体易吸湿结块、流动性和压缩性差等难题提供了有效解决方案, 对推动中药固体制剂的现代化发展具有重要指导意义[3]。
目前中药粉体改性的相关研究主要集中在: ①采用不同改性方法改善中药粉体的直压性能以实现中药粉体的直接压片; ②降低中药粉体的吸湿速率与吸湿量, 防止中药粉体的黏连与结块; ③制备多孔结构以提高中药粉体的载药量与崩解行为等[3-8]。但对中药粉体改性机制的研究较为缺乏, 且鲜有关于中药粉体改性的总结与概述。本综述基于近十年的相关研究, 分别从粒子设计原理、粉体改性技术、粉体改性所用设备、在中药粉体中的应用及改性机制方面, 对中药粉体改性研究进展进行总结与讨论。
1 粒子设计原理粒子设计是指在不改变物质基础的前提下, 根据组方药物粉体性质的差异, 通过控制物料的加入顺序、制备工艺、工艺过程参数, 在微观层面对组方粉体进行精密的分散与重组, 构建分散均匀、性质稳定、具有特定结构与功能的重组粒子, 即复合粒子[3, 9]。结构设计包括粒子立体结构[10]如多孔结构、核壳结构等, 和分子结构如晶型、晶癖等; 功能设计包括粉体的分散均匀性、润湿性、流动性、压缩性、溶出速度和崩解时限等[11]。此外, 基于粒子设计的中药粉体可应用于粉末直接压片, 提高载药量和产率[4]。目前, 基于粒子设计原理的复合粒子的制备主要通过共处理技术实现。在共处理过程中, 表面自由能、界面张力、粒径大小、静电吸附、毛细管力、液体桥、范德华力、吉布斯自由能、粒子间的同频率运动等, 均会影响复合粒子结构的实现, 上述因素的共同作用实现了特定结构粒子的制备(图 1)[12-27], 通过粒子特定的结构对粒子自身功能性质的影响, 最终实现粒子的功能设计。
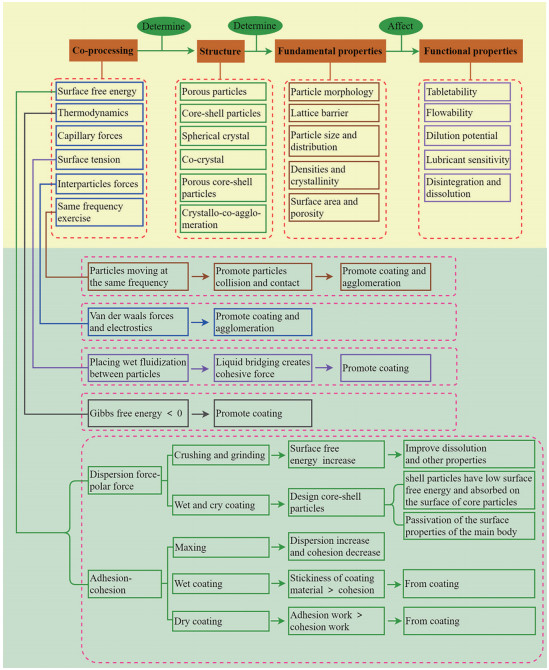
|
Figure 1 Principle of particle design |
在中药粉体改性中, 超微粉碎技术通过对物料冲击、碰撞、研磨、粉碎, 将原料粉碎至粒径约10 μm, 甚至更小[24, 25], 显著增加药物的溶出度并增强药效, 广泛应用于改善难溶性物质的溶出度和生物利用度[25]。将两种不同药物的粉末进行超微粉碎可制备具有“核壳”结构的复合粒子, 其粉体学性质得到提升, 可用于改善中药粉体的流动性、压缩性、溶出行为等[28]。
共研磨法将固体分散技术和超微粉碎进行结合, 以热力学为基础, 将物料和亲水性载体均匀混合后研磨一定时间, 物料和载体在氢键作用下结合, 得到结晶度变小、表面积增大、润湿分散性增强的固体分散体, 从而有效改善物料的溶解度和溶出速率[29-33]。
2.2 包衣法包衣改性具有掩味、调控释放、增加稳定性等优点, 可分为湿法包衣和干法包衣[34-36]。干法包衣技术使一种粒子黏附或者包覆在另一种颗粒表面, 过程无任何液体参与[34], 被包覆的粒子为主体粒子或核层粒子, 包覆粒子为客体粒子或壳层粒子, 其机制是通过干法包衣设备如流能磨、磁辅助冲击式涂层机、搅拌磨和共研磨机等给主体粒子和客体粒子提供一定的机械能, 使细小粒子渗入或者嵌入在较大颗粒的表面[37], 以改善粉体性能。Yuan等[38]以丹参和三七为主体粒子、二氧化硅为客体粒子, 进行干法包衣; 包衣后粉末休止角减小, 流动性得到显著改善(P < 0.01)。同样, Qu等[39]采用二氧化硅为壳层粒子, 对布洛芬粉末进行干法包衣, 包衣后其流动性和压缩性均得到显著改善。与干法包衣不同, 湿法包衣技术通常是一种或者多种改性材料溶液在一定溶剂中, 通过喷雾干燥、流化床底喷包衣、包衣锅等, 将包衣液包覆在需改性的粒子表面, 同时通过一定的热空气干燥, 除去水分, 在核粒子表面形成相对均一的壳层, 得到结构与性质均显著改善的复合粒子[40]。
2.3 结晶法基于粒子设计理论的新型结晶粉体改善技术主要包括球形结晶技术、聚晶技术、共晶技术[41, 42]。球形结晶技术最为常用, 主要包含球形聚集法和类乳浊液溶剂扩散法, 所制备的晶体通常呈球形, 可改善粉体的流动性和压缩性[41]。Gao等[43, 44]采用该技术成功制备了可直压的乙基纤维素, 结晶后的粉体流动性和压缩性都得到明显改善; 同样, 采用该方法制备的布洛芬颗粒的流动性和压缩性也得到显著改善。该技术可为中药单体粉体学性质的改善提供一定思路。
药物聚晶技术借助液体架桥剂和机械搅拌作用使得药物在液相状态中析出晶体, 同时与另外一种辅料的晶体或者微粒聚结成球形颗粒[45]。该技术最早用于克服传统球形结晶技术局限于制备水不溶性单一药物球晶的问题[45]。聚晶技术不仅可用于改善药物的粉体性质(制备的球晶具有良好流动性、压缩性、填充性), 实现了更多药物的直接压片, 扩大了粉末直接压片的应用范围; 而且还可在结晶过程中加入改性辅料和功能性高分子材料, 改善药物的溶出和释放速率, 提高生物利用度。Pawar等[46]对布洛芬和对乙酰氨基酚进行聚晶, 制备复方药物球晶, 进行直接压片, 并且加入PEG6000、EC改善释放度。
共晶是两种或两种以上的物质在非共价键作用下, 形成一种可电离的非盐形式的晶体配合物, 其形成过程主要通过氢键作用力[47]。药物共晶的制备方法包括研磨法、喷雾干燥法、电喷射法、纳米共结晶法、冷冻干燥法、超声和微波辅助共晶法、蒸汽扩散法、淤泥浆法和溶液法等[47]。共晶技术可在保证药物不改变药理性质的前提下, 改变或改善药物的溶解度、溶出速率、稳定性、吸湿性、流动性、压缩性和光热敏性[48]。实现共晶需要合适的共结晶剂, 可选用合适的药用辅料、食品添加剂等, 且必须要符合安全规定。
2.4 热熔挤出法热熔挤出技术最初主要用于塑料和高分子加工行业, 随后被引入制药行业, 在改善药物溶出等方面得到了广泛应用。热熔挤出技术将原药和聚合物辅料同时加入挤出机, 在单一挤出机中的药物和辅料进行混合-熔融-成型, 实现由原料药物由多相状态转为单相状态, 在强烈的混合和剪切作用下, 使得药物均匀分散在载体中, 以分子形式存在, 从而提高药物溶出度[49]。此外, 通过此工艺亦可制备缓释制剂或对药物掩味等[49]。
目前超微粉碎技术、干法包衣工艺、湿法包衣工艺均已成功应用到中药粉体改性中, 用于改善中药粉体的流动性、压缩性、润湿性、吸湿行为、崩解行为等。球形结晶技术、聚晶技术、共结晶技术等多用于改善单一成分的化药或辅料粉体的相关性质, 不适合成分复杂的中药粉体的改性, 但可借鉴这些技术用于中药单体物质的粉体性质的改善。
3 设备 3.1 粉碎与研磨设备粉碎与研磨设备按破坏物料分子间内聚力的方式可分为机械粉碎机、振动磨、流能磨等; 按粉碎力原理可分为干法粉碎和湿法粉碎[28], 湿法主要包括胶体磨和均质机, 干法主要包括机械式、气流式、搅拌式、振动式和球磨式等。常用设备包括机械粉碎机、气流式粉碎机、振动磨、搅拌磨及球磨机等[28]。
3.1.1 机械粉碎机机械粉碎机的工作原理是通过粉碎介质和粉碎零件, 在高速运动条件下给物料施加剪切、冲击、摩擦等外力, 使物料被粉碎, 具有效率高、粉碎比例大、结构简单、使用过程稳定等优点。普通粉碎机粉碎的粒径最小只能达到20 μm, 且易发热, 需对热敏性物料采取一定措施才能使用。随科技发展, CWJ超微粉碎机、MIC研磨剪切超细粉碎机解决了上述难题, 且得到的粉体粒径可达2 μm以下[50]。
3.1.2 气流式粉碎机气流式粉碎机即流能磨, 是在快速、高压气流作用下, 粒子间、粒子与容器壁间发生强烈的碰撞、冲击、摩擦, 从而使物料发生剧烈粉碎[28, 50]。气流式粉碎主要由进料、进气、粉碎、分级、收集、排气共6部分系统组成, 操作简便且能避免粉尘飞扬。
3.1.3 振动磨振动磨是一种通过振动介质研磨的粉碎装置, 在振动介质的高频振动之下产生挤压、摩擦、剪切等作用力以粉碎物料, 其填充率高, 可达60%~80%, 且振动能量大、适用性广。此外, 振动磨可与一些低温技术如水冷却技术联用, 从而避免震动过程中升温。目前常用的振动磨主要有Palla振动磨、三维振动磨、MTM型冲击磨[28, 50]。
3.1.4 球磨机球磨机主要靠衬板与研磨之间的冲击力将物料粉碎, 具有结构简单、粉碎比大、机械可靠性强、工艺成熟、适应性强的特点。但球磨机对于衬板材料的要求高, 必须能承受物料和研磨的冲击[28]。
3.1.5 搅拌磨搅拌磨是在球磨机的基础上发展起来的, 与普通球磨机相比, 其转速和介质填充率更高, 介质尺寸更小, 在研磨过程中产生的能量更大, 研磨所需时间也更短, 是目前超微粉碎机中能量利用率最高、应用最广的设备, 具有较好的发展前景。主要由研磨容器、输料泵、搅拌器、分散器和分离器组成。工作时, 搅拌器带动研磨介质转动, 物料和研磨介质和容器壁发生碰撞, 产生挤压、摩擦、剪切力, 从而使得物料粉碎[51]。
3.2 干法包衣设备干法包衣常用的设备有振动磨、流能磨、mechanofusion、hybrizer和theta-composer。此外, 亦有研究者采用Cyclomix、磁性辅助冲击式涂布机等实现粒子设计与粉体改性。它们虽然具有不同的涂布设备, 但是在包衣过程中的原理一致, 即在高剪切和高能作用下, 粒子间或粒子与装置间相互碰撞, 客体粒子或包衣材料包覆在主体粒子的表面[51]。
3.3 湿法包衣设备目前用于湿法包衣的设备主要有喷雾干燥设备、流化床设备、真空带式干燥设备等。喷雾干燥器种类较多, 按雾化器的结构可分为离心式、压力式、气流式[52]。实验室常用压力式喷雾干燥器, 在蠕动泵作用下, 液体按一定速度下进入干燥塔并被雾化或离心成小液滴, 在热气流作用下瞬时干燥成固体粉末, 再经过旋风分离器进行收集。采用喷雾干燥设备制备的粒子具有优良的功能性质, 广泛用于中药粉体的改性[53-55]。
流化床设备通常采用底喷工艺进行粉体包衣, 将粉体置于分布板上, 在热空气作用下进入流化状态, 同时底喷喷嘴喷出的雾滴在床体内自下而上运动, 包覆在粒子表面, 并在热空气作用下快速干燥, 完成包衣。流化床底喷包衣在一定程度上提高了包衣效率, 具有小巧、易操作、多功能的特点[27, 56]。
真空带式干燥将待干燥液体通过进料装置均匀分布在真空装置的传送上, 使用热传导或热辐射对物料加热干燥, 干燥后的物料经过冷却和切割处理再经过粉碎得到干产品(图 2), 具有干燥快、干燥时间短、动态控制和热效率高等优点, 且能对一些黏性高、易结块、具有热塑性与热敏性等不适合采用喷雾干燥的物料进行干燥[57]。Zhou等[58]研究了真空带式干燥和喷雾干燥两种工艺对灵芝皇粉体性质的影响, 与喷雾干燥相比, 真空带式干燥得到的粉体流动性更好、吸湿性更低, 其休止角由45.66°降低为37.50°, 临界相对湿度由67%增加为75%。同样, Liu等[59, 60]研究了喷雾、真空冷冻、真空带式3种干燥工艺对三七中皂苷成分的影响, 结果显示真空带式干燥所得样品的有效成分收率更高、含水量更低。
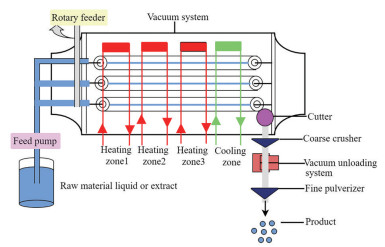
|
Figure 2 Vacuum belt dryer |
基于粒子设计的粉体改性技术不仅可用于改善成分单一的化药粉体的粉体学性质, 还可改善成分复杂的中药粉体的基本性质和功能性质。近年来, 粉体改性技术广泛用于改善中药粉体的流动性、压缩性、润湿性、吸湿性、崩解与溶出行为等, 在一定程度上推动了中药制剂的发展。
4.1 提高中药粉体的流动性不同改性方法在一定程度上均可改善中药粉体的流动性, 研究者通常采用休止角(AR)、流动性综合指数(FI)、Carr指数(CI)、流动因子(Ff)、Hausner ratio (HR) 等表征粉体的流动性[61-66]。其中, FI值越大、或AR值越小、或CI值越小、或Ff值越大、或HR值越小, 表明粉末的流动性越好[56, 67-71]。目前, 用于提高中药粉体流动性的改性材料主要有二氧化硅(SiO2)、羟丙甲纤维素(HPMC)、聚维酮(PVP) 等[61, 62, 65, 66], 常采用的工艺有干法包衣、超微粉碎、流化床底喷包衣、共喷雾干燥、共研磨等[61-67] (表 1[56, 61-70, 72])。笔者总结发现, 不同改性技术、改性剂种类和用量均对粉体流动性的改善具有重要影响[67-71], 其改性机制主要包括: ①粒子结构的改善。通过干法包衣技术, 加入合适的改性材料, 可有效改善粒子结构和表面形态, 使其形状更接近球形、表面更光滑、粒径更均一, 从而提高粉体流动性; ②加入SiO2等助流剂进行干法包衣, 可减少粒子间的摩擦, 提高粉体流动性; ③粒子的粒径及粒径分布的改变。通过流化床包衣、共喷雾干燥、干法包衣、超微粉碎共处理技术, 制备得到的复合粒子的粒径增加, 且粒径分布更均匀; ④颗粒间的范德华力降低。采用改性剂PVP、HPMC、SiO2等对中药原粒子进行包衣得到的复合粒子, 由于PVP、HPMC、SiO2有效包覆在原粒子表面, 增加了原粒子间的距离, 降低了原粒子间的接触面积, 从而降低了原粒子间的范德华力[71, 72]; ⑤晶形的变化。在液体中加入晶型诱导剂, 通过喷雾干燥法制备样品时, 物料的结晶习性或结晶形态会发生改变, 从而改变物料的流动性; ⑥粉末的黏附性降低。如采用SiO2改性后的粉体的堆密度、振实密度通常显著减小, 从而降低粒子间的黏附性; ⑦包衣材料的疏水作用。改性前, 中药粒子表面易吸湿形成水膜或粒子间凝结, 阻碍粉末的流动, 采用疏水性nano SiO2等材料进行包衣处理时, 可阻止空气中水分在粒子间的扩散。无论对单一成分的化药与辅料或成分复杂的中药粉体, 基于粒子设计的一系列改性方法均能在不同程度上改善物料的流动性。研究者亦尝试通过共处理制备流动性非常好的辅料, 用于中药制剂[71, 73, 74]。
| Table 1 The improvement of flowability. AR: Angle of repose; FI: Flowability index; CI: Carrs' index; Ff: Flow factor; HR: Hausner ratio; MCC: Microcrystalline cellulose; HPMC: Hydroxypropyl methylcellulose; PVP: Polyvinylpyrrolidone; PVPP: Polyvinylpolypyrrolidone |
基于粒子设计原理的粉体改性技术可有效改善中药粉体的压缩成型性, 对于实现中药粉体的直接压片具有重要作用。研究者通常采用压缩比、抗张强度、抗张强度曲线下面积、屈服压等来反映药物的可压缩性。通常采用SiO2[38, 62, 63]、PVP[75, 76]、HPMC[66, 72, 76-78]为改性剂, 通过共喷雾干燥[72, 78-83]、干法包衣[38, 62]、抗溶剂结晶、球形结晶、流化床包衣[56, 65-67, 76, 77]、超微粉碎[63, 75]等共处理技术制备复合粒子[76-83], 改善原料药物的压缩成型性(表 2[38, 56, 62, 63, 65-67, 72, 75-83])。改性机制主要包括: ①改善压缩性所使用的改性剂, 通常具有较好的黏合性和压缩性能, 在压缩过程中主要发生塑性形变, 且在改性过程中能有效包覆在原粒子表面, 如HPMC、PVP等; ②共处理制备的复合粒子的粒径分布更均一, 松散密度和振实密度更小, 导致粉末更松散, 因此在压片过程有更多的体积减少, 展现出良好压缩性; ③采用流化床底喷包衣改性过程中, 粒子间的碰撞、嵌合及液体桥或固体桥的形成均有利于提高物料的压缩成型性; ④共处理后, 表征物料压缩性能的粒子硬度与内聚性等质构参数显著增加; ⑤改善晶癖或晶型。与结晶状态相比, 无定形具有更强的塑性形变能力。在喷雾干燥等过程中, 合理调控过程参数或加入晶型诱导剂可使无定形的比例增加, 或制备利于压缩成型的晶型; ⑥颗粒的粒径和形状变化。通常情况下, 共喷雾干燥改性得到的复合粒子粒径更小、比表面积更大, 在压缩过程中, 可提供更多有效压缩位点, 促进压缩成型; 而通过流化床底喷包衣得到的粒子通常为类椭球形、且表面相对粗糙或凹凸不平, 在压缩过程中粒子间相互咬合, 提升压缩性。也有一些研究者尝试通过共处理制备压缩性显著改善的复合辅料, 如Li等[6]等通过喷雾干燥技术制备甘露醇-HPMC共处理辅料, 以栀子和白芍等5种中药提取物为模型药物, 考察共处理辅料在中药粉末直接压片中应用的可行性, 结果表明, 在中药粉体直接压片中, 此共处理辅料表现出比市售喷雾干燥甘露醇更好的压缩性和更高的载药量。
| Table 2 The improvements of compactibility. CR: Compression ratio; TS: Tensile strength; AUTCC: The area under the tensile strength curve |
基于粒子设计的粉体改性技术, 通过制备多孔材料或降低粒子粒径或改变物料的晶癖与晶型, 可有效提高难溶性药物的溶出和崩解[63, 74-90]。采用NaHCO3、NH4HCO3等遇热易产气的物质作为致孔剂, 通过共处理工艺制备高孔隙度的粒子; 或通过超微粉碎技术制备粒径非常小的复合粒子, 均可显著增加物料的比表面积, 从而增加物料与溶解介质的接触面积, 促进崩解与溶出[65, 80, 81]。通过加入晶型诱导剂或采用结晶改性技术, 可制备无定形粒子, 提高共处理粒子中无定形粒子的百分比。晶格势垒是结晶态粒子溶解的主要制约因素。无定形状态处于一种无序状态, 具有较高的自由能和较低的晶格势垒, 从而表现出较快的溶出行为。选用亲水性较强的改性剂如甘露醇、PVP等, 与药物共喷雾干燥处理得到的复合粒子, 不仅可具有较好的流动和压缩性, 同时具有较好的崩解行为; 同样, 采用亲水性多孔SiO2为改性剂制备的复合粒子, 在SiO2亲水效应和多孔效应的作用下, 溶出得到显著改善。但对于黏性较强的HPMC作为改性剂制备的复合粒子, 崩解相对延缓; 可通过加入不影响物料压缩性的超级崩解剂交联聚维酮(PVPP) 或制备多孔结构解决这一问题[65, 91] (表 3[63, 65, 80, 81, 84-91])。
| Table 3 The improvements of dissolution and disintegration performance. PEG: Polyethylene glycol |
粉体的润湿性对粉体在液体中的分散、混合、溶解等行为具有重要意义, 较好的润湿性可提高粉体的分散性和溶解性。通常采用接触角来反映物料的润湿性, 即液体在固体表面铺张的能力, 其值越小表明粉体在该液体中的润湿性能越好[92]。通常采用超微粉碎、研磨和干法包衣技术改善粉体的润湿性[92, 93]。改性机制主要包括: ①添加亲水性的改性剂, 乙醇和青黛共研磨处理后, 其接触角和未改性前相比降低57.9%, 润湿性得到显著提高; ②物料经微粉化改性处理后, 粒径减小, 比表面积增大, 暴露出更多的亲水活性位点, 改善润湿性, 便于粉体的后续处理(表 4[89, 92, 93])。
| Table 4 The improvements of wetting performance |
中药浸膏粉通常以无定型形式存在, 具有较强的吸湿性; 吸湿后易变软、结块甚至液化、霉变, 严重影响中药固体制剂的生产、运输、储存和产品质量, 采用粉体改性技术从源头上降低粉体的吸湿性具有重要意义和价值[63, 68]。粉体的吸湿性与粉体自身性质有关, 对于含多糖类物质以及吸附面积较大的粉体往往具有较强的吸湿性。研究者通常采用疏水性气相纳米二氧化硅或不易吸湿的辅料, 通过包衣工艺, 对吸湿性强的粉末进行表面包覆制备核壳型复合粒子, 以降低粉体的吸湿性[75, 94] (表 5[63, 68, 75, 94])。
| Table 5 Improved moisture absorption performance |
首先, 通过共处理, 改性剂附着于粉体表面形成一定的包覆结构, 使得中药粉体与外界的接触面降低, 减少粉体表面的活性吸附位点, 且毛细管通道在一定程度上被堵塞, 同时包覆在粒子表面的改性剂暴露出疏水性基团, 具有较低的吸湿性, 从而阻碍了空气中水分子在粉体表面的凝集及向粒子内部扩散。其次, 抑制粉体表面液体桥的形成。中药粉体中的极性基团与空气中水分子的羟基结合可形成液体桥, 导致粉体吸潮; 经过共处理后, 改性剂可覆盖在中药粉体表面阻碍液体桥的产生。
5 结语与展望基于粒子设计理论的粉体改性技术, 在不改变药物活性成分的前提下, 通过对初始粒子的结构进行修饰, 制备功能性质优良的粉体。通过粉体改性技术可显著改善粉体的流动性、压缩性、填充性, 调节药物释放, 提高生物利用度等, 对中药固体制剂的发展具有巨大推动作用。本综述从粒子设计原理、粉体改性技术、粉体改性所用设备、在中药粉体中的应用及改性机制方面, 对中药粉体改性研究进行全面概述与深入讨论, 为今后中药粒子设计与粉体改性技术奠定了系统的理论基础。
粒子设计理论是在宏观层面将辅料和工艺相统一, 形成相对系统和科学的解决方案, 提升工业生产效率、降低生产成本, 促进智能化生产, 最终满足临床需求。中药粉体具有独特性质, 应结合粉体与改性剂性质及各技术特点选择合适的改性技术和改性剂进行组合。超微粉碎技术能显著改善粉体粒径, 有效提高粉体溶解性。但超微粉碎改性技术涉及物料的冲击、碰撞、研磨、粉碎, 在快速冲击、研磨、粉碎的过程中容易产生大量热量, 因此不适合热不稳定粉体的改性; 且其制备的粉体粒径较小, 不利于粉体流动性的改善。喷雾干燥技术在一定程度可略微增大粉体的粒径, 但其粒径整体上依然偏小, 对粉体流动性的改善有限, 可通过加入适量助流剂如SiO2、滑石粉等改善其流动性; 此外, 亦可在液体中加入HPMC、PVP等共喷雾干燥来改善喷干过程的黏壁现象和粉体的压缩性、吸湿性等。喷雾干燥过程中, 物料在较高的进风温度下瞬时干燥, 相对适合遇热不稳定的药物。流化床包衣技术能显著改善粒子表面结构, 从而改善粉体的功能性质, 但流化床包衣过程需严格控制过程参数, 防止塌床现象的发生。黏性较强、含糖成分较高的物料不适合选用流化包衣技术进行粉体改性, 因将上述物料作为底料进行包衣时, 易发生塌床现象。聚晶、共晶、球形结晶技术仅适用于单体物质, 改变其结晶度, 改善单体物质的溶解、压缩、流动等性质, 可尝试应用于中药单体的粉体改性。
目前的报道大多集中在实验室规模的基础理论研究, 缺乏应用性研究的探索, 随着基础理论研究的进一步深入和完善, 可尝试并推动基于粒子设计理论的中药粉体改性技术向中试和大规模生产的方向延伸, 促进基础研究的应用与落地。同时, 应关注实验室研究到中试与放大生产过程中质量与热量的传递。此外, 粒子设计过程中, 应进一步加强粒子结构的定量表征, 为粉体改性过程中粒子结构的精准调控奠定一定的理论基础。
作者贡献: 朱卫丰提供文章撰写思路, 确定论文的整体设计与修改; 陈富财负责文献整理、图表制作及初稿撰写; 刘文君、管咏梅和陈丽华参与文章相关资料的调研; 明良山和李哲提供文章的框架设计, 负责全文的审阅与修改。
利益冲突: 所有作者均声明无利益冲突。
| [1] |
Zhou Y, Feng L, Zhang XF, et al. Research on application of Lingzhu Pulvis with particles design technology based on solvent evaporation method[J]. China J Chin Mater Med (中国中药杂志), 2021. DOI:10.19540/j.cnki.cjcmm.20211015.303 |
| [2] |
Yang M, Han L, Yang S, et al. Particle design technology for Chinese materia medica based on characteristics of traditional pill and powder[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 9-14. |
| [3] |
Li Z, Lin X, Shen L, et al. Composite particles based on particle engineering for direct compaction[J]. Int J Pharm, 2017, 519: 272-286. DOI:10.1016/j.ijpharm.2017.01.030 |
| [4] |
Li Z. Design of Traditional Chinese Medicine Composite Particles and Their Key Performance Improvement and Mechanism Research (中药复合粒子设计及其压片关键性能改善与机制研究) [D]. Shanghai: Shanghai University of Traditional Chinese Medicine, 2019.
|
| [5] |
Zhou MM. Research on Improving the Key Performance of Chinese Medicine Pueraria Lobata Extract Powder Tableting Through Porous Design (通过多孔设计改善中药葛根提取物粉体压片关键性能的研究) [D]. Shanghai: Shanghai University of Traditional Chinese Medicine, 2019.
|
| [6] |
Li JZ, Ruan HS, Lin X. Co-processing excipient mannitol-HPMC production process scale-up and its application in traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 2067-2073. |
| [7] |
Li Z, Li JZ, Lin X, et al. Direct compaction: an update of materials, trouble-shooting, and application[J]. Int J Pharm, 2017, 529: 543-556. DOI:10.1016/j.ijpharm.2017.07.035 |
| [8] |
Zhang Y, Li YP, Wu F, et al. Texture and surface feature-mediated striking improvements on multiple direct compaction properties of Zingiberis Rhizoma extracted powder by coprocessing with nano-silica[J]. Int J Pharm, 2021, 603: 120703. DOI:10.1016/j.ijpharm.2021.120703 |
| [9] |
Chen L, He ZZ, Kunnath KT, et al. Surface engineered excipients: III. Facilitating direct compaction tableting of binary blends containing fine cohesive poorly-compactable APIs[J]. Int J Pharm, 2019, 557: 354-365. DOI:10.1016/j.ijpharm.2018.12.055 |
| [10] |
Ming LS, Li Z, Wu F, et al. Research on compaction behavior of pharmaceutical powders based on surface free energy[J]. Acta Pharm Sin (药学学报), 2017, 52: 1170-1177. |
| [11] |
Chen M, Thalladi VR, Kim DK, et al. Harnessing ordered mixing to enable direct-compression process for low-dose tablet manufacturing at production scale[J]. Powder Technol, 2013, 239: 290-299. DOI:10.1016/j.powtec.2013.02.016 |
| [12] |
Xing X, Wang XP, Zhang DK, et al. Optimization and evaluation of intermediate uniformity in Chinese medicine pill powders based on particle design principle: exemplifying by Xiaojin Pills[J]. Acta Pharm Sin (药学学报), 2017, 52: 1611-1620. |
| [13] |
Zou JB, Feng L, Zhang XF, et al. Research on the practical application of particle design technology in the field of traditional Chinese medicine powder[J]. China J Chin Mater Med (中国中药杂志), 2021. DOI:10.19540/j.cnki.cjcmm.20210913.301 |
| [14] |
Cheverry E, Rojas J. Functionality enhancement of sorbitol and anhydrous calcium diphosphate composites for direct compression applications[J]. Int J Res Pharm Sci, 2014, 5: 299-303. |
| [15] |
Williams DR. Particle engineering in pharmaceutical solids processing: surface energy considerations[J]. Curr Pharm Des, 2015, 21: 2677-2694. DOI:10.2174/1381612821666150416100319 |
| [16] |
Puri V, Dantuluri AK, Kumar M, et al. Wettability and surface chemistry of crystalline and amorphous forms of a poorly watersoluble drug[J]. Eur J Pharm Sci, 2010, 40: 84-93. DOI:10.1016/j.ejps.2010.03.003 |
| [17] |
Li NN, Li GL, Wang HD, et al. Research progress of surface free energy's computing methods and the influence on the properties of material surface[J]. Mater Rev, 2015, 29: 30-35, 40. |
| [18] |
Otte A, Carvajal MT. Assessment of milling-induced disorder of two pharmaceutical compounds[J]. Pharm Sci, 2011, 100: 1793-1804. DOI:10.1002/jps.22415 |
| [19] |
Buckton G, Gill H. The importance of surface energetics of powders for drug delivery and the establishment of inverse gas chromatography[J]. Adv Drug Deliv Rev, 2007, 59: 1474-1479. DOI:10.1016/j.addr.2007.06.017 |
| [20] |
Papós K, Kása P Jr, Ilič I, et al. Effect of the surface free energy of materials on the lamination tendency of bilayer tablets[J]. Int J Pharm, 2015, 496: 609-613. DOI:10.1016/j.ijpharm.2015.10.061 |
| [21] |
Gamble JF, Leane M, Olusanmi D, et al. Surface energy analysis as a tool to probe the surface energy characteristics of micronized materials—a comparison with inverse gas chromatography[J]. Int J Pharm, 2012, 422: 238-244. DOI:10.1016/j.ijpharm.2011.11.002 |
| [22] |
Vehring R. Pharmaceutical particle engineering via spray drying[J]. Pharma Res, 2008, 25: 999-1022. DOI:10.1007/s11095-007-9475-1 |
| [23] |
Mullarney MP, Beach LE, Davé RN, et al. Applying dry powder coatings to pharmaceutical powders using a comil for improving powder flow and bulk density[J]. Powder Technol, 2011, 212: 397-402. DOI:10.1016/j.powtec.2011.06.008 |
| [24] |
Li YB, Li J, Liu BY, et al. Application overview on traditional Chinese medicine with ultra-fine powder[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2020, 35: 289-291. |
| [25] |
Qian SS, Gui SY, Yang MQ, et al. Research progress in ultrafine pulverization technology of traditional Chinese medicine[J]. J Shanghai Univ Tradit Chin Med (上海中医药大学学报), 2019, 42: 136-140. |
| [26] |
Ming LS, Li Z, Wu F, et al. Recent progress of particle design engineering based on surface free energy[J]. Chin Pharm J (中国药学杂志), 2017, 52: 1201-1207. |
| [27] |
Boyce CM. Gas-solid fluidization with liquid bridging: a review from a modeling perspective[J]. Powder Technol, 2018, 336: 12-29. DOI:10.1016/j.powtec.2018.05.027 |
| [28] |
Yang YJ, Zou JB, Zhang XF, et al. Research progress on superfine grinding technique in field of Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 5887-5891. |
| [29] |
Zhang DK, Guo ZP, Yang DX, et al. Design principle and application prospect of a novel Chinese medicine oral instant powders[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 3617-3622. |
| [30] |
Bolourchian N, Talamkhani Z, Nokhodchi A. Preparation and physicochemical characterization of binary and ternary ground mixtures of carvedilol with PVP and SLS aimed to improve the drug dissolution[J]. Pharm Dev Technol, 2019, 24: 1115-1124. DOI:10.1080/10837450.2019.1641516 |
| [31] |
Li F, Li LS, Wang SN, et al. Improved dissolution and oral absorption by co-grinding active drug probucol and ternary stabilizers mixtures with planetary beads-milling method[J]. Asian J Pharm Sci, 2019, 14: 649-657. DOI:10.1016/j.ajps.2018.12.001 |
| [32] |
Mao LJ, Wang YL, Li XM, et al. Co-grinding method improves the dissolution of lansoprazole[J]. Chin J Pharm (中国医药工业杂志), 2011, 42: 595-599, 606. |
| [33] |
Lu BB, Wang YL, Wang D, et al. Co-grinding method improves the in vitro dissolution of mosapride citrate[J]. West China J Pharm Sci (华西药学杂志), 2016, 31: 132-134. |
| [34] |
Albertini B, Bertoni S, Melegari C, et al. A novel approach for dry powder coating of pellets with ethylcellulose. Part I: evaluation of film formulation and process set up[J]. Int J Pharm, 2017, 516: 380-391. DOI:10.1016/j.ijpharm.2016.11.054 |
| [35] |
Macchi E, Felton LA. Influence of relative humidity during coating on polymer deposition and film formation[J]. Int J Pharm, 2016, 510: 116-124. DOI:10.1016/j.ijpharm.2016.05.063 |
| [36] |
Sauer D, Cerea M, Dinunzio J, et al. Dry powder coating of pharmaceuticals: a review[J]. Int J Pharm, 2013, 457: 488-502. DOI:10.1016/j.ijpharm.2013.02.032 |
| [37] |
Shi LM, Sun CQ. Transforming powder mechanical properties by core/shell structure: compressible sand[J]. J Pharm Sci, 2010, 99: 4458-4462. DOI:10.1002/jps.22172 |
| [38] |
Yuan JQ, Shi LM, Sun WJ, et al. Enabling direct compression of formulated Danshen powder by surface engineering[J]. Powder Technol, 2013, 241: 211-218. DOI:10.1016/j.powtec.2013.03.010 |
| [39] |
Qu L, Zhou QT, Gengenbach T, et al. Investigation of the potential for direct compaction of a fine ibuprofen powder dry-coated with magnesium stearate[J]. Drug Dev Ind Pharm, 2015, 41: 825-837. DOI:10.3109/03639045.2014.908901 |
| [40] |
Rojas J, Buckner I, Kumar V. Co-processed excipients with enhanced direct compression functionality for improved tableting performance[J]. Drug Dev Ind Pharm, 2012, 38: 1159-1170. DOI:10.3109/03639045.2011.645833 |
| [41] |
Pei XL, Ji Y. Spherical crystallization technology of drugs[J]. Chin J Exp Tradit Med From (中国实验方剂学杂志), 2015, 21: 210-216. |
| [42] |
Garala KC, Patel JM, Dhingani AP, et al. Quality by design (QbD) approach for developing agglomerates containing racecadotril and loperamide hydrochloride by crystallo-co-agglomeration[J]. Powder Technol, 2013, 247: 128-146. DOI:10.1016/j.powtec.2013.07.011 |
| [43] |
Gao S, Hu RF, Bai ZW, et al. Evaluation of micromeritics properties of the ethyloellulose directly compressed by spherical crystallization technique[J]. Chin J New drugs (中国新药杂志), 2011, 20: 905-908, 918. |
| [44] |
Ma X, Guan YZ, Li ST, et al. Improving the dissolution rate of tolbutamide with spherical crystallization technology[J]. Chin J Hosp Pharm (中国医院药学杂志), 1991, 11: 5-7, 49. |
| [45] |
Shen RF, Shan L, Gao CS. Advance on crystallo-co-agglomeration based particle engineering technique[J]. Chin Pharm J (中国药学杂志), 2014, 49: 1481-1485. |
| [46] |
Pawar AP, Paradkar AR, Kadam SS, et al. Crystallo-co-agglomeration: a novel technique to obtain ibuprofen-paracetamol agglomerates[J]. AAPS PharmSciTech, 2004, 5: 57-64. DOI:10.1208/pt050344 |
| [47] |
Xu M. Design, Synthesis and Properties of Co-crystals of Several Drugs (几种药物共晶的设计合成及性质研究) [D]. Lanzhou: Northwest Normal University, 2019.
|
| [48] |
Wang HR, Zhang CT, Liang WT. Preparation of erythritol-sucralose by melting co-crystallization method eutectic[J]. Mod Food Sci Technol (现代食品科技), 2017, 33: 228-232. |
| [49] |
Yang Y, Shen L, Li J, et al. Preparation and evaluation of metoprolol tartrate sustained-release pellets using hot melt extrusion combined with hot melt coating[J]. Drug Dev Ind Pharm, 2017, 43: 939-946. DOI:10.1080/03639045.2017.1287715 |
| [50] |
Meng Q, Fan H, Chen F, et al. Preparation and characterization of Dendrobium officinale powders through superfine grinding[J]. J Sci Food Agric, 2018, 98: 1906-1913. DOI:10.1002/jsfa.8672 |
| [51] |
Qu L, Morton DA, Zhou QT, et al. Particle engineering via mechanical dry coating in the design of pharmaceutical solid dosage forms[J]. Curr Pharm Des, 2015, 21: 5802-5814. DOI:10.2174/1381612821666151008151001 |
| [52] |
De Souza Lima R, Ré MI, Arlabosse P. Drying droplet as a template for solid formation: a review[J]. Powder Technol, 2020, 359: 161-171. DOI:10.1016/j.powtec.2019.09.052 |
| [53] |
Singh A, Van den Mooter G. Spray drying formulation of amorphous solid dispersions[J]. Adv Drug Deliv Rev, 2016, 100: 27-50. DOI:10.1016/j.addr.2015.12.010 |
| [54] |
Al-khattaui A, Koner J, Rue P, et al. A pragmatic approach for engineering porous mannitol and mechanistic evaluation of particle performance[J]. Eur J Pharm Biopharm, 2015, 94: 1-10. DOI:10.1016/j.ejpb.2015.04.011 |
| [55] |
Li JZ, Zhao LJ, Lin X, et al. Co-spray drying with HPMC as a platform to improve direct compaction properties of various tablet fillers[J]. AAPS PharmSciTech, 2017, 18: 3105-3115. DOI:10.1208/s12249-017-0794-1 |
| [56] |
Zhang W, Yu YT, Zhao LJ, et al. Improving compactibility properties of Lonicera Japonica Flos by Plasdone S-630[J]. Acta Pharm Sin (药学学报), 2021, 56: 2127-2135. |
| [57] |
Zhao LJ, Li JG, Pan YK. Application and research progress of vacuum belt dryer[J]. Chem Eng (化学工程), 2012, 277: 25-29. |
| [58] |
Zhou DY, Zhang X, Nie Y, et al. Quality comparison of Ganoderma lucidum powder by vacuum belt drying and spray drying[J]. Her Med (医药导报), 2020, 39: 1125-1128. |
| [59] |
Liu XS, Qiu ZF, Wang LH, et al. Research on vacuum belt drying process of Panax notoginseng extract[J]. China J Chin Mater Med (中国中药杂志), 2008, 33: 385-388. |
| [60] |
Qiu ZF. Research on Vacuum Belt Drying Process of Panax notoginseng Extract (三七提取物真空带式干燥工艺研究) [D]. Hangzhou: Zhejiang University, 2008.
|
| [61] |
Zeng RG, Jiang QY, Liao ZG, et al. Improvement of powder flowability and hygroscopicity of traditional Chinese medicine extract by surface coating modification technology[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2245-2249. |
| [62] |
Chattoraj S, Shi L, Sun CC. Profoundly improving flow properties of a cohesive cellulose powder by surface coating with nano‐silica through comilling[J]. J Pharm Sci, 2011, 100: 4943-4952. DOI:10.1002/jps.22677 |
| [63] |
Li J, Zhong Y, Hu PY, et al. Effects of ultrafine grinding and powder modification technology on the physical properties of glabrous sarcandra herb extract powders and qualities of the dispersible tablets[J]. Chin J Pharm (中国医药工业杂志), 2019, 50: 1304-1311. |
| [64] |
Yang YJ, Li JL, Wang M, et al. Innovation of pulvis modification technology in traditional Chinese medicine preparations: a case study of Shenling Baizhu Pulvis[J]. Chin Tradit Herb Drugs (中草药), 2020, 15: 3884-3893. |
| [65] |
Luo Y, Wu F, Shen L, et al. Improvement on the tableting properties of traditional Chinese medicine extracts by fluid-bed coating and pore forming[J]. Acta Pharm Sin (药学学报), 2020, 55: 2728-2735. |
| [66] |
Li Z, Xian JC, Wu F, et al. Development of TCM-based composite particles for direct compaction by particle design[J]. Powder Technol, 2018, 338: 481-492. DOI:10.1016/j.powtec.2018.07.014 |
| [67] |
Du Y, Yi QZ, Xiong YK, et al. Effect of fluidized bed technology on micromeritics properties of Leonurus Herba extract[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 2977-2983. |
| [68] |
Jiang YR, Zhang ZH, Ding DM, et al. Study on Xinyueshu spray drying assisted with copovidone and its effect on powder property[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 4067-4070. |
| [69] |
Yan HM, Jia XB, Zhang ZH, et al. Study on total flavonoids of Epimedium assisted with soybean polysaccharide spray-drying powder[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 2994-2998. |
| [70] |
Zhai WW, Dai JD, Liu LH, et al. Preparation and characterization of salvianolic acid-tanshinone composite micropowder for inhalation by co-grinding method[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 659-665. |
| [71] |
Zhou QT, Denman JA, Gengenbach T, et al. Characterization of the surface properties of a model pharmaceutical fine powder modified with a pharmaceutical lubricant to improve flow via a mechanical dry coating approach[J]. J Pharm Sci, 2011, 100: 3421-3430. DOI:10.1002/jps.22547 |
| [72] |
Dong QQ, Zhou MM, Lin X, et al. Differences in fundamental and functional properties of HPMC co-processed fillers prepared by fluid-bed coating and spray drying[J]. Eur J Pharm Sci, 2018, 119: 147-158. DOI:10.1016/j.ejps.2018.04.001 |
| [73] |
Li JZ, Wu F, Lin X, et al. Novel application of hydroxypropyl methylcellulose to improving direct compaction properties of tablet fillers by co-spray drying[J]. RSC Adv, 2015, 5: 69289-69298. DOI:10.1039/C5RA10496C |
| [74] |
Kaialy W, Maniruzzaman M, Shojaee S, et al. Antisolvent precipitation of novel xylitol-additive crystals to engineer tablets with improved pharmaceutical performance[J]. Int J Pharm, 2014, 477: 282-293. DOI:10.1016/j.ijpharm.2014.10.015 |
| [75] |
Chen LH, Shi TN, Wu Y, et al. Improving hygroscopicity of fermented Cordyceps powder based on particle design technology of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 1558-1563. |
| [76] |
Li Z, Wu F, Hong YL, et al. The fundamental and functional property differences between HPMC and PVP co-processed herbal particles prepared by fluid bed coating[J]. AAPS PharmSciTech, 2020, 21: 201-212. DOI:10.1208/s12249-020-01739-4 |
| [77] |
Li Z, Zhou MM, Wu F, et al. Direct compaction properties of Zingiberis Rhizoma extracted powders coated with various shell materials: improvements and mechanism analysis[J]. Int J Pharm, 2019, 564: 10-21. DOI:10.1016/j.ijpharm.2019.04.021 |
| [78] |
Zhang MS, Luo Y, Zhang Y, et al. Improvement on compatibility of the alcoholic extract of Zingiberis Rhizoma by co-spray drying with HPMC[J]. China J Chin Mater Med (中国中药杂志), 2021. DOI:10.19540/j.cnki.cjcmm.20210422.303 |
| [79] |
Xiong Y, Xiao JY, Gan XJ, et al. Effects of the granulation technique of lucidum polysaccharide on hygroscopicity and fluidity[J]. China Pharm (中国药师), 2020, 23: 1201-1204, 1207. |
| [80] |
Li JZ, Luo Y, Ruan HS, et al. Study on improvement and mechanism of tableting properties of porous Fagopyri Dibotryis Rhizoma powders[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 216-222. |
| [81] |
Zhu WF, Zhu L, Li Z, et al. The novel use of PVP K30 as templating agent in production of porous lactose[J]. Pharmaceutics, 2021, 13: 814. DOI:10.3390/pharmaceutics13060814 |
| [82] |
Li JZ, Wang YJ, Lin X, et al. Optimization of spray drying parameters for preparing the mannitol-HPMC co-processed excipients by central composite design-response surface methodology[J]. Chin J Pharm (中国医药工业杂志), 2015, 46: 1202-1207. |
| [83] |
Tanimura S, Tahara K, Takeuchi H, et al. Spray-dried composite particles of erythritol and porous silica for orally disintegrating tablets prepared by direct tableting[J]. Powder Technol, 2015, 286: 444-450. DOI:10.1016/j.powtec.2015.08.011 |
| [84] |
Wang XP, Han L, Ren GL, et al. Preparation and dissolution of andrographolide composite particles based on mechanical pulverization method[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 657-662. |
| [85] |
Liu YM, Wang X, Long JY, et al. Research progress of andrographolide solubilization preparation technology[J]. Pharm Clin Chin Mater Med (中药与临床), 2019, 10: 75-79. |
| [86] |
Ren GL, Han L, Wang XP, et al. Influence of Angelica powder micronization with wine on its micromeritic properties and dissolution[J]. Chin Tradit Pat Med (中成药), 2015, 37: 762-767. |
| [87] |
Tang XL, Lin YN, Zhang LH. The effect of superfine powder solid dispersion technology on the dissolution of index components of Danshen tablets[J]. Chin J Hosp Pharm (中国医院药学杂志), 2018, 38: 1617-1619. |
| [88] |
Zhang FJ, Qu JT, Wang Q. Effects of ultrafine grinding technology on the dissolution of triterpenoids from Ganoderma lucidum[J]. China Pharm (中国药房), 2018, 29: 599-602. |
| [89] |
Zhou X, Li JL, Zou JB, et al. Effect of particle design on pharmacokinetics of Shenling Baizhu Pulvis in rats[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 4925-4933. |
| [90] |
Qin ZM, Deng JY, Zhang DL, et al. Effects of superfine grinding technology on powder properties and dissolution of oyster shell[J]. China Pharm (中国药房), 2019, 30: 2216-2220. |
| [91] |
Li SK, Wang J, Tong M, et al. Properties and dissolution of curcumin-PVP co-grinding powder[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 5949-5955. |
| [92] |
Zhang DK, Lin JZ, Liu JY, et al. Powder modification technology used for the preparation of the hydrophilic decoction pieces of Indigo Naturalis and the modification principle[J]. Acta Pharm Sin (药学学报), 2013, 48: 1148-1155. |
| [93] |
Qin CF, Han L, Zhang DK, et al. The influence of ultrafine grinding and powder modification on the wettability and surface free energy of Qingdai decoction[J]. Chin Tradit Pat Med (中成药), 2013, 35: 2475-2479. |
| [94] |
Jiang QY, Zeng RG, Zhao GW, et al. Study on the influence of surface coating modification process parameters on the fluidity and hygroscopicity of traditional Chinese medicine extract powder[J]. Jiangxi J Tradit Chin Med (江西中医药), 2017, 48: 63-65, 80. |
 2022, Vol. 57
2022, Vol. 57


