2. 美国爱荷华大学药理系, 爱荷华州 爱荷华市 50011
2. Department of Pharmacology, Iowa University, Iowa City 50011, USA
靶向递药系统(targeting drug delivery system, TDDS) 是指药物被适宜的载体通过局部用药或全身血液循环而特异性聚集定位于特定组织、器官及细胞的给药系统[1]。目前, 药物靶向递送主要集中在器官、组织或细胞上, 而药物主要在细胞中亚细胞器的蛋白质、核酸等物质(靶) 点发挥作用。作为细胞器靶向递药优点更突出, 具有更好的减毒增效和药物利用作用[2]。因此, 改变药物的细胞内输送与分布至特定细胞器(如溶酶体、线粒体和内质网等) 输送的技术研究成为当前药物递送系统构建及研究的热点课题。
目前, 利用机体自身免疫系统杀伤作用的肿瘤免疫应答为抗肿瘤治疗提供了全新的临床思路。肿瘤免疫疗法通过激活先天性和适应性免疫过程, 以特异性方式精确逆转抑制性微环境、识别标志性抗原而杀伤肿瘤细胞[3]。此疗法的优势在于通过免疫细胞的记忆实现长期反应且不会产生不良反应。肿瘤免疫治疗已逐步发展并正在成为现今杀伤肿瘤的主要方法之一[4]。尽管免疫治疗后能够实现肿瘤完全消退, 但主要问题是治疗的响应率比较低。肿瘤微环境(tumor microenvironment, TME) 与免疫细胞间的相互作用干扰免疫细胞发挥正常功能。因此, 深入研究TME与免疫疗法间的影响机制格外重要。
本文整理了肿瘤细胞亚细胞器内药物靶向与肿瘤发展的关系, 并着重从基于提高TME的pH值、活性氧(reactive oxygen species, ROS) 及还原性物质含量高、免疫原性低, 以及免疫抑制细胞等肿瘤微环境特点的药物递送系统构建进行归纳, 最后分析了目前的不足和未来发展, 为亚细胞器靶向给药系统在肿瘤免疫治疗的研究等方面提供必要参考。
1 细胞器内药物靶向与肿瘤治疗 1.1 药物的细胞器靶向细胞器是胞内的子器官, 其活性及化学成分为细胞的正常生长、修复及增殖提供能量。细胞器各组分间各司其职, 协同细胞完成正常的生理功能。内体和溶酶体完成胞内自噬过程, 有助于消化细胞内异物, 是细胞防御的第一道防线[5]; 线粒体有助于监测细胞凋亡级联反应、钙循环和腺苷三磷酸(adenosine triphosphate, ATP) 合成等[6]; 细胞核进一步促进脱氧核糖核苷酸(deoxyribonucleic acid, DNA) 管理、基因表达和细胞增殖[7]; 内质网和高尔基体是蛋白质合成和“加工厂”[8, 9], 不仅可维持细胞正常生理活动, 同时在肿瘤的消融、凋亡、自噬和坏死等多种抑制转移途径中发挥着不可替代的作用。因此, 设计针对亚细胞器的靶向递药与治疗有助于提高抗肿瘤作用(表 1[10-35]), 对抗肿瘤的治疗效率有所提升; 另一方面, 可以解决由于过早渗漏和耐药导致的使用剂量过高的难题, 减少由此类问题造成的细胞毒性反应和不良反应, 达到较好的抗肿瘤治疗效果[36]。
| Table 1 Way of organelle targeted delivery. TPP: Triphenylphosphonium; SWNT: Single-walled carbon nanotubes; MPTP: 1-Methyl-4-phenyl-1, 2, 3, 6-tetrahydropyri-dine; α-TOS: α-Tocopherol succinate; CPT: Camptothecin; DMA: Dimethylarsinic acid; PCPK: PpIX-C-PEG-KKKKKKSKTKC-OMe; APZ: Autophagonizer; HCQ: Hydroxychloroquine |
内质网应激(endoplasmic reticulum stress, ERS) 在肿瘤细胞中发挥着至关重要的作用[37]。由于失控的细胞增殖, 恶性肿瘤在形成和生长过程中对蛋白质的分泌需求异常增加, 且细胞突变会影响蛋白质分泌路径从而阻碍其折叠。此外, 入侵或转移到外部环境中可使肿瘤细胞暴露于缺氧、氧化应激、葡萄糖剥夺和乳酸性酸中毒等劣性条件下。这些情况均对内质网中的蛋白质加工造成巨大压力[38, 39], 导致内质网中蛋白质错误折叠积累, 达到一定限度引起ERS[40], 而激活未折叠蛋白质反应(unfolded protein reaction, UPR)。在肿瘤的发生发展过程中, UPR可抑制肿瘤细胞生长, 但同时, 缺氧等不利环境反而有利于肿瘤细胞的生存、发展和转移。通过改善内质网膜如改善其流动性[18]、提高其融合性[19]、增加其通透性[20]均有助于抑制肿瘤生长。
1.2.2 高尔基体与肿瘤发展高尔基体调控肿瘤的新陈代谢是进行肿瘤治疗的潜在策略。由于肿瘤细胞处于增殖失控的状态, 恶性肿瘤细胞的高尔基体膨胀变形, 为其活跃的新陈代谢和蛋白质分泌提供便利条件[41]。高尔基体作为信号分子的交通枢纽参与肿瘤细胞的转移[42, 43], 高尔基体的结构完整性严重影响细胞迁移、侵袭和血管生成等信号通路的转运[34]。因此, 肿瘤细胞的高尔基体可作为抗肿瘤治疗的特殊靶点, 靶向破坏高尔基体的功能和结构是抑制肿瘤细胞生长和转移的有效方法[32, 33]。
1.2.3 线粒体与肿瘤发展线粒体是细胞的能量代谢中心, 其生成、融合分裂及功能异常与肿瘤等多种疾病发生密切相关。由于肿瘤细胞具有抗细胞凋亡、持续产生增殖信号等特征, 其线粒体大多具有外膜通透性差、凋亡信号释放不及时等功能障碍, 线粒体也由此成为肿瘤治疗的特异性靶点。线粒体在肿瘤细胞中具有重要作用, 其可利用电子传递链和氧化磷酸化将碳水化合物分解产生ATP, 为细胞代谢供给能量[44]。线粒体在肿瘤细胞遇到刺激时会释放位于膜间隙内的细胞色素C和凋亡相关因子, 激活半胱天冬酶与细胞凋亡相关通路, 所以改变线粒体外膜通透性的相关影响因素如促进线粒体膜通透性转孔开放[13]、增强B淋巴细胞瘤-2 (B-cell lymphoma-2, Bcl-2) 家族蛋白对线粒体外膜通透性的调控[14]均会引起线粒体因膨胀而破裂, 最终诱导细胞凋亡[45]。与此同时, 由于线粒体跨膜电位(mitochondrial transmembrane potential, MTP) 内负外正, 尤其在肿瘤细胞中MTP增高。因此, 正电性制剂[10-12]进入细胞, 在肿瘤细胞高MTP的驱动下, 靶向至线粒体中。随后释放出的生物活性分子在线粒体中积聚, 表现出线粒体毒性, 诱发肿瘤细胞死亡或凋亡。
1.2.4 溶酶体与肿瘤发展溶酶体损伤可触发细胞不同死亡方式并参与肿瘤的发生发展[27]。肿瘤细胞的快速增殖依赖于蛋白质、膜脂、DNA的快速合成, 因而对于细胞内部组分的回收和再利用过程的调控格外重要。在肿瘤形成过程中, 溶酶体的数量、形态、腔内pH值、水解酶含量和细胞内分布均发生变化[46]。高活性自噬溶酶体系统对多种肿瘤包括乳腺癌、肺癌等的生长具有重要作用[47], 改变溶酶体膜通透性[48]、破坏溶酶体膜完整性[28, 29]、操纵肿瘤细胞自噬溶酶体功能[30, 31]对于延缓肿瘤的发生发展有显著作用, 由此胞内溶酶体逐渐同样成为了肿瘤治疗的新靶点。
2 TME概述TME是指在肿瘤发生及发展过程中所处的内外生理部位, 通常为酸性、缺氧和免疫抑制的生物环境, 可为肿瘤细胞分化增殖提供支持和屏障, 为肿瘤增殖、侵袭和转移提供有利条件, 从而促进肿瘤的发生和发展[49]。
2.1 TME的基本特征TME是一个复杂的动态网络系统, 其相互作用贯穿于肿瘤发生发展的全过程。肿瘤组织快速增殖需消耗大量能量, 其主要能量供应方式由有氧呼吸转化成无氧糖酵解, 生成大量乳酸形成酸性环境。此外, 肿瘤细胞内的ROS浓度是正常细胞的100倍, 谷胱甘肽(glutathione, GSH) 浓度是正常细胞的5~10倍。与正常细胞相比, 肿瘤细胞的氧化还原动态平衡易被打破而呈现氧化应激态, 进而发生凋亡或死亡[50]。其次, 肿瘤对免疫治疗表现出低反应性最直接原因是多数肿瘤免疫原性低。研究表明, 免疫原性(热) 肿瘤中T细胞共刺激分子的存在明显增加, 而非免疫原性(冷) 肿瘤则缺乏这些成分[51]。高免疫原性肿瘤组织中通常有大量的免疫活性细胞浸润, 更易诱导宿主的强免疫反应, 免疫治疗对高免疫原性肿瘤易奏效。而低免疫原性肿瘤与之相反, 更易逃逸机体免疫的破坏。免疫原性低的肿瘤更可能对免疫疗法无反应, 从而限制了临床治疗效果[52]。TME的细胞组成主要包括免疫细胞、间充质细胞、内皮细胞和细胞外基质。而免疫细胞、间充质细胞和内皮细胞可分泌多种直接作用于肿瘤细胞的细胞因子, 如转化生长因子-β (transforming growth factor-β, TGF-β) 和肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α), 共同形成抑制性免疫微环境, 使肿瘤细胞能躲避机体免疫系统的攻击, 最终实现免疫逃逸[53]。
TME中有多种免疫细胞浸润, 这些细胞与TME相互协调, 共同构成了免疫抑制性微环境。T细胞是免疫系统中的重要功能细胞, 在TME中有几种不同功能的亚型, 其中细胞毒性T细胞(cytotoxic T lymphocyte, CTL) 发挥肿瘤杀伤作用, 而调节性T细胞(regulatory T, Treg) 作用是减弱效应T细胞的杀伤活性, 促进TME的免疫抑制。髓源性抑制细胞(myeloid-derived suppressor cell, MDSC) 是一种免疫负调控细胞, 在TME中能抑制T细胞激活和多种免疫细胞的活性, 具有一定的促肿瘤生长作用。肿瘤相关巨噬细胞(tumor-associated macrophage, TAM) 是另一种髓系来源的免疫细胞, TAM在TME中主要为M2型, 通过分泌Th2细胞因子促进血管生成和肿瘤侵袭。
2.2 TME的免疫抑制作用免疫系统拥有识别和杀伤肿瘤细胞的能力, 但在肿瘤浸润组织中, 免疫系统无法发挥应有的作用。造成肿瘤细胞可成功逃避机体免疫监视的根本原因是肿瘤组织的局部免疫抑制状态。因此, 通过多种方法改善TME的局部免疫抑制状态, 恢复或增加机体免疫系统对肿瘤的识别和杀伤能力是目前研究的热点[49]。
3 TME调节型药物递送系统 3.1 调节TME的pH值肿瘤细胞通过摄取大量葡萄糖为自身生长和存活提供所需能量。在未转化的细胞中, 葡萄糖通过有氧代谢被氧化生成ATP, 但肿瘤细胞主要通过糖酵解获得ATP, 此过程被称为“Warburg效应”。肿瘤细胞能产生所需的ATP, 但反过来也会以氢的形式产生酸离子。与正常组织不同的是, 肿瘤在生长过程中pH梯度发生逆转, 同时维持细胞内碱性pH值和细胞外酸性pH值。肿瘤多种进展均与这种pH梯度相关, 包括肿瘤生长、逃逸和侵袭。
3.1.1 调节溶酶体pH值溶酶体是酸性环境, 其将抗肿瘤药物隔离在酸性条件下, 严重影响药物发挥正常作用。但近年来有基于溶酶体酸性环境进而治疗多形性胶质母细胞瘤(glioblastoma multiforme, GBM) 的研究。Hong等[25]研究发现一种从白头翁根中提取的皂苷药物SB365, 可通过触发caspase非依赖性细胞死亡, 实现对GBM的相关治疗。应用SB365后, 自噬通量的抑制和溶酶体pH的中和迅速发生, 线粒体膜电位下降, 显示出GBM治疗的良好前景。Zhang等[26]研究发现增加pH和降低组织蛋白酶D活性可导致溶酶体功能障碍, 提高GBM细胞对顺铂的敏感性, 调节溶酶体pH已成为治疗GBM的有效方法之一。
3.1.2 调节高尔基体pH值高尔基体内的酸碱平衡会影响许多不同的生物过程。Galenkamp等[35]研究发现抑制NHE7 (sodium-hydrogen exchangers-7) 会导致高尔基体碱化及胞质酸积累, 进而细胞肌动蛋白失调致使肿瘤细胞适应性下降。另外, NHE7在体内的下调导致了肿瘤生长的消除。这些结果证实高尔基体碱化可能是肿瘤治疗的弱点。
3.2 ROS生成与扩增ROS不可逆地氧化并破坏邻近的生物分子, 从而影响细胞的代谢与生理活性。由于ROS的寿命短且活性半径非常有限, 在保持ROS活性的同时将其输送到所需部位显得非常重要。目前已报道的细胞核、线粒体、细胞膜等亚细胞靶向策略能显著增强ROS的活性并提升抗肿瘤效果(图 1[15, 22])。
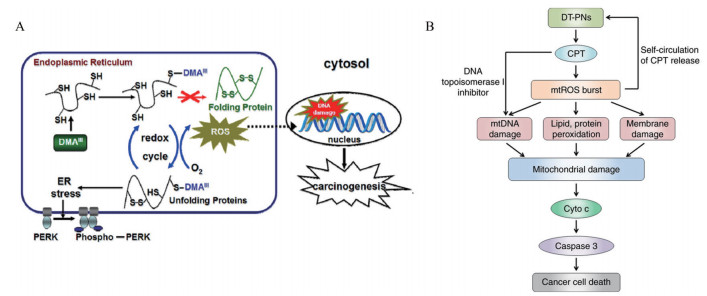
|
Figure 1 Subcellular targeting strategy can significantly enhance the activity of reactive oxygen species (ROS). A: Proposed mechanisms underlying the dimethylarsinous acid (DMAIII)-induced endoplasmic reticulum (ER) stress. (Adapted from Ref. 22 with permission. Copyright © 2012 Elsevier Inc.); B: Proposed mechanism for the mitochondria-specific self-circulation of CPT release and mtROS burst to damage mitochondria and initiate cell apoptosis/death by DT-PNs. [Adapted from Ref. 15 with permission. Copyright © The Author(s) 2019]. DT-PNs: Dual-targeted polyprodrug nanoreactors; SH: Sulfhydryl group; PERK: Protein kinase RNA-like ER kinase; mtROS: Mitochondrial ROS; Cyto C: Cytochrome C |
能量代谢是抗肿瘤治疗中有希望的靶标。具有相关囊泡和转运系统的高尔基体作为ROS的潜在来源是细胞代谢稳态中涉及最多的细胞器, 其直接或间接参与了能量代谢信号传导途径。因此靶向高尔基体、干扰能量代谢从而抑制肿瘤细胞生长是潜在的治疗手段。Li等[54]研究发现GOLPH3是高尔基体来源的应激相关蛋白, 与细胞内氧化应激水平呈正相关。在氧糖剥夺/复氧过程中, GOLPH3通过减少脑源性神经营养因子的分泌以及促进p75神经营养因子受体的降解介导高尔基体应激相关信号参与到氧化应激中, 并通过促进ROS的生成及影响应激后早期自噬体的形成, 最终促进凋亡的发生。
3.2.2 ROS与线粒体氧化应激线粒体代谢、融合分裂及ROS生成均影响CD8+ T细胞的生长与增殖。CD8+ T细胞中线粒体形态和功能明显异常, 主要体现在线粒体嵴的数目和长度明显减少以及线粒体片段化。Li等[55]发现增强CD8+ T细胞的线粒体生成可作为提高肿瘤治疗效果的潜在靶点。然而线粒体功能异常与直接诱导T细胞耗竭之间的关系仍不清楚。Yu等[56]发现线粒体自噬的缺陷及线粒体ROS大量产生可导致CD8+ T细胞耗竭。通过构建体外诱导T细胞耗竭模型, Vardhana等[57]发现慢性抗原刺激可破坏T细胞内线粒体的氧化磷酸化能力, 引起线粒体氧自由基累积进而导致细胞增殖及自我更新能力下降, 并进一步诱导T细胞耗竭。还有研究发现, 使用小分子化合物N-乙酰半胱氨酸(N-acetylcysteine, N-AC) 靶向线粒体氧化应激反应可明显延缓线粒体氧自由基产生并提高CD8+ T细胞抗肿瘤活性[58]。N-AC是一种含巯基化合物, 在体内脱乙酰基后变为半胱氨酸, 进而参与还原型GSH的合成, 具有抗氧化作用。利用N-AC脂质体预处理A549细胞可明显抑制百草枯诱导的细胞内GSH的下降和ROS的合成, 从而维持细胞正常的氧化还原状态。此外, N-AC脂质体还可改善百草枯诱导的线粒体膜电位下降, 保护线粒体免受氧化损伤。
3.2.3 ROS活性与线粒体扩增由于肿瘤基因刺激、代谢活性增加和线粒体功能紊乱等因素, 肿瘤细胞的ROS水平高于正常细胞。在持续的氧化应激情况下, 肿瘤细胞通过一系列通路得以适应, 不仅激活ROS清除系统, 也会抑制细胞凋亡。与正常细胞相比, 肿瘤细胞内含有的ROS水平略有升高, 细胞内约90%的ROS均在线粒体中产生。原位线粒体ROS扩增是一种有前途的抗肿瘤治疗策略。Zhang等[15]设计了一种ROS响应型、肿瘤细胞和线粒体双靶向纳米递送系统, 用于递送细胞呼吸抑制剂喜树碱(camptothecin, CPT)。该系统原位释放的CPT诱导线粒体活性氧(mitochondrial ROS, mtROS) 上调, 从而实现CPT释放和mtROS暴发的后续自循环。mtROS的扩增赋予长期高氧化应激以诱导癌细胞凋亡。该策略可避免传统光动力疗法(photodynamic therapy, PDT) 的治疗效果受穿透深度、光照受限等外源光的限制。
3.2.4 ROS与ERS氧化应激可能是导致肿瘤发生的主要原因, 因为ROS的产生与人体内的DNA损伤、缺失与突变有关。Naranmandura等[22]研究发现无机物三价二甲基亚砷酸(dimethylarsinous acid, DMAIII) 可诱导蛋白激酶样内质网激酶的磷酸化, 与单甲基亚砷酸作用于线粒体不同, DMAIII暴露后主要靶向内质网, 从而促进ROS的产生, 证明内质网是DMAIII诱导细胞毒性的靶细胞器。蛋白质生物合成抑制剂放线菌酮强烈抑制DMAIII诱导的内质网细胞内的ROS生成和PERK (protein kinase RNA-like ER kinase) 磷酸化, 表明ERS的诱导可能是通过抑制蛋白质折叠发生的。结果表明, 内质网是DMAIII诱导的细胞毒性的靶细胞器, 至少部分是通过诱导内质网及其产生的氧化应激反应进行的。
3.3 免疫细胞表型重塑TME中的一些免疫细胞在促进肿瘤生长和保护肿瘤不被发现和消灭方面发挥着关键作用。TME中主要免疫抑制细胞如肿瘤相关成纤维细胞(cancer-associated fibroblast, CAF) 和TAM, 是TME中重新编程免疫抑制的靶点(图 2[21, 59])。
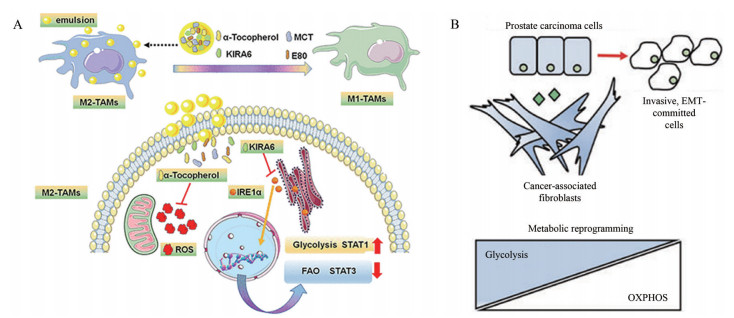
|
Figure 2 Subcellular organelle-targeting immunosuppressive cells in the tumor microenvironment (TME). A: Dual inhibition of endoplasmic reticulum stress and oxidation stress manipulates the polarization of macrophages under hypoxia to sensitize immunotherapy. (Adapted from Ref. 21 with permission. Copyright © 2021 American Chemical Society); B: The mitochondrial-associated signaling, resulting in tricarboxylic acid (TCA) cycle intermediates accumulation and mtROS-dependent signature. (Adapted from Ref. 59 with permission. Copyright © Springer Nature Limited 2019). TAMs: Tumor-associated macrophages; KIRA6: Kinase inhibiting RNase attenuator 6; MCT: Monocarboxylate transporters; IRE1α: Inositol-requiring transmembrane kinase/endonuclease 1α; STAT: Signal transducer and activator of transcription; FAO: Fatty acid oxidation; EMT: Epithelial-mesenchymal transition; OXPHOS: Oxidative phosphorylation |
M2-TAMs在肿瘤的发生、发展和转移中发挥重要作用, 而将M2-TAMs再极化为促进免疫的M1型也被认为是治疗临床顽固性肿瘤的一种有效策略。Jiang等[21]研究表明, M2巨噬细胞对肿瘤乏氧区具有高度趋向性, 其ERS相关的IRE1-XBP1通路也被激活, 从而抑制细胞糖酵解, 促进氧化磷酸化(oxidative phosphorylation, OXPHOS) 和细胞内脂质积聚, 形成典型的M2-TAMs表型, 由此表明调控M2-TAMs的ERS反应有望用于抗肿瘤治疗。该研究的体外和体内实验均表明, ERS和氧化应激的双重抑制成功地调控了M2-TAM的复极化, 通过诱导巨噬细胞从脂肪酸氧化向糖酵解的代谢转变。构建的纳米递送系统不仅延缓了肿瘤的恶化, 而且大大提高了PD-1抗体的治疗效果。因此, ERS与巨噬细胞极化紧密联系在一起, 为缺氧条件下M2-TAM的有效重编程提供了有效途径。
3.3.2 线粒体动力学控制巨噬细胞极化线粒体在肿瘤细胞中产生能量, 并可通过线粒体膜的分裂与融合改变其形态[60, 61]。线粒体的动态平衡对信号转导、ATP生成、铁硫簇生物发生和钙缓冲有至关重要的作用[57]。线粒体的形态转变也同时影响着细胞存活、凋亡和细胞代谢稳态。先天性免疫细胞如巨噬细胞、树突状细胞均积极参与炎症和免疫反应宿主对感染的防御。线粒体动力学的代谢变化与Toll样受体激动剂介导的炎症反应和免疫细胞极化相关。Otera等[62]研究发现, 在Toll样受体调节的线粒体形态转换过程中, 线粒体外膜表面的FAM73b蛋白起关键作用, 其消融有助于白介素-12的产生, 进一步促进T细胞的活化和抗肿瘤免疫反应的增强。结果表明, 调控肿瘤免疫的线粒体动力学相关机制是肿瘤免疫治疗的潜在靶点, 通过调节线粒体形态进行免疫治疗为肿瘤治疗提供了新思路。
3.3.3 线粒体转移调控癌相关成纤维细胞表型成纤维细胞是许多实体肿瘤细胞间质的重要组成部分, 被进一步激活为CAF表型, 有助于肿瘤的发生和进展。CAF通过重新编程肿瘤细胞代谢促进肿瘤的发生与进展。Ippolito等[59]研究发现CAF的表型改变导致乳酸的摄取增加, 肿瘤细胞中NAD+/NADH的比率有所变化, 线粒体的质量和活性增强, 最终引发三羧酸循环失调、肿瘤代谢物积累增加、线粒体复合体结构改变及超氧化物的产生。此外, 肿瘤细胞通过影响细胞之间的联系以改变CAF衍生的功能性细胞线粒体的形成。作为能量来源的线粒体影响CAF的代谢重编程过程。因此, 靶向改变线粒体的结构与质量有助于CAF的表型调控与抑制肿瘤生长及转移。
3.4 提高免疫原性诱导肿瘤细胞产生免疫原性死亡(immunogenic cell death, ICD) 可有效实现抗肿瘤治疗, 这主要归因于其利用免疫系统达到消灭肿瘤的能力[63]。钙网蛋白(calreticulin, CRT) 是肿瘤细胞产生免疫原性细胞死亡的标志物, 可作为“吞噬我”的信号来刺激树突状细胞放大抗原呈递功能。该系统进一步激活了系列免疫应答, 包括CD8+ T细胞增殖和毒性细胞因子的分泌, 在抑制肿瘤生长方面具有重要意义。对于激活肿瘤细胞发生ICD效应, ERS和ROS产生格外重要。目前, 大多数的化疗、放疗和非靶向PDT由于次级或间接ERS效应, 不能诱导有效的ICD作用[64, 65]。因此, 寻求直接靶向触发亚细胞器反应的ICD诱导剂是目前研究的重点(图 3[17, 23, 64, 66])。

|
Figure 3 ICD inducers directly target and trigger subcellular organelle response. A: Ds-sP/TCPP-TER can accumulate in the ER and generate ROS under NIR laser irradiation, resulting in ER stress that amplifies ICD. (Adapted from Ref. 64 with permission. Copyright © 2020 American Chemical Society); B: The antitumor mechanism of FAL-ICG-HAuNS plus FAL-Hb-lipo. [Adapted from Ref. 23 with permission. Copyright © The Author(s) 2019]; C: The endocytosis and the mitochondria target delivery of M-ChiP. (Adapted from Ref. 17 with permission. Copyright © 2018 Elsevier Ltd.); D: The proposed mechanism of TPE-DPA-TCyP as an effective ICD inducer for antitumor immunity. (Adapted from Ref. 66 with permission. Copyright © 1999-2022 John Wiley & Sons, Inc.). HOMO: Highest occupied molecular orbital; LUMO: Lowest unoccupied molecular orbital; Ds-sP: PEG-s-s-1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[amino (polyethylene glycol)-2000]; NIR: Near-infrared; DC: Dendritic cell; TNF-α: Tumor necrosis factor α; IFN-γ: Interferon-γ; HMGB1: High mobility group protein B1; PTT: Photothermal therapy; CRT: Chemoradiotherapy; ROS: Reactive oxygen species; ICD: Immunogenic cell death |
金丝桃素诱导的光动力治疗可直接实现光敏剂在内质网中的靶向积累, 产生高水平的ROS, 从而引起强烈的ICD[67]。然而大多数光敏剂不能实现内质网的有效积累(如吲哚菁绿, 主要分布在细胞内化后的细胞质), ICD的发生强度在一定程度上被抑制[68]。因此, 能实现内质网靶向的光动力治疗可在最大程度上满足ROS的产生标准, 为实现ICD等相关免疫治疗提供一定参考。Cheng等[17]合成了一种能直接靶向内质网的光敏剂TCPP-TER [4, 4′, 4″, 4′″-(porphyrin-5, 10, 15, 20-tetrayl)tetrakis(N-(2-((4-methylphenyl)sulfonamido)ethyl)benzamide)], 在近红外激光照射下, 其可以主动靶向内质网部位并局部释放大量的ROS, 从而诱导ERS, 提升ICD, 激活免疫细胞, 增强免疫治疗效果。此外, Luo等[33]开发了一种内质网靶向肽(ER-targeting pardaxin, FAL) 修饰的血红蛋白脂质体(hemoglobin liposome, Hb-lipo) 和FAL修饰的吲哚菁绿金纳米粒(FAL-indocyanine green-hollow gold nanospheres, FAL-ICG-HAuNS) 双重“内质网导弹”给药系统。结果显示, 与非靶向纳米系统相比, 靶向内质网的纳米系统在近红外光照射下诱导了强大的ERS反应并引起了CRT的暴露。内质网膜靶向作为最有效的亚细胞靶向光动力策略之一, 可有效提高细胞膜通透性、破坏膜完整性、诱导脂质过氧化、失活膜靶向信号蛋白, 最终导致内质网膜的破裂。Zhang等[24]设计酶驱动的内质网膜靶向的嵌合肽(PpIX-C6-PEG8-KKKKKKSKTKC-Ome, PCPK), 可实现靶向性的内质网膜损伤和细胞损伤相关分子的有效释放, 以提高光动力的免疫治疗效果。总之, 内质网靶向系统的构建通过直接基于ROS的ERS, 提高了基于ICD相关免疫治疗的效果, 并显示出增强的抗肿瘤功效。
3.4.2 线粒体氧化应激目前常用的ICD诱导剂非常有限, 且单独使用以光敏剂为基础的诱导剂难以诱导强大的ICD效应。Chen等[66]设计了一种具有扭曲分子结构的有机光敏剂(tetraphenylethene, TPE-DPA-TCyP), 其可产生强聚集诱导发射活动并有效诱导集中于肿瘤细胞的线粒体氧化应激, 从而使更多的吸收能量能用于产生ROS。纳米递送系统能实现在肿瘤细胞线粒体部位的高度聚集, 并在光照条件下引发线粒体氧化应激。该工作首次将重要细胞器线粒体与免疫原性死亡关联起来, 并验证了线粒体氧化应激能大量引发免疫原性死亡。因此, 诱导聚焦线粒体氧化应激是一种非常有效的抗肿瘤治疗策略, 在引起大量的大规模ICD效应的同时触发先天性和适应性免疫系统。
3.4.3 线粒体和质膜双靶向嵌合肽线粒体和细胞膜在维持细胞活性和稳定性方面起着重要作用。Wang等[20]设计了线粒体和质膜双靶向的嵌合肽纳米粒用于光动力治疗。嵌合肽纳米粒本身具有较高的载药效率和ROS生成的优异能力。此外, 双靶向性有助于光敏剂原卟啉IX (protoporphyrin IX, PpIX) 在亚细胞器原位释放、生成ROS, 用于增强光动力疗法的治疗效果。采用光化学内化效应促进光敏剂的跨膜传递和溶酶体逃逸, 基于双重光照策略实现光敏剂对细胞膜和细胞核的逐步破坏进而杀死肿瘤细胞。线粒体靶向的光动力治疗有助于进一步降低线粒体膜电位、破坏细胞膜结构, 导致细胞凋亡与坏死, 实现肿瘤的高效联合治疗。该研究的体内外结果表明, 线粒体和质膜双靶向的光动力治疗可在减少不良反应的情况下实现抗肿瘤的效果最大化。双靶向策略被证明是一种很有前途的协同抗肿瘤免疫治疗平台。
4 总结与展望根据药物递释系统的发展, 归纳起来可作3个阶段的划分: 以药用聚合物材料构建的长效控释递药系统; 经修饰化及纳米化处理的纳米靶向递药系统; 具生物学功能等的仿生智能递药系统。而无论何种基于亚细胞器机制的递药系统构建, 均须依据药物性质、材料特性、靶位环境等进行综合考虑、科学设计。
现阶段针对靶向亚细胞器的药物递送研究很多, 但真正应用于临床阶段仍需克服很多屏障。①载体系统的靶向能力: 纳米药物递送系统能否针对性靶向细胞器取决于递送过程中的细胞膜和细胞内膜两大障碍。因此深入了解亚细胞器靶向纳米递送系统在细胞内的运输机制显得尤为重要。靶向亚细胞器的纳米递送系统的设计重点是基于工程化的纳米制剂与细胞器膜间的静电物理化学相互作用。②药物的释放能力: 几乎所有递送至细胞的物质都利用内体系统进行细胞内运输。因此, 需严格评估纳米载体的内体逃逸能力, 还必须考虑到纳米制剂避免内体或溶酶体降解并保留生物学活性的能力, 探索该纳米制剂将药物释放至特定的细胞器的机制。③与亚细胞器的相互作用: 细胞内吞作用的复杂性也影响靶向亚细胞器的递送效率。单独靶向一种细胞器无法达到预期治疗效果, 不排除尝试同时靶向多个在作用上有关联的细胞器, 以达到综合治疗的效果。
本文在对亚细胞器途径递药与肿瘤发展联系作简要介绍的基础上, 对TME的特点及给药局限性进行了初步归纳, 并依据文献基于弱酸性、ROS活性低、免疫原性低及免疫抑制细胞微环境特点的不同抗肿瘤靶向递药系统研究进展进行了有益综述。
通过探究多种应用的可行策略, 开发选择性靶向包括内质网、线粒体、溶酶体、高尔基体在内的亚细胞器纳米给药递送系统已成为当今关注重点, 包括亚细胞可视化、多阶段、多靶点药物释放、患病细胞的选择性固化及细胞内转运。靶向亚细胞器是肿瘤治疗的潜在靶标, 肿瘤起源于局部而非全身, 与改善TME的治疗方式相结合, 可共同开创肿瘤靶向治疗的新局面。随着生物技术和医疗技术的发展, 具有精准、高效、安全、稳定特点的亚细胞器靶向设计如雨后春笋般涌现。此类策略也可进一步用于多种亚细胞器相关疾病包括肿瘤的诊断和治疗。
随着人们对恶性肿瘤病因病机认识的不断深化, 传统的化疗药物或基因药物治疗也经历着改进创新。肿瘤免疫治疗正在成为临床抗肿瘤的全新对策, 肿瘤抑制性微环境的逆转调控、肿瘤免疫检查点抑制剂(如酪氨酸激酶、PD-1或PDL-1、TIGIT) 等发挥了减毒增效并激活免疫应答的作用, 相信基于TME途径的新型亚细胞器靶向递药系统研究必将有着重要理论意义与实用前景。
作者贡献: 吴诗洋、常爽负责文献检索、分析及文稿撰写; 陈晴负责文献检索; 史梦浩、赵明负责文献数据整理; 胡海洋、陈大为负责文稿修改与检查。
利益冲突: 本综述内容与所引用文献的研究者或课题组没有任何产权及利益冲突。所有作者均声明不存在任何利益冲突。
| [1] |
Han M, Li C, Guo WW, et al. Mitochondrial drug delivery for cancer therapy[J]. Acta Pharm Sin (药学学报), 2016, 51: 257-263. |
| [2] |
Rajendran L, Knolker HJ, Simons K. Subcellular targeting strategies for drug design and delivery[J]. Nat Rev Drug Discov, 2010, 9: 29-42. DOI:10.1038/nrd2897 |
| [3] |
Mukalel AJ, Riley RS, Zhang R, et al. Nanoparticles for nucleic acid delivery: applications in cancer immunotherapy[J]. Cancer Lett, 2019, 458: 102-112. DOI:10.1016/j.canlet.2019.04.040 |
| [4] |
Gras JA, Ré RC, Pérez A, et al. Rectal cancer treatment (PDQ®): health professional version-PDQ cancer information summaries[J]. Kidney Int, 2002, 67: 1622-1629. |
| [5] |
Tian JW, Ding L, Ju HY, et al. A multifunctional nanomicelle for real-time targeted imaging and precise near-infrared cancer therapy[J]. Angew Chem, 2015, 53: 9544-9549. |
| [6] |
Wallace DC. Mitochondria and cancer[J]. Nat Rev Cancer, 2012, 12: 685-698. DOI:10.1038/nrc3365 |
| [7] |
Koshkaryev A, Piroyan A, Torchilin VP. Increased apoptosis in cancer cells in vitro and in vivo by ceramides in transferrin-modified liposomes[J]. Cancer Bio Ther, 2012, 13: 50-60. DOI:10.4161/cbt.13.1.18871 |
| [8] |
Iancu C, Mocan T, Mocan L, et al. Photothermal treatment of liver cancer with albumin-conjugated gold nanoparticles initiates Golgi apparatus-ER dysfunction and caspase-3 apoptotic pathway activation by selective targeting of Gp60 receptor[J]. Int J Nano, 2015, 10: 5435-5445. |
| [9] |
Ohashi Y, Okamura M, Katayama R, et al. Targeting the Golgi apparatus to overcome acquired resistance of non-small cell lung cancer cells to EGFR tyrosine kinase inhibitors[J]. Oncotarget, 2018, 9: 1641-1655. DOI:10.18632/oncotarget.22895 |
| [10] |
Han M, Vakili MR, Abyaneh HS, et al. Mitochondrial delivery of doxorubicin via triphenylphosphine modification for overcoming drug resistance in MDA-MB-435/DOX cells[J]. Mol Pharm, 2014, 11: 2640-2649. DOI:10.1021/mp500038g |
| [11] |
Wisnovsky S, Wilson J, Radford R, et al. Targeting mitochondrial DNA with a platinum-based anticancer agent[J]. Chem Biol, 2013, 20: 1323-1328. DOI:10.1016/j.chembiol.2013.08.010 |
| [12] |
Zhou FF, Xing D, Wu BY, et al. New insights of transmembranal mechanism and subcellular localization of noncovalently modified single-walled carbon nanotubes[J]. Nano Lett, 2010, 10: 1677-1681. DOI:10.1021/nl100004m |
| [13] |
Gogvadze V, Orrenius S, Zhivotovsky B, et al. Mitochondria as targets for chemotherapy[J]. Apoptosis, 2009, 19: 57-66. |
| [14] |
Zhao Y, Neuzil J, Wu K. Vitamin E analogues as mitochondria-targeting compounds: from the bench to the bedside?[J]. Mol Nutr Food Res, 2009, 53: 129-139. DOI:10.1002/mnfr.200800045 |
| [15] |
Zhang W, Hu X, Shen Q, et al. Mitochondria-specific drug release and reactive oxygen species burst induced by polyprodrug nanoreactors can enhance chemotherapy[J]. Nat Commun, 2019, 10: 1704. DOI:10.1038/s41467-019-09566-3 |
| [16] |
Gao Z, Li Y, Wang F, et al. Mitochondrial dynamics controls anti-tumour innate immunity by regulating CHIP-IRF1 axis stability[J]. Nat Commun, 2017, 8: 1805-1818. DOI:10.1038/s41467-017-01919-0 |
| [17] |
Cheng H, Zheng RR, Fan GL, et al. Mitochondria and plasma membrane dual-targeted chimeric peptide for single-agent synergistic photodynamic therapy[J]. Biomaterials, 2019, 188: 1-11. DOI:10.1016/j.biomaterials.2018.10.005 |
| [18] |
Wang J, Wang Y, Liang W, et al. Delivery of drugs to cell membranes by encapsulation in PEG-PE micelles[J]. J Control Release, 2012, 160: 637-651. DOI:10.1016/j.jconrel.2012.02.021 |
| [19] |
Pollock S, Antrobus R, Newton L, et al. Uptake and trafficking of liposomes to the endoplasmic reticulum[J]. FASEB J, 2010, 24: 1866-1878. DOI:10.1096/fj.09-145755 |
| [20] |
Wang T, Bai J, Jiang X, et al. Cellular uptake of nanoparticles by membrane penetration: a study combining confocal microscopy with FTIR spectroelectrochemistry[J]. ACS Nano, 2012, 6: 1251-1259. DOI:10.1021/nn203892h |
| [21] |
Jiang M, Li X, Zhang J, et al. Dual inhibition of endoplasmic reticulum stress and oxidation stress manipulates the polarization of macrophages under hypoxia to sensitize immunotherapy[J]. ACS Nano, 2021, 15: 14522-14534. DOI:10.1021/acsnano.1c04068 |
| [22] |
Naranmandura H, Shi X, Koike S, et al. The endoplasmic reticulum is a target organelle for trivalent dimethylarsinic acid (DMAIII)-induced cytotoxicity[J]. Toxicol Appl Pharmacol, 2012, 260: 241-249. DOI:10.1016/j.taap.2012.02.017 |
| [23] |
Li W, Yang J, Luo L, et al. Targeting photodynamic and photothermal therapy to the endoplasmic reticulum enhances immunogenic cancer cell death[J]. Nat Commun, 2019, 10: 3349. DOI:10.1038/s41467-019-11269-8 |
| [24] |
Zhang C, Gao F, Wu W, et al. Enzyme-driven membrane-targeted chimeric peptide for enhanced tumor photodynamic-immunotherapy[J]. ACS Nano, 2019, 13: 11249-11262. DOI:10.1021/acsnano.9b04315 |
| [25] |
Hong JM, Kim JH, Kim H, et al. SB365, pulsatilla saponin D induces caspase-independent cell death and augments the anticancer effect of temozolomide in glioblastoma multiforme cells[J]. Molecules, 2019, 24: 3230-3246. DOI:10.3390/molecules24183230 |
| [26] |
Zhang Y, Zhou L, Zhang J, et al. Suppression of chloride voltage‑gated channel 3 expression increases sensitivity of human glioma U251 cells to cisplatin through lysosomal dysfunction[J]. Oncol Lett, 2018, 16: 835-842. |
| [27] |
Zhu SY, Ren C, Yao RQ, et al. Lysosome damage and cell death: novel therapeutic target for human diseases[J]. Prog Physiol Sci (生理科学进展), 2021, 52: 111-116. |
| [28] |
Hwang HY, Cho YS, Kim JY, et al. Autophagic inhibition via lysosomal integrity dysfunction leads to antitumor activity in glioma treatment[J]. Cancers, 2020, 12: 543-566. DOI:10.3390/cancers12030543 |
| [29] |
Hueng DY, Hsieh CH, Cheng YC, et al. Cordycepin inhibits migration of human glioblastoma cells by affecting lysosomal degradation and protein phosphatase activation[J]. J Nutr Biochem, 2017, 41: 109-116. DOI:10.1016/j.jnutbio.2016.12.008 |
| [30] |
Liu LQ, Wang SB, Shao YF, et al. Hydroxychloroquine potentiates the anti-cancer effect of bevacizumab on glioblastoma via the inhibition of autophagy[J]. Biomed Pharmacother, 2019, 118: 109339. DOI:10.1016/j.biopha.2019.109339 |
| [31] |
Xu L, Li Z, Song S, et al. Downregulation of α‐l‐fucosidase 1 suppresses glioma progression by enhancing autophagy and inhibiting macrophage infiltration[J]. Cancer Sci, 2020, 111: 2284-2296. DOI:10.1111/cas.14427 |
| [32] |
Woldemichael GM, Turbyville TJ, Linehan WM, et al. Carminomycin I is an apoptosis inducer that targets the Golgi complex in clear cell renal carcinoma cells[J]. Cancer Res, 2011, 71: 134-142. DOI:10.1158/0008-5472.CAN-10-0757 |
| [33] |
Luo J, Zhang P, Zhao T, et al. Golgi apparatus-targeted chondroitin-modified nanomicelles suppress hepatic stellate cell activation for the management of liver fibrosis[J]. ACS Nano, 2019, 13: 3910-3923. DOI:10.1021/acsnano.8b06924 |
| [34] |
Yu RY, Xing L, Cui PF, et al. Regulating Golgi apparatus by co-delivery of COX-2 inhibitor and brefeldin A for suppression of tumor metastasis[J]. Biomater Sci, 2018, 6: 2144-2155. DOI:10.1039/C8BM00381E |
| [35] |
Galenkamp KM, Sosicka P, Jung M, et al. Golgi acidification by NHE7 regulates cytosolic pH homeostasis in pancreatic cancer cells[J]. Cancer Discov, 2020, 10: 822-835. DOI:10.1158/2159-8290.CD-19-1007 |
| [36] |
Liu CG, Han YH, Kankala RK, et al. Subcellular performance of nanoparticles in cancer therapy[J]. Int J Nano, 2020, 15: 675-704. DOI:10.2147/IJN.S226186 |
| [37] |
King AP, Wilson J. Endoplasmic reticulum stress: an arising target for metal-based anticancer agents[J]. Chem Soc Rev, 2020, 49: 8113-8336. DOI:10.1039/D0CS00259C |
| [38] |
Ho N, Xu C, Thibault G. From the unfolded protein response to metabolic diseases-lipids under the spotlight[J]. J Cell Sci, 2018, 131: jcs199307. DOI:10.1242/jcs.199307 |
| [39] |
Oakes SA. Endoplasmic reticulum stress signaling in cancer cells[J]. Am J Pathol, 2020, 190: 934-946. DOI:10.1016/j.ajpath.2020.01.010 |
| [40] |
Yan YY, He M, Wei MJ. Correlations of endoplasmic reticulum stress and cancer drug resistance[J]. Chin Pharm Bull (中国药理学通报), 2015, 31: 461-464. |
| [41] |
Misuth M, Joniova J, Horvath D, et al. The flashlights on a distinct role of protein kinase C δ: phosphorylation of regulatory and catalytic domain upon oxidative stress in glioma cells[J]. Cell Signal, 2017, 34: 11-22. DOI:10.1016/j.cellsig.2017.02.020 |
| [42] |
Halberg N, Sengelaub C, Navrazhina K, et al. PITPNC1 recruits RAB1B to the Golgi network to drive malignant secretion[J]. Cancer Cell, 2016, 29: 339-353. DOI:10.1016/j.ccell.2016.02.013 |
| [43] |
Tan X, Banerjee P, Guo HF, et al. Epithelial-to-mesenchymal transition drives a pro-metastatic Golgi compaction process through scaffolding protein PAQR11[J]. J Clin Invest, 2016, 127: 117-131. DOI:10.1172/JCI88736 |
| [44] |
Newmeyer DD, Ferguson-Miller S. Mitochondria: releasing power for life and unleashing the machineries of death[J]. Cell, 2003, 112: 481-490. DOI:10.1016/S0092-8674(03)00116-8 |
| [45] |
Špela Z, Petra K, Zariwala MG, et al. Design and development of novel mitochondrial targeted nanocarriers, DQAsomes for curcumin inhalation[J]. Mol Pharm, 2014, 117: 2334-2345. |
| [46] |
Davidson SM, Jonas O, Keibler MA, et al. Direct evidence for cancer-cell-autonomous extracellular protein catabolism in pancreatic tumors[J]. Nat Med, 2016, 23: 235-241. |
| [47] |
Levy J, Towers CG, Thorburn A. Targeting autophagy in cancer[J]. Nat Rev Cancer, 2017, 17: 528-542. DOI:10.1038/nrc.2017.53 |
| [48] |
Zhou W, Guo Y, Zhang X, et al. Lys05 induces lysosomal membrane permeabilization and increases radiosensitivity in glioblastoma[J]. J Cell Biochem, 2020, 121: 2027-2037. DOI:10.1002/jcb.29437 |
| [49] |
Zhou ZY, Li JL. Theory and treatment progress of tumor microenvironment[J]. Oncol Prog (癌症进展), 2019, 17: 2737-2740, 2780. |
| [50] |
Luo C, Sun J, Liu D, et al. Self-assembled redox dual-responsive prodrug-nanosystem formed by single thioether-bridged paclitaxel-fatty acid conjugate for cancer chemotherapy[J]. Nano Lett, 2016, 16: 5401-5408. DOI:10.1021/acs.nanolett.6b01632 |
| [51] |
Branca MA. Rekindling cancer vaccines[J]. Nat Biotechnol, 2016, 34: 1019-1024. DOI:10.1038/nbt.3690 |
| [52] |
Ott PA, Hodi FS. Talimogene laherparepvec for the treatment of advanced melanoma[J]. Clin Cancer Res, 2016, 22: 3127-3131. DOI:10.1158/1078-0432.CCR-15-2709 |
| [53] |
Huang SJ, Qiu XD, Li WY, et al. Cellular crosstalk and tumorigenic mechanisms in tumor microenvironment[J]. Chin Bull Life Sci (生命科学), 2020, 32: 315-324. |
| [54] |
Li T, Mo X, Jiang Z, et al. Study of αB-crystallin expression in Gerbil BCAO model of transient global cerebral ischemia[J]. Oxid Med Cell Longev, 2012, 2012: 945071. |
| [55] |
Li W, Cheng H, Li G, et al. Mitochondrial damage and the road to exhaustion[J]. Cell Metab, 2020, 32: 905-907. DOI:10.1016/j.cmet.2020.11.004 |
| [56] |
Yu YR, Imrichoca H, Wang HP, et al. Disturbed mitochondrial dynamics in CD8+ TILs reinforce T cell exhaustion[J]. Nat Immunol, 2020, 21: 1540-1551. DOI:10.1038/s41590-020-0793-3 |
| [57] |
Vardhana SA, Hwee MA, Berisa M, et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen[J]. Nat Immunol, 2020, 21: 1022-1033. DOI:10.1038/s41590-020-0725-2 |
| [58] |
Mitsopoulos P, Suntres ZE. Protective effects of liposomal N-acetylcysteine against paraquat-induced cytotoxicity and gene expression[J]. J Toxicol, 2011, 2011: 808967. |
| [59] |
Ippolito L, Morandi A, Taddei ML, et al. Cancer-associated fibroblasts promote prostate cancer malignancy via metabolic rewiring and mitochondrial transfer[J]. Oncogene, 2019, 38: 5339-5355. DOI:10.1038/s41388-019-0805-7 |
| [60] |
Chen H, Chan DC. Mitochondrial dynamics-fusion, fission, movement, and mitophagy-in neurodegenerative diseases[J]. Hum Mol Genet, 2009, 18: R169-R176. DOI:10.1093/hmg/ddp326 |
| [61] |
Youle RJ, Van D. Mitochondrial fission, fusion, and stress[J]. Science, 2012, 337: 1062-1065. DOI:10.1126/science.1219855 |
| [62] |
Otera H, Mihara K. Molecular mechanisms and physiologic functions of mitochondrial dynamics[J]. J Biochem, 2011, 149: 241-251. DOI:10.1093/jb/mvr002 |
| [63] |
Galluzzi L, Buqué A, Kepp O, et al. Immunogenic cell death in cancer and infectious disease[J]. Nat Rev Immun, 2016, 17: 97-111. DOI:10.1038/nrm.2015.14 |
| [64] |
Deng H, Zhou Z, Yang W, et al. Endoplasmic reticulum targeting to amplify immunogenic cell death for cancer immunotherapy[J]. Nano Lett, 2020, 20: 1928-1933. DOI:10.1021/acs.nanolett.9b05210 |
| [65] |
Dai Z, Tang J, Gu Z, et al. Eliciting immunogenic cell death via a unitized nanoinducer[J]. Nano Lett, 2020, 20: 6246-6254. DOI:10.1021/acs.nanolett.0c00713 |
| [66] |
Chen C, Ni X, Jia S, et al. Massively evoking immunogenic cell death by focused mitochondrial oxidative stress using an AIE luminogen with a twisted molecular structure[J]. Adv Mater, 2019, 31: e1904914. DOI:10.1002/adma.201904914 |
| [67] |
Garg A, Krysko D, Verfaillie T, et al. A novel pathway combining calreticulin exposure and ATP secretion in immunogenic cancer cell death[J]. EMBO J, 2014, 31: 1062-1079. |
| [68] |
Christoph A, Sonja F, Petra W, et al. Indocyanine green (ICG) and laser irradiation induce photooxidation[J]. Arch Dermatol Res, 2000, 292: 404-411. DOI:10.1007/s004030000147 |
 2022, Vol. 57
2022, Vol. 57


