超过85%的恶性肿瘤为实体瘤[1], 实体肿瘤组织由肿瘤细胞和肿瘤微环境(tumor microenvironment, TME) 组成, 后者包括细胞和非细胞成分, 主要有血管、淋巴管、结缔组织、炎性细胞及细胞外基质(extracellular matrix, ECM) 等成分, 在肿瘤的生长、转移和耐药过程中发挥着重要作用[2]。肿瘤血管内皮通透性差、血流不畅、较高的间质液压力(interstitial fluid pressure, IFP) 和固体压力及致密的ECM等共同构成了肿瘤组织的生物屏障[3], 这极大阻碍了抗癌纳米药物向肿瘤组织深处进行渗透, 使纳米药物难以发挥有效的抗肿瘤作用[4]。因此本文针对抗癌纳米药物实体瘤渗透困难这一瓶颈问题, 对近几年出现的两种新型策略—纳米药物的主动转胞吞作用和免疫细胞介导的肿瘤渗透进行综述。
1 抗癌纳米药物渗透进入肿瘤深部所面临的挑战 1.1 肿瘤组织生物屏障对抗癌纳米药物渗透性的影响 1.1.1 实体瘤的血管异常在TME中, 由骨髓来源内皮前体细胞分化形成的新生血管会融合、修饰现存的血管, 从而形成异质性的肿瘤血管系统, 这种异质性会破坏血管内皮完整性, 导致血管扭曲、结构异常[5]。一方面, 实体瘤血管的异质性会导致抗癌纳米药物从血管内向肿瘤组织运输的效率降低; 另一方面, 与正常组织相比, 实体瘤组织的血管排列无明显的有序性, 即不会按照从大血管到小血管的结构排列, 且深层肿瘤的血管密度低, 在没有足够血流和有序的血管分布下, 抗癌纳米药物难以渗透进肿瘤实质, 导致其抗肿瘤能力大大降低[6]。
1.1.2 实体瘤的淋巴管异常与血管系统一样, 实体瘤的淋巴管在结构和功能上也存在异常。在正常组织中, 淋巴管不仅可收集各级淋巴液(这些液体经汇合后, 最终在颈部回流到血液中去), 还能参与免疫应答[7]; 而在实体瘤中, 肿瘤细胞和间质细胞的快速增生会导致淋巴管塌陷, 使淋巴液无法从肿瘤组织中及时清除, 最终引起组织水肿和IFP增加[8]。因此, 大部分抗癌纳米药物只聚集在肿瘤组织表面, 难以渗透至肿瘤内部。
1.1.3 实体瘤致密的ECM实体瘤的ECM好比围绕着正常细胞和癌细胞的蛋白质网络, 主要由胶原蛋白、蛋白多糖、层黏连蛋白和纤维连接蛋白等多种糖蛋白组成[9]。一方面, 肿瘤细胞和间质细胞的增殖会导致肿瘤ECM过度产生, 细胞密度和刚度的增加使得ECM的固体压力升高, 形成物理屏障, 阻碍抗癌纳米药物的肿瘤渗透[10]; 另一方面, 致密的ECM将进一步增加IFP, 在实体瘤中IFP的取值范围通常为5~40 mmHg, 远大于正常组织[11], 高IFP将严重影响抗癌纳米药物的渗透。
TME中还存在大量肿瘤相关成纤维细胞(tumor-associated fibroblast cells, TAFs)、肿瘤相关免疫细胞、炎性细胞、胶质细胞及肿瘤血管内皮细胞(tumor vascular endothelial cells, TVEC), 其中肿瘤相关免疫细胞又包括肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)、T细胞(thymus dependent lymphocyte, T cell)、B细胞(bursa dependent lymphocyte, B cell)、自然杀伤(natural killer, NK) 细胞和中性粒细胞(neutrophils) 等[12]。TME具有缺氧、慢性炎症及免疫抑制3个特征, 为肿瘤生长提供了有利环境[13], 最终形成致密实体瘤和坚硬物理屏障, 导致抗癌纳米药物的渗透能力下降; 除肿瘤细胞外, TAFs和免疫细胞也会摄取一定量的纳米药物, 因此能渗透至肿瘤细胞深部的抗癌纳米药物的数量远小于理想数量[11]。实体瘤对纳米药物的深入渗透具有高度的抵抗力, 迫切需对抗癌纳米药物的肿瘤渗透能力进行研究。
1.2 现有抗癌纳米药物设计理论(EPR效应) 存在的挑战抗癌纳米药物包括脂质体[14]、胶束[15]、树状聚合物[16]、纳米胶囊[17]、纳米乳液[18]和自组装肽[19]等, 与小分子药物相比, 其往往具有较大尺寸, 从而可有效地延长血液循环时间、保护药物不被降解, 在临床上具有广泛和迫切的需求[20]。自20世纪80年代提出EPR效应[21]以来, 其一直被认为是抗癌纳米药物穿过肿瘤血管、治疗实体肿瘤的中心法则: 即当纳米粒的尺寸足够小时, 可通过异常肿瘤血管系统中相邻的内皮细胞间隙进行肿瘤渗透; 且肿瘤组织缺乏淋巴管, 纳米粒不易被淋巴液回流带走而长期保留在肿瘤组织内。然而, 过去30多年科研人员对抗癌纳米药物的研究却并不顺利, 据统计, 全球仅有15种基于纳米粒的抗癌纳米药物获得批准, 大多数进入临床试验的纳米药物都因毒性或治疗效果不佳被终止[22]; 经过这30多年有限的临床转化, 癌症纳米医学领域逐渐对EPR效应提出质疑。
Sindhwani等[23]重新探讨了纳米粒肿瘤渗透的现象和纳米粒进入实体瘤的机制。数据显示在313条血管中, 仅发现了26条间隙, 且只有7个是内皮间隙, 其余19个都是跨细胞通道, 说明肿瘤血管大部分是连续的, 没有足够间隙来解释纳米粒是通过EPR效应进行肿瘤渗透及聚集的。随后, 研究者还发现纳米粒可通过跨内皮途径利用主动转运方式进入实体瘤, 并通过建立仅保留小鼠的血管结构(即仅保留内皮间隙被动运输过程) 的Zombie模型小鼠证明纳米粒渗入肿瘤的主导机制是跨内皮主动转运过程, 该过程也被称为转胞吞作用; 这一重大发现为今后抗癌纳米药物的肿瘤渗透提供了新的策略。
2 促进抗癌纳米药物肿瘤渗透的两种新型策略抗癌纳米药物在体内如何克服肿瘤组织处的生物屏障、有效渗透到实体瘤实质已成为当前癌症纳米医学领域面临的最重要问题。依据传统EPR效应设计的抗癌纳米药物尽管在动物实验中能取得很好效果, 但其临床试验却不容乐观。因此, 越来越多的研究者将目光转向抗癌纳米药物进入肿瘤细胞的其他途径, 一是通过抗癌纳米药物的主动转胞吞作用实现肿瘤渗透, 二是利用搭便车策略借助具有特异性肿瘤倾向的免疫细胞实现抗癌纳米药物的肿瘤渗透。
2.1 抗癌纳米药物通过主动转胞吞作用实现肿瘤渗透主动转胞吞作用是一种特殊的内吞作用, 可通过膜载体将物质从细胞一侧运输到另一侧。转胞吞作用是一种代谢活跃的过程, 需细胞重新排列其细胞骨架和细胞膜, 形成可吸收纳米药物的囊泡或隔膜使药物能进出细胞, 并在细胞质内进行运输[23]。跨细胞的转胞吞作用根据其触发机制的不同可分为受体介导的转胞吞作用(receptor-mediated transcytosis, RMT) 和吸附介导的转胞吞作用(adsorptive-mediated transcytosis, AMT)[24]。
2.1.1 RMT抗癌纳米药物与细胞表面受体进行特异性结合, 触发RMT后, 通过由小窝蛋白或网格蛋白介导[25]的细胞内吞作用及随后发生的细胞内释药促进纳米药物渗透至肿瘤实质。
转铁蛋白受体(transferrin receptor, TfR) 在神经胶质瘤细胞和血脑屏障细胞上的表达很高[26], 许多研究者选择其作为靶点, 用其相应的抗体和配体修饰抗癌纳米药物, 提高其血脑屏障的转运效率及肿瘤渗透能力。如Huang等[27]利用一种能自我组装成笼状结构的铁储存蛋白质铁蛋白(H-ferritin, HFn) 为载体, 设计了以整合素α2β1靶向配体(DGEAGGDGEA) 修饰的HFn组装成的纳米粒2D-HFn, 并在HFn的空腔内装载多柔比星(doxorubicin, DOX)。人胶质母细胞瘤U-87MG细胞上有高表达的整合素α2β1和TfR1。一方面, 经整合素α2β1靶向配体修饰的2D-HFn具有很好的胶质瘤靶向作用; 另一方面, HFn对TfR1具有较高的特异性结合亲和性, HFn与TfR1的特异性结合将触发RMT, 先穿过血脑屏障、再逐渐被肿瘤细胞内吞, 而DOX在酸性环境中会快速从2D-HFn中释放出来, 因此实现了DOX的可控释放(图 1)。动物实验显示载DOX的2D-HFn组平均肿瘤体积明显小于其他各组, 且其平均肿瘤重量最小, 说明载DOX的2D-HFn可显著抑制肿瘤生长。2D-HFn的设计充分体现了受体介导的转胞吞治疗胶质瘤的可行性, 不仅显著提高了纳米粒的载药能力和肿瘤靶向能力, 且显著抑制了U-87MG肿瘤的生长, 结果显示胶质瘤小鼠经2D-HFn治疗后可存活80多天。
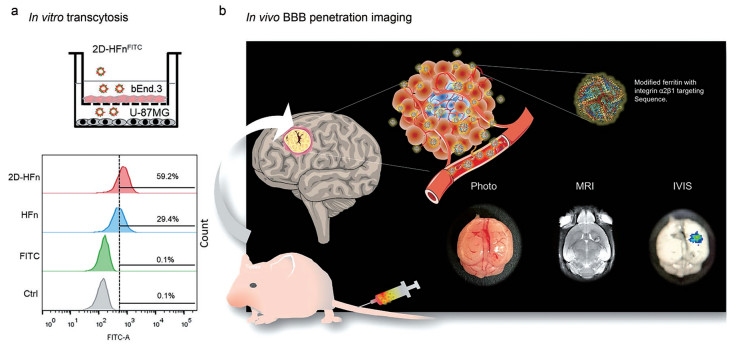
|
Figure 1 Receptor-mediated transcytosis. a: The in vitro transcytosis experiment was performed to assess the abilities of H-ferritin (HFn) and 2D-HFn to cross the blood brain barrier (BBB); b: 2D-HFn had a strong tumor-targeting capability in an orthotopic tumor model. [Adapted from Ref. 27 with permission. Copyright © The Author(s) 2021] |
低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein, LRP) 和清道夫受体(scavenger receptor, SR) 在大脑血管的内皮细胞上高表达, 且LRP1在胶质瘤细胞上的表达也很高, 而载脂蛋白(apolipoprotein, Apo) 可与LRP或SR进行特异性结合, 因此, 常在纳米粒表面修饰Apo, 进而靶向脑胶质瘤[28]。而Zhang等[29]巧妙利用纳米粒进入血流后, 其表面会吸附包括Apo在内的许多功能性蛋白, 形成蛋白质电晕这一生理现象, 用从Aβ1-42中提取的无神经毒性的Aβ25-35短肽(short peptide, SP) 修饰内载DOX的脂质体(doxorubicin-loaded SP-modified liposomes, SP-sLip/DOX), 其中SP与可交换Apo的脂结合域有特异性相互作用。SP-sLip/DOX进入血流后将吸附血浆载脂蛋白ApoE、ApoJ和ApoA1, 在SP作用下暴露出Apo的受体结合域, 以进行多受体识别(LRP1/ApoE、LRP2/ApoJ和SR-B1/ApoA1), 并通过LRP1/LRP2/SR-B1这3种RMT穿透血脑屏障; 然后SP-sLip/DOX在ApoE和LRP1的特异性结合作用下可进一步靶向颅内胶质瘤。实验结果显示SP-sLip/DOX能消融胶质瘤血管, 很好地诱导胶质瘤细胞凋亡; 与仅载DOX的脂质体相比, SP-sLip/DOX的脑分布显著增强且具有明显的抗脑瘤作用。蛋白质电晕原本会严重影响靶向效率并产生不良的体内分布情况, 有研究表明蛋白质电晕会阻碍转铁蛋白修饰的纳米粒通过血脑屏障的转胞吞作用, 减弱其靶向脑肿瘤的能力[30]; 但通过精准控制抗癌纳米药物表面吸附功能性血浆蛋白的种类并与之相互作用, 可实现蛋白质电晕介导的靶向作用, 同时结合RMT, 使靶向至肿瘤处的纳米药物向肿瘤实质进行渗透, 使抗肿瘤效果得到显著提升。
在三阴性乳腺癌(triple-negative breast cancer, TNBC) 细胞上高表达神经纤毛蛋白1 (neuropilin-1, NRP-1) 受体, 且该受体与CendR (RGDK) 基序具有很高的结合亲和力[31]。Mamnoon等[32]根据这一特点合成了DOX封装、iRGD偶联且能进行缺氧反应的聚合物纳米粒(doxorubicin-loaded iRGD-conjugated polymersomes, DOX-iPs)。其中, 肿瘤穿透肽iRGD因包含RGD基序, 可与内皮癌细胞上过表达的αvβ3整合素发生特异性相互作用; 随后, iRGD肽经切割暴露CendR基序, 该基序与NRP-1受体结合可触发转胞吞作用和内吞作用。待DOX-iPs进入TNBC肿瘤后, 聚合物在缺氧环境下发生还原反应、降解聚合物膜、进而释放聚合物内包裹的DOX, 起到较好的抗肿瘤作用。与纳米粒或游离药物被动的肿瘤扩散相比, DOX-iPs可通过主动的RMT靶向肿瘤并增强对肿瘤细胞深部的渗透, 其选择性地将DOX传递给TNBC肿瘤, 同时降低了脱靶毒性。
根据RMT设计的抗癌纳米药物具有如下优势: ①纳米载体通过与肿瘤细胞表面受体的特异性结合实现了抗肿瘤治疗的靶向性, 降低了纳米药物对正常细胞的不良反应; ②这种配体和受体的特异性结合易触发RMT, 使抗癌纳米药物不断向肿瘤组织深处进行渗透。近5年根据RMT设计的一些抗癌纳米药物如表 1[27, 29, 32-39]所示。
| Table 1 A brief summary of the receptor-mediated transcytosis (RMT)-based anticancer nanomedicines. Tf: Transferrin; TfR: Transferrin receptor; DOX: Doxorubicin; DGL: Dendrigraft poly-L-lysine; PC: Pheochromocytoma; LRP: Low-density lipoprotein receptor-related protein; ANG2: Angiopep2; RAP12: Receptor associated protein 12; ApoE: Apolipoprotein E; NRP-1: Neuropilin-1; PEG: Polyethylene glycol; PLA: Poly lactic acid; PTX: Paclitaxel; MSNPs: Mesoporous silica nanoparticles; PDAC: Pancreatic ductal adenocarcinoma; DTR: Diphtheria toxin receptor; RDT: Receptor-binding domain of diphtheria toxin; PLGA: Poly(lactic-co-glycolic acid); NPs: Nanoparticles |
但基于RMT设计抗癌纳米药物还存在一些挑战: 首先, 肿瘤细胞上必须特异性高表达某种受体, 而正常细胞不表达或低表达此受体, 才能依据该方法进行相应药物设计, 表 1中的大多数纳米药物靶向的都是表面高表达多种受体的胶质瘤细胞; 其次, 必须找到能与该受体进行特异性结合的相应配体, 并将此配体修饰到抗癌纳米药物表面, 且配体修饰的抗癌纳米药物与受体的结合不应干扰天然配体与该受体的结合, 否则可能干扰正常生理功能和受体的表达; 最后, 抗癌纳米药物表面修饰的配体密度及配体与受体的结合亲和力都可能影响纳米药物的转胞吞效率, 需经不断摸索才能找到转胞吞效率最高、治疗效果最好的条件。
2.1.2 AMTAMT往往是通过阳离子物质与带负电的细胞膜之间的静电相互作用触发的, 同样可使抗癌纳米药物向肿瘤更深处进行渗透[24]。
γ-谷氨酰转移酶(γ-glutamyltranspeptidase, GGT) 在肝癌和胰腺癌组织的肿瘤细胞和TVEC膜表面均高表达[40]。根据此特征, Wang等[41]研发了一种主动转运的脂质体纳米载体GCSDL, 其由谷胱甘肽(glutathione, GSH) 修饰的二油酰磷脂酰乙醇胺(1, 2-dioleoyl-sn-glycero-3-phosphoethanolamine, DOPE) 磷脂(DOPE-GSH)、氢化大豆卵磷脂(hydrogenated soy phosphatidylcholine, HSPC) 和胆固醇(cholesterol, CHOL) 组成, 并负载DOX。DOPE-GSH能在GGT的催化下发生谷氨酰转移, 使GCSDL由阴离子型转变为阳离子型。当GCSDL被运输到肿瘤组织附近后, 在GGT催化下会发生电荷翻转, 带正电的GCSDL通过激活小窝介导的内吞及囊泡介导的转胞吞作用主动运输穿越TVEC进入肿瘤外围, 增加肿瘤聚集; 随后, 带正电的GCSDL经连续囊泡介导的转胞吞作用跨肿瘤细胞主动运输到肿瘤实质, 实现肿瘤深部渗透递药。该团队根据AMT机制还设计了一种GGT响应性的聚合物与喜树碱(camptothecin, CPT) 的偶联物[42]和另一种GGT响应性的树状大分子-CPT偶联物[43], 二者都能以阳离子化触发转胞吞作用跨越生物屏障, 实现胰腺癌的靶向富集和深部渗透递药, 治疗效果良好。
Wu等[44]从提高肿瘤内高毒性活性氧(reactive oxygen species, ROS) 水平的角度出发, 设计了一个在超声(ultrasound, US) 刺激下发生尺寸和电荷转换的纳米催化药物; 脂质体外层本身带负电荷, 在US刺激下将释放带正电荷的类芬顿催化剂(copper-doped layered double hydroxide, Cu-LDH), 进而触发AMT, 大大增强了纳米药物在肿瘤内的渗透。与此同时, 共释放的声敏剂血卟啉单甲醚(hematoporphyrin monomethyl ether, HMME) 在US作用下催化O2产生单线态氧(1O2); 渗透至肿瘤深部的Cu-LDH还可催化H2O2分解产生高毒性羟基自由基(·OH)。这使肿瘤内部的ROS水平迅速上升, 在不影响正常组织的情况下, 更有效、更安全地杀死癌细胞。Zhang等[45]利用二甲基马来酸酐(dimethylmaleic anhydride, DMA) 修饰聚酰胺(polyamidoamine, PAMAM) 树状大分子制备了一种小形态纳米粒PDMA (polyamidoamine dendrimers with dimethylmaleic anhydride); PDMA在正常生理条件下保持负电性, 但在TME的酸性条件下会发生电荷反转, 迅速由负电荷转变为正电荷, 通过主动的、能量依赖性的、小窝介导的转胞吞作用进行肿瘤渗透(图 2)。实验结果表明阳离子型小形态纳米粒比阴离子型小形态纳米粒渗透得更深, PDMA表现出最佳的肿瘤渗透能力, 负载DOX的PDMA也具有更好的抗肿瘤效果。
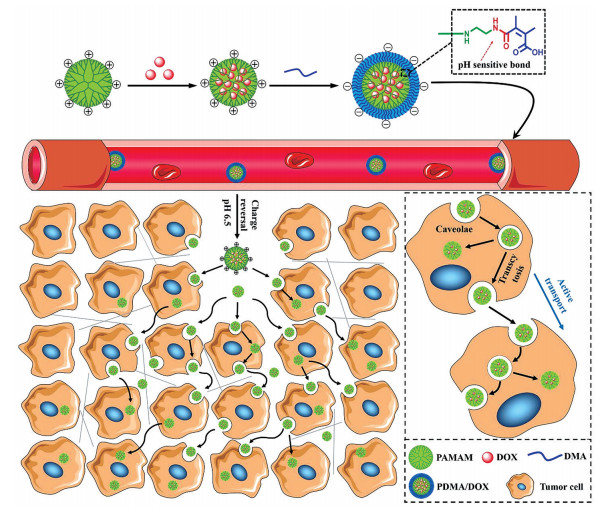
|
Figure 2 Adsorptive-mediated transcytosis. Schematic illustration of the preparation and in vivo fates of small morph PDMA/DOX. PAMAM: Polyamidoamine; DMA: Dimethylmaleic anhydride; PDMA: Polyamidoamine dendrimers with dimethylmaleic anhydride. (Adapted from Ref. 45 with permission. Copyright © 2020 American Chemical Society) |
根据AMT设计的抗癌纳米药物与RMT相似, 都可使抗癌纳米药物主动渗透至肿瘤组织实质; 且这种依赖能量的主动转胞吞作用比被动扩散的EPR效应渗透效果更佳, 能有效提高抗癌纳米药物的治疗效果; 此外, 这种设计策略可利用肿瘤组织的独特性质, 如pH成酸性[45]、缺氧[46]和高表达GGT[41]等, 以此为依据设计不同响应的纳米药物。近5年根据AMT设计的一些抗癌纳米药物如表 2[41-52]所示。
| Table 2 A brief summary of the adsorptive-mediated transcytosis (AMT)-based anticancer nanomedicines. GGT: γ-Glutamyltranspeptidase; CPT: Camptothecin; PDA: Pancreatic ductal adenocarcinoma; HCC: Hepatocellular carcinoma; HCPT: 10-Hydroxycamptothecin; MSNs: Mesoporous silica nanoparticles; US: Ultrasound; Cu-LDH: Copper-doped layered double hydroxide; HMME: Hematoporphyrin monomethyl ether; GEM: Gemcitabine; HA: Hyaluronic acid; ZnO: Zinc oxide; HAases: Hyaluronidases; ICP: Inductively coupled plasma; SN38: 7-Ethyl-10 hydroxycamptothecin |
值得注意的是, AMT要求抗癌纳米药物带正电荷, 而带正电的纳米药物在血液循环过程中易被清除, 且通常具有很高的细胞毒性; 因此为满足血液长循环时间和最佳的肿瘤渗透性, 常设计一个可随条件改变而发生电荷翻转的纳米药物, 即在血液循环过程中纳米药物带负电荷或呈电中性, 而在肿瘤部位产生正电荷。抗癌纳米药物在肿瘤部位发生电荷翻转的效率决定了纳米药物进行肿瘤渗透的效率, 目前设计较多的是通过GGT使纳米药物发生电荷翻转, 这种设计相对有效、能快速实现电荷翻转; 而通过pH发生电荷翻转的纳米药物可能难以应用到临床治疗, 原因可能是不同患者体内的实体瘤处的pH存在差异, 导致同一种纳米药物的治疗效果可能会产生较大的个体差异。AMT没有特异性, 进入肿瘤组织后有可能会被TAMs内吞, 从而导致没有足够的纳米药物到达肿瘤组织实质, 抗肿瘤效果降低。综上, 如何利用AMT有效提高纳米药物向肿瘤深部的递送亟待更深入的研究。
2.1.3 具有转胞吞作用的抗癌纳米药物的细胞内运输机制纳米药物通过小窝蛋白或网格蛋白等介导的内吞作用内化后常在早期核内体中汇合进行分选, 分选后可能直接返回质膜; 分选到晚期核内体的纳米药物往往被运输到溶酶体中进行降解; 而分选到循环核内体的纳米药物则会进行胞吐, 释放到细胞外[53]。
早期核内体的标记物有Rab4[54]和Rab5[55]; 晚期核内体有Rab7和Rab9[54]; 循环核内体有Rab11[56]; 溶酶体标记物有Lamp1[57]。Liu等[58]通过Rab蛋白标记评估纳米粒在细胞内的运输和胞外释放途径, 分别通过Rab5、Rab7和Rab11对各个时期的核内体进行标记, 选择多聚赖氨酸(poly-L-lysine)、原卟啉IX (protoporphyrin IX) 和叶酸(folic acid) 修饰的上转化纳米粒(upconversion nanoparticles, UCNs) 作为纳米药物模型UCNs@PPF。如图 3所示, UCNs@PPF经肿瘤细胞内化后, 先到达Rab5标记的早期核内体, 然后分成两条路径, 一部分UCNs@PPF向Rab7标记的晚期核内体转运, 最终运输到溶酶体中进行储存或降解; 另一部分则向Rab11标记的循环核内体转运, 再与基底细胞膜融合, 进行细胞外释放, 最后被邻近细胞继续吸收。实验结果表明UCNs@PPF的转胞吞作用主要由小窝蛋白介导, 且这种细胞间转运会反复发生, 使纳米药物不断渗透到肿瘤实质; 因此转胞吞作用在抗癌纳米药物的肿瘤渗透中起重要作用, 能产生大量内化和胞吐的纳米药物, 使肿瘤渗透范围更广、治疗效果更佳。此外, Reinholz等[59]同样根据这些标记物研究了小型聚苯乙烯纳米粒(polystyrene nanoparticles, PS-NPs) 在Caco-2细胞模型中的摄取机制和运输途径, Caco-2细胞模型是一种人克隆结肠癌细胞, 其结构和功能类似于分化的小肠上皮细胞, 可用来模拟体内的肠转运实验[60]。研究发现, PS-NPs在上皮细胞中始终表现出高摄取, 但并未观察到任何通过小窝介导的内吞作用进行内化的现象, 提示PS-NPs是通过RhoB和Rab5a介导的大胞饮作用被内化的; 实验还观察到大多数PS-NPs都被运输到Lamp1标记的溶酶体内, 只有少数PS-NPs释放到细胞外。这项研究表明, 溶酶体途径对纳米药物的降解是转胞吞作用的主要障碍。随后研究者将PS-NPs质量浓度从75增至600 mg·mL-1, 结果发现这并不能提高PS-NPs的转胞吞效率, 提示仅增加纳米粒浓度并不能增加其溶酶体逃逸量, 即大部分纳米粒经细胞内化后仍会被溶酶体降解, 仅有少量纳米粒能渗透至肿瘤细胞深处, 其抗肿瘤效果大打折扣。此外, 研究表明小窝介导的内吞途径涉及较少的溶酶体途径降解[24]。如Wang等[50]开发了内载Au5的纳米粒(self-reporting nano-pomegranates, RNPs), 当RNPs到达肿瘤后, 酸性环境会触发RNPs裂解释放出小尺寸的Au5纳米粒, 且Au5表面带正电荷, 将引发AMT。在转胞吞过程中, Au5通过小窝介导的内吞作用被细胞内化; 然后内化物质一部分通过晚期核内体途径运输至溶酶体进行储存或降解; 另一部分(约57%) 通过高尔基体-循环核内体途径进行运输, 最终排出质膜。Au5不断循环重复的内化和胞吐将提高纳米粒的细胞间运输效率, 使其进入肿瘤组织的远端缺氧区。
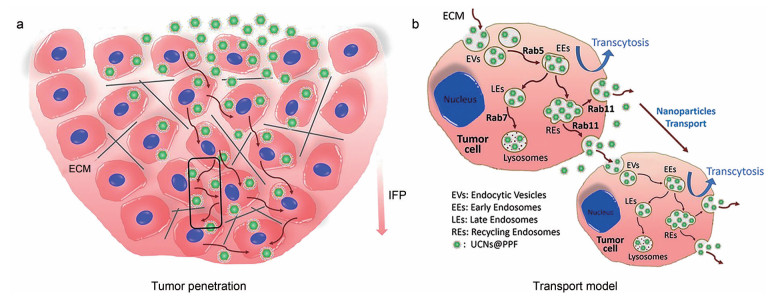
|
Figure 3 Intracellular transport mechanisms. a: The main penetration pathway of nanoparticles into deep tumor tissues; b: The intercellular transport model (as labeled by the black box in a) of nanoparticles mediated by transcytosis. (Adapted from Ref. 58 with permission. Copyright © 2019 American Chemical Society) |
纳米药物触发受体介导的转胞吞后, 往往因具有高结合力的配体在识别后不易与受体分离, 导致难以实现溶酶体逃逸, 限制了后续药物向肿瘤实质的胞吐; 因此不仅要寻找结合亲和力高的配体, 还要在纳米药物内化后快速与膜受体进行分离。Cai等[35]以血脑屏障上的TfR为靶点, 设计了一种Tet1和D肽(D peptide, Dp) 修饰的树状聚左旋赖氨酸(dendrigraft poly-L-lysines, DGL), 并连接了具有酸响应性的聚乙二醇链(NHS-PEG-DAK-PEG-MAL, PDP) 修饰的T7肽(HAIYPRH), 最后通过静电吸附siRNA得到纳米粒D-DTCT7/siRNA, 其中, T7肽与TfR具有高亲和力, 可特异性靶向该受体, 触发RMT, 实现高度内化。研究者通过添加不同的摄取抑制剂研究其内化途径, 结果表明小窝介导的和网格蛋白介导的内吞途径均参与了该过程; 其次, 亚细胞定位、体外BBB模型转胞吞和体内荧光成像研究表明, T7肽和D-DTCT7/siRNA之间酸响应连接子可在核内体/溶酶体中被剪切, 使纳米粒迅速从核内体/溶酶体逃逸, 然后通过Tet1肽靶向到脑实质中的神经元, 治疗效果显著提高。Song等[61]建立了3种不同受体的配体修饰明胶, 分别是新生儿Fc受体(neonatal Fc receptor, FcRn) 的配体FcBP、TfR的配体7pep和αvβ3整合素的配体c(RGDfK)。对不同配体密度的胶束的转胞吞途径研究表明, FcBP修饰的胶束(FcBP decorated micelle, F-M) 可通过普通循环核内体进行循环, 但不能通过高尔基体复合物, 且高配体密度(15%) 的F-M主要进入溶酶体降解途径; 7pep修饰的胶束(7pep decorated micelle, T-M) 以配体依赖方式转运到顶端循环核内体, 并释放到胞外顶端质膜, 而高配体密度(20%) 的T-M主要进入溶酶体降解途径; c(RGDfK) 修饰的胶束[c(RGDfK) decorated micelle, R-M] 通过CRE和高尔基体复合物转运到基底外侧质膜, 而中等配体密度(15%) 的R-M主要进入溶酶体降解途径。该实验结果说明不同受体具有不同特性, 会影响抗癌纳米药物的主动转胞吞效率。此外, 纳米药物上的配体密度也并非越高越好, 应选择合适的配体密度进行修饰, 并不断优化其密度, 使纳米药物的转胞吞作用的效率达到最大化, 更好渗透至肿瘤实质。
以上研究表明: 抗癌纳米药物在肿瘤细胞内的溶酶体降解途径在一定程度上降低了主动转胞吞效率; 要想达到良好的抗肿瘤效果, 纳米药物必须实现溶酶体逃逸, 即纳米药物经过RMT或AMT进入肿瘤细胞后必须通过非降解途径进行胞吐, 才能继续向更深处的肿瘤细胞渗透。根据主动转胞吞作用设计的纳米药物如何克服溶酶体降解这一问题仍需进行大量研究, 而这一问题能否解决将直接关系到主动转胞吞策略能否应用到临床实践。
此外, 还有研究表明肿瘤来源的外泌体(也称为细胞外囊泡, extracellular vesicles, EV) 可通过转胞吞作用穿越完整的血脑屏障促使肿瘤向大脑转移, Morad等[62]使用了几种BBB模型证实EV并不是从血脑屏障的细胞间空隙穿过以进入大脑, 而是诱使内皮细胞主动去吸收这些EV, 通过“劫持”转胞吞作用, 由内皮细胞直接吞噬EV, 将EV带入组织内部然后像特洛伊木马一样再释放到脑组织中。这些EV劫持了分子摄取和分选途径, 可通过降低脑内皮细胞Rab7的表达并增加Rab11的表达促进EV胞吐, 以此增加其运输效率, 改变了细胞内部通路的调节。并且肿瘤细胞来源的外泌体会优先与其母癌细胞融合[63], 因此若能利用肿瘤细胞来源的外泌体作为载体输送抗癌纳米药物, 可有效通过血脑屏障到达脑实质, 治疗各种脑部疾病。
总之, 根据主动转胞吞策略设计的抗癌纳米药物的肿瘤渗透效果比仅依靠EPR效应被动运输的效果显著增强, 无论是由配体-受体相结合还是吸附作用触发的转胞吞作用, 在细胞内经过非溶酶体降解途径运输后, 都能快速渗透至肿瘤组织中, 浸润缺血管和缺氧部位, 从而将药物递送到所有细胞中, 最终达到杀死肿瘤组织中所有肿瘤细胞的目的。
但这种策略仍存在一些问题值得探讨, 如抗癌纳米药物在进行肿瘤渗透的过程中会不断释放药物, 很可能在到达肿瘤实质之前纳米粒包覆的药物就被完全释放, 导致远端细胞内没有药物积累; 此外, 纳米药物的转胞吞作用是否也会发生在正常组织中, 长期给药后造成细胞毒性的积聚, 这在进行临床转化前必须经过严格检测。
2.2 抗癌纳米药物借助免疫细胞实现肿瘤渗透无论是通过被动的EPR效应还是主动的转胞吞作用进行肿瘤渗透, 抗癌纳米药物在一定程度上都会受到TME中各种生物屏障的阻碍, 如异常的血管和淋巴管、致密的ECM、较高的IFP和固体压力等[64]; 因此, 研究者开始利用具有特异性肿瘤倾向的细胞, 探索免疫细胞介导的药物递送及肿瘤渗透。由于肿瘤经常发生在慢性炎症部位, 免疫细胞如中性粒细胞、单核细胞、巨噬细胞、T细胞等将被优先招募到TME中, 利用这些细胞的细胞膜或胞外囊泡装载抗癌纳米药物或直接将纳米药物靶向免疫细胞, 可绕过一直以来纳米药物输送到实体瘤的瓶颈问题, 且能有效渗透至肿瘤实质[65]。
Naumenko等[66]为研究纳米药物的外渗机制, 使用活体显微镜追踪荧光脂质体(fluorescent liposomes, FL) 在不同肿瘤模型和正常血管中的外渗行为, 并成功识别出两种不同的外渗机制—微渗漏和大渗漏。微渗漏是一种局部血管周围的纳米药物沉积现象, 其外渗面积有限、扩散距离往往不超过血管20 µm, 且微渗漏既发生在肿瘤组织中, 也发生在正常血管周围, 很可能是纳米药物在正常组织中发生沉积的原因; 而大渗漏可覆盖大片间质区域, 并扩散至血管外数百微米、深入组织, 推测这是进入肿瘤细胞的主要途径。进一步研究表明, 被单核细胞摄取的FL不会越过血管屏障, 而被中性粒细胞摄取的FL往往会发生微渗漏和大渗漏, 尽管这些渗透的发生次数不多, 但原则上可证实是中性粒细胞介导的FL外渗途径; 且中性粒细胞附近(≤ 50 µm) 的大渗漏频率增加了3倍, 结果还显示大渗漏频率与中性粒细胞的浸润之间存在正相关; 当中性粒细胞减少时, FL在肿瘤中的积累显著减少。这一研究为脂质体的跨血管运输提供了新策略, 可靶向肿瘤组织部位的中性粒细胞, 引发脂质体的大渗漏, 使其能渗透至肿瘤组织深处, 起到更有效的抗肿瘤效果。
利用免疫细胞来源的细胞膜包覆纳米粒并载药, 可很好地实现肿瘤靶向和浸润, 药物的肿瘤渗透能力提高后, 相应的治疗效果也会得到较大提升。如Wei等[67]设计了甘露醇修饰的巨噬细胞衍生微粒(mannose-modified macrophage-derived microparticles, Man-MPs) 并加载二甲双胍(metformin, Met) 得到载药纳米粒Met@Man-MPs, 因M2型TAM高表达甘露糖受体CD206/MRC1, 故Met@Man-MPs可有效靶向M2型TAM, 使其重新极化为M1型, 从而抑制肿瘤生长。Met@Man-MPs重置的TAM通过增加CD8+ T细胞在肿瘤组织的募集和减少髓源性抑制细胞和调节性T细胞的免疫抑制浸润来重塑肿瘤免疫微环境; Man-MPs过表达MMP9、MMP14等基质金属蛋白酶(matrix metalloproteinases, MMP), 导致肿瘤胶原蛋白部分降解, 有助于CD8+ T细胞浸润到肿瘤内部, 增加肿瘤抗PD-1 (programmed cell death protein-1) 抗体的渗透和聚集, 结果显示抗PD-1抗体与Met@Man-MPs联用可显著增强抗肿瘤能力。
合理设计抗癌纳米药物, 使其靶向免疫细胞, 利用免疫细胞对肿瘤或炎症部位的趋向性, 携带纳米药物浸润至肿瘤实质, 以达到抗肿瘤目的。Schmid等[68]在聚乳酸-羟基乙酸[poly(lactic-co-glycolic acid), PLGA]/PEG的基础上设计了一种靶向T细胞的纳米粒, 实验证明CD8+靶向纳米粒或PD-1靶向纳米粒在体外和体内均能与T细胞进行特异性结合, 该纳米粒能靶向传递TGFβR1抑制剂(SD-208) 或TLR7/8激动剂(R848), SD-208可恢复效应T细胞的功能, 还可挽救其他被抑制免疫细胞的功能, 从而延缓肿瘤的生长、延长生命周期; R848可将淋巴细胞招募到非炎症肿瘤中, 促进CD8+ T细胞浸润到肿瘤内部, 并使肿瘤对抗PD-1敏感, 有效延长生存率。这些纳米粒在静脉注射后能与循环中的T细胞结合, T细胞主动迁移到实体瘤, 携带纳米粒进入严峻的TME中, 并持续释放纳米粒装载的小分子药物, 利用T细胞作为载体极大地增加了输送到肿瘤实质的药物数量; 这一设计既能使纳米粒有效渗透至肿瘤实质, 又能在肿瘤细胞中达到适宜的药物浓度, 有效杀死肿瘤细胞; 并且这一纳米粒体系还可根据T细胞和肿瘤组织的实际情况选择不同的配体靶向T细胞上的多种受体和合适的小分子药物充分发挥药效。Lee等[69]基于生物正交反应中点击化学的快速、高选择性和高效性, 尤其是1, 2, 4, 5-四嗪(tetrazines, Tz) 和反式环辛烯(trans-cyclooctene, TCO) 之间的[4 + 2] 环加成反应, 开发了一种点击反应辅助的免疫细胞靶向(click reaction-assisted immune cell targeting, CRAIT) 策略。由于不同类型的非成熟骨髓细胞(immature myeloid cells, iMCs), 又称髓源性抑制细胞, 在各种肿瘤类型的早期就能被快速招募, 通过抑制T细胞功能保护肿瘤组织免受免疫破坏, 且iMCs还能渗透进入肿瘤深部, 远离经常发生缺氧的血管, 故选择以iMCs为靶标。根据iMCs表面高特异性表达受体CD11b, 合成了TCO修饰的CD11b抗体anti-CD11b-TCO, 同时合成Tz修饰的介孔纳米粒(mesoporous silica nanoparticles functionalized with tetrazines, MSNs-Tz), 并建立4T1小鼠乳腺癌模型; 先尾静脉注射anti-CD11b-TCO, 24 h后确定iMCs标记TCO后, 再尾静脉注射MSNs-Tz, Tz与TCO发生点击化学反应实现MSNs与iMCs的特异性连接, 最后利用iMCs将MSNs递送至肿瘤深部, MSNs包覆的DOX可有效到达肿瘤深部的缺血管部位, 其积累量比EPR效应高出2倍, 能明显改善肿瘤治疗效果(图 4)。CRAIT策略避免了离体操作免疫细胞, 更简洁、高效, 同时也增加了纳米粒在肿瘤缺血管区域的渗透, 抗肿瘤效果更好。
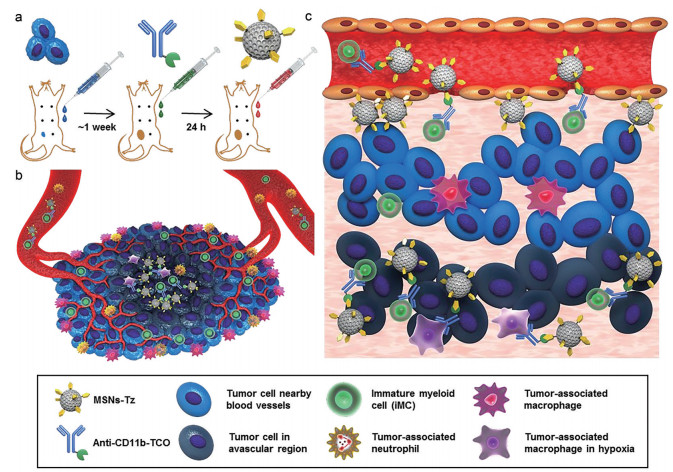
|
Figure 4 Immune cell-mediated tumor penetration. a: Schematic illustrating the click reaction-assisted immune cell targeting (CRAIT) method applied to an orthotopic 4T1 tumor mouse model; b: Schematic illustrating the CRAIT method applied to an orthotopic 4T1 tumor mouse model; c: Schematic illustration of how the CRAIT strategy probes (anti-CD11b-TCO and MSNs-Tz) are delivered into the avascular region of the tumor. (Adapted from Ref. 69 with permission. Copyright © 2019 American Chemical Society) |
综上, 借助免疫细胞实现的肿瘤渗透为抗癌纳米药物提供了一种新的有效途径, 一方面, 免疫细胞对组织损伤、感染和炎症部位具有天然的趋向性, 而肿瘤部位常常表现为难以治愈的慢性炎症, 因此免疫细胞会不断被招募到肿瘤部位, 借助免疫细胞实现的肿瘤渗透能有效克服抗癌纳米药物难以穿过内皮细胞和TME的障碍; 另一方面, 免疫细胞表面存在自我识别信号, 其装载的纳米药物不易被单核吞噬细胞系统吞噬或被肝脏过滤, 可延长血液循环时间[70]; 并且由免疫细胞的细胞膜或胞外囊泡装载的纳米药物可降低免疫原性和细胞毒性, 有效改善药物的治疗效果。近5年借助免疫细胞实现肿瘤渗透的一些抗癌纳米药物如表 3[66-69, 71-74]所示。
| Table 3 A brief summary of the immune cell-mediated tumor penetration-based anticancer nanomedicines. SMNs: Self-assembled into nanoparticles; FL: Fluorescent liposomes; Met: Metformin |
但这一策略也面临许多挑战, 肿瘤可分为“热”和“冷”两种类型, “热”肿瘤表现为病灶部位有大量T细胞浸润, 而“冷”肿瘤病灶部位几乎没有T细胞分布, 因此免疫细胞很难渗透进入“冷”肿瘤[75]; 此外, 免疫细胞作为生物材料, 在制备过程中, 如分离、体外培养、转染等步骤, 导致免疫细胞表面发生变化的多种因素都有可能影响其生物活性及趋向性, 甚至引发脱靶效应; 最后, 免疫细胞到达肿瘤部位后如何使内部装载的抗癌纳米药物释放及其释放效率是该方法必须考虑的关键性问题, 否则, 免疫细胞即使渗透到肿瘤实质也无法释放出足够药物杀灭肿瘤细胞。
3 总结与展望抗癌纳米药物在肿瘤组织中的渗透问题很大程度上抑制了其在实体瘤治疗中的临床应用, 纳米药物固有的大尺寸和实体瘤中复杂的生物屏障使纳米药物很难通过EPR效应被动运输到远离血管的肿瘤细胞中, 根据EPR效应设计的纳米药物在临床肿瘤中的渗透性差, 且有很强的异质性, 同一药物对不同患者的治疗效果差异较大; 若能改善纳米药物的肿瘤渗透问题, 先前设计的多种抗癌纳米药物的治疗效果将显著增强, 癌症纳米医学领域的临床转化指日可待。
为克服抗癌纳米药物递送过程中的各种生物屏障、增加药物的肿瘤渗透深度, 研究人员设计纳米药物的依据逐渐从被动的EPR效应转向主动的转胞吞作用和免疫细胞介导的肿瘤渗透策略; 上述许多研究结果显示: 无论是通过RMT和AMT, 还是借助免疫细胞实现的肿瘤渗透策略都比仅依靠EPR效应被动运输的肿瘤渗透性好, 治疗效果更佳。在今后设计中, 可将多种策略相结合实现协同作用, 如设计一种尺寸和电荷双转换的抗癌纳米药物, 既能增加药物EPR效应又能触发AMT, 同时结合被动运输和主动转胞吞策略, 进一步提高纳米药物的肿瘤渗透深度。此外, 针对免疫细胞离体培养困难的问题, 也可采取免疫细胞体内原位载药的策略进行肿瘤渗透, 该方法相较于在体外将纳米药物载入免疫细胞内的方法操作更简单易行, 更有利于临床实践[76]。
然而, 对这两种新型肿瘤渗透策略的研究和理解还远远不够, 仍存在许多问题亟待解决。一方面, 临床转化的实现必然需抗癌纳米药物的大规模生产, 根据这两种新型策略设计的纳米药物的制备过程是否简单易行、能否满足工业化生产还需进一步探索; 另一方面, 大多数研究使用的动物模型均为小鼠, 而小鼠实体瘤与人类实体瘤的差异较大, 尽管各种研究表明根据主动转胞吞作用或基于免疫细胞介导的肿瘤渗透策略设计的抗癌纳米药物在小鼠实体瘤模型中有较好的渗透性和抗肿瘤效果, 但这并不代表其在人体肿瘤内也能达到相同疗效, 因此还需建立与人类实体瘤更加相似的肿瘤模型进行研究, 离真正实现抗癌纳米药物的临床转化还有很长路要走。
作者贡献: 黄婧负责部分资料搜集及文章撰写; 邹俊娜和任欢欢负责部分资料搜集并校对全文; 王珊负责构思文章框架、补充和修改全文。
利益冲突: 全体作者声明本文不存在任何利益冲突。
| [1] |
Shemi A, Khvalevsky EZ, Gabai RM, et al. Multistep, effective drug distribution within solid tumors[J]. Oncotarget, 2015, 6: 39564-39577. DOI:10.18632/oncotarget.5051 |
| [2] |
Lin W, Noel P, Borazanci EH, et al. Single-cell transcriptome analysis of tumor and stromal compartments of pancreatic ductal adenocarcinoma primary tumors and metastatic lesions[J]. Genome Med, 2020, 12: 80. DOI:10.1186/s13073-020-00776-9 |
| [3] |
Jain M, Venkatraman G, Batra SK. Optimization of radioimmunotherapy of solid tumors: biological impediments and their modulation[J]. Clin Cancer Res, 2007, 13: 1374-1382. DOI:10.1158/1078-0432.CCR-06-2436 |
| [4] |
Gao M, Fu JX, Wang XT. Major progress in tumor accumulation and penetration of nanomedicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 138-145. |
| [5] |
Schaaf MB, Garg AD, Agostinis P. Defining the role of the tumor vasculature in antitumor immunity and immunotherapy[J]. Cell Death Dis, 2018, 9: 115. DOI:10.1038/s41419-017-0061-0 |
| [6] |
Primeau AJ, Rendon A, Hedley D, et al. The distribution of the anticancer drug doxorubicin in relation to blood vessels in solid tumors[J]. Clin Cancer Res, 2005, 11: 8782-8788. DOI:10.1158/1078-0432.CCR-05-1664 |
| [7] |
Oliver G, Kipnis J, Randolph GJ, et al. The lymphatic vasculature in the 21st century: novel functional roles in homeostasis and disease[J]. Cell, 2020, 182: 270-296. DOI:10.1016/j.cell.2020.06.039 |
| [8] |
Padera TP, Stoll BR, Tooredman JB, et al. Pathology: cancer cells compress intratumour vessels[J]. Nature, 2004, 427: 695. DOI:10.1038/427695a |
| [9] |
Theocharis AD, Skandalis SS, Gialeli C, et al. Extracellular matrix structure[J]. Adv Drug Deliv Rev, 2016, 97: 4-27. DOI:10.1016/j.addr.2015.11.001 |
| [10] |
Insua-Rodríguez J, Oskarsson T. The extracellular matrix in breast cancer[J]. Adv Drug Deliv Rev, 2016, 97: 41-55. DOI:10.1016/j.addr.2015.12.017 |
| [11] |
Li Z, Shan X, Chen Z, et al. Applications of surface modification technologies in nanomedicine for deep tumor penetration[J]. Adv Sci (Weinh), 2020, 8: 2002589. |
| [12] |
Ansell SM, Vonderheide RH. Cellular composition of the tumor microenvironment[J]. Am Soc Clin Oncol Educ Book, 2013, 33: e91. DOI:10.14694/EdBook_AM.2013.33.e91 |
| [13] |
Li L, Yu R, Cai T, et al. Effects of immune cells and cytokines on inflammation and immunosuppression in the tumor microenvironment[J]. Int Immunopharmacol, 2020, 88: 106939. DOI:10.1016/j.intimp.2020.106939 |
| [14] |
Du C, Li S, Li Y, et al. F7 and topotecan co-loaded thermosensitive liposome as a nano-drug delivery system for tumor hyperthermia[J]. Drug Deliv, 2020, 27: 836-847. DOI:10.1080/10717544.2020.1772409 |
| [15] |
Luo Y, Li J, Hu Y, et al. Injectable thermo-responsive nano-hydrogel loading triptolide for the anti-breast cancer enhancement via localized treatment based on "two strikes" effects[J]. Acta Pharm Sin B, 2020, 10: 2227-2245. DOI:10.1016/j.apsb.2020.05.011 |
| [16] |
Tang J, Meka AK, Theivendran S, et al. Openwork @ dendritic mesoporous silica nanoparticles for lactate depletion and tumor microenvironment regulation[J]. Angew Chem Int Ed Engl, 2020, 59: 22054-22062. DOI:10.1002/anie.202001469 |
| [17] |
Wu B, Yuan Y, Liu J, et al. Single-cell RNA sequencing reveals the mechanism of sonodynamic therapy combined with a RAS inhibitor in the setting of hepatocellular carcinoma[J]. J Nanobiotechnology, 2021, 19: 177. DOI:10.1186/s12951-021-00923-3 |
| [18] |
Song B, Wu S, Li W, et al. Folate modified long circulating nano-emulsion as a promising approach for improving the efficiency of chemotherapy drugs in cancer treatment[J]. Pharm Res, 2020, 37: 242. DOI:10.1007/s11095-020-02811-1 |
| [19] |
Zhu L, Shi Y, Xiong Y, et al. Emerging self-assembling peptide nanomaterial for anti-cancer therapy[J]. J Biomater Appl, 2021, 36: 882-901. DOI:10.1177/08853282211027882 |
| [20] |
Huang W, Chen L, Kang L, et al. Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs[J]. Adv Drug Deliv Rev, 2017, 115: 82-97. DOI:10.1016/j.addr.2017.06.004 |
| [21] |
Matsumura Y, Maeda H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs[J]. Cancer Res, 1986, 46: 6387-6392. |
| [22] |
He H, Liu L, Morin EE, et al. Survey of clinical translation of cancer nanomedicines-lessons learned from successes and failures[J]. Acc Chem Res, 2019, 52: 2445-2461. DOI:10.1021/acs.accounts.9b00228 |
| [23] |
Sindhwani S, Syed AM, Ngai J, et al. The entry of nanoparticles into solid tumours[J]. Nat Mater, 2020, 19: 566-575. DOI:10.1038/s41563-019-0566-2 |
| [24] |
Zhou Q, Dong C, Fan W, et al. Tumor extravasation and infiltration as barriers of nanomedicine for high efficacy: the current status and transcytosis strategy[J]. Biomaterials, 2020, 240: 119902. DOI:10.1016/j.biomaterials.2020.119902 |
| [25] |
Yang AC, Stevens MY, Chen MB, et al. Physiological blood-brain transport is impaired with age by a shift in transcytosis[J]. Nature, 2020, 583: 425-430. DOI:10.1038/s41586-020-2453-z |
| [26] |
Terstappen GC, Meyer AH, Bell RD, et al. Strategies for delivering therapeutics across the blood-brain barrier[J]. Nat Rev Drug Discov, 2021, 20: 362-383. |
| [27] |
Huang CW, Chuang CP, Chen YJ, et al. Integrin α2β1-targeting ferritin nanocarrier traverses the blood-brain barrier for effective glioma chemotherapy[J]. J Nanobiotechnology, 2021, 19: 180. DOI:10.1186/s12951-021-00925-1 |
| [28] |
Ding Y, Wang RN, Han Y, et al. Research advances in nano-scale drug delivery system for crossing the blood brain barrier[J]. Chin J Pharm (中国医药工业杂志), 2015, 46: 754-761. |
| [29] |
Zhang Z, Guan J, Jiang Z, et al. Brain-targeted drug delivery by manipulating protein corona functions[J]. Nat Commun, 2019, 10: 3561. DOI:10.1038/s41467-019-11593-z |
| [30] |
Xiao W, Wang Y, Zhang H, et al. The protein corona hampers the transcytosis of transferrin-modified nanoparticles through blood-brain barrier and attenuates their targeting ability to brain tumor[J]. Biomaterials, 2021, 274: 120888. DOI:10.1016/j.biomaterials.2021.120888 |
| [31] |
Ruoslahti E. Tumor penetrating peptides for improved drug delivery[J]. Adv Drug Deliv Rev, 2017, 110-111: 3-12. DOI:10.1016/j.addr.2016.03.008 |
| [32] |
Mamnoon B, Loganathan J, Confeld MI, et al. Targeted polymeric nanoparticles for drug delivery to hypoxic, triple-negative breast tumors[J]. ACS Appl Bio Mater, 2021, 4: 1450-1460. DOI:10.1021/acsabm.0c01336 |
| [33] |
Liu C, Liu XN, Wang GL, et al. A dual-mediated liposomal drug delivery system targeting the brain: rational construction, integrity evaluation across the blood-brain barrier, and the transporting mechanism to glioma cells[J]. Int J Nanomedicine, 2017, 12: 2407-2425. DOI:10.2147/IJN.S131367 |
| [34] |
Ruan SB, Qin L, Xiao W, et al. Acid-responsive transferrin dissociation and GLUT mediated exocytosis for increased blood-brain barrier transcytosis and programmed glioma targeting delivery[J]. Adv Funct Mater, 2018, 28: 1802227. DOI:10.1002/adfm.201802227 |
| [35] |
Cai L, Yang C, Jia W, et al. Endo/lysosome-escapable delivery depot for improving BBB transcytosis and neuron targeted therapy of Alzheimer's disease[J]. Adv Funct Mater, 2020, 30: 1909999. DOI:10.1002/adfm.201909999 |
| [36] |
Figueiredo P, Balasubramanian V, Shahbazi MA, et al. Angiopep2-functionalized polymersomes for targeted doxorubicin delivery to glioblastoma cells[J]. Int J Pharm, 2016, 511: 794-803. DOI:10.1016/j.ijpharm.2016.07.066 |
| [37] |
Ruan H, Chai Z, Shen Q, et al. A novel peptide ligand RAP12 of LRP1 for glioma targeted drug delivery[J]. J Control Release, 2018, 279: 306-315. DOI:10.1016/j.jconrel.2018.04.035 |
| [38] |
Liu X, Lin P, Perrett I, et al. Tumor-penetrating peptide enhances transcytosis of silicasome-based chemotherapy for pancreatic cancer[J]. J Clin Invest, 2017, 127: 2007-2018. DOI:10.1172/JCI92284 |
| [39] |
Agarwal M, Sahoo AK, Bose B. Receptor-mediated enhanced cellular delivery of nanoparticles using recombinant receptor-binding domain of diphtheria toxin[J]. Mol Pharm, 2017, 14: 23-30. DOI:10.1021/acs.molpharmaceut.6b00480 |
| [40] |
Corti A, Franzini M, Paolicchi A, et al. Gamma-glutamyltransferase of cancer cells at the crossroads of tumor progression, drug resistance and drug targeting[J]. Anticancer Res, 2010, 30: 1169-1181. |
| [41] |
Wang G, Wu B, Li Q, et al. Active transportation of liposome enhances tumor accumulation, penetration, and therapeutic efficacy[J]. Small, 2020, 16: e2004172. DOI:10.1002/smll.202004172 |
| [42] |
Zhou Q, Shao S, Wang J, et al. Enzyme-activatable polymer-drug conjugate augments tumour penetration and treatment efficacy[J]. Nat Nanotechnol, 2019, 14: 799-809. DOI:10.1038/s41565-019-0485-z |
| [43] |
Wang G, Zhou Z, Zhao Z, et al. Enzyme-triggered transcytosis of dendrimer-drug conjugate for deep penetration into pancreatic tumors[J]. ACS Nano, 2020, 14: 4890-4904. DOI:10.1021/acsnano.0c00974 |
| [44] |
Wu W, Pu Y, Shi J. Dual size/charge-switchable nanocatalytic medicine for deep tumor therapy[J]. Adv Sci (Weinh), 2021, 8: 2002816. DOI:10.1002/advs.202002816 |
| [45] |
Zhang Z, Wang T, Yang R, et al. Small morph nanoparticles for deep tumor penetration via caveolae-mediated transcytosis[J]. ACS Appl Mater Interfaces, 2020, 12: 38499-38511. DOI:10.1021/acsami.0c06872 |
| [46] |
Zhen J, Tian S, Liu Q, et al. Nanocarriers responsive to a hypoxia gradient facilitate enhanced tumor penetration and improved anti-tumor efficacy[J]. Biomater Sci, 2019, 7: 2986-2995. DOI:10.1039/C9BM00461K |
| [47] |
Wang G, Zhang C, Jiang Y, et al. Ultrasonic cavitation-assisted and acid-activated transcytosis of liposomes for universal active tumor penetration[J]. Adv Funct Mater, 2021. DOI:10.1002/adfm.202102786 |
| [48] |
Jing Y, Xiong X, Ming Y, et al. A multifunctional micellar nanoplatform with pH-triggered cell penetration and nuclear targeting for effective cancer therapy and inhibition to lung metastasis[J]. Adv Healthc Mater, 2018, 7: e1700974. DOI:10.1002/adhm.201700974 |
| [49] |
Chen L, Zhao T, Zhao M, et al. Size and charge dual-transformable mesoporous nanoassemblies for enhanced drug delivery and tumor penetration[J]. Chem Sci, 2020, 11: 2819-2827. DOI:10.1039/C9SC06260B |
| [50] |
Wang L, Jiang W, Xiao L, et al. Self-reporting and splitting nanopomegranates potentiate deep tissue cancer radiotherapy via elevated diffusion and transcytosis[J]. ACS Nano, 2020, 14: 8459-8472. DOI:10.1021/acsnano.0c02674 |
| [51] |
Cui T, Yan Z, Qin H, et al. A sequential target-responsive nanocarrier with enhanced tumor penetration and neighboring effect in vivo[J]. Small, 2019, 15: e1903323. DOI:10.1002/smll.201903323 |
| [52] |
Cong Z, Zhang L, Ma SQ, et al. Size-transformable hyaluronan stacked self-assembling peptide nanoparticles for improved transcellular tumor penetration and photo-chemo combination therapy[J]. ACS Nano, 2020, 14: 1958-1970. DOI:10.1021/acsnano.9b08434 |
| [53] |
Villaseñor R, Lampe J, Schwaninger M, et al. Intracellular transport and regulation of transcytosis across the blood-brain barrier[J]. Cell Mol Life Sci, 2019, 76: 1081-1092. DOI:10.1007/s00018-018-2982-x |
| [54] |
Chichger H, Braza J, Duong H, et al. Select Rab GTPases regulate the pulmonary endothelium via endosomal trafficking of vascular endothelial-cadherin[J]. Am J Respir Cell Mol Biol, 2016, 54: 769-781. DOI:10.1165/rcmb.2015-0286OC |
| [55] |
Yuan W, Song C. The emerging role of Rab5 in membrane receptor trafficking and signaling pathways[J]. Biochem Res Int, 2020, 2020: 4186308. |
| [56] |
Majzoub RN, Wonder E, Ewert KK, et al. Rab11 and lysotracker markers reveal correlation between endosomal pathways and transfection efficiency of surface-functionalized cationic liposome-DNA nanoparticles[J]. J Phys Chem B, 2016, 120: 6439-6453. DOI:10.1021/acs.jpcb.6b04441 |
| [57] |
Sugaya K, Seto S, Tsujimura K, et al. Mobility of late endosomal and lysosomal markers on phagosomes analyzed by fluorescence recovery after photobleaching[J]. Biochem Biophys Res Commun, 2011, 410: 371-375. DOI:10.1016/j.bbrc.2011.06.023 |
| [58] |
Liu Y, Huo Y, Yao L, et al. Transcytosis of nanomedicine for tumor penetration[J]. Nano Lett, 2019, 19: 8010-8020. DOI:10.1021/acs.nanolett.9b03211 |
| [59] |
Reinholz J, Diesler C, Schöttler S, et al. Protein machineries defining pathways of nanocarrier exocytosis and transcytosis[J]. Acta Biomater, 2018, 71: 432-443. DOI:10.1016/j.actbio.2018.03.006 |
| [60] |
van Breemen RB, Li Y. Caco-2 cell permeability assays to measure drug absorption[J]. Expert Opin Drug Metab Toxicol, 2005, 1: 175-185. DOI:10.1517/17425255.1.2.175 |
| [61] |
Song X, Li R, Deng H, et al. Receptor mediated transcytosis in biological barrier: the influence of receptor character and their ligand density on the transmembrane pathway of active-targeting nanocarriers[J]. Biomaterials, 2018, 180: 78-90. DOI:10.1016/j.biomaterials.2018.07.006 |
| [62] |
Morad G, Carman CV, Hagedorn EJ, et al. Tumor-derived extracellular vesicles breach the intact blood-brain barrier via transcytosis[J]. ACS Nano, 2019, 13: 13853-13865. DOI:10.1021/acsnano.9b04397 |
| [63] |
Qiao L, Hu S, Huang K, et al. Tumor cell-derived exosomes home to their cells of origin and can be used as Trojan horses to deliver cancer drugs[J]. Theranostics, 2020, 10: 3474-3487. DOI:10.7150/thno.39434 |
| [64] |
Yang H, Tong Z, Sun S, et al. Enhancement of tumour penetration by nanomedicines through strategies based on transport processes and barriers[J]. J Control Release, 2020, 328: 28-44. DOI:10.1016/j.jconrel.2020.08.024 |
| [65] |
Pandit S, Dutta D, Nie S. Active transcytosis and new opportunities for cancer nanomedicine[J]. Nat Mater, 2020, 19: 478-480. DOI:10.1038/s41563-020-0672-1 |
| [66] |
Naumenko VA, Vlasova KY, Garanina AS, et al. Extravasating neutrophils open vascular barrier and improve liposomes delivery to tumors[J]. ACS Nano, 2019, 13: 12599-12612. DOI:10.1021/acsnano.9b03848 |
| [67] |
Wei Z, Zhang X, Yong T, et al. Boosting anti-PD-1 therapy with metformin-loaded macrophage-derived microparticles[J]. Nat Commun, 2021, 12: 440. DOI:10.1038/s41467-020-20723-x |
| [68] |
Schmid D, Park CG, Hartl CA, et al. T cell-targeting nanoparticles focus delivery of immunotherapy to improve antitumor immunity[J]. Nat Commun, 2017, 8: 1747. |
| [69] |
Lee SH, Park OK, Kim J, et al. Deep tumor penetration of drug-loaded nanoparticles by click reaction-assisted immune cell targeting strategy[J]. J Am Chem Soc, 2019, 141: 13829-13840. DOI:10.1021/jacs.9b04621 |
| [70] |
Wang H, Liu Y, He R, et al. Cell membrane biomimetic nanoparticles for inflammation and cancer targeting in drug delivery[J]. Biomater Sci, 2020, 8: 552-568. DOI:10.1039/C9BM01392J |
| [71] |
He X, Cao H, Wang H, et al. Inflammatory monocytes loading protease-sensitive nanoparticles enable lung metastasis targeting and intelligent drug release for anti-metastasis therapy[J]. Nano Lett, 2017, 17: 5546-5554. |
| [72] |
Wang C, Li K, Li T, et al. Monocyte-mediated chemotherapy drug delivery in glioblastoma[J]. Nanomedicine (Lond), 2018, 13: 157-178. DOI:10.2217/nnm-2017-0266 |
| [73] |
Li TF, Li K, Zhang Q, et al. Dendritic cell-mediated delivery of doxorubicin-polyglycerol-nanodiamond composites elicits enhanced anti-cancer immune response in glioblastoma[J]. Biomaterials, 2018, 181: 35-52. |
| [74] |
Li TF, Li K, Wang C, et al. Harnessing the cross-talk between tumor cells and tumor-associated macrophages with a nano-drug for modulation of glioblastoma immune microenvironment[J]. J Control Release, 2017, 268: 128-146. |
| [75] |
De Guillebon E, Dardenne A, Saldmann A, et al. Beyond the concept of cold and hot tumors for the development of novel predictive biomarkers and the rational design of immunotherapy combination[J]. Int J Cancer, 2020, 147: 1509-1518. |
| [76] |
Li M, Li S, Zhou H, et al. Chemotaxis-driven delivery of nano-pathogenoids for complete eradication of tumors post-phototherapy[J]. Nat Commun, 2020, 11: 1126. |
 2022, Vol. 57
2022, Vol. 57


