胶质母细胞瘤(glioblastoma, GBM) 是一种临床常见的原发性神经系统恶性肿瘤, 其发病率约为每年3/10万人[1]。由于GBM侵袭性强, 且好发于大脑的重要功能区, 目前临床上常见的治疗方法为最大限度的手术切除并联合放化疗及电场治疗等方式[2]。但上述治疗方式在过去15~20年中并没有太大改变, 且GBM患者在术后易复发, 总体预后差, 治疗后患者中位生存期仅为15个月左右[3]。加之放化疗不良反应大, 而电场治疗属于前瞻性治疗策略且治疗成本昂贵, 因此GBM的总体治疗效果欠佳。截至目前, GBM的分子靶向治疗也没有表现出很好的效果。而且由于GBM细胞的遗传不稳定性和瘤内异质性, 造成GBM靶向治疗失败率较高[4]。综上, 新的GBM治疗策略亟待开发并应用于临床。
光动力疗法(photodynamic therapy, PDT) 是一种发展前景良好的非手术治疗方式, 具有安全、创伤小、毒性低、适应性好和可重复操作等优点, 先后被欧美和日本等国家用于肿瘤治疗, 目前也在GBM上开展了临床试验[5]。光敏剂(photosensitizer, PS) 是PDT的关键因素之一, 也是目前PDT研究中的重点。PS对肿瘤组织的特异性选择作用决定了PDT在肿瘤组织中的靶向性。在一定程度上, PS通过增强其肿瘤选择性, 使其优先定位于病变组织, 因此对健康组织的损伤非常轻微[6]。同时, 由于PDT能增强宿主对癌症的免疫应答, 其对免疫系统有显著影响[7], 而其诱导的细胞损伤释放出的肿瘤抗原和其他信号分子能激活先天免疫反应, 有助于长期控制肿瘤[8, 9], 从而增强肿瘤治疗效果, 延长肿瘤患者的生存期。鉴于此, 本文就PDT在GBM中的研究进展进行综述, 以期为GBM临床治疗提供新的策略。
1 光动力疗法及其作用机制 1.1 光动力疗法介绍PDT是指PS通过特定波长光源激发后, 在靶细胞中发生一系列光化学效应, 产生活性氧(reactive oxygen species, ROS), 从而破坏靶细胞, 达到治疗效果[10]。截至目前, PDT已在部分癌症中开展相关临床应用, 如乳腺癌[11]、食管癌[12]、胆管癌[13]等。1972年, PDT首次应用于颅内肿瘤模型。Diamond等[14]证实血卟啉(hematoporphyrin, Hp) 在体内和体外对胶质瘤均具有明显抑制效果。1980年, Perria等[15]首次报道PDT用于临床治疗恶性胶质瘤。虽然目前受光源的限制, PDT的临床应用主要集中在体表肿瘤, 但PDT并不依赖于特定的GBM标记或分子特征, 对肿瘤细胞具有广谱杀伤作用, 其对体内肿瘤的敏感性主要取决于不同肿瘤间微环境或肿瘤特性的差异, 如肿瘤组织中的乏氧情况、新生血管不成熟、淋巴引流不畅和酸性pH值等[16]。而且PDT治疗成本相对较少。因此, 相比于常规治疗方式, PDT的广谱型细胞毒性局部靶向治疗GBM可能更具优势。
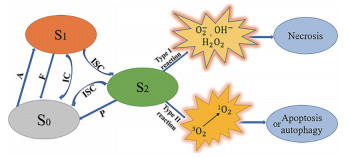
1.2 光动力疗法的作用机制PDT主要包含三要素: PS、光源和氧。PS定位于靶细胞内, 当受到特定波长的光照射时, PS吸收光子后从基态跃迁为单重激发态。但单重激发态的PS寿命很短(纳秒级), 不能与周围的生物分子发生反应。为了返回基态, 受激发的PS以荧光或内部转换(internal conversion, IC) 形式释放热能。或者, 单重态PS发生系间转换(intersystem crossing, ISC), 跃迁成寿命较长的三重态PS (微秒级), 从而具有足够时间与周围的生物分子发生反应, 同时, 三重态PS也可辐射磷光或以ISC方式返回基态。三重态PS与周围生物分子主要发生两种不同类型的光化学反应: Ⅰ型反应是将电子转移到周围的生物分子或其他电子受体, 产生超氧化物阴离子、自由基和过氧化物等, 导致肿瘤细胞坏死(缺氧环境); Ⅱ型反应是将其电子能量转移到分子氧, 产生高反应性的单线态氧(1O2), 导致肿瘤细胞凋亡或自噬(有氧环境)[17, 18]。这两种途径都会导致生物分子的氧化, 最终破坏靶细胞[19] (图 1)。
|
Figure 1 Principle of photodynamic therapy and mechanism of cell death. S0: Ground state; S1: Singlet excited state; S2: Triplet state; A: Photon absorption; F: Fluorescence (emission); IC: Internal conversion; ISC: Intersystem crossing; P: Phosphorescence |
此外, PS在细胞中的定位和剂量也可影响肿瘤细胞的死亡方式。定位于质膜和溶酶体或高剂量的PS可导致细胞坏死, 而定位于线粒体或低剂量的PS可导致细胞凋亡[17]。多数研究认为PS的作用方式主要是通过Ⅱ型反应, 因为单线态氧只存在4 μs, 且迁移距离不超过1 μm, 因此不会对相邻组织细胞造成损伤, 甚至对同一细胞内的细胞器都不会造成太大伤害[20]。
PDT对肿瘤的损伤主要通过以下3种机制: ①导致氧化应激, 引起癌细胞的DNA损伤, 激活细胞死亡信号通路; ②破坏肿瘤组织中的血管, 导致肿瘤细胞缺氧, 通过减少其营养供应而导致细胞的间接性死亡; ③诱导急性的局部和全身炎症反应, 刺激T细胞活化, 产生抗肿瘤免疫反应[21, 22]。PDT的成功与否取决于PS的光物理和光化学性质、PS的吸收程度以及发生PDT时PS的亚细胞定位[23]。而PS、光源和治疗参数的最佳组合是完成有效PDT的关键[24]。
2 光动力疗法用于胶质母细胞瘤治疗的临床研究目前, PDT治疗胶质母细胞瘤还处于临床试验和临床前研究阶段。鉴于光动力疗法的众多优点, PDT有望在GBM的综合治疗中占据优势, 但其自身具有的缺点及在临床应用中遇到的障碍仍有待解决, 国内外众多专家也在就这些问题进行探索。下面就目前PDT在GBM治疗的现有临床研究进行总结。
2.1 光源的选择在光源的波长选择时, 必须考虑组织对光的影响, 大多数组织会散射光, 但色素含量高的区域会吸收光, 光在组织中的穿透深度与光的波长密切相关, 通常在500~800 nm的波长范围内, 光源在各种类型组织中穿透的深度约为1~6 mm, 且该穿透效果随着波长增大而增加[25]。波长越长, 光在组织中的穿透深度越深[26]。可见光的红色区域到吸收光最小的近红外区域(600~1 300 nm) 通常被称为组织的光学窗口[27]。然而, PDT的最佳治疗窗口在600~800 nm之间, 因为较长波长的光(大于800 nm) 单线态氧的产率很低[28]。大部分光会在最初的5 mm内损失大部分能量, 只有少量光的穿透深度达到1 cm。而PDT损伤的有效深度大于光的穿透深度, 可延伸到1 cm甚至更深距离[29]。
用于PDT的光源设备通常有激光器、发光二极管和灯等, 激光可提供较高的功率和波长, 产生非常窄的单色相干光, 广泛应用于表面和组织间的光动力治疗。发光二极管的价格低廉, 操作简单, 光谱较宽, 可产生任意颜色的光, 但也导致PS的吸收效率较低, 在临床上常用于浅表肿瘤的治疗。灯的主要优点为成本低和照明范围广, 但在使用过程中需过滤, 以除去不必要的紫外和红外光, 使波长与PS的激活波长相对应, 常用于皮肤和口腔肿瘤的治疗[27]。此外, 还有研究者将X-射线联合纳米粒作为PDT的光源, 以突破传统PDT对肿瘤深度的限制, 但由于纳米材料的光量子产率较低, 要提高纳米粒的发光强度, 则需提高X-射线的辐照强度, 然而高强度的X-射线会对人体正常组织造成损伤, 因此未来需进一步提高纳米复合材料的光量子产率, 以降低X-射线的辐照强度[30, 31]。
针对GBM的光动力治疗, 已开发出了术中装置[32]。该装置由一个充满液体的充气球囊与一个带有光纤导丝的套管耦合。在荧光引导手术指导下的最大限度切除肿瘤后, 该装置被引导到切除腔内, 往球囊内充液体直到球囊壁达到腔的边界, 然后激光通过光纤传输到球囊壁上。该装置的安全性已在GBM术中光动力治疗(INDYGO) 临床试验分析中进行了初步评估, 认为在术中任何显著的不良反应和毒性均与PDT无关[1]。此外, 对于深部或无法手术的肿瘤, 可将光纤装置插入到肿瘤中以传送光线。但这种方法需仔细规划, 以确保治疗的安全性和疗效[33, 34]。
2.2 氧环境对光动力治疗的影响在进行PDT治疗时, 氧的存在必不可少。大多数PDT以Ⅱ型反应机制为主, 涉及大量氧的消耗, 而肿瘤组织乏氧是公认的特征, 这极大降低了PDT的疗效[35]。为此, 人们对肿瘤乏氧的处理加大研究力度, 进行了很多创新性策略研究, 包括: ①直接或间接方式增加肿瘤内氧含量。直接增加肿瘤组织内氧含量的方式为提高携氧物质的含量, 如血红蛋白的含量; 间接方式为通过产氧物质, 如过氧化氢分解来产生氧气; ②非氧依赖性PDT的研究。由于Ⅰ型反应对氧的依赖低, 即使在低氧的情况下仍表现出较好的效果, 因此开发以Ⅰ型反应为主的PS可减少PDT对氧的依赖; ③节约用氧。氧消耗的去路主要为细胞呼吸, 通过抑制细胞呼吸可减少氧的消耗[18]。已有报道在GBM进行PDT的过程中, 通过增加氧含量来提高疗效, 在术中将氧气的饱和度设置为100%, 以防止细胞缺氧影响PDT的治疗效果[34]。
2.3 在胶质母细胞瘤治疗中光敏剂的选择用于颅内肿瘤的理想PS必须是无毒的, 其最佳激发波长需在600~800 nm之间, 被光源激活后只在聚集区发挥效应, 且对周围组织无不良反应[29]。因此, 许多PS及PS前体包括血卟啉衍生物(hematoporphyrin derivatives, HpD)、卟吩姆钠、替莫泊芬、维替泊芬和5-氨基乙酰丙酸(5-aminolevulinic acid, 5-ALA) 等均可达到上述条件[36]。到目前为止, 各类光敏剂介导的PDT治疗GBM仍处于临床试验阶段。1993年, 第一代光敏剂首次用于临床试验, 包括HpD、卟吩姆钠, 其临床适应证主要为食管癌、宫颈癌、肺癌和浅表性膀胱癌。这类光敏剂较难激发, 在极性溶剂中的溶解度很低, 单线态氧产率也较低, 需延长光刺激才能达到效果[37]。因此, 第二代光敏剂的开发克服了第一代光敏剂的缺陷, 其激发波长通常大于600 nm, 单线态氧的产率更高。研究最多的为替莫泊芬、塔拉泊芬钠(talaporfin sodium, TPS)、5-ALA、硼卟啉(boronated porphyrins, BOPP) 等[29]。
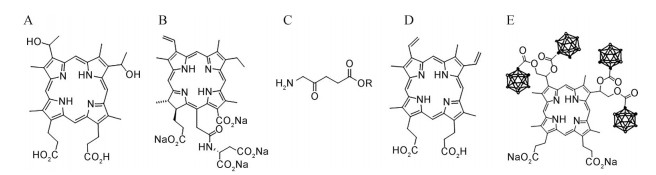
其中, TPS可被664 nm波长的光激活, 具有水溶性, 在体内可被快速清除[38]。替莫泊芬的临床应用效果好, 给药后6周内仍具有光敏性, 被称为临床最强力的PS之一[39]。5-ALA是形成原卟啉IX (protoporphyrin IX, PpIX) 的前体, PpIX是一种内源性的PS。在ALA过量的情况下, 肿瘤细胞产生的PpIX量远高于正常细胞[40]。5-ALA给药后, PpIX在肿瘤中的积聚存在明显的异质性[41], 在胶质母细胞瘤中这种积聚作用更明显[29]。BOPP主要在肿瘤细胞线粒体内发挥作用, 有研究表明, BOPP诱导肿瘤细胞死亡所需光能比HpD少。BOPP结合PDT和硼中子捕获疗法, 有潜力为脑恶性肿瘤提供新的治疗策略[42]。图 2列出了部分光敏剂的化学结构。
|
Figure 2 Chemical structure of photosensitizer. A: Hematoporphyrin (Hp); B: Talaporfin sodium (TPS); C: 5-Aminolevulinic acid (5-ALA); D: Protoporphyrin IX (PpIX); E: Boronated porphyrins (BOPP) |
第二代光敏剂面临的主要问题是缺乏靶向性, 光照后全身性的不良反应大, 因此第三代光敏剂则是在第二代光敏剂的基础上, 通过PS与修饰物(如纳米粒和抗体) 的结合来提高PS对肿瘤的靶向性[43]。纳米技术的出现改善了PS的生物传递、生物利用度、靶向性和功能, 同时减少PS的不良反应[44]。纳米粒具有亲水性, 因此当PS与纳米粒结合时, 纳米粒进入肿瘤细胞之间的微小空间抑制淋巴过滤, 从而增加肿瘤细胞对PS的摄取[45]。此外, 纳米粒着重于仿生技术的开发, 从而逃避免疫系统的监控, 因此不会受到各种免疫成分的影响, 使得PS在肿瘤中传递和摄取更加畅通[46]。由于PDT的最终目标是选择性地杀死肿瘤细胞, 同时对正常组织的损害最小化, 符合这些条件的纳米粒负载传递机制是当前研究的热点。因此, 为提高肿瘤对PS选择性摄取和PS的亚细胞定位, 通过将特异性活性靶向部分(如抗体、多肽或适配体等) 连接到其表面, 可进一步优化纳米粒负载PS的靶向性[47]。
目前, 第三代光敏剂还没有用于GBM的临床试验, 但其临床前实验研究正在开展中。Xu等[48]通过组装亲水的聚乙二醇(PEG)、二氢卟吩E6 (Ce6) 和钆离子(Gd3+) 生成了PEG-Ce6-Gd纳米粒, 应用于小鼠胶质瘤细胞和胶质瘤小鼠模型的PDT研究。Ibarra等[49]将单核细胞作为共轭聚合物纳米粒PS的载体进行GBM的PDT研究。另外, 还有其他纳米粒负载PS也应用于颅内肿瘤PDT[50]。在此基础上, 本文主要总结不同光敏剂治疗GBM的相关临床研究(表 1[15, 34, 42, 51-60])。
| Table 1 Clinical study of different photosensitizers in the treatment of glioblastoma (GBM). N: Newly diagnosed GBM; R: Recurrent GBM; /: Unknown; HpD: Hematoporphyrin derivatives |
Stylli等[51]检测了58例GBM患者肿瘤组织中HpD浓度, 并比较了PDT后患者生存率。术前24 h, 避光静脉注射5 mg·kg-1 (体重) 的HpD, 手术时在安全范围内最大限度切除肿瘤。光照时不断用0.5%脂质填充空腔, 以使光源均匀分布并冷却脑组织。接受治疗的患者中, HpD摄取与生存率之间有很强相关性(危险比= 0.26, P = 0.001), 且HpD的摄取也与年龄相关。进行PDT后, 这些患者的中位总生存期为24个月。另一项类似研究表明, 经HpD介导的PDT治疗的86例GBM患者中, 新诊断GBM的平均中位生存期为14.3个月, 复发患者的中位生存期为14.9个月[52]。
另外, 一项18例GBM患者的临床研究评估了HpD介导的PDT的疗效。术前血管造影后立即颈内动脉注射HpD, 3天后行肿瘤切除, 同时利用光源对瘤腔进行局部PDT。患者于术后3天再次开颅, 重复1次PDT。结果显示, 5例原发性GBM患者最长存活达19个月。此外, 该研究表明, 直接在肿瘤组织中局部注射的HpD的积聚作用明显比静脉注射高[53]。
Muller等[54]对用HpD或卟吩姆钠介导的PDT治疗的GBM患者进行了评价。患者在术前18~24 h内服用光敏剂, 肿瘤最大限度切除后用气囊扩充瘤腔进行PDT。随访发现, 患者的中位生存期为6.3个月。
2.4.2 塔拉泊芬钠TPS介导的PDT也被批准用于GBM的临床试验。Kobayashi等[61]揭示了TPS介导的PDT诱导GBM细胞死亡的详细分子机制。肿瘤组织中的荧光强度和TPS浓度与肿瘤恶性程度分级相关, 被认为有助于高级别胶质瘤的荧光诊断, 同时能提高切除范围的准确性[62]。此外, 有结果表明, 3名GBM患者经TPS介导的PDT治疗后分别存活了13、18、20个月, 且无瘤细胞复发[55]。
Nitta等[63]的Ⅱ期临床研究显示, 进行标准的分次放疗和替莫唑胺治疗的同时接受TPS介导的PDT治疗的患者, 其中位生存期为27.4个月, 而接受标准治疗患者的中位生存期为22.1个月。另一项Ⅱ期临床研究显示, 22例原发性恶性脑实质肿瘤的患者(其中13例为新诊断的GBM患者) 在进行TPS介导的PDT治疗后, 新诊断的GBM患者的生存率均高于其他患者[56]。
一份病例报道显示, 4例新诊断的GBM患者在进行最大限度肿瘤切除术后接受TPS介导的PDT治疗, 中位生存期为31个月, 而6例复发性GBM患者接受相同治疗, 中位生存期只有9个月[57]。Akimoto[20]对22例接受TPS介导的PDT治疗的恶性脑肿瘤患者进行了安全性评价, 结果显示与PDT治疗直接相关的负面效应很少。
2.4.3 5-氨基乙酰丙酸为评估在GBM切除术后的PDT早期介入的可行性, Dupont等[64]设计了一项治疗高级别胶质瘤的模型, 10名GBM患者进行5-ALA为前药的荧光引导切除术和术中PDT治疗。该研究利用荧光区分健康组织和肿瘤组织, 为手术提供支持, 并用磁共振评估切除的质量, 还评估了免疫反应和生物标志物。
在一项27名GBM患者的Ⅲ期临床试验中, 治疗组的13名患者在术前48 h静脉注射2 mg·kg-1卟吩姆钠, 并在前3 h口服20 mg·kg-1混合在无泡沫橙汁中的5-ALA。随后, 在外科显微镜下切除大部分肿瘤, 剩余瘤体在荧光引导切除术(fluorescence guided resection, FGR) 的引导下切除, 直至检测不到荧光。然后, 每隔24 h进行1次卟吩姆钠介导的PDT, 共进行5次。与对照组相比, 治疗组的平均生存期提高(52.8周: 24.2周), 平均肿瘤进展延迟(8.6月: 4.8月)[58]。
另一项30名患者参与的5-ALA使用剂量分析研究中, 选用15名患者口服5 mg·kg-1溶于橙汁的5-ALA作为低剂量组, 高剂量组是低剂量组的4倍。随后, 用带有手持式光纤探针的荧光光谱系统进行荧光定量检测, 来比较每种剂量的荧光信号强度和诊断性能。研究发现, 高剂量组患者肿瘤中的荧光强度是低剂量组的2~3倍, 同时高剂量组患者的皮肤中可检测到PpIX, 低剂量组没有, 而两者的诊断性能没有显著差异[59]。
在另一项初步研究中, 有10例小范围复发的恶性胶质瘤患者接受了间质5-ALA介导的PDT治疗。该项研究利用三维光照模拟, 每个患者立体定向放置6个圆柱形光漫射器, 以实现肿瘤的完全光照。结果显示, 患者的1年生存率为60%, 中位生存期为15个月, 而预期的生存期为6~8个月[34]。
2.4.4 硼卟啉Rosenthal等[65]对BOPP介导的PDT治疗高级别胶质瘤进行了Ⅰ期临床试验和药代动力学研究, 明确了BOPP的药物限制毒性和最大耐受光剂量, 推荐的未来研究剂量为4.0 mg·kg-1, 光照剂量至少为50~100 J·cm-2。同时, 还发现BOPP在体内清除非常缓慢且清除率与给药剂量无关。
之后, 该团队又对BOPP治疗恶性程度高的胶质瘤的安全性进行了评估[60]。该评估包括7例新诊断的GBM患者和9例复发的GBM患者, 以确定最大安全剂量为目标, 逐步改变BOPP和光照剂量。结果显示, 新诊断的GBM患者的中位总生存期为5.0个月, 复发的GBM患者的中位总生存期为11.0个月。
上述临床试验尽管样本量有限、随机对照研究较少, 但这些数据均表明, 与传统治疗手段相比, 患者进行PDT治疗后, 其中位生存期较对照组平均提升了近5个月, 耐药程度降低, 且PDT的不良反应相对较少, 在GBM的治疗中具有较好的生存期和治疗效果。这些结果对未来的PDT临床试验和PDT的肿瘤治疗应用也具有较高的指导作用。
3 总结与展望GBM仍然是目前已知的最致命的癌症之一, 手术切除不彻底、癌细胞浸润导致局部复发等仍是治疗GBM面临的主要问题。多年来, PDT已成为治疗GBM的一种新型的替代疗法。然而, 传统PDT在临床应用上仍面临诸多挑战, 如大多数PS缺乏肿瘤靶向能力、光源对肿瘤组织的光穿透受限、肿瘤微环境中缺氧情况、PS在肿瘤中的积聚受限、T细胞浸润受限等, 临床试验结果显示上述局限性导致其不能成为GBM的主要治疗手段, 在未来较长的一段时间PDT只能用于辅助治疗手术无法切除的GBM。未来GBM的PDT研究有待进一步发展, 这取决于多方面因素: ①新一代具有靶向性PS的开发, 能够准确定位肿瘤细胞, 只在肿瘤区发挥作用; ②改进光源设备, 如能够规划特定照射区域, 以减小对瘤周组织的损伤, 能深入到光源无法穿透的组织; ③克服肿瘤乏氧环境, 进行PDT时提供足够的氧气用于治疗; ④提高PS在肿瘤组织中的蓄积; ⑤将GBM独特的生物学特性同患者的个体差异相结合, 制定个体化的治疗方案; ⑥进行PDT的同时联合其他治疗手段, 以提高疗效。此外, 体内荧光光学技术的发展有可能拓宽PDT的临床应用, 能特异性标记肿瘤区, 使治疗更加精确。因此, 考虑到迄今为止PDT治疗GBM的进展状况和各种障碍, 新的方案和策略以及新型PS的开发和光源设备的改进至关重要。
作者贡献: 赵红诚为本文主要撰写者及图表绘制者; 李青芸、邓昊参与文献的分析与整理; 刘晓雯和谭潇负责文章内容的审核和修改及经费支持; 王栎清负责文章的选题和思路并提出修改意见及经费支持。
利益冲突: 本文作者声明无任何利益冲突。
| [1] |
Vermandel M, Dupont C, Lecomte F, et al. Standardized intraoperative 5-ALA photodynamic therapy for newly diagnosed glioblastoma patients: a preliminary analysis of the INDYGO clinical trial[J]. J Neurooncol, 2021, 152: 501-514. DOI:10.1007/s11060-021-03718-6 |
| [2] |
Pinel S, Thomas N, Boura C, et al. Approaches to physical stimulation of metallic nanoparticles for glioblastoma treatment[J]. Adv Drug Deliv Rev, 2019, 138: 344-357. DOI:10.1016/j.addr.2018.10.013 |
| [3] |
Wei Y, Lu C, Zhou P, et al. EIF4A3-induced circular RNA ASAP1 promotes tumorigenesis and temozolomide resistance of glioblastoma via NRAS/MEK1/ERK1-2 signaling[J]. Neuro Oncol, 2021, 23: 611-624. DOI:10.1093/neuonc/noaa214 |
| [4] |
Mooney J, Bernstock JD, Ilyas A, et al. Current approaches and challenges in the molecular therapeutic targeting of glioblastoma[J]. World Neurosurg, 2019, 129: 90-100. DOI:10.1016/j.wneu.2019.05.205 |
| [5] |
Leroy HA, Guerin L, Lecomte F, et al. Is interstitial photodynamic therapy for brain tumors ready for clinical practice? A systematic review[J]. Photodiagnosis Photodyn Ther, 2021, 36: 102492. DOI:10.1016/j.pdpdt.2021.102492 |
| [6] |
Hodgkinson N, Kruger CA, Abrahamse H. Targeted photodynamic therapy as potential treatment modality for the eradication of colon cancer and colon cancer stem cells[J]. Tumour Biol, 2017, 39: 1393354973. |
| [7] |
Hirschberg H, Berg K, Peng Q. Photodynamic therapy mediated immune therapy of brain tumors[J]. Neuroimmunol Neuroinflamm, 2018, 5: 27. DOI:10.20517/2347-8659.2018.31 |
| [8] |
Castano AP, Mroz P, Hamblin MR. Photodynamic therapy and anti-tumour immunity[J]. Nat Rev Cancer, 2006, 6: 535-545. DOI:10.1038/nrc1894 |
| [9] |
Yi W, Xu HT, Tian DF, et al. Photodynamic therapy mediated by 5-aminolevulinic acid suppresses gliomas growth by decreasing the microvessels[J]. J Huazhong Univ Sci Technolog Med Sci, 2015, 35: 259-264. DOI:10.1007/s11596-015-1421-6 |
| [10] |
Inoue T, Ishihara R. Photodynamic therapy for esophageal cancer[J]. Clin Endosc, 2021, 54: 494-498. DOI:10.5946/ce.2020.073 |
| [11] |
Banerjee SM, El-Sheikh S, Malhotra A, et al. Photodynamic therapy in primary breast cancer[J]. J Clin Med, 2020, 9: 483. DOI:10.3390/jcm9020483 |
| [12] |
Ishida N, Osawa S, Miyazu T, et al. Photodynamic therapy using talaporfin sodium for local failure after chemoradiotherapy or radiotherapy for esophageal cancer: a single center experience[J]. J Clin Med, 2020, 9: 1509. DOI:10.3390/jcm9051509 |
| [13] |
Nanashima A, Hiyoshi M, Imamura N, et al. Two cases of bile duct carcinoma patients who underwent the photodynamic therapy using talaporfin sodium (Laserphyrin®)[J]. Clin J Gastroenterol, 2020, 13: 102-109. DOI:10.1007/s12328-019-01006-5 |
| [14] |
Diamond I, Granelli SG, McDonagh AF, et al. Photodynamic therapy of malignant tumours[J]. Lancet, 1972, 2: 1175-1177. |
| [15] |
Perria C, Capuzzo T, Cavagnaro G, et al. Fast attempts at the photodynamic treatment of human gliomas[J]. J Neurosurg Sci, 1980, 24: 119-129. |
| [16] |
Castano AP, Demidova TN, Hamblin MR. Mechanisms in photodynamic therapy: part three-photosensitizer pharmacokinetics, biodistribution, tumor localization and modes of tumor destruction[J]. Photodiagnosis Photodyn Ther, 2005, 2: 91-106. DOI:10.1016/S1572-1000(05)00060-8 |
| [17] |
Chilakamarthi U, Giribabu L. Photodynamic therapy: past, present and future[J]. Chem Rec, 2017, 17: 775-802. DOI:10.1002/tcr.201600121 |
| [18] |
Hu T, Wang Z, Shen W, et al. Recent advances in innovative strategies for enhanced cancer photodynamic therapy[J]. Theranostics, 2021, 11: 3278-3300. DOI:10.7150/thno.54227 |
| [19] |
Shi X, Zhang CY, Gao J, et al. Recent advances in photodynamic therapy for cancer and infectious diseases[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2019, 11: e1560. |
| [20] |
Akimoto J. Photodynamic therapy for malignant brain tumors[J]. Neurol Med Chir (Tokyo), 2016, 56: 151-157. DOI:10.2176/nmc.ra.2015-0296 |
| [21] |
Ho JH, Kozlovski J. Private parts: emergency medicine in the private sector[J]. Emerg Med Australas, 2021, 33: 142-144. DOI:10.1111/1742-6723.13708 |
| [22] |
Gunaydin G, Gedik ME, Ayan S. Photodynamic therapy-current limitations and novel approaches[J]. Front Chem, 2021, 9: 691697. |
| [23] |
de Almeida R, Fontana LC, Dos SVG, et al. Analysis of the effect of photodynamic therapy with fotoenticine on gliosarcoma cells[J]. Photodiagnosis Photodyn Ther, 2020, 30: 101685. DOI:10.1016/j.pdpdt.2020.101685 |
| [24] |
Wang K, Yu B, Pathak JL. An update in clinical utilization of photodynamic therapy for lung cancer[J]. J Cancer, 2021, 12: 1154-1160. DOI:10.7150/jca.51537 |
| [25] |
Warrier A, Mazumder N, Prabhu S, et al. Photodynamic therapy to control microbial biofilms[J]. Photodiagnosis Photodyn Ther, 2021, 33: 102090. DOI:10.1016/j.pdpdt.2020.102090 |
| [26] |
Ash C, Dubec M, Donne K, et al. Effect of wavelength and beam width on penetration in light-tissue interaction using computational methods[J]. Lasers Med Sci, 2017, 32: 1909-1918. DOI:10.1007/s10103-017-2317-4 |
| [27] |
Kim MM, Darafsheh A. Light sources and dosimetry techniques for photodynamic therapy[J]. Photochem Photobiol, 2020, 96: 280-294. DOI:10.1111/php.13219 |
| [28] |
Zhu TC, Finlay JC. The role of photodynamic therapy (PDT) physics[J]. Med Phys, 2008, 35: 3127-3136. DOI:10.1118/1.2937440 |
| [29] |
Mahmoudi K, Garvey KL, Bouras A, et al. 5-Aminolevulinic acid photodynamic therapy for the treatment of high-grade gliomas[J]. J Neurooncol, 2019, 141: 595-607. DOI:10.1007/s11060-019-03103-4 |
| [30] |
Tang Y, Hu J, Elmenoufy AH, et al. Highly efficient FRET system capable of deep photodynamic therapy established on X-ray excited mesoporous LaF3: Tb scintillating nanoparticles[J]. ACS Appl Mater Interfaces, 2015, 7: 12261-12269. DOI:10.1021/acsami.5b03067 |
| [31] |
Ma L, Zou X, Chen W. A new X-ray activated nanoparticle photosensitizer for cancer treatment[J]. J Biomed Nanotechnol, 2014, 10: 1501-1508. DOI:10.1166/jbn.2014.1954 |
| [32] |
Dupont C, Mordon S, Deleporte P, et al. A novel device for intraoperative photodynamic therapy dedicated to glioblastoma treatment[J]. Future Oncol, 2017, 13: 2441-2454. DOI:10.2217/fon-2017-0261 |
| [33] |
Yassine AA, Kingsford W, Xu Y, et al. Automatic interstitial photodynamic therapy planning via convex optimization[J]. Biomed Opt Express, 2018, 9: 898-920. DOI:10.1364/BOE.9.000898 |
| [34] |
Beck TJ, Kreth FW, Beyer W, et al. Interstitial photodynamic therapy of nonresectable malignant glioma recurrences using 5-aminolevulinic acid induced protoporphyrin IX[J]. Lasers Surg Med, 2007, 39: 386-393. DOI:10.1002/lsm.20507 |
| [35] |
Sahu A, Kwon I, Tae G. Improving cancer therapy through the nanomaterials-assisted alleviation of hypoxia[J]. Biomaterials, 2020, 228: 119578. DOI:10.1016/j.biomaterials.2019.119578 |
| [36] |
Kaneko S, Fujimoto S, Yamaguchi H, et al. Photodynamic therapy of malignant gliomas[J]. Prog Neurol Surg, 2018, 32: 1-13. |
| [37] |
Allison RR, Sibata CH. Oncologic photodynamic therapy photosensitizers: a clinical review[J]. Photodiagnosis Photodyn Ther, 2010, 7: 61-75. DOI:10.1016/j.pdpdt.2010.02.001 |
| [38] |
Yano T, Minamide T, Takashima K, et al. Clinical practice of photodynamic therapy using talaporfin sodium for esophageal cancer[J]. J Clin Med, 2021, 10: 2785. DOI:10.3390/jcm10132785 |
| [39] |
Yakavets I, Millard M, Zorin V, et al. Current state of the nanoscale delivery systems for temoporfin-based photodynamic therapy: advanced delivery strategies[J]. J Control Release, 2019, 304: 268-287. DOI:10.1016/j.jconrel.2019.05.035 |
| [40] |
Casas A. Clinical uses of 5-aminolaevulinic acid in photodynamic treatment and photodetection of cancer: a review[J]. Cancer Lett, 2020, 490: 165-173. DOI:10.1016/j.canlet.2020.06.008 |
| [41] |
Stepp H, Stummer W. 5-ALA in the management of malignant glioma[J]. Lasers Surg Med, 2018, 50: 399-419. DOI:10.1002/lsm.22933 |
| [42] |
Hiramatsu R, Kawabata S, Miyatake S, et al. Application of a novel boronated porphyrin (H2OCP) as a dual sensitizer for both PDT and BNCT[J]. Lasers Surg Med, 2011, 43: 52-58. DOI:10.1002/lsm.21026 |
| [43] |
Josefsen LB, Boyle RW. Photodynamic therapy: novel third-generation photosensitizers one step closer?[J]. Br J Pharmacol, 2008, 154: 1-3. DOI:10.1038/bjp.2008.98 |
| [44] |
Ganau L, Prisco L, Ligarotti G, et al. Understanding the pathological basis of neurological diseases through diagnostic platforms based on innovations in biomedical engineering: new concepts and theranostics perspectives[J]. Medicines (Basel), 2018, 5: 22. |
| [45] |
Naidoo C, Kruger CA, Abrahamse H. Photodynamic therapy for metastatic melanoma treatment: a review[J]. Technol Cancer Res Treat, 2018, 17: 1077059443. |
| [46] |
Debele TA, Peng S, Tsai HC. Drug carrier for photodynamic cancer therapy[J]. Int J Mol Sci, 2015, 16: 22094-22136. DOI:10.3390/ijms160922094 |
| [47] |
Lim CK, Heo J, Shin S, et al. Nanophotosensitizers toward advanced photodynamic therapy of cancer[J]. Cancer Lett, 2013, 334: 176-187. DOI:10.1016/j.canlet.2012.09.012 |
| [48] |
Xu D, Baidya A, Deng K, et al. Multifunctional nanoparticle PEG-Ce6-Gd for MRI-guided photodynamic therapy[J]. Oncol Rep, 2021, 45: 547-556. |
| [49] |
Ibarra LE, Beauge L, Arias-Ramos N, et al. Trojan horse monocyte-mediated delivery of conjugated polymer nanoparticles for improved photodynamic therapy of glioblastoma[J]. Nanomedicine (Lond), 2020, 15: 1687-1707. DOI:10.2217/nnm-2020-0106 |
| [50] |
Wang X, Tian Y, Liao X, et al. Enhancing selective photosensitizer accumulation and oxygen supply for high-efficacy photodynamic therapy toward glioma by 5-aminolevulinic acid loaded nanoplatform[J]. J Colloid Interface Sci, 2020, 565: 483-493. DOI:10.1016/j.jcis.2020.01.020 |
| [51] |
Stylli SS, Howes M, MacGregor L, et al. Photodynamic therapy of brain tumours: evaluation of porphyrin uptake versus clinical outcome[J]. J Clin Neurosci, 2004, 11: 584-596. DOI:10.1016/j.jocn.2004.02.001 |
| [52] |
Stylli SS, Kaye AH, MacGregor L, et al. Photodynamic therapy of high grade glioma-long term survival[J]. J Clin Neurosci, 2005, 12: 389-398. DOI:10.1016/j.jocn.2005.01.006 |
| [53] |
Kostron H, Fritsch E, Grunert V. Photodynamic therapy of malignant brain tumours: a phase I/II trial[J]. Br J Neurosurg, 1988, 2: 241-248. DOI:10.3109/02688698808992675 |
| [54] |
Muller PJ, Wilson BC. Photodynamic therapy of malignant primary brain tumours: clinical effects, post-operative ICP, and light penetration of the brain[J]. Photochem Photobiol, 1987, 46: 929-935. DOI:10.1111/j.1751-1097.1987.tb04871.x |
| [55] |
Akimoto J, Fukami S, Suda T, et al. First autopsy analysis of the efficacy of intra-operative additional photodynamic therapy for patients with glioblastoma[J]. Brain Tumor Pathol, 2019, 36: 144-151. DOI:10.1007/s10014-019-00351-0 |
| [56] |
Muragaki Y, Akimoto J, Maruyama T, et al. Phase II clinical study on intraoperative photodynamic therapy with talaporfin sodium and semiconductor laser in patients with malignant brain tumors[J]. J Neurosurg, 2013, 119: 845-852. DOI:10.3171/2013.7.JNS13415 |
| [57] |
Akimoto J, Haraoka J, Aizawa K. Preliminary clinical report on safety and efficacy of photodynamic therapy using talaporfin sodium for malignant gliomas[J]. Photodiagnosis Photodyn Ther, 2012, 9: 91-99. DOI:10.1016/j.pdpdt.2012.01.001 |
| [58] |
Eljamel MS, Goodman C, Moseley H. ALA and photofrin fluorescence-guided resection and repetitive PDT in glioblastoma multiforme: a single centre phase III randomised controlled trial[J]. Lasers Med Sci, 2008, 23: 361-367. DOI:10.1007/s10103-007-0494-2 |
| [59] |
Haj-Hosseini N, Richter JC, Hallbeck M, et al. Low dose 5-aminolevulinic acid: implications in spectroscopic measurements during brain tumor surgery[J]. Photodiagnosis Photodyn Ther, 2015, 12: 209-214. DOI:10.1016/j.pdpdt.2015.03.004 |
| [60] |
Rosenthal MA, Kavar B, Uren S, et al. Promising survival in patients with high-grade gliomas following therapy with a novel boronated porphyrin[J]. J Clin Neurosci, 2003, 10: 425-427. DOI:10.1016/S0967-5868(03)00062-6 |
| [61] |
Kobayashi T, Miyazaki M, Sasaki N, et al. Enhanced malignant phenotypes of glioblastoma cells surviving NPe6-mediated photodynamic therapy are regulated via ERK1/2 activation[J]. Cancers (Basel), 2020, 12: 3641. DOI:10.3390/cancers12123641 |
| [62] |
Akimoto J, Fukami S, Ichikawa M, et al. Intraoperative photodiagnosis for malignant glioma using photosensitizer talaporfin sodium[J]. Front Surg, 2019, 6: 12. DOI:10.3389/fsurg.2019.00012 |
| [63] |
Nitta M, Muragaki Y, Maruyama T, et al. Role of photodynamic therapy using talaporfin sodium and a semiconductor laser in patients with newly diagnosed glioblastoma[J]. J Neurosurg, 2018, 131: 1361-1368. |
| [64] |
Dupont C, Vermandel M, Leroy HA, et al. INtraoperative photoDYnamic therapy for GliOblastomas (INDYGO): study protocol for a phase I clinical trial[J]. Neurosurgery, 2019, 84: E414-E419. DOI:10.1093/neuros/nyy324 |
| [65] |
Rosenthal MA, Kavar B, Hill JS, et al. Phase I and pharmacokinetic study of photodynamic therapy for high-grade gliomas using a novel boronated porphyrin[J]. J Clin Oncol, 2001, 19: 519-524. DOI:10.1200/JCO.2001.19.2.519 |
 2022, Vol. 57
2022, Vol. 57


