中药西洋参(Panax quinquefolium L.) 始载于《本草纲目拾遗》, 是五加科(Araliaceae) 人参属(Panax L.) 的一种多年生草本植物, 又名花旗参、美国参。西洋参原产于北美洲的原始森林, 主要栽培于加拿大安大略省和美国威斯康辛州[1]。19世纪70年代起, 我国开始引进并栽培西洋参, 目前已形成东北三省、陕西汉中、山东威海和北京怀柔四大主要种植区。据2020版《中华人民共和国药典》记载, 西洋参味甘, 微苦, 性凉, 其药用部位为干燥根, 具有补气养阴、清热生津等功效[2]。
西洋参在我国的使用历史较长。中国为西洋参的生产、消费大国, 深入了解其物质基础、功效作用和质量控制标准将极大保障西洋参产业的科学发展和进步。关于西洋参的研究进展, 虽有个别的综述报道, 但多数都集中在单一类型的化学成分和生物活性, 如皂苷类或多糖类[3-5], 不够全面和深入。西洋参的化学成分类型较为丰富, 除皂苷和多糖类成分外, 还有聚乙炔类、黄酮类、有机酸类等, 这些成分均缺乏系统介绍。另外, 关于西洋参的产品开发现状也缺乏总结。因此, 为了让读者对西洋参已有研究和开发利用有更深入的了解, 本文系统综述了近些年来西洋参在化学成分、生物活性、质量评价和产品开发方面的研究进展, 并将其与人参、三七的异同点进行简要介绍, 旨在为西洋参的进一步研究开发与产业健康发展, 以及临床合理使用提供科学依据。
1 化学成分目前, 关于西洋参的化学成分研究较为丰富。本文系统整理了已报道文献, 将西洋参各类化学成分的研究进展总结如下。
1.1 皂苷类根据苷元的结构, 人参皂苷常分为达玛烷型(dammarane)、齐墩果烷型(oleanane, OA)、奥克梯隆型(ocotillol, OT)、C17-侧链变异型和其他类型。达玛烷型皂苷又分为原人参二醇型(protopanaxadiol, PPD) 和原人参三醇型(protopanaxatriol, PPT)。人参皂苷苷元上常连有1~6个糖基, 连接糖多为阿拉伯糖(arabinose, Ara)、木糖(xylose, Xyl)、鼠李糖(rhamnose, Rha)、葡萄糖(glucose, Glc) 和葡萄糖醛酸(glucuronic acid, GlcA) 等。糖基上又容易附着一些小分子, 如乙酰基(acetyl)、丙二酰基(malonyl)、丁烯酰基(butenoyl)、辛烯酰基(octenoyl) 等。
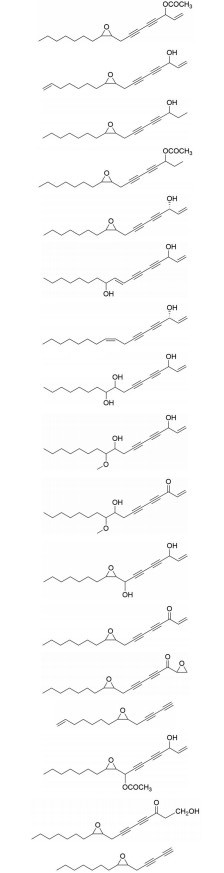
西洋参中的皂苷主要为达玛烷型, 且PPD型皂苷含量较高。4年生以上的西洋参主根中总皂苷含量约为2.60%~5.89%, 其中特征性成分24(R)-pseudo-ginsenoside F11 (P-F11) 约占0.1%左右[6, 7]。西洋参中Rb1、Re、Rg1、Rc、Rd含量占总皂苷含量的70%以上, 且相对含量Rb1 > Re > Rg1 = Rc > Rd[7]。经文献[8-11]调研发现, 截止目前, 从西洋参中分离到的皂苷类化合物约134个, 包括PPD型41个、PPT型18个、OA型6个、OT型15个、C17-侧链变异型48个以及其他类型皂苷6个。西洋参中分离出的皂苷类成分详细信息见图 1。

|
Figure 1 Structures of saponins isolated from P. quinquefolium. Ara: Arabinose; Glc: Glucose; GlcA: Glucuronic acid; OA: Oleanane; OT: Ocotillol; PPD: Protopanaxadiol; PPT: Protopanaxatriol; Rha: Rhamnose; Xyl: Xylose |
西洋参中含有一些具有生物活性的聚乙炔类化合物, 含量约为0.08%[12], 且其在主根中含量较低(0.06%), 在须根中含量较高(0.26%)[13]。Liu[14]从西洋参花蕾中分离出4个聚乙炔类化合物, 分别为ginsenoyne A、ginsenoyne D、人参炔醇(panaxynol) 和人参炔三醇(panaxytriol)。Fujimoto等[15-17]从西洋参中陆续分离出ginsenoyne G、acetylpanaxydol及多个西洋参炔醇(panaquin-quecols), 包括PQ-1~PQ-8。Satoh等[18]从西洋参中分离出人参环氧炔醇(panaxydol)、人参炔二醇(panaxydiol) 等8种聚乙炔类化合物, 其中包括一种新的具有毒性的聚乙炔3-oxo-PQ-1。西洋参中分离出的聚乙炔类化合物具体结构见表 1[14-18]。
| Table 1 Structures of polyacetylenes isolated from Panax quinquefolium. PQ: Panaquin-quecol |
西洋参中还含有少量的黄酮醇及其糖苷类化合物, 其总黄酮含量约为0.17%[19]。Wei等[20]首次从西洋参叶中分离得到了山柰酚(kaempferol) 和人参黄酮苷(panasenoside)。Liu[14]从西洋参花蕾中分离出了4个黄酮醇苷类化合物, 分别为山柰酚、人参黄酮苷、人参黄酮苷Ⅱ (panasenoside Ⅱ) 及三叶豆苷(trifolioside), 具体结构见图 2。
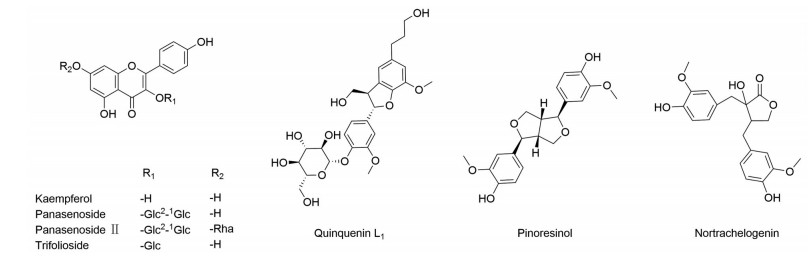
|
Figure 2 Structures of flavonoids and lignans isolated from Panax quinquefolium |
Wang等[21]从西洋参茎叶中分离出1个木脂素类化合物, 命名为西洋参素L1 (quinquenin L1)。Liu[14]从西洋参花蕾中分离出了松脂素(pinoresinol) 和nortrachelogenin。西洋参分离出的木脂素类化合物的具体结构见图 2。
1.5 有机酸类西洋参中含有多种有机酸类化合物, 包括氨基酸、脂肪酸和酚酸等。其中, 含氨基酸16种以上, 总氨基酸含量在7.37%左右, 精氨酸含量占1%以上, 还有一种具有止血活血作用的特殊氨基酸——三七素(dencichine)[22], 结构见图 3。Zheng等[23]从西洋参油脂中鉴定出12个脂肪酸, 包括十五酸、十六酸、十八酸、十八烯酸、十八二烯酸、9, 12, 15-十八三烯酸等。He等[24]从西洋参中分离检测到8个酚酸类化合物, 分别为苯甲酸、对羟基苯甲酸、对香豆酸、香草酸、水杨酸、丁香酸、肉桂酸和阿魏酸。
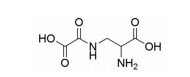
|
Figure 3 Chemical structure of dencichine |
西洋参总糖含量约为52.3%~65.0%。多糖含量在5%~10%之间, 分为中性多糖和酸性多糖, 是西洋参的主要活性成分之一[4]。目前, 从西洋参中分离出的相对均一的多糖约42种(表 2[25-40])。
| Table 2 Polysaccharides isolated from Panax quinquefolium. Ara: Arabinose; Gal: Galactose; GalA: Galaturonic acid; Glc: Glucose; GlcA: Glucuronic acid; Man: Mannose; Rha: Rhamnose; Xyl: Xylose. aNeutral polysaccharide; bAcidic polysaccharide |
中性多糖主要由Glc、Ara、Xyl、Gal和Man组成, 西洋参中主要有葡聚半乳糖和阿拉伯半乳聚糖两种。从西洋参中分离出的葡聚半乳糖包括PPQ[30]、PPQN[37]等, 阿拉伯半乳聚糖包括PPQⅠ[31]和PPQ5-2[33]等。酸性多糖又称果胶, 是一种富含GalA的多糖类化合物, 主要由Ara、Gal、Glc、GlcA和GalA组成。植物中的果胶分为聚半乳糖醛酸(homogalacturonan, HG)、Ⅰ型聚鼠李半乳糖醛酸(type Ⅰ rhamnogalacturonan, RG-Ⅰ)、Ⅱ型聚鼠李半乳糖醛酸(type Ⅱ rhamnogalacturonan, RG-Ⅱ)、木聚半乳糖醛酸(xylogalacturonan, XGA) 和芹糖半乳糖醛酸(apiogalacturonan, AGA)。从西洋参中提取得到的西洋参果胶主要为HG型和AG型两种, 包括PPQⅠ-1~4[31]、PPPQA2、PPPQA4和PPPQA5[35]等。
1.7 甾醇类Matsumoto等[41]从西洋参种子油中检测到15个甾醇类成分。Ding[42]从西洋参种子中检测出豆甾醇和β-谷甾醇。
1.8 挥发油类挥发油是西洋参特殊香气的来源, 含量约占0.04%~0.09%[43]。西洋参中的挥发性成分以倍半萜类为主, 其中β-金合欢烯含量最高, 约占总挥发性成分的29.79%~44.50%[44]。Si等[44]对不同产地、不同年限的西洋参挥发性成分进行测定, 共鉴定了151个化合物, 包括99个烃类、21个酚醇类、15个醛酮类以及16个其他成分。Jiao等[45]对国内外不同年限的西洋参中的挥发性成分进行分析, 共鉴定147个化合物, 包括92个烃类、17个醇类、16个醛酮类, 以及22个其他类化合物。
1.9 其他类西洋参中还含有香草醛[24]、角鲨烯[42]、多种维生素如VA、VB、VB2、VB6等, 多种微量元素如Fe、Al、Mn、Mg、Ca、Cu、Zn等, 以及肽类和蛋白质类化合物。
2 生物活性 2.1 神经保护作用西洋参可调节中枢和外周神经系统功能, 提升记忆力, 改善学习能力, 有潜力用于辅助治疗认知衰退的老年患者。西洋参中起神经保护作用的有效成分主要为人参皂苷Rb1、Rg1、Rg3[46]、Rc[47]、Re[48]、Rh1[49]和Rh2[50]。Yamaguchi等[51]通过径向迷宫实验发现Rg1能改善东莨菪碱所致的大鼠空间学习障碍, 其通过调节中枢胆碱能神经产生中枢刺激作用。Benishin等[52]发现Rb1通过促进中枢胆碱释放, 改善大鼠的被动回避性学习。Mook-Jung等[53]通过小鼠水迷宫实验进一步证实Rg1和Rb1可调节胆碱能神经功能, 增强海马体依赖性学习和记忆, 有认知增强作用, 可用做老年患者和阿尔茨海默病患者的记忆增强剂。Qu等[54]研究发现Rb1具有保护多巴胺能神经元的作用, 能改善空间学习和记忆缺陷, 可用于治疗帕金森病产生的记忆缺失。Tian等[55]证实20(S)-Rg3可减少脂质代谢产生的过氧化物, 清除自由基, 改善能量代谢, 进而为大鼠缺血性损伤提供神经保护。
2.2 心血管保护作用西洋参中的皂苷类成分具有减轻心肌缺血再灌注损伤, 抗心肌缺氧等作用。研究发现人参皂苷单体Rb1、Re[56]、Rg3[57]、Rb2和Rg2[58]均具有明显的心肌缺血再灌注损伤保护作用。Sun等[59]发现西洋参茎叶总皂苷能激活AMPK通路, 抑制Erk1/2和CaMKII/HDAC4通路, 进而改善模拟失重导致的大鼠心肌重塑。此外, Wei等[60]研究发现西洋参叶中的总黄酮可降低家猫和大鼠的血压, 且不降低心肌收缩力, 具有扩张外周血管作用。
2.3 代谢调节作用Yin等[61]研究了西洋参总皂苷对四氧嘧啶性高血糖大鼠的影响, 发现其能明显降低血糖, 并提高血清胰岛素水平。Zhang等[62]构建了脂肪细胞胰岛素抵抗模型研究西洋参茎叶总皂苷对糖脂代谢的影响, 发现其能促进脂肪细胞利用葡萄糖, 抑制TNF-α的促脂解作用, 改善胰岛素抵抗。Cao[63]研究发现Rb1通过调节JNK信号通路, 可改善糖尿病大鼠的肝损伤、糖脂代谢异常, 并降低炎症反应。此外, 有研究证实西洋参中的部分皂苷如Rb2[64]和Re[65]还具有调节脂质代谢作用。
Xie等[66, 67]证明了西洋参果中的多糖成分可降低糖尿病ob/ob鼠的血糖。Chen等[68]通过动物实验发现西洋参多糖肽能降低糖尿病模型小鼠血糖, 调节其脂质代谢, 抗脂质过氧化。
2.4 免疫调节作用西洋参为补气类中药, 可增强机体免疫功能, 提高机体抗病能力。西洋参中的皂苷类及多糖类成分均有明显的免疫增强作用。Liu等[69]构建了抗原诱导的小鼠Th1/Th2免疫失调模型, 给予Rg3后发现其对免疫失衡有调节作用。Lv等[70]通过构建免疫低下斑马鱼模型, 发现西洋参皂苷提取物能增加中性粒细胞、巨噬细胞的数目, 上调炎症因子IFN-γ含量, 起到免疫调节作用。
Liu等[71]研究证实西洋参花中的多糖能增强巨噬细胞的吞噬能力, 释放免疫因子, 增强机体免疫力。Li等[72]研究表明西洋参根粗多糖CPPQ能改善环磷酰胺诱导的小鼠免疫低下, 增强机体免疫, 且作用随剂量增加而增强。Zhu等[73]研究发现西洋参多糖PPQ Ⅰ-1~4能协同刀豆蛋白A刺激小鼠脾淋巴细胞转化, 促进IL-2合成, 进而增强机体免疫。Lemmon等[74]研究证实西洋参中的高分子量多糖可激活MAPK (ERK-1/2)、PI3K、p38和NF-κB通路, 上调促炎细胞因子IFN-γ、IL-23A、IL-6, 并下调TGF-β、IL-13、CD14的表达, 从而起到免疫调节作用。
2.5 抗肿瘤作用经统计, 西洋参皂苷类化合物中具有抗肿瘤作用的人参皂苷有PPD、PPT、人参皂苷F1、F2、Rg2、Rg3、Rg6、Rk1、Rk2、Rk3、Rh1、Rh2、Rh3、Rh4, 还有一些皂苷经肠道菌代谢转化为有活性的皂苷发挥抗肿瘤作用, 如Rg1可代谢转化为Rh1、F1[75]。有研究发现, 人参皂苷Rh2和Rg3对乳腺癌、前列腺癌、肝癌和肠癌均有抑制作用, 且能与抗肿瘤药物如5-氟尿嘧啶、顺铂、环磷酰胺等联合使用增强药效[76-78]。Liu[79]对32种人参皂苷的抗癌作用强弱及其构效关系进行了评价, 发现抗肿瘤作用强弱与皂苷所连糖基数目有关, 糖基越少, 作用越强, 且20(S) 型皂苷活性强于20(R) 型。
西洋参中的多糖也有抗肿瘤活性。Qu等[80]研究表明西洋参根多糖可诱导脾淋巴细胞合成IL-3样活性物质, 进而抑制S180荷瘤鼠肿瘤增长。Zheng[40]研究发现西洋参多糖WQP、WQPN和WQPA在体外研究中对结肠癌细胞HCT-116具有一定的抑制作用, 但对结肠癌细胞HT-29没有抑制作用。Pu等[81]研究证实西洋参多糖I、Ⅱ、Ⅲ能阻断S期肿瘤细胞的DNA合成, 破坏其细胞膜结构, 具有抗肿瘤活性。
此外, 西洋参中的聚乙炔类化合物也具有抗肿瘤活性。Sohn等[82]研究发现人参炔醇和人参环氧炔醇可阻断细胞周期从G1期向S期的转变, 抑制人RCC细胞的增殖。Guo等[83]通过实验发现人参炔三醇可降低p-ERK1/2、p-mTORC1和p65的磷酸化水平, 降低Bcl-2的蛋白表达水平, 抑制肺癌NCI-H1299细胞增殖, 并诱导细胞凋亡。
2.6 抗氧化作用西洋参中的Rg1、Rb1、Re、Rd等成分能抑制自由基介导的脂质过氧化反应, 有较强的抗氧化能力。Wu等[84]发现西洋参皂苷具有较强的体内外抗氧活性, 对环磷酰胺导致的小鼠遗传损伤具有明显保护作用。Mehendale等[85]的研究发现西洋参浆果能清除自由基、抗氧化, 改善顺铂诱发的大鼠异食癖, 可用于减轻顺铂引起的恶心和呕吐。Qi等[86]发现茎叶中提取的12-one-pseudoginsenoside F11能抑制过氧化氢引起的人肺癌A549细胞的氧化应激。Yu等[26]研究证明西洋参中的碱提取多糖AEP和AEP-2具有显著的抗氧活性, 且有浓度依赖性。
2.7 抗疲劳作用Lin等[87]构建了大鼠“气虚”模型, 采用游泳耐疲劳实验, 发现人参和西洋参都有抗疲劳作用。Li等[88]通过小鼠强迫游泳测试和生化分析发现从西洋参中分离出的小分子肽可抑制氧化应激, 改善骨骼肌线粒体功能, 具有抗疲劳作用。Qi等[89]通过小鼠强迫游泳实验和试剂盒检测发现西洋参中的蛋白能显著降低血乳酸、血清尿素氮、丙二醛含量, 增加肝糖原、谷胱甘肽还原酶和超氧化物歧化酶水平, 具有抗疲劳作用。
2.8 其他作用除了上述的活性外, 西洋参还可促进造血功能[90], 具有雌激素样作用[91]、抑菌作用[92]、抗病毒作用[93]和抗辐射作用等。
3 品质评价研究西洋参市场需求逐渐增大, 既是机遇, 亦是挑战。庞大的市场需求使得西洋参产业日益壮大, 同时也带来了一些问题, 如部分商家以次充好, 或用伪品假冒西洋参生产等。原料药的品质将极大决定其制剂及其保健食品的质量, 因此, 建立一套成熟且完备的质量控制标准势在必行。
2020版《中国药典》中西洋参项下规定Rg1、Re、Rb1的总含量不得少于2.0%[2], 但该标准过于宽泛、单一, 仅靠几个皂苷的含量测定, 难以真正控制西洋参的品质。首先, 西洋参中含有大量酸性的皂苷成分, 在受热或受潮情况下, 它们可转化为对应的中性皂苷, 影响含量测定的结果, 如malonyl-ginsenoside Rb1可转化为Rb1[94]。其次, 西洋参中还含有许多具有药理活性的其他皂苷类成分如Rc、Rg3、Rh1等, 以及具有药理活性的其他成分如多糖类、聚乙炔类等, 这些成分也会影响西洋参的质量和药效。同时, 在实际生产过程中, 西洋参的质量还会受药材产地、生长年限、采收期、炮制加工、运输贮存条件、提取纯化过程等多种因素影响[95]。现将相关报道总结如下。
3.1 不同产地西洋参的品质差异传统认为美国和加拿大为西洋参道地产区, 国内为引种栽培区, 不同产地西洋参外观性状有明显差异。我国为西洋参生产、消费大国, 从化学成分种类、含量和中药药效的角度阐述不同产地西洋参品质及西洋参道地性的内涵具有重要意义。
已有研究表明, 不同产地西洋参的皂苷类成分种类相似, 但含量略有差异[96]。Zhang等[97]使用HPLC技术测定了西洋参中8个皂苷成分的含量, 并建立了西洋参药材的指纹图谱。Jia[98]建立了一套基于傅里叶红外光谱法的15个人参皂苷快速分析技术, 用于不同产地西洋参品质评价, 发现加拿大产西洋参Rg1、Re、Rb1及皂苷总含量最高, 美国产西洋参Rc、Rb3、Rg3含量最高, 吉林产西洋参Rb2、Rd含量最高。Zhang等[99]采用HPLC法对加拿大、美国、吉林靖宇、吉林抚顺、北京怀柔和云南丽江6个地区的西洋参中的Rg1、Re和Rb1含量进行测定, 发现云南丽江的西洋参3个单体皂苷总含量最高, 美国产西洋参Rg1含量最高, 加拿大产西洋参Re含量最高, 吉林靖宇产西洋参Rb1含量最高。Ma等[96]采用HPLC法分析了中国山东、吉林、北京及美国产西洋参中Rg1、Re和Rb1含量, 发现皂苷总含量排序为美国 > 吉林 > 山东 > 北京。
西洋参中还含有一些有医疗价值的药用氨基酸, 主要包括必需氨基酸中的蛋氨酸、亮氨酸、异亮氨酸、苯丙氨酸、赖氨酸和精氨酸, 非必需氨基酸中的天门冬氨酸、甘氨酸和谷氨酸[100]。药用氨基酸的含量可用于评价食品和中药材的品质。Zhao等[100]对加拿大多伦多市、陕西留坝县、吉林抚松县、山东文登市的西洋参进行了对比分析, 发现药用氨基酸含量加拿大 > 陕西 > 山东 > 吉林。Wang等[101]研究了不同产地不同年限的西洋参中氨基酸含量的差异, 发现西洋参中氨基酸呈“V”字型增长, 3年生西洋参的氨基酸含量最低, 吉林集安总氨基酸含量最高, 吉林通化含量最低。
从已有研究可看出, 对于不同产地西洋参的品质研究, 选用不同的评价指标和角度, 评价结果差异较大; 即使都选皂苷作为评价指标, 选用不同的皂苷种类和数目, 也会导致评价结果出现较大差异。因此, 亟需构建一个更广泛全面的评价体系, 系统研究不同产地化学成分种类及其含量的差异, 对不同产地西洋参的品质进行更为客观的评价。
3.2 不同部位西洋参的品质差异目前, 市售西洋参的传统用药部位为主根, 药材均去芦头、去参节、去须根后出售, 但有研究发现西洋参某些其他部位皂苷含量甚至高于主根, 比如花蕾、须根等[102]。随着人们保健意识的增强, 西洋参的市场需求也日益增大, 对非传统用药部位的研究和开发, 将避免资源浪费, 对西洋参的合理利用提供科学依据。
西洋参的不同部位的化学成分类型较为相似, 但也有仅存在特定部位的成分, 比如floralquinquenosides A~D仅存在于花蕾中[8]。此外, 西洋参不同部位的化学成分含量存在明显差异。Meng等[103]对不同部位西洋参中Rb1、Rb2、Rb3、Rc、Rd、Re、Rg1及P-F11含量进行对比分析, 发现总皂苷含量花蕾(14.87%) > 花柄 > 果肉 > 根 > 茎叶(5.79%), 根中以Rb1为主, 地上部分则以Rb2、Rb3为主。Liu等[102]对西洋参不同部位的7种皂苷含量进行对比分析后, 发现总皂苷含量: 花蕾 > 须根 > 芦头 > 叶 > 侧根 > 主根 > 茎。Qu[104]对不同部位西洋参中Rg1、Re和Rb1含量进行了测定, 发现总皂苷含量: 叶 > 参须 > 芽孢 > 果实 > 参芯 > 参根 > 参皮 > 芦头 > 花序 > 茎。Xia等[105]采用UPLC-MS对黑龙江产西洋参不同部位的22种皂苷含量进行了定量分析, 发现总皂苷含量: 须根(1.3×105 µg·g-1) > 根茎(7.1×104 µg·g-1) > 主根(6.5×104 µg·g-1) > 叶(4.2×104 µg·g-1) > 茎(2.4×104 µg·g-1)。
3.3 人参、西洋参和三七的成分比较在中药研究中, 鉴别同属中药是一项具有挑战性的工作。人参、西洋参和三七都是常用中药, 其主要活性成分均为三萜皂苷, 但三者具有不同的功效。人参、西洋参均有滋补作用, 但人参性“温”, 西洋参性“凉”, 三七则主要用于祛瘀止血、消肿定痛。这些药理作用上的差异根源于化学成分的差异。因此研究这三种同属中药的化学成分, 尤其是活性成分的差异具有极大的现实意义。目前已有很多研究致力于人参、西洋参和三七的化学成分差异, 挖掘更多的中药质量标志物, 先将其整理总结如下。
人参和西洋参中皂苷类成分以达玛烷型皂苷为主, 同时还有少量齐墩果烷型皂苷; 三七中则只含有达玛烷型人参皂苷, 不含齐墩果烷型[7]。人参、西洋参、三七的特征性成分分别为Rf、P-F11和notoginsenoside R1 (Noto-R1), Noto-R1同时存在于人参中, 但三七不含Ro [106]。Liu等[107]利用UPLC及UPLC-MS对人参、西洋参和三七的质量标志物(Q-marker) 进行研究, 对其特有成分Rf、P-F11和Noto-R1及共有成分Rg1、Re、Rb1的比例特征进行分析, 建立了区分中药材及其中成药的质量控制方法。Huang等[106]用UPLC Orbitrap HRMS对西洋参、人参和三七中的19种人参皂苷进行了对比分析, 发现其含量差异可达50倍, 研究发现三种植物PPD/PPT的比值呈现一定的规律性, 西洋参中PPD/PPT = 3左右, 人参中PPD/PPT在1~3之间, 三七中PPD/PPT则小于1。Wang等[108]研究发现西洋参中Rg1 > > Rf, Rc > Rb2, 而人参Rg1 < Rf, Rc < Rb2。Chan等[109]研究西洋参和人参中Rg1/Re和Rb2/Rc的比值存在一定规律性, 西洋参Rg1/Re < 1, Rb2/Rc ≈ 0.2, 人参Rg1/Re > > 1, Rb2/Rc ≈ 0.8。Yang等[110]采用LC-MS指纹图谱分析了西洋参、人参和三七中的40种主要人参皂苷, 并进行主成分分析和聚类分析, 发现了17种可能的诊断化学标志物, 提出用于区分人参和西洋参的化学标志物除已知的Rf和P-F11外, 还有人参中的潜在的新化学标志物Rs1。此外, 人参中Rg1和Rb1分别占0.27%和0.50%~1.50%, 西洋参中Rg1和Rb1各占0.13%和4.94%, 比例相去甚远, Rg1和Rb1对中枢神经均有兴奋作用, 但Rb1作用较弱, 甚至有一定的中枢抑制作用, 有学者认为西洋参中Rb1的含量较高, 导致其对中枢有一定的镇静作用, 是它性“凉”的原因之一[7]。
多糖类物质在西洋参和人参中也有一定差异。人参中性糖主要以Glc为主, 并含有少量的Rha、Gal、Ara、Man[111], 而西洋参中性糖中Glc和Gal含量均较高; 西洋参酸性糖比人参酸性糖含有更多的GalA和GlcA[5]。Zheng[40]研究并对比了西洋参多糖和人参多糖的结构及抗肿瘤活性的差异: 发现西洋参和人参中水溶性多糖的结构有相似之处, 但单糖的比例有明显区别, 西洋参多糖WQP主要由Glc和GalA组成, 约占43.3%和33.8%, 其中淀粉样葡聚糖: AG: HG = 44:1:13, 而人参多糖WQP中Glc和GalA约占80.0%和7.3%, 且淀粉样葡聚糖: AG: HG = 54:1:5, 可见西洋参中含有更多的酸性多糖, 而人参中主要含淀粉样葡聚糖; 体外抗肿瘤实验证实西洋参多糖对结肠癌细胞HCT-116的抑制作用弱于人参多糖, 且对HT-29没有抑制作用。
4 产品开发西洋参作为一种名贵中药材, 既有滋补作用, 又无人参“燥”性, 是滋补圣品。近年来, 西洋参市场需求逐渐增大, 以西洋参为原料的保健品和药品数量也日益增加。据国家市场监督管理总局的保健食品注册数据, 截至2021年以西洋参为主要原料的保健食品共719个, 包括改善体力疲劳、增强免疫力、辅助降血糖、抗氧化、延缓衰老等17种保健功能。含西洋参保健品的主要功效和批准文号数量信息见表 3。
| Table 3 Health functions and quantity statistics of American ginseng health products (State Administration for Market Regulation) |
2020版中国药典(一部) 中以西洋参为原料的中成药共6种, 包括二十五味定坤丸、心悦胶囊、肾炎康复片、复方皂矾丸、恒制咳喘胶囊和洋参保肺丸[2]。根据国家市场监督管理总局的国产药品注册数据, 截至2021年以西洋参为主要原料的国产药品共91个, 功能主治包括滋阴补肺、止咳平喘、消肿止痛、滋补肝肾等, 或可用于高脂血症、Ⅱ型糖尿病、冠心病、内分泌紊乱、慢性肾炎、再生障碍性贫血、癌症及放疗的辅助治疗。含西洋参的国产药品主要功效和批准文号数量信息见表 4。
| Table 4 Major functions and quantity statistics of Chinese patent medicines containing American ginseng (State Administration for Market Regulation) |
本文对西洋参的化学成分、生物活性, 以及质量控制研究问题进行了论述, 发现以往关于西洋参的研究主要局限于人参皂苷, 但西洋参中还有许多具有生物活性的其他成分。近年来, 越来越多的研究发现多糖类、聚乙炔类、氨基酸类等也有一定的生物活性。这些不同类型活性成分的药理作用有相似之处, 也有不同, 有研究发现多糖和皂苷可能存在协同抗肿瘤作用[112], 但具体机制还需要更深入的研究。简言之, 西洋参中皂苷类化合物的研究已有许多, 但对于其他类型化合物的研究比较少。其一, 西洋参中有较多的活性多糖类化合物, 目前大多数研究仅对多糖类化合物的单糖组成、比例和分子量进行了研究, 许多多糖的糖苷键连接方式、分支度等精细结构都未见报道, 活性和作用机制研究更是有待加强。其二, 西洋参中各类型化合物存在相似的生物活性, 这些成分是否存在协同增效作用?如果存在协同增效, 作用机制是什么?其三, 西洋参、人参和三七具有不同的功效和用途, 导致其药效差异的活性成分除差异的皂苷类还有哪些其他成分类型?诸如此类的问题都需要更多的研究来探索解决。
我国西洋参消费日益增长, 西洋参药材及其制剂的应用逐渐增多, 但目前西洋参产品的质量控制标准过于宽泛。质量标准的不完善导致了市面上的西洋参产品品质参差不齐, 进而影响其合理使用。根据文献调研结果, 目前西洋参品质方面主要面临的问题有两方面。第一, 质量标准不完善导致药材品质良莠不齐, 以次充好的情况时有发生。第二, 西洋参道地性研究不够深入, 不同产地、不同部位的西洋参化学成分、药理活性和药效差异未得到充分研究。仅基于少数皂苷类化合物的研究往往无法全面客观评价其品质, 甚至得到相悖的结果。
因此, 建立一套完善的质量评价体系及质量标准对西洋参的品质评价和合理使用具有重要意义。在西洋参质量评价研究中, 一方面可以采用“一标多测”的方法加入更多的具有药理活性的皂苷[113]; 另一方面也可将其他具有药理活性的成分纳入质量评价指标中, 比如多糖类、聚乙炔类等。此外, 目前西洋参的质量控制方法主要为HPLC法, 近些年来许多新兴方法如UPLC、质谱法、液-质联用技术[114]、定量核磁技术等在化学成分的定性和定量分析方面有显著优势, 也可考虑使用这些方法进行西洋参的质量控制。总之, 未来应当考虑建立一套全面的西洋参药材质量评价体系, 将化学成分的定性、定量与中药多功效、多靶点的特点相结合, 全面系统地控制西洋参的质量; 也可以构建基于特定功效成分的针对性的质量控制方法, 有目的地选择合适的药材。另外, 采用合适的生物活性评价方法与化学分析相结合开展西洋参的质量控制也是未来的一种趋势。
关于西洋参的综合开发利用也是值得注意的内容。现有研究表明, 西洋参的茎叶、花蕾和须根都含有丰富的皂苷类成分, 有的含量甚至高于主根, 因此仿照人参的综合开发利用, 合理开发利用西洋参的其他部位值得深入研究。2019年国家卫健委颁布了《关于对党参、黄芪等9种物质开展药食同源试点工作的通知》, 为西洋参作为食品的研发提供了新的契机, 相信在不远的将来, 关于西洋参的大健康产品开发将更加丰富。
另外, 关于西洋参与人参、三七等药性功效的差异仍有待进一步阐明, 构建成分和功效之间更清晰的网络关系对于临床的合理用药将会有重要的指导作用。关于西洋参的连作障碍也是一个不容忽视的问题, 如何避免产量的降低和品质退化都值得关注。因此, 进一步加强优质品种的选育, 提高种植技术的规范化和标准化, 对于保障和提升西洋参的品质都将起着重要的作用。
作者贡献: 吴首蓉负责调研文献、整理资料、执笔、作图; 姜勇、郭晓宇、屠鹏飞负责指导、修改和审校。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Nadeau I, Olivier A. The biology and forest cultivation of American ginseng (Panax quinquefolius L.) in Canada[J]. Rev Can Phytotech, 2003, 83: 877-891. |
| [2] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. 2020 Ed. Part 1. Beijing: China Medical Science Press, 2020: 136-137.
|
| [3] |
Xu LH, Wang XM, Yu JQ, et al. Advances in chemical constituents and pharmacological effects of stems and leaves of Panax quinquefolium[J]. Food Drug (食品与药品), 2021, 23: 278-284. |
| [4] |
Tang HL, Wang XC, Li J, et al. Research progress on saponins, biological activities of saponins, and quality control of Panax quinquefolium[J]. China J Chin Mater Med (中国中药杂志), 2020, 67: 1-16. |
| [5] |
Li SS, Sun YS. Research achievements on structures and activities of polysaccharides from Panax quinquefolium[J]. Spec Wild Econ Anim Plant Res (特产研究), 2017, 39: 68-71. |
| [6] |
Li W, Gu C, Zhang H, et al. Use of high-performance liquid chromatography-tandem mass spectrometry to distinguish Panax ginseng C. A. Meyer (Asian ginseng) and Panax quinquefolius L. (North American ginseng)[J]. Anal Chem, 2000, 72: 5417-5422. DOI:10.1021/ac000650l |
| [7] |
Chen CF, Chiou WF, Zhang JT. Comparison of the pharmacological effects of Panax ginseng and Panax quinquefolium[J]. Acta Pharmacol Sin, 2008, 29: 1103-1108. DOI:10.1111/j.1745-7254.2008.00868.x |
| [8] |
Nakamura S, Sugimoto S, Matsuda H, et al. Medicinal flowers. XVII. New dammarane-type triterpene glycosides from flower buds of American ginseng, Panax quinquefolium L.[J]. Chem Pharm Bull, 2007, 55: 1342-1348. DOI:10.1248/cpb.55.1342 |
| [9] |
Chen W, Balan P, Popovich DG. Studies in Natural Products Chemistry [M]. Netherlands: Elsevier, 2019: 161-191.
|
| [10] |
Wang LJ, Li PY, Zhao CF, et al. Studies on chemical constituents in the fruits of Panax quinquefolius[J]. Chin Tradit Herb Drugs (中草药), 2000, 31: 723-724. |
| [11] |
Wang JH. Studies on Chemical Constituents and Biological Activities of the Stems and Leaves of Panax quinquefolium (西洋参茎叶化学成分和生物活性的研究) [D]. Shenyang: Shenyang Pharmaceutical University, 1999.
|
| [12] |
Washida D, Kitanaka S. Determination of polyacetylenes and ginsenosides in Panax species using high performance liquid chromatography[J]. Chem Pharm Bull, 2003, 51: 1314-1317. DOI:10.1248/cpb.51.1314 |
| [13] |
Christensen LP, Jensen M, Kidmose U. Simultaneous determination of ginsenosides and polyacetylenes in American ginseng root (Panax quinquefolium L.) by high-performance liquid chromatography[J]. J Agric Food Chem, 2006, 54: 8995-9003. DOI:10.1021/jf062068p |
| [14] |
Liu CD. Research on Chemical Constituents of Flower Buds of Panax quinquefolium (西洋参花蕾化学成分的研究) [D]. Shenyang: Shenyang Pharmaceutical University, 2008.
|
| [15] |
Fujimoto Y, Satoh M, Takeuchi N, et al. Cytotoxic acetylenes from Panax quinquefolium[J]. Chem Pharm Bull, 1991, 39: 521-523. DOI:10.1248/cpb.39.521 |
| [16] |
Fujimoto Y, Wang H, Kirisawa M, et al. Acetylenes from Panax quinquefolium[J]. Phytochemistry, 1992, 31: 3499-3501. DOI:10.1016/0031-9422(92)83715-B |
| [17] |
Fujimoto Y, Wang H, Satoh M, et al. Polyacetylenes from Panax quinquefolium[J]. Phytochemistry, 1994, 35: 1255-1257. DOI:10.1016/S0031-9422(00)94831-3 |
| [18] |
Satoh Y, Satoh M, Isobe K, et al. Studies on Panax acetylenes: absolute structure of a new Panax acetylene, and inhibitory effects of related acetylenes on the growth of L-1210 cells[J]. Chem Pharm Bull, 2007, 55: 561-564. DOI:10.1248/cpb.55.561 |
| [19] |
Zheng ZH, Chen JQ. Study on extraction of total flavonoids from Panax quinquefolium and its antioxidation effects[J]. J Anhui Agric Sci (安徽农业科学), 2012, 40: 15903-15904. |
| [20] |
Wei CY, Xu CF, Luo WY, et al. Study on flavone in the leaves of Panax quinquefolium cultured in China[J]. J Jilin Agric Univ (吉林农业大学学报), 1999, 21: 7-11. |
| [21] |
Wang JH, Hou BL, Li X, et al. A lignan found in the stems and leaves of Panax quinquefolius[J]. Chin Tradit Herb Drugs (中草药), 2001, 32: 17-19. |
| [22] |
Zheng YN, Li XG, Shi F, et al. Comparative analysis of hemostatic components of plants of genus Panax[J]. J Jilin Agric Univ (吉林农业大学学报, 1989, 11: 24-27. |
| [23] |
Zheng YL, Zhang CX, Li XG, et al. Studies on chemical constituents of Panax quinquefolium - isolation and identification of fatty acids in oil[J]. Chin Tradit Pat Med (中成药), 1988, 11: 32-33. |
| [24] |
He CN, Gao WW, Yang JX, et al. Identification of autotoxic compounds from fibrous roots of Panax quinquefolium L.[J]. Plant Soil, 2009, 318: 63-72. DOI:10.1007/s11104-008-9817-8 |
| [25] |
Lui EMK, Azike CG, Guerrero-Analco JA, et al. The Complex World of Polysaccharides: Chapter 19[M]. London: IntechOpen, 2012: 513-534.
|
| [26] |
Yu XN, Yang XS, Cui B, et al. Antioxidant and immunoregulatory activity of alkali-extractable polysaccharides from North American ginseng[J]. Int J Biol Macromol, 2014, 65: 357-361. DOI:10.1016/j.ijbiomac.2014.01.046 |
| [27] |
Yang XS, Zhou XR, Wang LJ, et al. Ultrafiltration separation and immune enhancing activity of American ginseng polysaccharide[J]. Sci Technol Food Ind (食品工业科技), 2014, 35: 49-52. |
| [28] |
Guo QB, Cui SW, Kang J, et al. Non-starch polysaccharides from American ginseng: physicochemical investigation and structural characterization[J]. Food Hydrocolloids, 2015, 44: 320-327. DOI:10.1016/j.foodhyd.2014.09.031 |
| [29] |
Wang MQ, Ghuibert LJ, Ling L, et al. Immunomodulating activity of CVT-E002, a proprietary extract from North American ginseng (Panax quinquefolium)[J]. J Pharm Pharmacol, 2001, 53: 1515-1523. |
| [30] |
Zhu WJ, Han B, Sun Y, et al. Immunoregulatory effects of a glucogalactan from the root of Panax quinquefolium L.[J]. Carbohydr Polym, 2012, 87: 2725-2729. DOI:10.1016/j.carbpol.2011.11.066 |
| [31] |
Ma XL, Zhao DC, Sun YX, et al. Isolation and characterization of four polysaccharides from American ginseng[J]. Chin Tradit Herb Drugs (中草药), 2000, 31: 165-167. |
| [32] |
Wang LJ. Bioactivities of Ginsenosides and Polysaccharides from American ginseng (西洋参皂苷和多糖的活性研究) [D]. Beijing: Chinese Academy of Agricultural Sciences, 2013.
|
| [33] |
Ma XL, Hao CY, Zhu W, et al. Isolation, properties and bioactivities of polysaccharide 5-2 from Panax quinquefolium[J]. Chin Pharm J (中国药学杂志), 1998, 33: 48-50. |
| [34] |
Chen MQ, Xu RM. Isolation and purification of polysaccharides from transgenic crown gall cultures of Panax quinquefolium[J]. Chin Tradit Herb Drugs (中草药), 2007, 38: 1606-1610. |
| [35] |
Wang LJ, Yao Y, Sang W, et al. Structural features and immunostimulating effects of three acidic polysaccharides isolated from Panax quinquefolius[J]. Int J Biol Macromol, 2015, 80: 77-86. DOI:10.1016/j.ijbiomac.2015.06.007 |
| [36] |
Ma XL, Bai YB, Sun YX, et al. Observation of polysaccharide from Panax quinquefolium L. PPQ-d by atomic force microscopy[J]. J Jilin Univ (吉林大学自然科学学报), 2000, 46: 105-106. |
| [37] |
Wang LJ, Yu XN, Yang XS, et al. Structural and anti-inflammatory characterization of a novel neutral polysaccharide from North American ginseng (Panax quinquefolius)[J]. Int J Biol Macromol, 2015, 74: 12-17. DOI:10.1016/j.ijbiomac.2014.10.062 |
| [38] |
Oshima Y, Sato K, Hikino H. Isolation and hypoglycemic activity of quinquefolans A, B, and C, glycans of Panax quinquefolium roots[J]. J Nat Prod, 1987, 50: 188-190. DOI:10.1021/np50050a010 |
| [39] |
Liang ZY, Miao CY, Chen LY, et al. Isolation and analysis of water-soluble polysaccharides from stems and leaves of Panax quinquefolium cultivated in China[J]. Spec Wild Econ Anim Plant Res (特产研究), 1993, 32: 44-45. |
| [40] |
Zheng Y. Purification and Structure Analysis of the Polysaccharides from Panax quinquefolium (西洋参多糖的分离纯化及结构研究) [D]. Changchun: Northeast Normal University, 2015.
|
| [41] |
Matsumoto T, Akigisa T, Soma SI, et al. Composition of unsaponifiable lipid from seed oils of Panax ginseng and P. quiquefolium[J]. J Am Oil Chem Soc, 1986, 63: 544-546. DOI:10.1007/BF02645749 |
| [42] |
Ding J. Study on the Microdetermination Method of American Ginseng Saponin and Composition of Seed Oil (西洋参人参皂苷微量检测方法及种子油脂构成研究) [D]. Hanzhong: Shaanxi University of Technology, 2014.
|
| [43] |
Zheng YL, Zhang CX, Li XG, et al. A comparison between Chinese Panax quinquefolium and imported Panax quinquefolium-analysis of composition of essential oil in Panax quinquefolium[J]. Acta Pharm Sin (药学学报), 1989, 69: 118-121. |
| [44] |
Si Y, Liu YH, Wang ZY, et al. Comparison of volatile oil of domestic and foreign Panacix Quinquefolii Radix by HS-SPME/GC-MS[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2019, 25: 130-138. |
| [45] |
Jiao YF, Li PY, Liu YH, et al. Comparison of volatile components of Panax quinquefolium at home and abroad by HS-SPME/GC-MS[J]. J Chin Med Mater (中药材), 2019, 42: 2574-2581. |
| [46] |
Han YJ, Wang T, Li CY, et al. Ginsenoside Rg3 exerts a neuroprotective effect in rotenone-induced Parkinson's disease mice via its anti-oxidative properties[J]. Eur J Pharmacol, 2021, 909: 174413. DOI:10.1016/j.ejphar.2021.174413 |
| [47] |
Huang MM, Chen SR, Zheng KN, et al. Integrated LC-MS/MS method and network pharmacology for exploring the mechanism of neuroprotective effect of ginsenoside Rc in oxygen-glucose deprivation/reperfusion injury[J]. Rev Bras Farmacogn, 2021, 31: 207-216. DOI:10.1007/s43450-021-00145-6 |
| [48] |
Iskander M, JiHee K, Eun SJ, et al. Ginsenoside Re exhibits neuroprotective effects by inhibiting neuroinflammation via CAMK/MAPK/NF-κB signaling in microglia[J]. Mol Med Rep, 2021, 24: 698. DOI:10.3892/mmr.2021.12337 |
| [49] |
Park M, Kim SH, Lee HJ. Ginsenoside Rh1 exerts neuroprotective effects by activating the PI3K/Akt pathway in amyloid-β induced SH-SY5Y cells[J]. Appl Sci, 2021, 11: 5654. DOI:10.3390/app11125654 |
| [50] |
Lv JW, Lu C, Jiang N, et al. Protective effect of ginsenoside Rh2 on scopolamine-induced memory deficits through regulation of cholinergic transmission, oxidative stress and the ERK-CREB-BDNF signaling pathway[J]. Phytother Res, 2020, 35: 337-345. |
| [51] |
Yamaguchi Y, Haruta K, Kobayashi H. Effects of ginsenosides on impaired performance induced in the rat by scopolamine in a radial-arm maze[J]. Psychoneuroendocrinology, 1995, 20: 645-653. DOI:10.1016/0306-4530(95)00008-C |
| [52] |
Benishin CG, Lee R, Wang LC, et al. Effects of ginsenoside Rb1 on central cholinergic metabolism[J]. Pharmacology, 1991, 42: 223-229. DOI:10.1159/000138801 |
| [53] |
Mook-Jung I, Hong HS, Boo JH, et al. Ginsenoside Rb1 and Rg1 improve spatial learning and increase hippocampal synaptophysin level in mice[J]. J Neurosci Res, 2001, 63: 509-515. DOI:10.1002/jnr.1045 |
| [54] |
Qu SG, Meng XJ, Liu Y, et al. Ginsenoside Rb1 prevents MPTP-induced changes in hippocampal memory via regulation of the α-synuclein/PSD-95 pathway[J]. Aging, 2019, 11: 1934-1964. DOI:10.18632/aging.101884 |
| [55] |
Tian JW, Fu FH, Geng MY, et al. Neuroprotective effect of 20(S)-ginsenoside Rg3 on cerebral ischemia in rats[J]. Neurosci Lett, 2005, 374: 92-97. DOI:10.1016/j.neulet.2004.10.030 |
| [56] |
Liu ZX, Liu XC. Effects of ginsenoside Rb1 and Re on cardiomyocyte apoptosis after ischemia and reperfusion in rats[J]. Chin J Histochem Cytochem (中国组织化学与细胞化学杂志), 2002, 11: 374-377. |
| [57] |
Zhang LP. Effects and Mechanism of Alprostadil and Ginsenoside Rg3 on Myocardial Ischemia/reperfusion Injury in Rats (注射用前列地尔及人参皂苷Rg3对大鼠心肌缺血/再灌注损伤的影响及机制研究) [D]. Changchun: Jinlin University, 2017.
|
| [58] |
Xu Y, Chen XH, Ma HW. Effect of ginsenoside Rg2 on SOD and MDA of myocardial ischemia reperfusion in rats[J]. Jilin Med J (吉林医学), 2016, 37: 1575-1576. |
| [59] |
Sun HY, Shi DZ. Effects of total saponins from stems and leaves of Panax quinquefolium on myocardial remodeling induced by simulated weightlessness in rats[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2019, 33: 655. |
| [60] |
Wei CY, Li XG, Du XR, et al. Pharmacological effects of the total flavone of leave of Panax quinquefolium (cultured in China)[J]. Chin Pharmacol Bull (中国药理学通报), 2000, 16: 229-230. |
| [61] |
Yin HJ, Zhang Y, Jiang YR, et al. Effects of total saponins in leaf of Panacis Quinquefolii on blood sugar and serum in rats with alloxan induced hyperglycemia[J]. Tianjin J Tradit Chin Med (天津中医药), 2004, 21: 365-367. |
| [62] |
Zhang Y, Chen KY, Yang LH, et al. Effects of Panax quinquefolius saponins of stem and leaf on glucose-lipid metabolism and insulin signal transduction in insulin resistant model adipocytes[J]. Chin J Integr Tradit West Med (中国中西医结合杂志), 2010, 30: 748-751. |
| [63] |
Cao M. Ginsenoside Rb1 ameliorates abnormal glucolipid metabolism of liver through inhibition of JNK signal pathway in diabetic rats[J]. Chin J Immunol (中国免疫学杂志), 2018, 34: 531-536. |
| [64] |
Sun GZ, Wang JY, Liu Z, et al. General view of pharmacological research of ginsenoside Rb2[J]. J Jilin Agric Univ (吉林农业大学学报), 2005, 27: 299-305. |
| [65] |
Yao PP. Study on the Mechanism of Ginsenoside Re Improving Lipid Metabolism (人参皂苷Re改善脂代谢的作用机制研究) [D]. Qingdao: Qingdao University, 2014.
|
| [66] |
Xie JT, Aung HH, Wu JA, et al. Effects of American ginseng berry extract on blood glucose levels in ob/ob mice[J]. Am J Chin Med, 2002, 30: 187-194. DOI:10.1142/S0192415X02000442 |
| [67] |
Xie JT, Wu JA, Mehendale S, et al. Anti-hyperglycemic effect of the polysaccharides fraction from American ginseng berry extract in ob/ob mice[J]. Phytomedicine, 2004, 11: 182-187. DOI:10.1078/0944-7113-00325 |
| [68] |
Chen R, Chen DJ, Zhang JX. Lowering blood glucose, blood lipids and antioxidant effects of Panax quinquefolius polysaccharide peptide on diabetic mice[J]. Acta Agric Boreali-Occident Sin (西北农业学报), 2013, 22: 195-201. |
| [69] |
Liu Y, Chen YX, Wu Q, et al. Preparation of 20(S/R)-ginsenoside Rg3 and their effects on regulation Th1/Th2 imbalance[J]. Chem J Chin Univ (高等学校化学学报), 2018, 39: 2419-2424. |
| [70] |
Lv J, Gao Y, Li C, et al. Effect of American ginseng saponins on enhancing immunity based on zebrafish model organisms[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 3728-3733. |
| [71] |
Liu XY, Zhao Y, Liu L, et al. The extraction of polysaccharides from American ginseng flowers and immunomodulation activities in vitro[J]. Food Ind (食品工业), 2018, 39: 23-25. |
| [72] |
Li Y, Ma XL, Qu SC, et al. Effects of CPPQ on immunologic function of immunosuppressive mice induced with cyclophosphamide[J]. J Jilin Univ (白求恩医科大学学报), 1996, 22: 137-139. |
| [73] |
Zhu W, Du BR, Zhu X, et al. Stimulating effect of PPQ on spleen lymphocyte of mice[J]. J Jilin Univ (白求恩医科大学学报), 1997, 23: 19-21. |
| [74] |
Lemmon HR, Sham J, Chau LA, et al. High molecular weight polysaccharides are key immunomodulators in North American ginseng extracts: Characterization of the ginseng genetic signature in primary human immune cells[J]. J Ethnopharmacol, 2012, 142: 1-13. DOI:10.1016/j.jep.2012.04.004 |
| [75] |
Luo LM, Shi YN, Jiang YN, et al. Advance in components with antitumor effect of Panax ginseng and their mechanisms[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 582-596. |
| [76] |
Xu HL, Miao H, Li J, et al. Reversal of 5-fluorouracil resistance in HepG2 cells by ginsenoside Rh2[J]. Drug Eval Res (药物评价研究), 2021, 44: 1876-1881. |
| [77] |
Fan JK, Wang JY, Qing C. Antitumor effect of ginsenoside Rh2 combining with DDP on S180 bearing in mice[J]. China Pharm (中国药师), 2010, 13: 15-17. |
| [78] |
Wang JY, Qing C. Antitumor effect of ginsenoside Rh2 combining with cyclophosphamide on sarcoma S180 bearing in mice[J]. China Pharm (中国药师), 2008, 11: 897-899. |
| [79] |
Liu JM. Structure-activity Relationship of 32 Ginsenosides Inhibiting the Proliferation of Hepatoma Cells HepG2 and SMMC7721 (32种人参皂苷抑制肝癌细胞HepG2和SMMC7721增殖作用的构效关系) [D]. Nanchang: Nanchang University, 2021.
|
| [80] |
Qu SC, Xu CY, Li Y, et al. Inhibitory effect of polysaccharides from Panax quinquefolium roots on S180 tumor bearing mice[J]. J Changchun Univ Chin Med (长春中医学院学报), 1998, 14: 54. |
| [81] |
Pu YF, Ming Y, Li JT. Study on the inhibitory effects of polysaccharide Ⅰ, Ⅱ and Ⅲ on DNA synthesis of hepatic carcinoma cell[J]. J Clin Hepatol (临床肝胆病杂志), 1999, 15: 213-214. |
| [82] |
Sohn J, Lee CH, Chung DJ, et al. Effect of petroleum ether extract of Panax ginseng roots on proliferation and cell cycle progression of human renal cell carcinoma cells[J]. Exp Mol Med, 1998, 30: 47-51. DOI:10.1038/emm.1998.7 |
| [83] |
Guo WQ, Ju X, Xu B, et al. Effects of panaxytriol on proliferation and apoptosis through down-regulating ERK1/2 and mTORC1 pathways in lung cancer cells line NCI-H1299[J]. Anti-Tumor Pharm (肿瘤药学), 2020, 10: 536-539. |
| [84] |
Wu HZ, Zhao YL, Fei HJ, et al. Protective effect on genetic damage of mice and antioxidation of Panax ginsenoside[J]. Chin J Biol (中国生物制品学杂志, 2012, 25: 61-64. |
| [85] |
Mehendale SR, Aung HH, Yin JJ, et al. Effects of antioxidant herbs on chemotherapy-induced nausea and vomiting in a rat-pica model[J]. Am J Chin Med, 2004, 32: 897-905. DOI:10.1142/S0192415X04002508 |
| [86] |
Qi Z, Wang ZZ, Zhou BS, et al. A new ocotillol-type ginsenoside from stems and leaves of Panax quinquefolium L. and its anti-oxidative effect on hydrogen peroxide exposed A549 cells[J]. Nat Prod Res, 2020, 34: 2474-2481. DOI:10.1080/14786419.2018.1543677 |
| [87] |
Lin HQ, Song QL, Zhao ML, et al. Experimental study on "Qixu" model of rats by Panax ginseng and Panax quinquefolium[J]. Chin Arch Tradit Chin Med (中医药学刊), 2006, 24: 2111-2112. |
| [88] |
Li D, Ren JW, Zhang T, et al. Anti-fatigue effects of small-molecule oligopeptides isolated from Panax quinquefolium L. in mice[J]. Food Funct, 2018, 9: 4266-4273. DOI:10.1039/C7FO01658A |
| [89] |
Qi B, Liu L, Zhang H, et al. Anti-fatigue effects of proteins isolated from Panax quinquefolium L.[J]. J Ethnopharmacol, 2014, 153: 430-434. DOI:10.1016/j.jep.2014.02.045 |
| [90] |
Zhang DJ, Wang SH, Chang YP, et al. Effects of Panax quinquefolia on haematopoietic growth factor in cyclophosphamide depressed mice[J]. J Jilin Univ (白求恩医科大学学报), 1992, 18: 412-414. |
| [91] |
Chan RYK, Chen WF, Dong A, et al. Estrogen-like activity of ginsenoside Rg1 derived from Panax notoginseng[J]. J Clin Endocrinol Metab, 2002, 87: 3691-3695. DOI:10.1210/jcem.87.8.8717 |
| [92] |
Trammell RA, Cox L, Pikora J, et al. Evaluation of an extract of North American ginseng (Panax quinquefolius L.) in Candida albicans-infected complement-deficient mice[J]. J Ethnopharmacol, 2012, 139: 414-421. DOI:10.1016/j.jep.2011.11.026 |
| [93] |
Ilarraza R, Wu YQ, Davoine F, et al. Human dendritic cells promote an antiviral immune response when stimulated by CVT-E002[J]. J Pharm Pharmacol, 2011, 63: 670-678. DOI:10.1111/j.2042-7158.2011.01257.x |
| [94] |
Zhou J. Systematic Studies on Quality Standard and Processing Method of American ginseng (西洋参质量标准的系统研究及加工方法考察) [D]. Harbin: Heilongjiang University of Chinese Medicine, 2005.
|
| [95] |
Liu CX, Chen SL, Xiao XH, et al. A new concept on quality marker of Chinese materia medica: quality control for Chinese medicinal products[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1443-1457. |
| [96] |
Ma J, Rui HB. The main chemical component analysis of 4 different Panax quinquefolium L.[J]. Northwest Pharm J (西北药学杂志), 2019, 34: 601-604. |
| [97] |
Zhang D, Wu LF, Wang Q, et al. Determination and fingerprinting of 8 ginsenosides in Panax quinquefolium L. from different areas[J]. J Chin Med Mater (中药材), 2016, 39: 2276-2280. |
| [98] |
Jia C. Quality Evaluation of Panax quinquefolius L. from Different Regions (不同产地西洋参的品质评价) [D]. Beijing: Peking Union Medical College, 2017.
|
| [99] |
Zhang J, Chen R, He PF, et al. Determination of ginsenoside Rb1, Re and Rg1 in Panax quinquefolium L. from different areas by HPLC[J]. Yunnan J Tradit Chin Med Mater Med (云南中医中药杂志), 2018, 39: 73-74. |
| [100] |
Zhao FJ, Lian XH, Hu XP, et al. Analysis of amino acid type and quantity of American ginseng in different planting areas[J]. Acta Agric Boreali-Occident Sin (西北农业学报), 2020, 29: 1051-1058. |
| [101] |
Wang Q, Xu JM, Wang S, et al. Comparative study on contents of amino acids in Panax quinquefolium L. in different growing years[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2016, 27: 3007-3010. |
| [102] |
Liu JW, Xu ML, Xu B, et al. Study on saponin components in different parts of Panax quinquefolium L.[J]. Tianjin J Tradit Chin Med (天津中医药), 2019, 36: 715-718. |
| [103] |
Meng XY, Li XG, Zhang H, et al. Analysis of the volatile oil in the flowerbuds of Panax quinquefolius L.[J]. Chin J Anal Chem (分析化学), 2001, 29: 542-545. |
| [104] |
Qu XY. Study on the Quality Evaluation of American ginseng from Liuba, Shaanxi Province (陕西留坝西洋参药材质量评价研究) [D]. Xi'an: Shaanxi Normal University, 2006.
|
| [105] |
Xia YG, Song Y, Liang J, et al. Quality analysis of American ginseng cultivated in Heilongjiang using UPLC-ESI-MRM-MS with chemometric methods[J]. Molecules, 2018, 23: 2396. DOI:10.3390/molecules23092396 |
| [106] |
Huang X, Liu Y, Zhang N, et al. UPLC orbitrap HRMS analysis of Panax quinquefolium L. for authentication of Panax genus with chemometric methods[J]. J Chromatogr Sci, 2018, 56: 25-35. DOI:10.1093/chromsci/bmx077 |
| [107] |
Liu YL, Lei R, Wang XL, et al. Research on quality control methods of Panax ginseng, Panax quinquefolius, Panax notoginseng and related proprietary Chinese medicines based on Q-markers[J]. Chin Pharm J (中国药学杂志), 2019, 54: 1402-1410. |
| [108] |
Wang X, Sakuma T, Asafu-Adjaye E, et al. Determination of ginsenosides in plant extracts from Panax ginseng and Panax quinquefolius L. by LC/MS/MS[J]. Anal Chem, 1999, 71: 1579-1584. DOI:10.1021/ac980890p |
| [109] |
Chan TW, But PP, Cheng SW, et al. Differentiation and authentication of Panax ginseng, Panax quinquefolius, and ginseng products by using HPLC/MS[J]. Anal Chem, 2000, 72: 1281-1287. DOI:10.1021/ac990819z |
| [110] |
Yang WZ, Qiao X, Li K, et al. Identification and differentiation of Panax ginseng, Panax quinquefolium, and Panax notoginseng by monitoring multiple diagnostic chemical markers[J]. Acta Pharm Sin B, 2016, 6: 568-575. DOI:10.1016/j.apsb.2016.05.005 |
| [111] |
Liu HB. Fractionation and Structural Analysis of the Neutral Polysaccharides from Panax ginseng C. A. Meyer (中性人参多糖的系统分级及结构分析) [D]. Changchun: Northeast Normal University, 2011.
|
| [112] |
Zhou RR, He D, Xie J, et al. The synergistic effects of polysaccharides and ginsenosides from American ginseng (Panax quinquefolius L.) ameliorating cyclophosphamide-induced intestinal immune disorders and gut barrier dysfunctions based on microbiome-metabolomics analysis[J]. Front Immunol, 2021, 12: 66591. |
| [113] |
Yao J, Sun XG, Dong R, et al. Simultaneous quantitative analyses of six components in Astragalus membranaceus based on HPLC-CAD and quantitative analysis of multi-components with a single-marker[J]. Acta Pharm Sin (药学学报), 2021, 56: 557-564. |
| [114] |
Fan SS, Ren HB, Yang MT, et al. Simultaneous determination of seven components in Citri Exocarpium Rubrum by UPLC-MS/MS[J]. Acta Pharm Sin (药学学报), 2021, 56: 2835-2840. |
 2022, Vol. 57
2022, Vol. 57