痛风是一种由单钠尿酸盐(monosodium urate, MSU) 沉积所致的关节病, 与嘌呤代谢紊乱及(或) 尿酸排泄减少所致的高尿酸血症直接相关, 属代谢性风湿病范畴[1]。近年来, 我国高尿酸血症及痛风发病率呈明显上升和年轻化趋势, 大大加重了患者和社会的负担。目前临床上的抗痛风药物主要以小分子合成药物为主, 如抑制尿酸生成的别嘌呤醇、非布司他, 促进尿酸排泄的苯溴马隆、雷西纳德, 以及针对痛风急性发作期的非甾体抗炎药等。虽然这些药物在降低血清尿酸水平方面有明显的治疗效果, 但存在严重的过敏反应和肝肾损害等不良反应。天然产物来源广泛、毒副作用较低, 是药物发现的重要源泉, 越来越多的天然产物被发现具有广泛的降尿酸或抗痛风活性, 且安全性高, 已成为抗痛风新药发现的重要方向。本文综述了具有降尿酸或抗痛风药理作用的天然产物及其机制研究, 为药物研发提供参考。
1 痛风治疗方法及作用机制 1.1 降低血尿酸水平尿酸(uric acid, UA) 是嘌呤代谢的最终氧化产物, 在生理pH条件下, 主要以尿酸盐离子形式存在。人体尿酸产生过多或排出异常减少是导致高尿酸血症的主要原因, 其中尿酸排泄过少所致高尿酸血症的发病人数约占90%。
黄嘌呤氧化酶(xanthine oxidase, XO) 主要存在于人体的肝脏和小肠中, 连续氧化次黄嘌呤和黄嘌呤产生尿酸, 直接调控尿酸的生成[2] (图 1)。在XO催化嘌呤代谢过程中, 还会生成超氧阴离子自由基(O2-·) 和过氧化氢(H2O2) 等活性氧分子(reactive oxygen species, ROS), 而这些ROS又可参与机体的氧化应激, 调节炎症反应[3]。因此, 抑制XO的活性不仅能减少尿酸的生成, 降低血尿酸水平, 而且能够减少炎症的发生。腺嘌呤核苷脱氨酶(adenosine deaminase, ADA) 属于巯基酶, 也是嘌呤代谢中的重要酶, 催化腺苷和2′-脱氧腺苷分别脱氨为肌苷(又称为次黄嘌呤核苷)、2′-脱氧肌苷和氨, 间接调控尿酸的生成[3] (图 1)。因此, ADA也是发现降尿酸药物的重要靶点。

|
Figure 1 Schematic diagram of uric acid production pathway |
肾脏和小肠是尿酸排泄的主要器官, 分别承担70%和30%的排泄量[4]。由于尿酸在生理pH下主要以尿酸盐离子形式存在, 不能自由通过细胞磷脂双分子层, 所以在肾小管中尿酸需依赖转运蛋白实现重吸收和分泌[5]。如图 2所示, 尿酸转运蛋白主要分布在肾近端小管细胞的基底外侧膜和顶端膜, 按其功能可分为排泄转运蛋白和重吸收转运蛋白两类。其中SLC22A12基因编码的电中性尿酸阴离子转运蛋白1 (urate anion transporter 1, SLC22A12/URAT1)、SLC22A家族的有机阴离子转运体OATs (organic anion transporters, SLC22A6/OAT1、SLC22A8/OAT3、SLC22A11/OAT4、SLC22A13/OAT10)、SLC2A9基因编码的葡萄糖转运蛋白9 (glucose transporter 9, SLC2A9/GLUT9) 以及ATP结合盒转运蛋白超家族的三磷酸腺苷结合盒转运体G2 (adenosine triphosphate binding box transporter G2, ABCG2) 在肾脏中对尿酸的重吸收和分泌起重要作用[6]。因此, 以尿酸转运蛋白为靶点, 通过上调排泄转运蛋白和(或) 下调重吸收转运蛋白的表达, 可以减少尿酸重吸收而增加肾脏的排泄, 从而降低血尿酸水平, 控制高尿酸血症的发展。
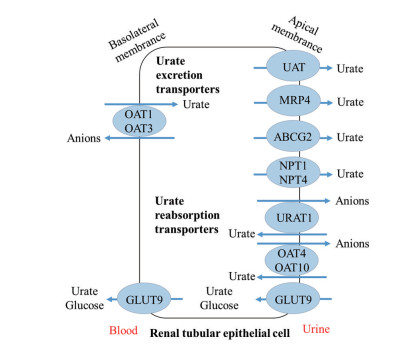
|
Figure 2 Schematic diagram of uric acid transports in kidney epithelial cells |
尿酸酶是生物体内嘌呤代谢途径中的一种氧化酶, 可以催化尿酸氧化为更容易被肾脏排泄的水溶性小分子尿囊素, 进而排出体外。自然界中大多数生物体内均存在这种酶, 而鸟类、爬行类及部分灵长类(人类和大型猿类) 在进化过程中尿酸酶基因发生了突变, 导致该基因无法表达, 其体内尿酸无法继续分解而在体内积累[7]。不能合成尿酸酶是人类易患高尿酸血症的重要原因, 因此通过服用或注射能够降解尿酸的生物活性物质, 分解血液中的尿酸, 有效降低血清中尿酸含量, 也成为治疗痛风及高尿酸血症的重要手段之一。
1.2 抑制炎症因子当血清尿酸水平超过其物理溶解度(约7 mg·dL-1) 时便以MSU晶体的形式析出, 而尿酸盐晶体可通过多条信号通路活化固有免疫细胞, 诱发炎性反应。其中Toll样受体(Toll-like receptors, TLR)、核苷酸寡聚化结构域样受体蛋白3 (NOD-like receptor protein, NLRP3) 炎性小体及白细胞介素类(interleukin, IL) 细胞因子与MSU晶体介导的痛风炎症关系密切[8]。通过抑制炎性小体活化的多个节点, 干涉炎症发展途径, 对于痛风急性发作可以起到较好的治疗作用(图 3)[9, 10]。
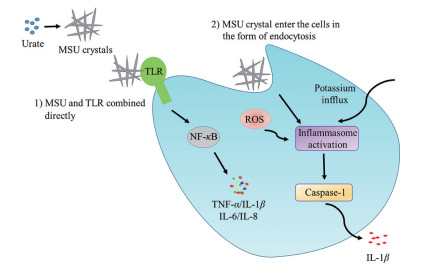
|
Figure 3 The cell signal pathways of monosodium urate (MSU) crystal activating innate immune cells[9, 10] |
天然产物源经过初步提取(水或有机溶剂) 得到的粗提物往往就能表现抑制XO、调节尿酸转运蛋白、抑制氧化应激和减轻炎症等生物活性[11]。但天然产物化学成分非常复杂, 具体药效物质有待进一步研究[12]。
2.1 抑制尿酸生成和促进尿酸排泄的天然产物提取物山茶叶提取物中含有高浓度的维生素E、芦丁等与降尿酸相关的活性物质, Yoon等[13]对比了10 mg·kg-1别嘌呤醇、100 mg·kg-1和300 mg·kg-1的山茶叶提取物对氧嗪酸钾诱导的高尿酸血症小鼠肝脏和血清XO活性的影响(结果显示肝脏XO活性分别降低66.1%、55.2%和64.7%, 血清XO活性分别降低65%、45.2%和59.3%), 证实了山茶叶乙醇提取物对XO有明显抑制作用, 同时还具有抗氧化和降尿酸的效果(300 mg·kg-1的山茶叶提取物与10 mg·kg-1的别嘌呤醇对尿酸的抑制率相似, 分别为49.1%和53%)。
Kim等[14]发现丹参提取物可抑制XO活性, 通过液质联用鉴定出的泽兰黄酮、野黄芩素和木犀草素显示出最高的抑制效力, IC50分别为2.35、1.74、1.90 µmol·L-1。野菊花和肉桂提取物是治疗高尿酸血症和痛风方剂中的常用成分, Lee等[15]从两者混合物中提取的DKB114在体内通过抑制XO活性(200 mg·kg-1 DKB114对XO活性抑制率为66.7%), 下调URAT1、GLUT9的蛋白质表达(200 mg·kg-1 DKB114对氧嗪酸钾诱导的高尿酸血症小鼠的肾脏URAT1和GLUT9的下调率分别为50%和30%), 发挥促进尿酸排泄和抑制尿酸生成的双重作用。富含黄酮和绿原酸的甜叶菊残渣提取物[16]对XO有较强的抑制作用(IC50: 8.78 ± 0.89 µg·mL-1), 但活性低于别嘌呤醇(IC50: 3.23 ± 0.23 µg·mL-1), Mehmood等[17]在随后的体内实验中发现该提取物不仅能抑制XO活性, 而且能与尿酸转运体相互作用(下调URAT1和GLUT9 mRNA和蛋白质的表达, 上调ABCG2 mRNA和蛋白质的表达), 降低高尿酸血症模型小鼠的血尿酸水平。
木瓜具有治疗高尿酸血症和痛风的作用, Zhang等[18]分离了木瓜的乙酸乙酯提取物发现其能显著抑制高尿酸血症小鼠血清和肝脏XO活性(口服120 mg·kg-1木瓜提取物时血清XO活性最低, 相比于高尿酸血症模型组抑制率为21%; 口服180 mg·kg-1木瓜提取物时对肝脏XO活性最低, 相比于高尿酸血症模型组抑制率为61%), 降低血清尿酸、肌酐和尿素氮水平, 并通过下调肾脏mURAT1 (120 mg·kg-1木瓜提取物下调率为38%, 10 mg·kg-1别嘌呤醇下调率为54%) 和上调mOAT1 (120 mg·kg-1木瓜提取物上调率为113%) 的蛋白表达增加尿酸排泄水平。
Peng等[19]对菊花提取物的XO抑制活性进行了比较评价, 结果表明白菊提取物S8具有最高的XOI值(45.68 μmol·g-1提取物), 并结合生化特征和UPLC-ESI-QTOF/MS代谢组学结果阐明白菊改善高尿酸血症的机制可能为抑制血清XO活性, 调节肾脏ABCG2、URAT1和GLUT9的蛋白表达, 减轻高尿酸血症相关疾病。
辣木叶中化学成分丰富, 含有具有较好XO抑制活性的黄酮、黄酮醇类物质, Tian等[20]研究发现, 富含酚类和肽类的辣木叶水解物(200 mg·kg-1和500 mg·kg-1) 可通过调节黄嘌呤氧化酶活性(酚类组分XOI值为16.55 ± 0.78 μmol·g-1提取物, 肽类组分XOI值为1.10 ± 0.18 μmol·g-1提取物; 酚类组分和肽类组分对XOI活性的贡献率分别为25.87%和58.85%) 和尿酸转运体的蛋白表达(200 mg·kg-1提取物对高尿酸血症小鼠的肾脏URAT1的下调率为20%, 对ABCG2的上调率为25%; 500 mg·kg-1提取物对URAT1的下调率为30%, 而对ABCG2的影响不明显), 有效降低高尿酸血症大鼠血清尿酸水平, 同时该水解物还可通过对肝脏丙二醛、血清肌酐和血清甘油三酯的多方面作用, 改善高尿酸血症所致的代谢紊乱。
Han等[21]探究了高原荨麻提取物的降尿酸水平, 结果表明各提取物均能降低尿酸水平, 调节URAT1的表达, 并推测乙醇提取物的主要作用机制为调节XO (25 μg·mL-1的乙醇提取物相比于模型组抑制率为52%, 与别嘌呤醇44%相当) 和ADA (50 μg·mL-1的乙醇提取物相比于模型组抑制率为66.7%, 明显高于别嘌呤醇16.7%), 以及尿酸转运蛋白(50 μg·mL-1的乙醇提取物相比于模型组URAT1下调率为80%, 但仍低于别嘌呤醇88%; OAT1上调率为400%, 但仍低于别嘌呤醇500%) 的表达。
Zhou等[22]比较了3个产地(陕西、河南和河北) 的秦皮对高尿酸血症的治疗作用, 发现200 mg·kg-1的陕西秦皮提取物能显著降低高尿酸血症大鼠的血尿酸水平(模型组SUA为254.14 ± 13.15 μmol·L-1, 200 mg·kg-1陕西秦皮提取物SUA为153.77 ± 17.30 μmol·L-1), 升高尿酸水平(模型组UUA为617.69 ± 14.55 μmol·L-1, 200 mg·kg-1陕西秦皮提取物UUA为1 433.42 ± 96.78 μmol·L-1), 并推测其机制可能与调节靶蛋白GLUT9 (抑制率为60%) 和URAT1 (抑制率为50%) 有关。
杜仲几乎无毒, 并可能通过显著增加OAT1和OAT3的mRNA表达(320 mg·kg-1的杜仲提取物相比于模型组的上调率分别为540%和60%, 高于10 mg·kg-1的别嘌呤醇400%和0%) 促进尿酸排泄以及降低URAT1 (320 mg·kg-1的杜仲提取物的下调率为90%, 与10 mg·kg-1的别嘌呤醇95%相当) 和GLUT9的mRNA表达(320 mg·kg-1的杜仲提取物相比于模型组的下调率为84%, 高于10 mg·kg-1的别嘌呤醇6%), 抑制尿酸的重吸收而发挥抗高尿酸血症的作用[23]。
二丁颗粒是由紫花地丁、蒲公英、半边莲和板蓝根组成的一种中药, 近期发现具有抗高尿酸血症的作用。Zhang等[24]通过蛋白印迹分析发现, 二丁颗粒50%乙醇提取物可以下调URAT1和GLUT9的表达(2.9 g·kg-1的50%乙醇提取物相比于模型组下调率分别为33%和75%), 并上调OAT1的表达(2.9 g·kg-1的50%乙醇提取物相比于模型组上调率为11%), 由此推断二丁颗粒可能是通过调节肾脏转运体降低血清尿酸浓度。
软骨素是一种新型中药, 由黄芪、金银花叶、当归、威灵仙、黄柏按一定比例组成后的水提物组成。Oh等[25]评估了软骨素对高尿酸血症模型小鼠的影响, 推测软骨素可能通过抑制XO的活性(软骨素IC50为414.09 μg·mL-1, 别嘌呤醇IC50为0.21 μg·mL-1) 和下调URAT1蛋白的表达(150 mg·kg-1的软骨素相比于模型组下调率为93%, 高于5 mg·kg-1的别嘌呤醇83%) 来降低血尿酸水平。
2.2 抑制氧化应激或减轻炎症反应的天然产物提取物葵花盘乙醇提取物在MSU晶体诱导的急性痛风大鼠模型中能促进IL-10和单核细胞趋化因子1α的表达(1 g·kg-1的葵花盘乙醇提取物相比于模型组的促进率分别为59.2%和35.7%), 减少了炎症细胞, 增加了踝关节间隙, 显著缓解痛风大鼠的足踝肿胀; 在高尿酸血症小鼠模型中降低了肝组织中谷胱甘肽过氧化物酶、超氧化物歧化酶、丙二醛和一氧化氮的水平(1 g·kg-1的葵花盘乙醇提取物相比于模型组的抑制率分别为65.2%、59.2%、66.4%和59%), 充分发挥抗炎和抑制氧化应激的作用[26]。
冬凌草甲素是中药冬凌草的主要活性成分, He等[27]研究表明冬凌草甲素是NLRP3炎症体的特异性共价抑制剂, 其通过抑制NLRP3的激活对痛风性关节炎小鼠模型具有预防或治疗作用。
鼠曲草提取物具有显著的抗高尿酸血症活性, 该提取物不仅能通过影响肾脏mURAT1和mGLUT9促进尿酸排泄(200 mg·kg-1和400 mg·kg-1的鼠曲草提取物相比于模型组对mURAT1的下调率分别为34.2%和53.9%, 100 mg·kg-1的鼠曲草提取物对mGLUT9的下调率为15%), 而且可以下调细胞因子IL-1β和TNF-α的产生(400 mg·kg-1的鼠曲草提取物相比于模型组对IL-1β和TNF-α的下调率为76.7%和52.6%), 减轻MSU晶体诱导的急性痛风性关节炎小鼠的爪肿胀[28]。
土茯苓根茎水提物中富含黄酮类化合物, 该成分不仅能抑制XO活性以减少尿酸生成, 促进尿酸转运蛋白(ABCG2、OAT1、OCT2、OCTN2) 的表达以增强尿酸排泄, 还能显著提高抗氧化酶活性, 抑制IL-1β、IL-6、TNF-α和COX-2的表达(500 mg·kg-1的提取物对IL-1β、IL-6、TNF-α和COX-2表达的抑制率分别为50%、30%、30%和51.6%), 抑制肾脏炎症反应[29]。
芹菜籽提取物可以降低高尿酸血症模型小鼠血清中的活性氧水平(75 mg·kg-1的芹菜籽水提物可使ROS水平降低13.6%), 提高血清超氧化物歧化酶和谷胱甘肽过氧化物酶水平(75 mg·kg-1的芹菜籽水提物相比于模型组可使SOD和GSH-Px水平提高22.6%和14.2%), 具有抗氧化作用; 在急性痛风性关节炎大鼠中, 芹菜籽提取物也能减低IL-1β和TNF-α水平(200 mg·kg-1的芹菜籽水提物相比于模型组可使IL-1β和TNF-α水平降低22.4%和17.2%), 升高IL-10水平(200 mg·kg-1的芹菜籽水提物相比于模型组可使IL-10水平升高8.8%), 减轻踝关节肿胀, 具有抗炎作用[30]。
石斛种类繁多, Lou等[31]研究发现, 铁皮石斛叶的大孔树脂提取物通过抑制XOD·ADA系统和TLR4·NF-κB炎症信号通路, 可降低血清尿酸水平, 对高尿酸血症有较好的治疗作用, 且对肝、肾、肠组织具有一定保护作用, 但其活性成分还需进一步研究。
Zhang等[32]发现美花石斛提取物通过调节包括GLUT9、URAT1和OAT1在内的尿酸转运蛋白的转录水平(3.0 g·kg-1的美花石斛提取物相比于模型组对mGLUT9、mURAT1转录水平的下调率分别为42.1%和37.5%, 对mOAT1转录水平的上调率为60%), 可增强尿酸排泄并保护肾脏; 同时, 该提取物还可以通过下调TLRs/MyD88/NF-κB及其下游炎症因子IL-1β、IL-6和TNF-α的蛋白表达(2.0 g·kg-1的美花石斛提取物相比于模型组对IL-1β、IL-6和TNF-α蛋白表达的下调率分别为54%、22.2%和45.4%) 达到抗炎作用, 减轻单钠尿酸盐结晶诱导的大鼠急性痛风性关节炎的踝关节肿胀。
3 具有降尿酸作用的天然产物化学单体 3.1 黄酮类降尿酸分子黄酮类化合物(flavonoids) 由两个具有酚羟基的苯环(A和B环) 通过中央三碳原子相互连接而成(图 4), 具有突出的生物活性, 在防治痛风或高尿酸血症方面获得广泛关注, 是目前抗高尿酸血症研究最多的天然产物。
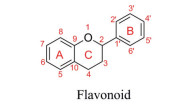
|
Figure 4 Core structure of flavonoids |
研究[33]表明, 黄酮类化合物普遍对XO活性有抑制作用, 且不同类型黄酮类化合物对XO活性的抑制能力不同, 黄酮类最强, 其次为黄酮醇类。数据分析表明[34], 疏水力是黄酮类化合物与XO结合的主要作用力, 保持黄酮类化合物平面结构的C-2和C-3之间的双键是抑制XO活性的关键, 而B环和C-3位上的羟基取代则不利于XO的抑制, 这可能与极性羟基伸展到活性中心的疏水区不稳定, 导致亲和力降低有关。另外, 由于XO含有一个钼蝶呤活性中心, 所以黄酮类化合物C-5和C-7上的羟基部分与XO的活性位点之间容易形成氢键, 对XO活性的抑制能力也较强[35]。此外, 一些黄酮类化合物还可作用于尿酸转运体促进尿酸排泄, 作用于COX-2、5-LOX (脂氧合酶) 减少炎症因子产生, 调节诱导型NO合成酶(iNOS) 的基因表达减轻NO毒性作用等, 用于防治高尿酸血症和痛风[35]。
槲皮素(1, 图 5) 为黄酮醇类化合物, 可以混合型方式(竞争性抑制和非竞争性抑制) 可逆地抑制XO (IC50为2.74 ± 0.04 µmol·L-1) 催化的尿酸和超氧自由基生成[36], 并可通过上调肾脏、肠道中的尿酸转运体ABCG2 (400 mg·kg-1的槲皮素相比于模型组在肾脏和肠道中的上调率分别为100%和40%) 和下调GLUT9 (400 mg·kg-1的槲皮素相比于模型组在肾脏和肠道中的下调率分别为28.6%和50%) 的蛋白表达来降低尿酸[37]。
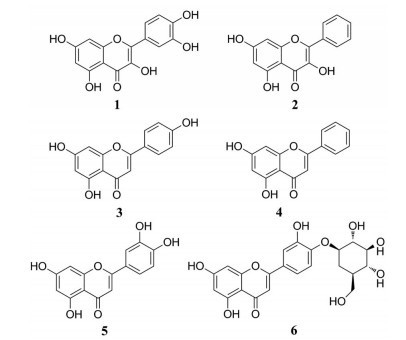
|
Figure 5 Structures of flavonoids for the treatment of hyperuricemia and gout |
高良姜素(2) 为3, 5, 7-三羟基黄酮, 可以进入XO的酶催化中心, 对XO活性有抑制作用(IC50为48.25 μmol·L-1) 而减少尿酸的生成, 并与山柰素具有协同作用, 且摩尔比为4∶1时对XO的抑制作用较强(当XOI率小于90%时, 0.1 < CI < 0.8)[38]。
芹菜素(3) 与其他黄酮类物质(槲皮素、山柰酚等) 相比具有低毒、无诱变性等特点, 能显著改善高尿酸血症肾病, 减轻肾脏纤维化[39], 其作用机制可能与下调高尿酸血症小鼠肾脏mURAT1水平的表达(80 mg·kg-1的芹菜素相比于模型组下调率为28.6%, 高于5 mg·kg-1的别嘌呤醇14.3%) 降低肾脏尿酸盐重吸收能力, 以及上调肾脏mOCTN1、mOCTN2、mOCT1及mOCT2表达水平(80 mg·kg-1的芹菜素相比于模型组上调率分别为94.4%、87.5%、40%和38.9%) 增加肾脏尿酸排泄能力有关[40]。
白杨素(4) 与芹菜素具有相似的结构, Chang等[41]研究表明白杨素不仅能通过抑制XO活性而减少尿酸生成, 而且能显著下调URAT1和GLUT9 (100 mg·kg-1的白杨素相比于模型组下调率分别为28%和20%, 150 mg·kg-1的白杨素下调率分别为36%和16%, 10 mg·kg-1的别嘌呤醇下调率分别为52%和32%), 上调OAT1和ABCG2 (50 mg·kg-1的白杨素相比于模型组上调率分别为66.7%和78.6%, 10 mg·kg-1的别嘌呤醇上调率分别为150%和42.9%) 的蛋白表达增加尿酸排泄; 此外, 白杨素还具有显著的抗氧化和炎症作用(100 mg·kg-1的白杨素相比于模型组对NLRP3的抑制率为38.5%), 能有效降低大鼠肾脏和血清中IL-1β的浓度, 可用于辅助治疗痛风性关节炎。
木犀草素(5) 多以糖苷的形式存在于多种植物中, Lin等[42]评估了木犀草素和木犀草素-4′-O-葡萄糖苷(6) 在高尿酸血症和急性痛风性关节炎治疗中的作用, 结果发现两者均能抑制XO (100 mg·kg-1的木犀草素和糖苷的抑制率分别为47%和48%, 但均低于40 mg·kg-1的别嘌呤醇56.8%) 减少尿酸生成, 下调肾脏mURAT1 (100 mg·kg-1的木犀草素和糖苷相比于模型组的下调率分别为56.4%和66%) 增加尿酸排泄, 改善高尿酸血症小鼠肾功能。另外, 此两种化合物还具有降低炎症细胞因子水平的作用(40 mg·kg-1的木犀草素相比于模型组对IL-1β和TNF-α的抑制率分别为26.7%和46.7%, 100 mg·kg-1的糖苷对IL-1β和TNF-α的抑制率分别为60%和46.7%), MSU晶体所致的足肿胀和炎症反应有明显的改善作用。
3.2 具有降尿酸作用的其他类天然产物除黄酮类化合物外, 植物中富含的皂苷类、香豆素类等化合物也具有抑制尿酸生成和(或) 促进尿酸排泄的作用, 可以作为新型降尿酸药物的先导化合物。
薯蓣皂苷(7, 图 6) 是一种螺甾烷苷, Zhang等[43]发现薯蓣皂苷能显著降低高尿酸血症模型小鼠的血尿酸和肌酐水平(100 mg·kg-1的薯蓣皂苷给药2周后相比于模型组降低率分别为70%和58.3%), 增加尿酸和肌酐的清除率(100 mg·kg-1的薯蓣皂苷相比于模型组增加率分别为700%和660%), 增加尿酸的排泄分数(100 mg·kg-1的薯蓣皂苷相比于模型组增加率为75%), 减少高尿酸血症引起的肾脏病理损害。此外, 薯蓣皂苷元的代谢产物剑麻皂素(8) 能通过抑制URAT1显著减少尿酸在10~100 μmol·L-1范围内的再吸收(当薯蓣皂苷浓度为100 μmol·L-1时, 尿酸吸收率降低至60%), 通过促进ABCG2增加尿酸分泌, 具有体内抗高尿酸血症活性。Wu等[44]从绞股蓝中分离得到的绞股蓝皂苷Ⅶ (9)、绞股蓝皂苷Ⅷ (10)、人参皂苷Rb1 (11) 和人身皂苷Rb3 (12) 具有一定的降尿酸、尿素氮和肌酐作用, 可作为肾脏保护药物进行开发。
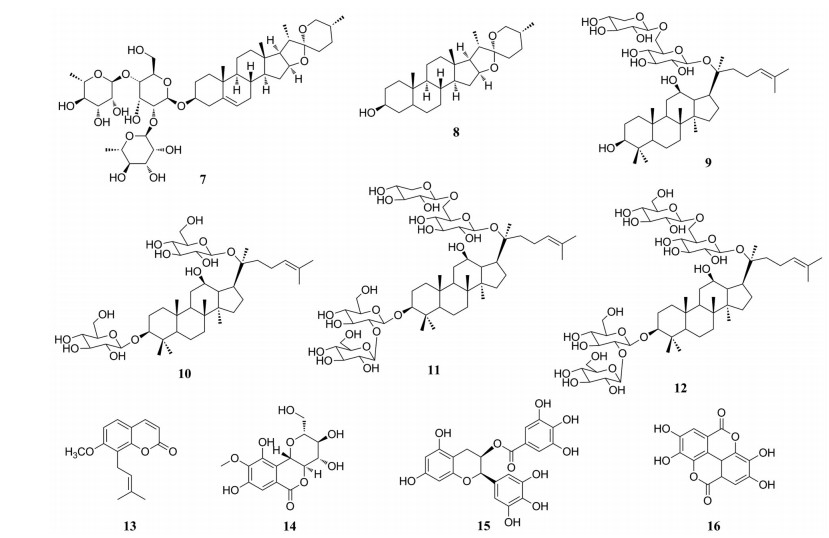
|
Figure 6 Structures of other natural products with uric acid-lowering effects |
蛇床子素化学名为7-甲氧基-8-异戊烯基香豆素(13), 是伞形科植物蛇床子果实的主要活性成分。Tashiro等[45]发现蛇床子素对URAT1具有非竞争性抑制作用(IC50为78.8 µmol·L-1), 并评价比较了其他香豆素的作用, 结果表明结合在香豆素8位的戊烯基在抑制URAT1中起着重要作用, 可能与URAT1的变构口袋结合来抑制其功能。岩白菜素属异香豆素类化合物(14), Chen等[46]发现岩白菜素不仅可以通过调节ABCG2 (80 mg·kg-1和40 mg·kg-1的岩白菜素相比于模型组对ABCG2 mRNA水平分别增加了200%和150%) 和SLC2A9 (80 mg·kg-1的岩白菜素相比于模型组在mRNA和蛋白质水平上对SLC2A9的下调率分别为42%和64%) 的表达促进肾脏和肠道尿酸的排泄, 而且还可以减轻炎症, 诱导巨噬细胞极化从M1表型转变为M2表型, 是一种很有前途的治疗高尿酸血症的候选药物。
表没食子儿茶素-3-没食子酸酯(15) 可下调高尿酸血症模型小鼠的GLUT9和URAT1的mRNA表达水平从而减少尿酸重吸收(50 mg·kg-1的表没食子儿茶素-3-没食子酸酯相比于模型组对GLUT9和URAT1的mRNA表达水平下调率分别为53.3%和81.8%, 高于5 mg·kg-1的别嘌呤醇13.3%和68.2%), 降低血清肌酐水平(20 mg·kg-1的表没食子儿茶素-3-没食子酸酯相比于模型组下降率为15.8%), 对肾脏具有一定的保护作用[47]。
鞣花酸(16) 是一种天然的小分子多酚化合物, 具有XO抑制活性(IC50为165.6 μmol·L-1) 和超氧阴离子清除活性(IC50为27.66 μmol·L-1), 能显著降低高尿酸血症小鼠血清XO活性和尿酸水平(50 mg·kg-1的鞣花酸相较于高尿酸血症小鼠模型组下降率为27.3%和40.5%, 10 mg·kg-1的别嘌呤醇下降率为27.3%和38.1%), 并明显改善肝肾组织病变, 还可抑制NLRP3途径相关蛋白(TLR4、TNF-α、IL-18等) 的表达, 对足底水肿有改善作用[48]。
4 具有降尿酸作用的蛋白酶解物和多肽虽然植物中的黄酮类、萜类、皂苷类、生物碱等活性成分具有良好的降尿酸作用, 但需经分离纯化后得到, 工艺复杂、提取率低、提取成本高, 限制了其工业化应用。研究发现, 部分蛋白酶解物和多肽近年来已被证明具有一定的降尿酸功效, 并且蛋白酶解物和多肽具有制备成本低、安全易吸收、活性高和特异性强等特点, 具有一定的研究价值。
4.1 抑制XO活性的多肽目前具有高黄嘌呤氧化酶抑制活性的生物肽引起了很多关注, 此种肽类多来源于鲨鱼软骨蛋白、核桃蛋白和金枪鱼蛋白水解物等。
Murota等[49]通过活体活性引导分级, 从鲨鱼软骨蛋白水解液中分离鉴定出了Tyr-Leu-Asp-Asn-Tyr (YLDNY) 和Ser-Pro-Pro-Tyr-Trp-Pro-Tyr (SPPYWPY) 具有抗高尿酸血症的活性物质, 且YLDNY口服后可能被进一步降解为具有黄嘌呤氧化酶抑制活性的二肽或三肽(Asp-Asn的IC50值为500 μmol·L-1, Leu-Asp-Asn的IC50值为760 μmol·L-1, 别嘌呤醇的IC50值为38 μmol·L-1)。
Li等[50]从核桃粕水解物(WMH) 和脱酚核桃粕水解物(DWMH) 中分离和鉴定出了两个活性多肽: Trp-Pro-Pro-Lys-Asn (WPPKN) 和Ala-Asp-Ile-Tyr-Thr-Glu (ADIYTE), 它们在体内均能抑制XO活性(IC50分别为17.75 ± 0.12 mg·mL-1和19.01 ± 0.23 mg·mL-1), 进而降低高尿酸血症大鼠的血尿酸水平。
2019年, Li等[51]又发现含有Trp的核桃蛋白肽能有效抑制XO, 且随着Trp数目的增加, 其抑制活性显著增强(含有两个Trp的肽WW4的IC50值为1.0 mmol·L-1, 含有3个Trp的肽WW5的IC50值为0.6 mmol·L-1, 含有4个Trp的肽WW6的IC50值为0.3 mmol·L-1)。同时, 含有Trp的核桃蛋白衍生肽也被发现具有很强的抗氧化活性(WW4的ORAC值比标准抗氧化肽谷胱甘肽高11倍), 可用于改善氧化应激。
He等[52]用重量百分含量80%乙醇水溶液分离了碱性蛋白酶制备的金枪鱼鱼肉水解物(TPH), 得到富含小肽(< 1 000 Da) 的乙醇可溶性部分(ESF) 对XO具有很强的抑制作用(抑制率最高可达67.5% ± 2.8%)。随后, 他们对这些小肽进行了分离并评价了它们的XO抑制活性, 结果表明含有Phe的多肽比含有Trp的多肽具有更强的活性(肽FH显示出最高的抑制活性, IC50为25.7 nmol·L-1)。
Yu等[53]通过虚拟筛选的方法从金枪鱼蛋白中筛选出了新的XO抑制肽EEAK (IC50为173 ± 0.06 μmol·L-1), 分子对接模拟表明EEAK与XO活性中心的关键残基通过氢键和静电相互作用相结合。
4.2 促进尿酸排泄的多肽虽然抑制XO活性的多肽研究较多, 但以尿酸转运体为靶点的生物活性肽却报道很少。
Wan等[54]比较了刺参酶解产物(EH-JAP) 和白刺参酶解产物(EH-LEU) 的抗高尿酸血症和抗炎作用, 结果表明EH-JAP和EH-LEU均能抑制尿酸生物合成(EH-JAP和EH-LEU相比于模型组对XO的抑制率分别为80%和73.3%), 促进尿酸排泄(相比于模型组, EH-JAP对OAT4、GLUT9和URAT1蛋白表达的下调率分别为24.2%、64.4%和57.1%, 对ABCG2、MRP4和OAT1蛋白表达的上调率分别为150%、40%和100%; EH-LEU对OAT4、GLUT9和URAT1蛋白表达的下调率分别为21.2%、55.6%和46.4%, 对ABCG2、MRP4和OAT1蛋白表达的上调率分别为133.3%、20%和108%), 从而减轻高尿酸血症, 并调节细胞因子转录, 减轻肾脏炎症, 其中EH-JAP的作用更优。
Liu等[55]在水稻去壳果实水提物中鉴定出了一种新的多肽(RDP3, AAAAMAGPK-NH2), 该多肽可通过抑制XO和URAT1双重靶点降低尿酸水平(1 mg·kg-1的RDP3相比于模型组对XO体内抑制率为27.1%, 与10 mg·kg-1的别嘌呤醇38.3%相似; 1 mg·kg-1的RDP3相比于模型组对URAT1蛋白表达的下调率为54.5%), 还可通过减少NLRP3炎症体的表达(1 mg·kg-1的RDP3相比于模型组对NLRP3表达的下调率为50%)减轻肾损伤, 显示出抗炎和镇痛活性。
Zhu等[56]研究发现采用酶解法的大米肽(RP) 和胶原肽(CP) 不仅对XO和ADA活性有抑制作用(RP、CP、RCP对XO的抑制率分别为25.90%、18.19%、19.05%; 对ADA的抑制率分别为22.02%、26.67%、28.03%), 还在基因和蛋白水平上抑制URAT1和GLUT9的表达(基因水平上RP和CP对mURAT1的表达水平下调率为29.22%和27.92%, 对mGLUT9的表达水平下调率为56.7%和26.7%; 蛋白水平上RP和CP对URAT1的蛋白表达水平下调率为46.83%和55.69%, 对GLUT9的蛋白表达水平下调率为48.78%和42.61%), 促进OAT1的表达(基因水平上RP和CP对mOAT1的表达水平上调率为7.7%和68.03%, 且RP和CP的混合物对mOAT1的表达水平有协同促进作用, RCP上调率为100%; 蛋白水平上RP和CP对OAT1的蛋白表达水平上调率为33.33%和38.63%, 且RCP组较RP和CP组分别显著提高26.70%和21.86%), 从而减少尿酸在肾脏的重吸收。在预防高尿酸血症和保护肾脏方面, RP和CP联合应用的效果优于两种多肽单独使用的效果。
5 总结与展望当前, 痛风发病率逐年升高, 且在年轻人群中已显示出早发的趋势, 但现有治疗痛风的药物仍十分有限, 且部分药物不良反应明显, 不具备良好的耐受性。而天然产物资源丰富、来源广泛, 毒副作用较少, 可作为缓解和治疗高尿酸血症或痛风的潜在药物进行开发, 前景广阔。本文对最近五年植物提取物和蛋白酶解物及多肽的抗痛风治疗进行了综述。整体来看, 目前关于植物提取物的研究较多, 且涵盖面较广, 肽类的研究相对较少, 可作为未来新药研发的切入点之一。
黄酮类化合物是植物提取物中研究最多的活性物质, 通过研究其对黄嘌呤氧化酶抑制作用的构效关系, 有望对现有药物进行结构改造, 引入新的药效团, 进一步提高药效并减轻毒副作用。但目前植物提取物研究仍处于初级阶段, 多种活性成分和作用机制并未明确, 因此对植物提取物有效成分的提取、鉴定和机制研究仍是天然产物开发的重要环节。肽类与植物提取物相比提取成本较低, 工业化生产较易实现。通过动物模型(特别是以啮齿类动物为主的高尿酸血症动物模型) 和细胞模型, 进一步阐明黄嘌呤氧化酶肽类抑制剂的构效关系及活性机制, 开发XO和尿酸转运体URAT1的双靶点肽类抗痛风药物, 这对于推进抗痛风药物的研发具有重要意义。
作者贡献: 张志姣是文章框架的构思者并负责内容的撰写和文献整理; 刘新泳和展鹏指导论文写作; 梁瑞鹏、赵彤和徐淑静对论文进行了检查和修改。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Ni Q. Guideline for diagnosis and treatment of hyperuricemia and gout (2021-01-20)[J]. World J Tradit Chin Med (世界中医药), 2021, 16: 183-189. |
| [2] |
Das A, Modak P, Sarkar AP, et al. Promising actions of certain medicinal and dietary plants for the management of hyperuricemia as a natural remedy: a review[J]. Asian J Pharm Pharmacol, 2020, 6: 284-297. DOI:10.31024/ajpp.2020.6.4.5 |
| [3] |
Maiuolo J, Oppedisano F, Gratteri S, et al. Regulation of uric acid metabolism and excretion[J]. Int J Cardiol, 2016, 213: 8-14. DOI:10.1016/j.ijcard.2015.08.109 |
| [4] |
Liu JC, Wang T. Present research situation and thinking of drug in treating hyperuricemia[J]. Tianjin J Tradit Chin Med (天津中医药), 2017, 34: 291-294. |
| [5] |
An YT, Yang PS, Wang YQ, et al. Pathogenesis and pharmacotherapy for hyperuricemia[J]. Tianjin Pharm (天津药学), 2015, 27: 72-75. |
| [6] |
Xu L, Shi Y, Zhuang S, et al. Recent advances on uric acid transporters[J]. OncoTargets Ther, 2017, 8: 100852. DOI:10.18632/oncotarget.20135 |
| [7] |
Li XD, Li CG. Evaluation on the safety and efficacy of drugs promote the decomposition of uric acid[J]. J Drug Eval (药品评价), 2015, 12: 55-60. |
| [8] |
Li JH, Yang B, Li ZF. Advances in the pathogensis of gout[J]. World Latest Med Inf (世界最新医学信息文摘), 2017, 17: 22-24. |
| [9] |
So AK, Martinon F. Inflammation in gout: mechanisms and therapeutic targets[J]. Nat Rev Rheumatol, 2017, 13: 639-647. DOI:10.1038/nrrheum.2017.155 |
| [10] |
Dong P, Song H. Research progess in mechanisms of gout[J]. Basic Res Clin Med (基础医学与临床), 2015, 35: 1695. |
| [11] |
Jiang LH, Yang XH, Xie JW, et al. Research progress on the mechanism of uric acid-lowering natural bioactive compounds[J]. Food Machinery (食品与机械), 2020, 36: 210-216. |
| [12] |
Jiang N, Zhang XY, Tian JY, et al. Recent studies on the natural products with xanthine oxidase inhibitory effect[J]. Acta Pharm Sin (药学学报), 2021, 56: 1229-1237. |
| [13] |
Yoon IS, Park DH, Kim JE, et al. Identification of the biologically active constituents of Camellia japonica leaf and anti-hyperuricemic effect in vitro and in vivo[J]. Int J Mol Med, 2017, 39: 1613-1620. DOI:10.3892/ijmm.2017.2973 |
| [14] |
Kim JK, Kim WJ, Hyun JM, et al. Salvia plebeia extract inhibits xanthine oxidase activity in vitro and reduces serum uric acid in an animal model of hyperuricemia[J]. Planta Med, 2017, 83: 1335-1341. DOI:10.1055/s-0043-111012 |
| [15] |
Lee YS, Kim SH, Yuk HJ, et al. DKB114, a mixture of Chrysanthemum indicum linne flower and Cinnamomum cassia (L.) J. presl bark extracts, improves hyperuricemia through inhibition of xanthine oxidase activity and increasing urine excretion[J]. Nutrients, 2018, 10: 1381. DOI:10.3390/nu10101381 |
| [16] |
Mehmood A, Zhao L, Wang C, et al. Stevia residue extract increases intestinal uric acid excretion via interactions with intestinal urate transporters in hyperuricemic mice[J]. Food Funct, 2019, 10: 7900-7912. DOI:10.1039/C9FO02032B |
| [17] |
Mehmood A, Zhao L, Ishaq M, et al. Anti-hyperuricemic potential of stevia (Stevia rebaudiana Bertoni) residue extract in hyperuricemic mice[J]. Food Funct, 2020, 11: 6387-6406. DOI:10.1039/C9FO02246E |
| [18] |
Zhang R, Zhan S, Li S, et al. Anti-hyperuricemic and nephroprotective effects of extracts from Chaenomeles sinensis (Thouin) Koehne in hyperuricemic mice[J]. Food Funct, 2018, 9: 5778-5790. DOI:10.1039/C8FO01480A |
| [19] |
Peng A, Lin L, Zhao M, et al. Identifying mechanisms underlying the amelioration effect of Chrysanthemum morifolium Ramat. 'Boju' extract on hyperuricemia using biochemical characterization and UPLC-ESI-QTOF/MS-based metabolomics[J]. Food Funct, 2019, 10: 8042-8055. DOI:10.1039/C9FO01821B |
| [20] |
Tian Y, Lin L, Zhao M, et al. Xanthine oxidase inhibitory activity and antihyperuricemic effect of Moringa oleifera Lam. leaf hydrolysate rich in phenolics and peptides[J]. J Ethnopharmacol, 2021, 270: 113808. DOI:10.1016/j.jep.2021.113808 |
| [21] |
Han S, Wei R, Han D, et al. Hypouricemic effects of extracts from Urtica hyperborea Jacq. ex Wedd. in hyperuricemia mice through XOD, URAT1, and OAT1[J]. Biomed Res Int, 2020, 2020: 2968135. |
| [22] |
Zhou Y, Zhang X, Li C, et al. Research on the pharmacodynamics and mechanism of Fraxini Cortex on hyperuricemia based on the regulation of URAT1 and GLUT9[J]. Biomed Pharmacother, 2018, 106: 434-442. DOI:10.1016/j.biopha.2018.06.163 |
| [23] |
Fang C, Chen L, He M, et al. Molecular mechanistic insight into the anti-hyperuricemic effect of Eucommia ulmoides in mice and rats[J]. Pharm Biol, 2019, 57: 112-119. DOI:10.1080/13880209.2019.1568510 |
| [24] |
Zhang W, Du W, Li G, et al. Constituents and anti-hyperuricemia mechanism of traditional Chinese herbal formulae erding granule[J]. Molecules, 2019, 24: 3248. DOI:10.3390/molecules24183248 |
| [25] |
Oh DR, Kim JR, Choi CY, et al. Effects of chondroT on potassium oxonate-induced hyperuricemic mice: downregulation of xanthine oxidase and urate transporter 1[J]. BMC Complement Altern Med, 2019, 19: 10. DOI:10.1186/s12906-018-2415-2 |
| [26] |
Li L, Teng M, Liu Y, et al. Anti-gouty arthritis and antihyperuricemia effects of sunflower (Helianthus annuus) head extract in gouty and hyperuricemia animal models[J]. Biomed Res Int, 2017, 2017: 5852076. |
| [27] |
He H, Jiang H, Chen Y, et al. Oridonin is a covalent NLRP3 inhibitor with strong anti-inflammasome activity[J]. Nat Commun, 2018, 9: 2550. DOI:10.1038/s41467-018-04947-6 |
| [28] |
Zhang HJ, Li LN, Zhou J, et al. Effects of Gnaphalium affine D. Don on hyperuricemia and acute gouty arthritis[J]. J Ethnopharmacol, 2017, 203: 304-311. DOI:10.1016/j.jep.2017.03.057 |
| [29] |
Wang S, Fang Y, Yu X, et al. The flavonoid-rich fraction from rhizomes of Smilax glabra Roxb. ameliorates renal oxidative stress and inflammation in uric acid nephropathy rats through promoting uric acid excretion[J]. Biomed Pharmacother, 2019, 111: 162-168. DOI:10.1016/j.biopha.2018.12.050 |
| [30] |
Li S, Li L, Yan H, et al. Anti-gouty arthritis and anti-hyperuricemia properties of celery seed extracts in rodent models[J]. Mol Med Rep, 2019, 20: 4623-4633. |
| [31] |
Lou XJ, Wang YZ, Lei SS, et al. Beneficial effects of macroporous resin extract of Dendrobium candidum leaves in rats with hyperuricemia induced by a high-purine diet[J]. Evid Based Complement Altern Med, 2020, 2020: 3086106. |
| [32] |
Zhang KH, Wang MQ, Wei LL, et al. Investigation of the effects and mechanisms of Dendrobium loddigesii Rolfe extract on the treatment of gout[J]. Evid Based Complement Altern Med, 2020, 2020: 4367347. |
| [33] |
Cos P, Ying L, Calomme M, et al. Structure-activity relationship and classification of flavonoids as inhibitors of xanthine oxidase and superoxide scavengers[J]. J Nat Prod, 1998, 61: 71-76. DOI:10.1021/np970237h |
| [34] |
Lin S, Zhang G, Liao Y, et al. Dietary flavonoids as xanthine oxidase inhibitors: structure-affinity and structure-activity relationships[J]. J Agric Food Chem, 2015, 63: 7784-7794. DOI:10.1021/acs.jafc.5b03386 |
| [35] |
Xia DZ, Zhang Y, Lv GY. Research progress of flavonoids in prevention and treatment of hyperuricemia and gout[J]. Chin Pharm J (中国药学杂志), 2009, 44: 721-723. |
| [36] |
Zhang C, Wang R, Zhang G, et al. Mechanistic insights into the inhibition of quercetin on xanthine oxidase[J]. Int J Biol Macromol, 2018, 112: 405-412. DOI:10.1016/j.ijbiomac.2018.01.190 |
| [37] |
Chen HQ, Zhou X, Wang XX. Study on the mechanism of quercetin in treating hyperuricemia[J]. Guangming J Chin Med (光明中医), 2019, 9: 1340-1344. |
| [38] |
Ou R, Lin L, Zhao M, et al. Action mechanisms and interaction of two key xanthine oxidase inhibitors in galangal: combination of in vitro and in silico molecular docking studies[J]. Int J Biol Macromol, 2020, 162: 1526-1535. DOI:10.1016/j.ijbiomac.2020.07.297 |
| [39] |
Li Y, Zhao Z, Luo J, et al. Apigenin ameliorates hyperuricemic nephropathy by inhibiting URAT1 and GLUT9 and relieving renal fibrosis via the Wnt/β-catenin pathway[J]. Phytomedicine, 2021, 87: 153585. DOI:10.1016/j.phymed.2021.153585 |
| [40] |
Miao MX, Wang X, Lu X, et al. Mechanism study effects of apigenin on reducing uric acid and renal protection in oteracil potassium-induced hyperuricemia mice[J]. China Pharm (中国药房), 2016, 27: 4794-4797. |
| [41] |
Chang YH, Chiang YF, Chen HY, et al. Anti-inflammatory and anti-hyperuricemic effects of chrysin on a high fructose corn syrup-induced hyperuricemia rat model via the amelioration of urate transporters and inhibition of NLRP3 inflammasome signaling pathway[J]. Antioxidants, 2021, 10: 564. DOI:10.3390/antiox10040564 |
| [42] |
Lin Y, Liu PG, Liang WQ, et al. Luteolin-4′-O-glucoside and its aglycone, two major flavones of Gnaphalium affine D. Don, resist hyperuricemia and acute gouty arthritis activity in animal models[J]. Phytomedicine, 2018, 41: 54-61. DOI:10.1016/j.phymed.2018.02.002 |
| [43] |
Zhang Y, Jin L, Liu J, et al. Effect and mechanism of dioscin from Dioscorea spongiosa on uric acid excretion in animal model of hyperuricemia[J]. J Ethnopharmacol, 2018, 214: 29-36. DOI:10.1016/j.jep.2017.12.004 |
| [44] |
Wu FP, Jin P, Pu YC, et al. Study on chemical constituents and kidney protection of Gynostemma pentaphyllum[J]. Chin J Med Chem (中国药物化学杂志), 2020, 30: 153-158. |
| [45] |
Tashiro Y, Sakai R, Hirose-Sugiura T, et al. Effects of osthol isolated from Cnidium monnieri fruit on urate transporter 1[J]. Molecules, 2018, 23: 2837. DOI:10.3390/molecules23112837 |
| [46] |
Chen M, Ye C, Zhu J, et al. Bergenin as a novel urate-lowering therapeutic strategy for hyperuricemia[J]. Front Cell Dev Biol, 2020, 8: 703. |
| [47] |
Zhu C, Xu Y, Liu ZH, et al. The anti-hyperuricemic effect of epigallocatechin-3-gallate (EGCG) on hyperuricemic mice[J]. Biomed Pharmacother, 2018, 97: 168-173. DOI:10.1016/j.biopha.2017.10.013 |
| [48] |
Sun ZR, Liu HR, Hu D, et al. Ellagic acid exerts beneficial effects on hyperuricemia by inhibiting xanthine oxidase and NLRP3 inflammasome activation[J]. J Agric Food Chem, 2021, 69: 12741-12752. |
| [49] |
Murota I, Taguchi S, Sato N, et al. Identification of antihyperuricemic peptides in the proteolytic digest of shark cartilage water extract using in vivo activity-guided fractionation[J]. J Agric Food Chem, 2014, 62: 2392-2397. |
| [50] |
Li Q, Kang X, Shi C, et al. Moderation of hyperuricemia in rats via consuming walnut protein hydrolysate diet and identification of new antihyperuricemic peptides[J]. Food Funct, 2018, 9: 107-116. |
| [51] |
Li Q, Shi C, Wang M, et al. Tryptophan residue enhances in vitro walnut protein-derived peptides exerting xanthine oxidase inhibition and antioxidant activities[J]. J Funct Foods, 2019, 53: 276-285. |
| [52] |
He W, Su G, Sun-Waterhouse D, et al. In vivo anti-hyperuricemic and xanthine oxidase inhibitory properties of tuna protein hydrolysates and its isolated fractions[J]. Food Chem, 2019, 272: 453-461. |
| [53] |
Yu Z, Kan R, Wu S, et al. Xanthine oxidase inhibitory peptides derived from tuna protein: virtual screening, inhibitory activity, and molecular mechanisms[J]. J Sci Food Agric, 2021, 101: 1349-1354. |
| [54] |
Wan H, Han J, Tang S, et al. Comparisons of protective effects between two sea cucumber hydrolysates against diet induced hyperuricemia and renal inflammation in mice[J]. Food Funct, 2020, 11: 1074-1086. |
| [55] |
Liu N, Wang Y, Zeng L, et al. RDP3, a novel antigout peptide derived from water extract of rice[J]. J Agric Food Chem, 2020, 68: 7143-7151. |
| [56] |
Zhu Y, Zhang R, Wei Y, et al. Rice peptide and collagen peptide prevented potassium oxonate-induced hyperuricemia and renal damage[J]. Food Biosci, 2021, 42: 101147. |
 2022, Vol. 57
2022, Vol. 57


