2. 广州中医药大学, 广东 广州 510006
2. Guangzhou University of Chinese Medicine, Guangzhou 510006, China
高尿酸血症(hyperuricemia, HUA) 是一种以血清尿酸水平升高为特征的代谢紊乱[1]。肾脏尿酸沉积过多导致高尿酸血症肾病(hyperuricemic nephropathy, HN), 主要表现为肾脏炎症、肾小球和小管损伤、小管间质纤维化和尿酸性肾结石[2], 随着人们生活水平的提高, HUA成为严重影响人类生活质量的主要疾病之一[3]。建立理想的HN动物模型是推动HN研究的关键, 因此建立一种高效、稳定、能模拟HN发生机制的小鼠动物模型, 对人类HN药效靶点的发现和新药开发具有重要意义。
高等灵长类动物在进化过程中编码尿酸酶(urate oxidase, Uox) 的基因丢失, 但是小鼠体内的尿酸酶会将尿酸代谢为尿囊素排出体外[4], 因此小鼠的HN模型一直存在稳定性差、评价方法不统一的现象。目前, HN小鼠模型的建立大多采用氧嗪酸钾(potassium oxonate, PO) 和次黄嘌呤(hypoxanthine, Hx) 联合诱导的方式, 但是灌胃PO出现剂量大, 造成小鼠食欲不振、尿酸值波动大、模型不稳定的现象。因此, 本研究旨在通过比较PO的不同给药方式来探索建立一种新的高效的小鼠模型。
材料与方法实验动物 18只SPF级雄性C57BL/6小鼠, 体重20~25 g, 8周龄, 购自北京维通利华实验动物技术有限公司, 动物生产许可证号: SCXK (浙) 2018-0002。小鼠饲养于广东药科大学SPF级动物实验中心, 实验单位使用许可证编号: SYXK (粤) 2017-0125, 动物实验获得广东药科大学实验室动物护理和使用伦理委员会批准, 批准号: gdpulacspf2020007。
药物与试剂 氧嗪酸钾(批号: STBH0976)、次黄嘌呤(批号: SLBZ9513) 和活性氧荧光探针(DCFH-DA, 批号: 059M4133) 均购自美国Sigma公司; 羧甲基纤维素钠(CMC-Na, 批号: 20190304)和Triton X-100 (批号: C428BA001) 购自生工生物工程有限公司; 苏木素伊红染液(HE, 批号: 0729A20); 天狼猩红染液(Sirius red, 批号: 20211111)、Masson染色液(批号: 0928A20) 均购自北京雷根生物技术有限公司; 血清尿酸(serum uric acid, SUA, 批号: 20200911)、血清肌酐(serum creatinine, SCr, 批号: 20201106)、黄嘌呤氧化酶(xanthine oxidase, XOD, 批号: 20210512)、尿蛋白检测试剂盒(批号: 20200608) 均购自南京建成生物技术研究所; DAB显色液(批号: UD283195) 购自赛默飞世尔科技有限公司; 4-羟基壬烯酸(4-HNE) 抗体购自美国R & D Systems公司; 纤维连接蛋白(fibronectin, FN) 抗体购自博士德生物工程有限公司; 尿酸盐转运蛋白1 (urate transporter 1, URAT1) 抗体购自美国Proteintech有限公司; β-actin抗体购自北京全式金生物技术股份有限公司。
仪器 多功能酶标仪(美国Thermo Fisher Scientific公司); ECL化学发光仪(美国Bio-Rad公司); 荧光显微镜(日本Olympus公司); 高速冷冻离心机(美国Scilogex公司)。
动物实验分组、造模与给药 将18只C57BL/6雄性小鼠随机均分3组: 正常对照组(control)、氧嗪酸钾(PO; 灌胃给药100 mg·kg-1·d-1) + 次黄嘌呤(Hx; 灌胃给药500 mg·kg-1·d-1) 模型组、氧嗪酸钾(腹腔注射给药100 mg·kg-1·d-1) + 次黄嘌呤(灌胃给药500 mg·kg-1·d-1) 模型组, 每天上午9:30, 除正常对照组灌胃0.5% CMC-Na (10 μL·g-1·d-1) 外, 各组小鼠分别按实验方案给予相应体积的氧嗪酸钾和次黄嘌呤诱导HN模型, 持续3周。
样品采集 给药第20天对小鼠禁食不禁水收集24 h尿液, 第21天给完造模药1.5 h后取小鼠血液, 室温静置30 min后3 000 r·min-1离心15 min, 分离得到血清。处死小鼠后取肾脏和肝脏, 左肾脱水包埋做病理切片, 右肾及肝脏置于-80 ℃冰箱保存。
生化指标检测 取上述小鼠血清按照试剂盒说明书方法测量SUA、SCr和肝脏XOD水平, 取小鼠24 h尿液测尿蛋白含量。
病理学评价 将小鼠肾脏按常规方法固定、脱水、包埋、切片, HE染色观察肾脏组织结构及肾小管和肾小球形态; 天狼猩红染色检测肾脏胶原沉积情况; Masson染色检测肾脏组织纤维化程度。为了评估肾脏损伤的程度, 参照相关文献描述的方法[5], 根据肾脏炎症浸润情况和肾小管坏死程度, 综合判断肾损伤程度并进行肾脏病理损伤半定量评分, 评分越高代表肾脏损伤越严重。使用以下量表对每组6张切片的8~10个视野的形态学损伤进行量化, 具体标准如表 1。
| Table 1 Histological scoring of the renal lesion |
免疫组织化学检测小鼠肾脏组织中4-HNE的表达水平 组织玻片按常规方法烘片、脱蜡后用柠檬酸盐缓冲液(pH = 6) 高压修复, 待玻片冷却至室温后放于3%过氧化氢中常温静置10 min。漂洗后用1% BSA封闭1 h, 加4-HNE抗体于4 ℃过夜。次日取出玻片恢复至室温, 经漂洗后加二抗在室温放置1 h。DAB显色(避光) 后苏木素染细胞核, 脱水, 风干, 封片。显微镜下观察拍照, Image J统计分析。
DCFH-DA检测小鼠肾脏组织活性氧(ROS) 表达情况 组织玻片按常规方法烘片、脱蜡、柠檬酸盐缓冲液(pH = 6) 高压修复, 1% Triton X-100孵育破膜, 经PBS漂洗后用探针孵育20 min, 荧光封片剂封片。
蛋白提取及Western blot检测小鼠肾脏组织中FN和URAT1的蛋白表达水平 取20 mg组织放入1.5 mL EP管中, 每管加入500 μL含有蛋白酶抑制剂的裂解液, 匀浆机匀浆后在冰上充分裂解15 min。使用高速冷冻离心机于12 000 r·min-1、4 ℃离心30 min, 取上清。用BCA法测蛋白浓度并调整, 加入蛋白上样缓冲液, 加热变性。Western blot实验: 每孔上样等量蛋白样品, 进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳, 电转移至PVDF膜, 5%脱脂奶粉封闭1 h, 漂洗之后与FN和URAT1的一抗4 ℃下孵育过夜, 经TBST洗膜后, 加入相应二抗, 室温孵育1 h, 洗膜, ECL显色、曝光、分析条带。
统计学方法 实验结果采用GraphPad Prism 7.0软件进行统计分析。所有结果均以
造模期间, 各组小鼠的体重基本呈上升趋势; 连续给药21天后, 各组小鼠状态良好, 毛色光滑, 饮食饮水正常; 相对于正常对照组小鼠, PO (i.g.) + Hx小鼠尿量并无明显变化; 而PO (i.p.) + Hx小鼠尿量明显增加(P < 0.05), 模型组小鼠均未出现精神萎靡和死亡情况, 各组小鼠饮食量没有差异(图 1)。
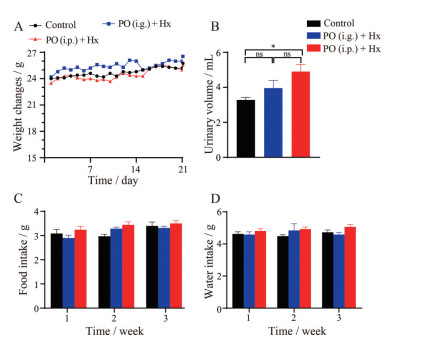
|
Figure 1 The global appearance and characteristics of control and hyperuricemic nephropathy (HN) mice. A: Body weight; B: The 24 h urinary volume; C: Food intake; D: Water intake. n = 6, |
肝脏XOD是体内合成尿酸的限速酶, 既能够催化次黄嘌呤生成黄嘌呤, 进而生成尿酸, 也可直接催化黄嘌呤生成尿酸[4]; SCr和24 h尿蛋白已被提出作为基础和临床实践中常规和准确的肾小球滤过率参数, 是反映肾功能的重要指标[6, 7]。如图 2所示, 与正常对照组小鼠比较, PO (i.g.) + Hx小鼠SUA、SCr水平和24 h尿蛋白含量明显升高(P < 0.05); PO (i.p.) + Hx小鼠SUA、SCr、肝脏XOD水平及24 h尿蛋白含量显著升高(P < 0.01)。
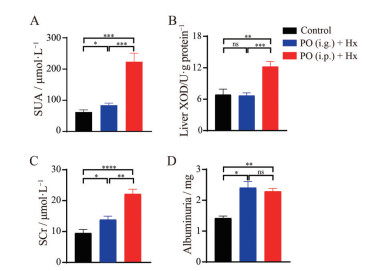
|
Figure 2 The biochemistry analysis of uric acid and renal function in HN mice. A: Serum uric acid (SUA) level; B: Activity of liver xanthine oxidase (XOD); C: Serum creatinine (SCr) level; D: The content of 24 h albuminuria in urine of mice. n = 6, |
HE病理结果显示(图 3), 正常对照组肾小管细胞形态正常, 肾小球大小和形态正常、未见明显萎缩或增生, 肾脏无明显炎症浸润; PO (i.g.) + Hx小鼠可见轻微肾小管扩张和炎症细胞浸润, 肾小球系膜增生; PO (i.p.) + Hx小鼠肾组织可见明显炎症细胞浸润, 肾小管普遍扩张变性, 肾小管上皮细胞排列紊乱或脱落。肾脏组织病理损伤半定量评分显示: PO (i.p.) + Hx组小鼠肾脏组织病理损伤评分明显高于PO (i.g.) + Hx组(P < 0.000 1)。
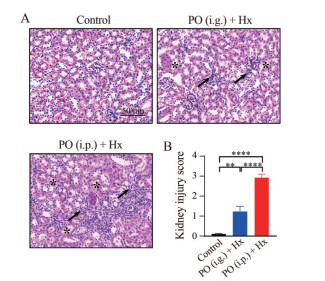
|
Figure 3 Renal histology was examined by HE staining in HN mice. A: Representative HE staining of HN mice. PO (i.g.) + Hx group, slight tubular epithelial cell necrosis and renal tubule dilatation (asterisk) and inflammatory infiltration (black arrow); PO (i.p.) + Hx group, severe tubular epithelial cell necrosis and renal tubule dilatation (asterisk) and inflammatory infiltration (black arrow); B: Semi-quantitative score of pathological damage of kidney tissue in mice. n = 6, |
DCFH-DA检测结果显示(图 4), 相较于正常对照组小鼠, PO (i.g.) + Hx小鼠和PO (i.p.) + Hx小鼠组织内ROS生成显著增加(P < 0.05, P < 0.001); 免疫组织化学检测结果显示, 脂质过氧化物4-HNE在PO (i.g.) + Hx小鼠中部分肾小管区域表达, 在PO (i.p.) + Hx小鼠组织中表达显著增多(P < 0.001)。
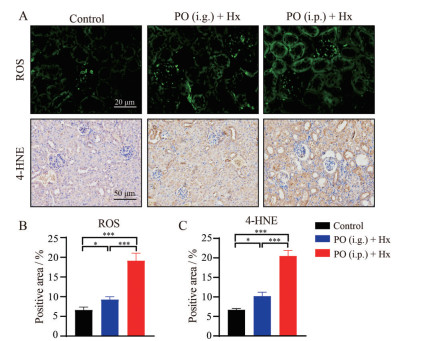
|
Figure 4 Oxidative stress indexes were detected in HN mice. A: Representative images of DCFH-DA fluorescence and immunofluorescent staining of 4-hydroxynonenal (4-HNE); B, C: The quantification of positive staining of ROS (B) and 4-HNE (C). n = 6, |
天狼猩红和Masson染色病理结果显示(图 5), 相较于正常对照组小鼠, PO (i.g.) + Hx小鼠肾脏组织腔中可见明显胶原纤维生成; PO (i.p.) + Hx组小鼠胶原沉积明显, 胶原纤维生成进一步显著增多, 并交联成网状。统计结果显示, PO (i.p.) + Hx组小鼠纤维化程度相较于正常对照组小鼠显著增加(P < 0.001), 纤维化程度明显强于PO (i.g.) + Hx小鼠(P < 0.05)。
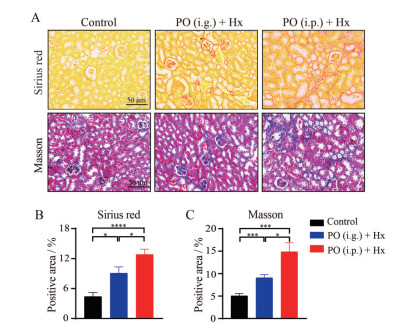
|
Figure 5 Sirius red and Masson's trichrome stainings were performed in HN mice. A: Representative images of Sirius red and Masson's trichrome; B: The quantification of positive staining of Sirius red; C: The quantification of positive staining of Masson's trichrome. n = 6, |
如图 6所示, 相较于正常对照组小鼠, PO (i.g.) + Hx和PO (i.p.) + Hx小鼠FN表达量明显上调(P < 0.01, P < 0.000 1), 且与PO (i.g.) + Hx组小鼠相比, PO (i.p.) + Hx小鼠FN表达增加更为显著(P < 0.05)。

|
Figure 6 The expression of fibronectin (FN) in HN mice. A: The protein expression of FN was examined by Western blot; B: The density analysis of FN. n = 6, |
如图 7所示, 相较于正常对照组小鼠, PO (i.g.) + Hx组小鼠和PO (i.p.) + Hx组小鼠的URAT1表达量明显上调(P < 0.01, P < 0.001), 且与PO (i.g.) + Hx小鼠相比, PO (i.p.) + Hx小鼠URAT1表达量显著上调(P < 0.001)。

|
Figure 7 The expression of urate transporter 1 (URAT1) in HN mice. A: The protein expression of URAT1 was examined by Western blot; B: The density analysis of URAT1. n = 6, |
高尿酸血症作为继高血压、高血糖、高血脂以后的“第四高”, 与多种代谢紊乱相关, 同时也是高尿酸血症肾病的一个独立危险因素[8]。动物模型是研究高尿酸血症疾病的重要工具, 对治疗药物的开发、发病机制的研究起着关键性的作用, 因此构建一个可重复的、与人类高尿酸血症肾病发病机制相似的动物模型至关重要。目前, 构建高尿酸血症肾脏模型主要有两种: ①增加尿酸的生成。如使用富含嘌呤、次黄嘌呤的食物来增加小鼠体内尿酸的生成; ②抑制尿酸分解。如使用抑制尿酸酶的药物氧嗪酸钾抑制小鼠体内的尿酸分解。
目前, 研究中大多使用氧嗪酸钾联合次黄嘌呤或者腺嘌呤构建高尿酸血症肾病小鼠模型。Yong等[9]灌胃300 mg·kg-1 PO联合500 mg·kg-1 Hx持续7天诱导模型; 或注射100 mg·kg-1 PO联合灌胃500 mg·kg-1 Hx持续7天诱导模型[10]; Ren等[11]灌胃2 400 mg·kg-1 PO联合160 mg·kg-1腺嘌呤持续28天诱导模型; Wen等[12]灌胃200 mg·kg-1 PO联合50 mg·kg-1腺嘌呤持续21天诱导模型。由于腺嘌呤本身易在肾脏形成结晶, 与尿酸结晶造成的肾脏损伤难以区分, 因此近来研究逐渐淘汰腺嘌呤进行诱导高尿酸血症肾病模型。因此, 本研究选择氧嗪酸钾联合次黄嘌呤诱导高尿酸血症肾病模型。有研究[11]显示, 灌胃PO剂量达到2 400 mg·kg-1, 易引起小鼠肠胃负担过重, 影响饮食饮水。基于以上研究, 灌胃和注射PO联合灌胃Hx都可诱导高尿酸血症, 但目前没有研究比较灌胃和注射哪种给药方式能够更好地诱导出高尿酸血症肾病模型。综上, 本研究优化了造模方法为100 mg·kg-1 PO和500 mg·kg-1 Hx, 给药时间为21天, 并在灌胃Hx的情况下对比PO使用灌胃和腹腔注射两种给药方式对构建小鼠高尿酸血症肾病模型的影响。
在本研究中, 灌胃和腹腔注射组HN小鼠饮食和体重稳定、精神状态良好、未出现死亡现象, 造模周期短。相较于灌胃组小鼠, 腹腔注射氧嗪酸钾会使小鼠尿酸上升平稳且持久, 小鼠肾脏出现明显肾损伤和肾脏纤维化。血清尿酸水平是判断高尿酸血症动物模型构建成功与否的重要指标。本实验结果表明, 腹腔注射氧嗪酸钾联合灌胃次黄嘌呤使小鼠血清中的尿酸和肌酐水平以及尿蛋白含量升高得更明显, 肾脏的病理损伤更为严重。ROS的产生与内源性抗氧化网络的代偿反应之间的氧化还原失衡导致氧化应激。过量的ROS生成可激活一系列细胞信号通路, 导致严重肾损伤和肾功能障碍[13]。在本研究中, 腹腔注射氧嗪酸钾联合灌胃次黄嘌呤可以使小鼠肾脏内ROS及脂质过氧化物4-HNE生成增多, 造成了进一步的肾损伤。肾脏是尿酸排泄的主要器官, 尿酸转运体介导的尿酸过度重吸收是高尿酸血症发生的一大原因[14]。本研究结果表明, 模型组小鼠体内URAT1蛋白表达增多, 造成尿酸重吸收增多。
本研究采用的腹腔注射氧嗪酸钾联合灌胃次黄嘌呤造成了小鼠体内尿酸稳定升高及肾脏的病理损伤, 比较符合人类高尿酸血症肾病病理形成过程, 但仍存在一定的局限性。氧嗪酸钾长期腹腔注射将会导致小鼠产生应激反应发生腹腔积水和腹膜硬化[15], 造成非本模型所特征的病理损伤, 对HN损伤动物模型的建立产生一定程度的干扰。由于小鼠体内表达Uox, 可持续降解尿酸, 所以即使在摄取高嘌呤食物的情况下也很难形成高尿酸血症。因此对尿酸酶进行基因修饰是构建自发HN模型的关键技术。胚胎干细胞同源重组Uox敲除小鼠模型的平均血清尿酸浓度比野生型对照组高约12倍, 但小鼠在4周龄时死亡率高达65%[16]。Lu等[17]使用转录激活因子样效应物核酸酶(TALEN) 技术构建Uox敲除小鼠模型, 这些小鼠模型血清尿酸盐浓度适度升高至7.1~8.7 mg·dL-1, 与人类血尿酸水平相似, 但活产率仅为15.9%。敲除小鼠体内Uox引起尿酸升高且造成相应的肾损伤, 与人类高尿酸血症肾病的发病机制更为接近。因此, 如何获得高产率和高存活率的Uox敲除小鼠, 并在高尿酸环境下易存活是目前面临的一大挑战。未来Uox敲除鼠与饮食诱导相结合将是一种很有前景的高尿酸血症造模方式。
综上所述, 通过腹腔注射100 mg·kg-1氧嗪酸钾和灌胃500 mg·kg-1次黄嘌呤成功地构建了高尿酸血症肾病小鼠模型。小鼠血清中的尿酸和肌酐水平的升高、肾脏的病理损伤及体内FN和URAT1的蛋白表达增加可以证明本研究构建的是一个更优化、可重复的高尿酸血症肾病小鼠模型。
作者贡献: 李明慧负责完成实验和论文撰写工作; 吴铠礽、陈哲和孙蕾妍参与部分实验的操作和数据处理工作; 兰天、胡旭光和黄晓其负责实验指导和论文修改工作。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Dalbeth N, Merriman TR, Stamp LK. Gout[J]. Lancet, 2016, 388: 2039-2052. DOI:10.1016/S0140-6736(16)00346-9 |
| [2] |
Hu QH, Zhang X, Wang Y, et al. Mangiferin promotes uric acid excretion and kidney function improvement and modulates related renal transporters in hyperuricemic mice[J]. Acta Pharm Sin (药学学报), 2010, 45: 1239-1246. |
| [3] |
Wan Q, Gao YX, Wu YS, et al. Research progress on the relationship between hyperuricemia and cardiovascular disease[J]. Chin J Integr Med Cardio/Cerebrovasc Dis (中西医结合心脑血管病杂志), 2018, 16: 54-56. |
| [4] |
Lu J, Dalbeth N, Yin H, et al. Mouse models for human hyperuricaemia: a critical review[J]. Nat Rev Rheumatol, 2019, 15: 413-426. |
| [5] |
Liu N, Wang L, Yang T, et al. EGF receptor inhibition alleviates hyperuricemic nephropathy[J]. J Am Soc Nephrol, 2015, 26: 2716-2729. DOI:10.1681/ASN.2014080793 |
| [6] |
Waijer SW, Provenzano M, Mulder S, et al. Impact of random variation in albuminuria and estimated glomerular filtration rate on patient enrolment and duration of clinical trials in nephrology[J]. Diabetes Obes Metab, 2022. DOI:10.1111/dom.14660 |
| [7] |
Dharnidharka VR, Kwon C, Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis[J]. Am J Kidney Dis, 2002, 40: 221-226. DOI:10.1053/ajkd.2002.34487 |
| [8] |
Dehlin M, Jacobsson L, Roddy E. Global epidemiology of gout: prevalence, incidence, treatment patterns and risk factors[J]. Nat Rev Rheumatol, 2020, 16: 380-390. DOI:10.1038/s41584-020-0441-1 |
| [9] |
Yong T, Li D, Li M, et al. Anti-hyperuricemic effect of 2-hydroxy-4-methoxy-benzophenone-5-sulfonic acid in hyperuricemic mice through XOD[J]. Molecules, 2018, 23: 2671. DOI:10.3390/molecules23102671 |
| [10] |
Yong T, Zhang M, Chen D, et al. Actions of water extract from Cordyceps militaris in hyperuricemic mice induced by potassium oxonate combined with hypoxanthine[J]. J Ethnopharmacol, 2016, 194: 403-411. DOI:10.1016/j.jep.2016.10.001 |
| [11] |
Ren Q, Tao S, Guo F, et al. Natural flavonol fisetin attenuated hyperuricemic nephropathy via inhibiting IL-6/JAK2/STAT3 and TGF-beta/SMAD3 signaling[J]. Phytomedicine, 2021, 87: 153552. |
| [12] |
Wen S, Wang D, Yu H, et al. The time-feature of uric acid excretion in hyperuricemia mice induced by potassium oxonate and adenine[J]. Int J Mol Sci, 2020, 21: 5178. DOI:10.3390/ijms21155178 |
| [13] |
Ha H, Hwang IA, Park JH, et al. Role of reactive oxygen species in the pathogenesis of diabetic nephropathy[J]. Diabetes Res Clin Pract, 2008, 82 Suppl 1: S42-S45. |
| [14] |
Yanai H, Adachi H, Hakoshima M, et al. Molecular biological and clinical understanding of the pathophysiology and treatments of hyperuricemia and its association with metabolic syndrome, cardiovascular diseases and chronic kidney disease[J]. Int J Mol Sci, 2021, 22: 9221. |
| [15] |
Li YY, Zhou HY, Wu LY, et al. Establishment and study of a hyperuricemia rat model[J]. Acta Lab Anim Sci Sin (中国实验动物学报), 2019, 27: 747-752. |
| [16] |
Wu X, Wakamiya M, Vaishnav S, et al. Hyperuricemia and urate nephropathy in urate oxidase-deficient mice[J]. Proc Natl Acad Sci U S A, 1994, 91: 742-746. |
| [17] |
Lu J, Hou X, Yuan X, et al. Knockout of the urate oxidase gene provides a stable mouse model of hyperuricemia associated with metabolic disorders[J]. Kidney Int, 2018, 93: 69-80. |
 2022, Vol. 57
2022, Vol. 57


