2. 北京生物医药研究所, 北京 100091;
3. 中国科学技术大学附属第一医院 (安徽省立医院), 安徽 合肥 230022
2. Beijing Institute of Biomedicine, Beijing 100091, China;
3. The First Affiliated Hospital of USTC (Anhui Provincial Hospital), Hefei 230022, China
心衰是一种临床综合征[1], 其主要特征是结构性或功能性心脏疾病引起的心室充盈或心脏舒张功能受损[2]。近期统计, 在我国年龄≥ 35岁的居民中, 心衰患病率为1.3%, 即约有1 370万心衰患者[3, 4]。血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂、β-受体拮抗剂和盐皮质激素拮抗剂均可降低心力衰竭患者的发病率和死亡率[5], 被称为心衰治疗的“金三角”, 但其治疗效果却差强人意。因此, 发现和研究新的可以用于心衰治疗的药物或手段十分关键。
纤维母细胞生长因子21 (fibroblast growth factor 21, FGF21) 是一种分泌蛋白, 在细胞的生长发育、修复[6, 7]及能量代谢调节[8]中发挥重要作用。FGF21可以特异性地与FGF受体和β-Klotho7结合[9], 且肝脏被认为是人类和小鼠产生和分泌FGF21的主要部位[10]。尽管心脏中FGF21的分泌水平低于肝脏, 但FGF21在心脏中同样发挥重要的功能。有研究显示, 心衰患者循环系统中FGF21水平与舒张性功能障碍相关[11]; FGF21可通过抗氧化和促进脂肪酸氧化改善异丙肾上腺素诱导的心肌肥大[12]; 此外, FGF21可改善缺血再灌注造成的心脏损伤[13, 14]。上述研究提示, FGF21在心衰功能改善及心脏重塑中可能发挥一定功能, 并可能是心衰的一个治疗靶点。
依帕列净(empagliflozin, EMP) 是钠-葡萄糖共转运蛋白2 (sodium-glucose cotransporter 2, SGLT2) 的选择性抑制剂, 是一类新的抗糖尿病药物, 可作为单一治疗或与其他糖尿病药物联合使用[15]。糖尿病是现代社会的主要健康威胁之一[16], 在所有糖尿病并发症中, 心血管疾病被认为是糖尿病患者死亡的主要原因[17]。糖尿病性心肌病是糖尿病患者心力衰竭的主要原因[18], 以心脏结构和功能受损为主要特征。另有研究表明, 无论患者是否患有糖尿病, EMP对心衰都有治疗作用[19], 但其改善心衰的机制目前尚不清楚。因此, 本文拟研究EMP治疗心衰的功能是否依赖于FGF21, 以揭示其改善心衰的作用机制。
材料与方法实验动物 FGF21敲除(FGF21 knockout, FGF21 KO) 小鼠和野生型(WT) 小鼠[动物生产许可证号: SCXK (苏) 2018-0008] 均购自南京模式动物所, 所有实验均在合肥工业大学食品与生物工程学院动物实验中心进行, 饲养环境温度控制在22~24 ℃, 实验动物可自由进食和饮水, 所有动物实验均符合合肥工业大学动物伦理委员会的规定。
药品和试剂 多柔比星(Dox) 购自美国MedChemExpress公司; EMP购自MCE公司; siRNA购自北京擎科科技有限公司; 高效转染试剂购自倍沃医学科技(Biomiga) 公司; DMEM培养基和胎牛血清(FBS) 购自美国Gibco公司; 天狼星红染色试剂盒和马森三色染色试剂盒均购自索莱宝(Solarbio) 公司。兔抗-SOD1 (superoxide dismutase 1)、IL-1β (interleukin 1 beta)、NLRP3 (NOD-like receptor protein 3) 一抗和鼠抗GAPDH (glyceraldehyde-3-phosphate dehydrogenase) 一抗均购自武汉Abclonal公司; 兔抗-TGF-β (transforming growth factor-beta)、FOXO3a (forkhead box O3a)、β-actin购自美国Proteintech公司; 兔抗-Nrf2 (nuclear factor erythroid 2 related factor 2)、Sirt1 (sirtuin 1)、IL-6和鼠抗-α-SMA (α smooth muscle actin) 一抗均购自美国Affinity Biosciences公司。
实验分组及药物干预 选取健康SPF级8周龄WT小鼠和FGF21 KO小鼠各24只, 适应性喂养1周后各随机分为3组, 每组8只, 分别命名为: 对照组(Ctrl)、模型组(Dox)、依帕列净组(Dox+EMP)、FGF21 KO对照组(F-Ctrl)、FGF21 KO模型组(F-Dox)、FGF21 KO依帕列净组(F-Dox+EMP)。实验开始后, Ctrl组和F-Ctrl组每周腹腔注射一次100 μL磷酸盐缓冲液(PBS), 在第一次注射PBS的前3天开始每天灌胃100 μL PBS; Dox组和F-Dox组腹腔注射剂量为5 mg·kg-1体重的Dox, 每周一次, 连续4周, 每次每只注射体积为100 μL, 在第一次注射Dox的前3天开始每天灌胃100 μL PBS; Dox+EMP组和F-Dox+EMP组腹腔注射剂量为5 mg·kg-1体重的Dox, 每周一次, 连续4周, 每次每只注射体积为100 μL, 在第一次注射Dox的前3天开始每天灌胃剂量为10 mg·kg-1体重的EMP 100 μL至实验结束。随后对所有小鼠进行心脏超声检测, 稳定两天之后处死小鼠收集组织、血清。动物实验如图 1所示。

|
Figure 1 The schedule of in vivo experiment. WT and FGF21 KO mice were randomly divided into 3 groups (8 mice/group), respectively. Ctrl was intraperitoneally injected with PBS once a week and intragastriclly administrated with PBS daily; Dox or Dox + EMP group was intraperitoneally injected with 5 mg·kg-1 body weight Dox once a week and intragastriclly administrated with PBS or 10 mg·kg-1 body weight EMP daily for 4 weeks. WT: Wide type; FGF21 KO: FGF21 knockout; Ctrl: The control group; PBS: Phosphate buffer saline; Dox: Doxorubicin; EMP: Empagliflozin |
小鼠心脏超声 实验期间观察记录小鼠体重和状态。实验结束时, 让小鼠吸入异氟烷进行麻醉, 随后将其胸部脱毛并固定在37 ℃板上, 使用便携式数字化彩色超声诊断仪(苏州VINNO公司, VINNO 6 LAB) 进行超声心动图检测, 在M模式下, 获得小鼠胸骨左侧缘的稳定超声图像。左心室收缩期(LVIDs) 和舒张期内径(LVIDd) 由超声心动图数据获得。射血分数(EF) 和缩短分数(FS) 计算公式如下: EF (%) = [(LVIDd3-LVIDs3)/LVIDd3] × 100; FS (%) = [(LVIDd-LVIDs)/LVIDd] × 100。
H & E染色 取小鼠心脏组织中间部位, 以乳头肌为界限进行横切[20], 用4%多聚甲醛固定24 h以上, 脱水机脱水, 进行石蜡包埋, 制备5 μm石蜡切片。切片烘干之后进行脱蜡水化, 苏木素染色30 s, 伊红染色3 min, 脱水、二甲苯透明, 中性树脂封片。显微镜下观察心脏组织病理学变化并拍照记录。
天狼星红染色 取小鼠心脏组织石蜡切片, 常规脱蜡水化, Weigert铁苏木素染液染色1 min, 自来水洗10 min, 蒸馏水洗一次, 天狼猩红染色液滴染色1 h, 流水稍微清洗去除表面染液, 常规脱水透明, 中性树脂封片。显微镜下观察心脏组织中胶原纤维情况并拍照记录。采用Photoshop统计红色区域面积与总面积的比值, 即为小鼠心脏纤维化程度的统计学结果。
马森染色 取小鼠心脏组织石蜡切片, 常规脱蜡水化, 苏木素染液染色3 min, 然后用马森三色染色液染色, 常规脱水透明, 中性树脂封片。显微镜下观察心脏组织胶原纤维情况并拍照记录。采用Photoshop统计蓝色区域面积与总面积的比值, 即为小鼠心脏纤维化程度的统计学结果。
细胞培养与转染 大鼠心肌细胞H9c2细胞系, 购自ATCC公司, 采用DMEM培养基添加10%胎牛血清和1%双抗, 在37 ℃、5%的CO2培养箱中进行常规培养。待细胞培养至50%汇合度时, 用高效转染试剂转染FGF21 siRNA至H9c2细胞中培养两天。H9c2细胞分组及处理如下: ①对照组(siC-Ctrl): 转染siCtrl; ②模型组(siC-Dox): 转染siCtrl并采用1 μmol·L-1 Dox处理细胞24 h; ③ EMP处理组(siC-Dox + EMP): 转染siCtrl并采用500 nmol·L-1 EMP和1 μmol·L-1 Dox处理细胞24 h; ④ siFGF21 + 对照组(siFGF21-Ctrl): 转染20 nmol·L-1 FGF21的siRNA; ⑤ siFGF21+模型组(siFGF21-Dox): 转染20 nmol·L-1 FGF21的siRNA并采用1 μmol·L-1 Dox处理细胞24 h; ⑥ siFGF21 + EMP处理组(siFGF21-Dox + EMP): 转染20 nmol·L-1 FGF21的siRNA并采用500 nmol·L-1 EMP和1 μmol·L-1 Dox处理细胞24 h。
小鼠血清生化指标检测 实验结束后, 对小鼠进行安乐死, 收集小鼠全血, 于室温静置2 h之后, 2 000 ×g离心20 min, 小心收集上清即为血清, 用生化分析仪(日本东京HITACHI公司, 日立3100) 测量血清中天门冬氨酸氨基转移酶(aspartate amino transferase, AST)、肌酸激酶(creatine kinase, CK)、羟丁酸脱氢酶(hydroxybutyrate dehydrogenase, HBDH)、乳酸盐脱氢酶(lactate dehydrogenase, LDH) 水平, 其余血清于-80 ℃冻存。
Western blot检测目的基因蛋白表达 小鼠心脏组织经处理之后, 加入对应的组织或细胞裂解液, 研磨或摇床冰浴裂解, 收集裂解液, 于4 ℃、12 000 r·min-1离心10 min, 小心收集上清并转移至新的EP管中, 即为组织或细胞总蛋白。BCA法测定蛋白浓度, 蛋白定量和变性之后采用SDS-PAGE变性电泳, 转模、室温封闭、一抗孵育、二抗孵育之后, 经ECL显色, 用化学发光成像分析系统(上海勤翔科学仪器有限公司, ChemiScope 3000mini系列) 进行曝光成像, 并对条带进行分析和处理。
Real time qPCR检测目的基因mRNA表达 小鼠心脏组织或H9c2细胞经处理之后, 提取总RNA, 经反转录合成cDNA, 引物序列如表 1所示。采用SYBR Green Master Mix扩增引物, qRT-PCR检测mRNA表达。将相应样本中所有基因的mRNA水平用内参进行归一化。
| Table 1 Primer sequence used for real-time quantitative PCR: GPX1: Glutathione peroxidase 1; PRDX1: Peroxiredoxin 1; SQSTM1: Sequestosome 1; CAT: Chloramphnicol acetyltransferase; UCP3: Uncouplingprotein 3; SOD1: Superoxide dismutase 1; FABP3: Fatty acid binding protein 3; FGF21: Fibroblast growth factor 21; FOXO3a: Forkhead box O3a; Nrf2: Nuclear factor erythroid 2 related factor 2; NLRP3: NOD-like receptor protein 3; α-SMA: α-Smooth muscle actin; TGF-β: Transforming growth factor-beta; IL-1β: Interleukin 1 beta; β-actin: Beta-actin |
统计学分析 本实验中涉及到的所有数据均采用平均数±标准误形式表示, 采用Graphpad Prism软件进行绘图和统计学分析, 数据分析方式采用单因素方差分析(one-way ANOVA), 将P < 0.05定义为具有显著差异。
结果 1 EMP对小鼠心脏功能的影响Dox引起的心衰主要表现为心脏收缩功能下降。实验结束时, 对图 1所示6组小鼠进行M型超声心动实验, 分析心脏功能。与Ctrl对照组相比, Dox造模组的心脏收缩力明显降低(图 2A), 主要表现为EF和FS的显著降低(图 2B、C)。另外, Dox导致心脏萎缩, 显著降低心脏重量与体重的比值(图 2D)。而在上述指标中, WT小鼠在EMP治疗后具有显著改善, 而在FGF21 KO小鼠中, EMP对于Dox诱导的小鼠心衰症状的改善作用大大降低。以上结果提示, EMP对于Dox诱导的小鼠心衰具有较为明显的改善作用, 并且在一定程度上依赖于FGF21的存在。

|
Figure 2 Cardiac function was analyzed by M-echocardiography. A: Echocardiogram image; B: Ejection fraction of mice; C: Fractional shortening of mice; D: Heart weight and body weight ratio of mice. n ≥ 5, mean ± SEM. **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs Ctrl group in the indicated type of mice; #P < 0.05, ##P < 0.01, ###P < 0.001 vs Dox group in the indicated type of mice; $P < 0.05, $$$P < 0.001 vs Dox + EMP group in WT mice |
图 3A中H & E染色结果显示, 与Ctrl对照组相比, WT小鼠和FGF21 KO小鼠的Dox造模组心脏出现明显的坏死症状, 心肌细胞排列和心肌结构不规则、出现空泡化。相比之下, WT小鼠经EMP处理之后上述症状得到明显改善, 而在FGF21 KO小鼠中则变化不大。同时, 血清生化分析结果显示, Dox造模后, 心肌酶AST、CK、HBDH、LDH (图 3B~E) 含量显著升高, 经EMP处理后, WT小鼠中上述指标显著下调, 而在FGF21 KO小鼠中没有明显改变。以上结果提示: EMP改善Dox诱导的小鼠心脏毒性与FGF21有关。

|
Figure 3 Effect of EMP on Dox induced cardiotoxicity in mice. A: H & E staining of mice heart tissue. Scale bar: 50 μm; B-E: Mice serum were prepared and determined AST (B), CK (C), HBDH (D) and LDH (E) levels. n ≥ 5, mean ± SEM. **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs Ctrl group in the indicated type of mice; ###P < 0.001, ####P < 0.000 1 vs Dox group in the indicated type of mice; $P < 0.05, $$P < 0.01 vs Dox + EMP group in WT mice. AST: Aspartate amino transferase; CK: Creatine kinase; HBDH: Hydroxybutyrate dehydrogenase; LDH: Lactate dehydrogenase |
通过马森染色和天狼星红染色观察EMP对Dox诱导的小鼠心脏纤维化的影响。如图 4A、B所示, 与Ctrl相比, Dox造模组心肌细胞排列不规则, 出现严重的胶原沉积和纤维化。在WT小鼠中, EMP治疗后上述纤维化程度得到明显改善, 而在FGF21 KO小鼠中改善的程度大大降低。对两种染色结果进行统计学分析, 结果显示上述差异均具有显著性。为了探究EMP能否抑制Dox诱导的小鼠心肌炎症, 进一步检测了心脏IL-1β、IL-6、NLRP3蛋白的表达水平, 如图 4C所示, 与Ctrl组相比, Dox造模组IL-1β、IL-6、NLRP3蛋白水平显著上调, EMP处理显著降低WT小鼠的炎症蛋白表达, 而对FGF21 KO小鼠没有显著影响, 且FGF21 KO小鼠的整体炎症水平表现出明显上调。此外, 检测小鼠心脏组织中纤维化的标志蛋白TGF-β和α-SMA, 同样得到与上述一致的趋势。以上结果提示, EMP改善Dox诱导的小鼠心肌纤维化和炎症与FGF21有关。
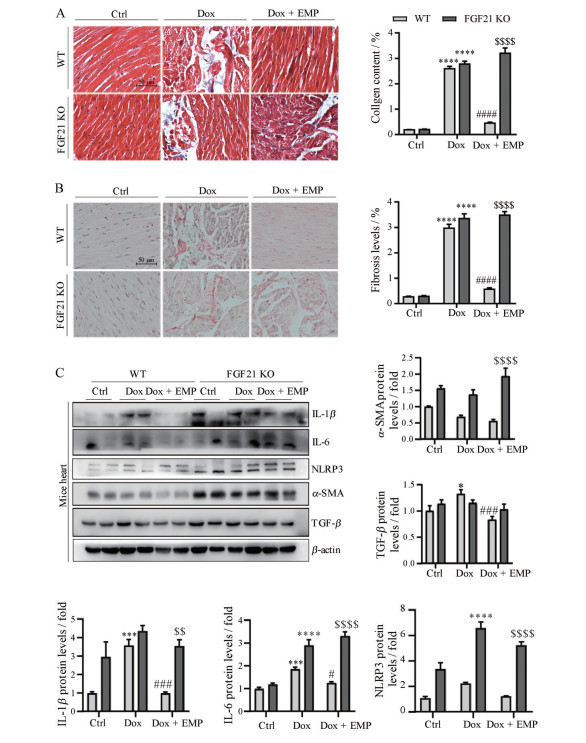
|
Figure 4 EMP improved Dox induced cardiac fibrosis and inflammation in mice. A: Determination of collagen content in heart tissue by Masson staining (left) and relative statistics (right); Scale bar: 50 μm; B: The degree of fibrosis in heart tissue was determined by Picrosirius Red staining (left) and relative statistics (right); Scale bar: 50 μm; C: Expression levels of IL-1β, IL-6, NLRP3, TGF-β and α-SMA in mice heart were analyzed by Western blot and statistic. n ≥ 5, mean ± SEM. *P < 0.05, ***P < 0.001, ****P < 0.000 1 vs Ctrl group in the indicated type of mice; #P < 0.05, ###P < 0.001, ####P < 0.000 1 vs Dox group in the indicated type of mice; $$P < 0.01, $$$$P < 0.000 1 vs Dox + EMP group in WT mice |
本文还探究了FGF21在EMP抗心脏氧化应激中的作用, 采用Western blot检测了氧化应激相关蛋白Sirt1、FOXO3a、Nrf2和SOD1的表达情况。图 5A结果显示, Dox诱导WT小鼠和FGF21 KO小鼠心脏氧化应激反应, 而EMP的治疗显著改善WT小鼠心脏氧化应激, 但是在FGF21 KO小鼠中改善作用大大减弱。同时, 本研究采用Real time qPCR方法对相关氧化应激基因的mRNA水平进行检测, 如图 5B所示, WT小鼠在经过EMP治疗后, CAT、FABP3、GPX1、PRDX1、SOD1、SQSTM1、UCP3等抗氧化基因显著上调, FGF21 KO小鼠中相关抗氧化基因与造模组相比均无统计学意义, 有的甚至呈下调趋势。以上结果提示, EMP改善Dox诱导的小鼠氧化应激反应依赖于FGF21。
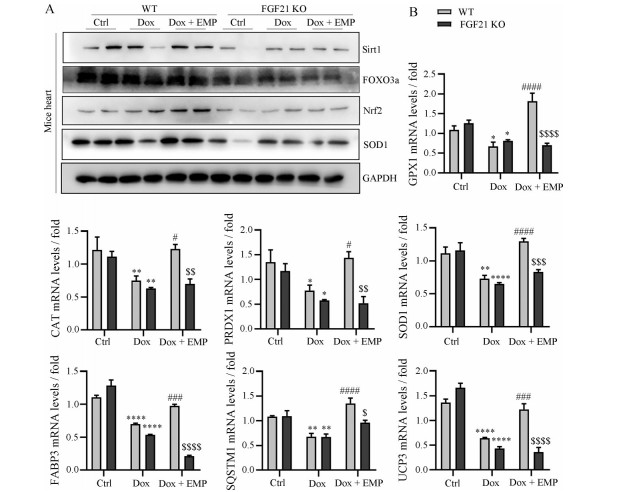
|
Figure 5 EMP improved Dox induced oxidative stress in mice. A: Expression levels of Sirt1, FOXO3a, Nrf2 and SOD1 in mice heart were analyzed by Western blot; B: Expression levels of GPX1, CAT, PRDX1, SOD1, FABP3, SQSTM1 and UCP3 in mice heart were analyzed by real time qPCR. n ≥ 5, mean ± SEM. *P < 0.05, **P < 0.01, ****P < 0.000 1 vs Ctrl group in the indicated type of mice; #P < 0.05, ###P < 0.001, ####P < 0.000 1 vs Dox group in the indicated type of mice; $P < 0.05, $$P < 0.01, $$$P < 0.001, $$$$P < 0.000 1 vs Dox + EMP group in WT mice |
为了探讨EMP是否能直接影响FGF21的表达, 本研究采用H9c2转染FGF21的siRNA (si-FGF21)。首先如图 6A所示, si-FGF21转染后显著抑制H9c2细胞中FGF21表达, 证明敲减成功。对H9c2细胞采用Dox和EMP处理, 并分别转染对照si-Ctrl和抑制FGF21表达的si-FGF21, 采用Real time qPCR检测氧化应激(SOD1、FOXO3a、Nrf2)、炎症(NLRP3、IL-1β)、纤维化(α-SMA、TGF-β) 相关基因表达, 结果显示, 在转染si-Ctrl时, EMP显著改善Dox诱导的H9c2细胞氧化应激、炎症和纤维化基因表达, 但是在转染si-FGF21组上述改善作用大大降低甚至消失, 与体内结果一致。以上结果表明, EMP能够拮抗Dox对FGF21表达的抑制作用, 同时EMP改善Dox诱导的心衰相关氧化应激、炎症、纤维化依赖于FGF21。
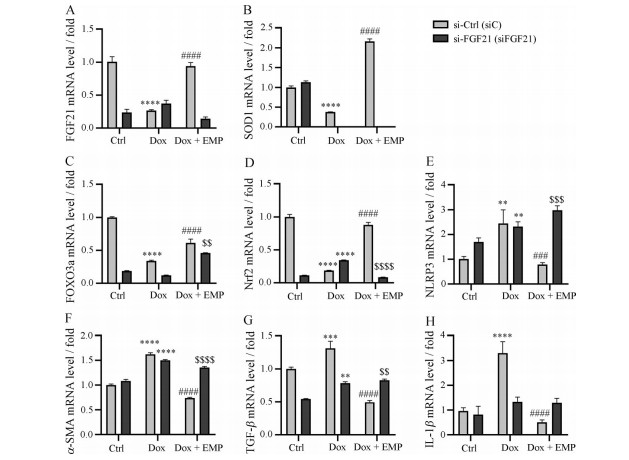
|
Figure 6 EMP improves Dox induced H9c2 heart failure related gene expression in an FGF21 dependent manner. A-H: Expression levels of FGF21, SOD1, FOXO3a, Nrf2, NLRP3, α-SMA, TGF-β and IL-1β in H9c2 were analysed by real time qPCR. n ≥ 5, mean ± SEM. **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs Ctrl group in the indicated type of H9c2 cells; ###P < 0.001, ####P < 0.000 1 vs siC-Dox group in the indicated type of H9c2 cells; $$P < 0.01, $$$P < 0.001, $$$$P < 0.000 1 vs siC-Dox + EMP group |
上述实验结果表明, 在野生型小鼠中, EMP通过FGF21抑制Dox诱导的心衰, 具体机制在于抑制炎症、纤维化、氧化应激反应, 而在FGF21敲除小鼠中, 由于FGF21表达缺失, 导致EMP通过FGF21发挥抗炎、抗纤维化、抗氧化应激的作用大打折扣, 因此对于Dox诱导的心衰的改善效果显著减弱。
心衰是多种心脏疾病的终末阶段, 伴随着心脏功能的严重下降, 并涉及多种临床表现, 如呼吸困难、关节水肿、乏力等。同时, 心衰还可引起肺破裂、颈动脉高压[21]等, 具有较高的发病率和死亡率。心衰的发生与多种因素有关, 其中, 糖尿病引起的血管病变、进而导致的动脉粥样硬化、冠心病等心血管疾病, 是心衰发生的一个重要病理基础, 与此同时, 糖尿病、血管功能障碍、心衰三者之间存在着恶性循环, 每一种疾病均可能引发或加剧其他疾病的发生[22]。
依帕列净是钠-葡萄糖共转运蛋白2抑制剂(SGLT2i), 是一类新型的2型糖尿病的治疗药物, 能够发挥降血糖的作用, 在其治疗2型糖尿病的过程中发现, SGLT2i具有降低心衰发病率和死亡率的作用, 而依帕列净相较于其他SLGT2i能够更加显著地降低心衰患者的住院率, 但机制尚未明确。有文献报道, SGLT2i可能通过激活Sirt1/PGC-1α/FGF21通路, 减轻心衰相关的氧化应激和自噬, 同时增加红细胞比容、降低尿酸水平进而发挥心脏保护作用[23]; 另有研究表明, 依帕列净通过激活AMPK改善能量消耗和心脏炎症[24]; 在糖尿病小鼠中, 依帕列净通过抑制TGFβ/Smad通路、激活Nrf2/ARE通路, 增强心肌功能, 降低心脏氧化应激和纤维化[25]。FGF21是一种由多种组织包括肝脏、脂肪组织[26]、肌肉[27]、心脏[28]等分泌的细胞因子, 通过与其受体及β-Klotho形成复合物发挥功能[29]。越来越多的研究证实了FGF21在心脏功能中的保护作用, 如FGF21能够通过发挥抗氧化作用进而保护氧化应激造成的心脏损伤[30], FGF21通过抑制NF-κB及p38/MAPK/AMPK通路改善炎症和细胞凋亡[31]等。而依帕列净对于心衰的治疗作用是否与FGF21有关还不得而知。因此本研究旨在探究FGF21是否为依帕列净改善心衰作用的一个关键因子。
本研究在体内采用多柔比星诱导的小鼠心衰模型作为研究对象。多柔比星是临床上广泛用于实体肿瘤和急性白血病治疗的一种化疗药物[32], 在抗肿瘤功能上功效显著, 然而多柔比星对于肝脏、肾脏及心脏的毒性作用却大大限制了其使用[33]。多柔比星能够通过产生大量活性氧进而引起氧化应激反应, 从而引起心肌细胞的大量凋亡, 并强烈激活心脏的炎症反应。本研究构建了FGF21 KO小鼠和WT小鼠一起采用多柔比星诱导心衰模型, 并给予依帕列净治疗, 结果表明多柔比星在两种基因型小鼠中均产生典型的心衰症状, 在WT小鼠中, 依帕列净显著改善多柔比星诱导的小鼠心衰(图 2), 而在FGF21 KO小鼠中, 依帕列净改善多柔比星诱导的小鼠心衰的功能被明显抑制。同时, 在大鼠心肌细胞系H9c2中采用抑制FGF21表达的siRNA转染、多柔比星和依帕列净处理, 同样得到与小鼠实验一致的结论。由此可见, 依帕列净改善心衰在一定程度上依赖于FGF21的表达。
多柔比星诱导的心衰伴随着心脏纤维化、炎症和氧化应激反应的出现, 本研究结果表明, 依帕列净对多柔比星引起的心脏纤维化(图 4A~C)、炎症反应(图 4C)、氧化应激反应(图 5) 均具有显著的抑制效果, 然而, 在FGF21 KO小鼠中, 依帕列净对上述反应的抑制效果大大削弱, 表明依帕列净改善心脏纤维化、炎症和氧化应激反应同样依赖于FGF21的表达。
综上所述, 依帕列净能够拮抗多柔比星对心脏FGF21表达的抑制作用, 改善多柔比星诱导的小鼠心衰并在一定程度上依赖于FGF21的表达, 其机制可能与FGF21改善小鼠心脏纤维化、炎症和氧化应激反应, 进而改善心脏功能有关。此外, 依帕列净如何调节心脏FGF21及其在上述过程中发挥作用的具体通路, 均有待进一步进行探索和验证。
作者贡献: 王垣钰负责查阅文献设计实验方案; 张梦雪负责文献查阅、实验操作、数据分析及文章撰写; 段亚君和张爽负责实验方案设计和指导论文写作及修改。
利益冲突: 所有作者声明无任何利益冲突。
| [1] |
Balan I, Khayo T, Sultanova S, et al. Overview of sodium-glucose co-transporter 2 (SGLT2) inhibitors for the treatment of non-diabetic heart failure patients[J]. Cureus, 2021, 13: e17118. |
| [2] |
Khatiwada S, Boro H, Farooqui FA, et al. Endocrine causes of heart failure: a clinical primer for cardiologists[J]. Indian Heart J, 2021, 73: 14-21. DOI:10.1016/j.ihj.2020.11.003 |
| [3] |
Wang X, Hao G, Chen L, et al. Heart failure and left ventricular dysfunction in older patients with chronic kidney disease: the China Hypertension Survey (2012-2015)[J]. J Geriatr Cardiol, 2020, 17: 597-603. |
| [4] |
Hao G, Wang X, Chen Z, et al. Prevalence of heart failure and left ventricular dysfunction in China: the China Hypertension Survey, 2012-2015[J]. Eur J Heart Fail, 2019, 21: 1329-1337. DOI:10.1002/ejhf.1629 |
| [5] |
Jorsal A, Pryds K, McMurray JJV, et al. Optimizing heart failure treatment following cardiac resynchronization therapy[J]. Clin Res Cardiol, 2020, 109: 638-645. DOI:10.1007/s00392-019-01553-4 |
| [6] |
Yang H, Feng A, Lin S, et al. Fibroblast growth factor-21 prevents diabetic cardiomyopathy via AMPK-mediated antioxidation and lipid-lowering effects in the heart[J]. Cell Death Dis, 2018, 9: 227. DOI:10.1038/s41419-018-0307-5 |
| [7] |
Phan P, Saikia BB, Sonnaila S, et al. The saga of endocrine FGFs[J]. Cells, 2021, 10: 2418. DOI:10.3390/cells10092418 |
| [8] |
Tanajak P, Sa-Nguanmoo P, Wang X, et al. Fibroblast growth factor 21 (FGF21) therapy attenuates left ventricular dysfunction and metabolic disturbance by improving FGF21 sensitivity, cardiac mitochondrial redox homoeostasis and structural changes in pre-diabetic rats[J]. Acta Physiol, 2016, 217: 287-299. DOI:10.1111/apha.12698 |
| [9] |
Keipert S, Ost M. Stress-induced FGF21 and GDF15 in obesity and obesity resistance[J]. Trends Endocrinol Metab, 2021, 32: 904-915. DOI:10.1016/j.tem.2021.08.008 |
| [10] |
Eder K, Gessner DK, Ringseis R. Fibroblast growth factor 21 in dairy cows: current knowledge and potential relevance[J]. J Anim Sci Biotechnol, 2021, 12: 97. DOI:10.1186/s40104-021-00621-y |
| [11] |
Chou RH, Huang PH, Hsu CY, et al. Circulating fibroblast growth factor 21 is associated with diastolic dysfunction in heart failure patients with preserved ejection fraction[J]. Sci Rep, 2016, 6: 33953. DOI:10.1038/srep33953 |
| [12] |
Planavila A, Redondo I, Hondares E, et al. Fibroblast growth factor 21 protects against cardiac hypertrophy in mice[J]. Nat Commun, 2013, 4: 2019. DOI:10.1038/ncomms3019 |
| [13] |
Liu SQ, Roberts D, Kharitonenkov A, et al. Endocrine protection of ischemic myocardium by FGF21 from the liver and adipose tissue[J]. Sci Rep, 2013, 3: 2767. DOI:10.1038/srep02767 |
| [14] |
Cong WT, Ling J, Tian HS, et al. Proteomic study on the protective mechanism of fibroblast growth factor 21 to ischemia-reperfusion injury[J]. Can J Physiol Pharmacol, 2013, 91: 973-984. DOI:10.1139/cjpp-2012-0441 |
| [15] |
Oh CM, Cho S, Jang JY, et al. Cardioprotective potential of an SGLT2 inhibitor against doxorubicin-induced heart failure[J]. Korean Circ J, 2019, 49: 1183-1195. DOI:10.4070/kcj.2019.0180 |
| [16] |
Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030[J]. Diabetes Res Clin Pract, 2010, 87: 4-14. DOI:10.1016/j.diabres.2009.10.007 |
| [17] |
Zhang J, Cheng Y, Gu J, et al. Fenofibrate increases cardiac autophagy via FGF21/SIRT1 and prevents fibrosis and inflammation in the hearts of type 1 diabetic mice[J]. Clin Sci (Lond), 2016, 130: 625-641. DOI:10.1042/CS20150623 |
| [18] |
Rubler S, Dlugash J, Yuceoglu YZ, et al. New type of cardiomyopathy associated with diabetic glomerulosclerosis[J]. Am J Cardiol, 1972, 30: 595-602. DOI:10.1016/0002-9149(72)90595-4 |
| [19] |
Jarcho JA. More evidence for SGLT2 inhibitors in heart failure[J]. N Engl J Med, 2020, 383: 1481-1482. DOI:10.1056/NEJMe2027915 |
| [20] |
Dong X, Wen RJ, Chen ZX, et al. Effect of Nuanxinkang on cardiomyocyte apoptosis in myocardial ischemia reperfusion model mice[J]. J Tradit Chin Med (中医杂志), 2021, 62: 1622-1627. |
| [21] |
Metra M, Teerlink JR. Heart failure[J]. Lancet, 2017, 390: 1981-1995. DOI:10.1016/S0140-6736(17)31071-1 |
| [22] |
Braunwald E. Diabetes, heart failure, and renal dysfunction: the vicious circles[J]. Prog Cardiovasc Dis, 2019, 62: 298-302. DOI:10.1016/j.pcad.2019.07.003 |
| [23] |
Packer M. Cardioprotective effects of sirtuin-1 and its downstream effectors: potential role in mediating the heart failure benefits of SGLT2 (sodium-glucose cotransporter 2) inhibitors[J]. Circ Heart Fail, 2020, 13: e007197. DOI:10.1161/CIRCHEARTFAILURE.120.007197 |
| [24] |
Koyani CN, Plastira I, Sourij H, et al. Empagliflozin protects heart from inflammation and energy depletion via AMPK activation[J]. Pharmacol Res, 2020, 158: 104870. DOI:10.1016/j.phrs.2020.104870 |
| [25] |
Li C, Zhang J, Xue M, et al. SGLT2 inhibition with empagliflozin attenuates myocardial oxidative stress and fibrosis in diabetic mice heart[J]. Cardiovasc Diabetol, 2019, 18: 15. DOI:10.1186/s12933-019-0816-2 |
| [26] |
Ito S, Kinoshita S, Shiraishi N, et al. Molecular cloning and expression analyses of mouse betaklotho, which encodes a novel Klotho family protein[J]. Mech Dev, 2000, 98: 115-119. DOI:10.1016/S0925-4773(00)00439-1 |
| [27] |
Joki Y, Ohashi K, Yuasa D, et al. FGF21 attenuates pathological myocardial remodeling following myocardial infarction through the adiponectin-dependent mechanism[J]. Biochem Biophys Res Commun, 2015, 459: 124-130. DOI:10.1016/j.bbrc.2015.02.081 |
| [28] |
Nishimura T, Nakatake Y, Konishi M, et al. Identification of a novel FGF, FGF-21, preferentially expressed in the liver[J]. Biochim Biophys Acta, 2000, 1492: 203-206. DOI:10.1016/S0167-4781(00)00067-1 |
| [29] |
Kharitonenkov A, Dunbar JD, Bina HA, et al. FGF-21/FGF-21 receptor interaction and activation is determined by betaKlotho[J]. J Cell Physiol, 2008, 215: 1-7. DOI:10.1002/jcp.21357 |
| [30] |
Planavila A, Redondo-Angulo I, Ribas F, et al. Fibroblast growth factor 21 protects the heart from oxidative stress[J]. Cardiovasc Res, 2015, 106: 19-31. DOI:10.1093/cvr/cvu263 |
| [31] |
Planavila A, Redondo-Angulo I, Villarroya F. FGF21 and cardiac physiopathology[J]. Front Endocrinol, 2015, 6: 133. |
| [32] |
Arcamone F, Cassinelli G, Fantini G, et al. Adriamycin, 14-hydroxydaunomycin, a new antitumor antibiotic from S. peucetius var. caesius. Reprinted from Biotechnology and Bioengineering, Vol. XI, Issue 6, Pages 1101-1110 (1969)[J]. Biotechnol Bioeng, 2000, 67: 704-713. DOI:10.1002/(SICI)1097-0290(20000320)67:6<704::AID-BIT8>3.0.CO;2-L |
| [33] |
Thorn CF, Oshiro C, Marsh S, et al. Doxorubicin pathways: pharmacodynamics and adverse effects[J]. Pharmacogenet Genomics, 2011, 21: 440-446. DOI:10.1097/FPC.0b013e32833ffb56 |
 2022, Vol. 57
2022, Vol. 57


