2. 暨南大学药学院, 中药及天然药物研究所, 广东 广州 510632;
3. 暨南大学, 广东省中药药效物质基础及创新药物研究重点实验室, 广东 广州 510632;
4. 新疆医科大学中医学院, 新疆 乌鲁木齐 830054;
5. 广州中医药大学第一附属医院, 广东 广州 510405
2. Institute of Traditional Chinese Medicine and Natural Products, College of Pharmacy, Jinan University, Guangzhou 510632, China;
3. Guangdong Provincial Key Laboratory of Pharmacodynamic Substances of Traditional Chinese Medicine and Innovative Drugs, Jinan University, Guangzhou 510632, China;
4. Institute of Traditional Chinese Medicine, Xinjiang Medical University, Urumqi 830054, China;
5. The First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510405, China
冠心病是一种因冠状动脉粥样硬化病变引发血管腔狭窄或堵塞, 导致心肌缺血、缺氧为主要临床表现的一类心脏病, 是高发病率和高致死率的疾病之一。到2020年, 我国冠心病患者已高达1 139万人[1]。目前, 临床针对冠心病的治疗主要包括药物治疗和必要时采取介入治疗。虽然这样的治疗策略可以延缓疾病进程, 却无法挽救已经坏死的心肌组织和恢复血液灌流后对心肌造成的二次再灌注损伤。因此, 对该疾病二级危险因素的早期预防则尤为重要。近年来, 围绕对冠心病二级预防的研究发现, 80%的冠心病患者可以通过调整饮食、增强运动和改善体重指数延缓发病进程[2]。
脂肪、糖类、蛋白质是机体的三大营养物质, 其中脂肪可为维持心脏的正常功能提供约60%的能量[3]。随着研究的深入, 采用多不饱和脂肪酸(polyunsaturated fatty acid, PUFA) 代替部分饮食饱和脂肪酸(saturated fatty acid, SFA) 的代替疗法被广泛关注。有研究表明, PUFA可作一种营养补剂与他汀类药物共同作用, 通过调节血糖、血压和胰岛素分泌, 来降低冠心病患病风险[4]。亚油酸(linoleic acid, LA) 是一种由18个碳原子组成, 含有2个不饱和双键的PUFA, 广泛存在于芝麻油、花生油及橄榄油中, 是日常饮食摄入最多的PUFA之一[5]。LA因具有协助胆固醇转运代谢的功能, 可降低血清中低密度脂蛋白水平从而减缓动脉粥样硬化发展, 被膳食指南推荐可以代替SFA, 以降低冠心病风险[6]。因LA生物化学性质的特点, 有研究认为LA虽然可以在β-氧化中作为提供能量的底物, 但在体内丰富的酶促系统下也可以代谢产生前列腺素、白三烯等诱导炎症的发生[7]。此外, PUFA作为膜磷脂的重要组成成分, 在维持膜的流动性上具有重要意义, 但因其含有不饱和键的结构特点, 使细胞膜具有较大的氧化风险[8]。有大量研究显示, LA摄入过量会导致氧化应激、肥胖和炎症等, 加剧冠心病的发病进程[9]。但是, LA对冠心病病理机制的具体作用仍不明确。
综上所述, 本研究通过建立LA负荷急性心肌缺血的动物模型, 采用磷脂质组学分析和Western blot等技术, 对LA增加心肌缺血损伤“易感性”的具体病理机制进行深入研究, 旨在为PUFA代替疗法预防冠心病的策略是否具有可行性提供实验依据, 更为早期冠心病治疗提供干预靶标。
材料与方法药品与试剂 亚油酸(L-100442) 购自于上海阿拉丁生化科技有限公司; 异丙肾上腺素(isoprenaline hydrochloride, ISO) (HY-B0468-1G) 购自于MedChemExpress公司; BCA蛋白定量试剂盒(23225) 购自于美国Thermo Fisher Scientific公司; 花生四烯酸12/15-脂氧合酶(arachidonic acid 12/15-lipoxygenase, ALOX15) 抗体(ab244205) 和4-羟基壬烯醛(4-hydroxynonenal, 4-HNE) 抗体(ab46545) 购自于英国Abcam公司; GAPDH (FD0068)、辣根酶标记山羊抗兔IgG (FDR007)、辣根酶标记山羊抗小鼠IgG (FDM007) 和蛋白5×loading buffer (FD002) 均购自于杭州弗德生物科技有限公司; RIPA裂解液(P0013C) 和丙二醛(malondialdehyde, MDA) 检测试剂盒(S0131S) 购自于上海碧云天生物技术有限公司; 还原型辅酶Ⅱ (nicotinamide adenine dinucleotide phosphate, NADPH) 含量试剂盒(NADP-1-Y) 购自于苏州科铭生物技术有限公司; 谷胱甘肽(glutathione, GSH) 测定试剂盒(A006-2-1) 购自于南京建成生物科技公司; 氯仿(3084) 购自于天津大茂化学试剂厂; 甲醇(67-56-1) 购自于广东光华科技有限公司; Na2MoO4·2H2O (M1003)、抗坏血酸(A5960) 和磷酸二氢钠(S8282) 均购自于美国Sigma Aldrich公司。
实验仪器 全自动快速研磨仪(JXFSTPRP-24, 上海净信科技公司); 高速冷冻离心机(D-16C, Satorius公司); 多功能酶标仪(MK-3, Labsystem公司); 垂直电泳仪(DYCZ-25E, 北京六一生物科技公司); 全自动化学发光成像分析系统(Tanon 5200, 上海天能科技有限公司); 全自动生化分析仪(BK-400, Biobase博科公司); 超高频高分辨小动物超声影像系统(Vevo 2100, Visualsonics公司); 双三元高效液相色谱仪(DGLC)、四极杆轨道阱高分辨质谱仪(Q-Exactive) 均购自赛默飞公司。
实验动物 7~8周龄雄性昆明小鼠, 购自南方医科大学实验动物管理中心, 许可证编号SCXK (粤) 2021-0041。饲养于SPF级实验动物中心, 饲养条件保持(22 ± 2) ℃, 相对湿度(50% ± 10%), 12 h/12 h明暗交替, 自由饮食摄水。实验方案及程序均符合动物使用和护理的伦理原则, 并已获暨南大学动物实验伦理委员会批准。
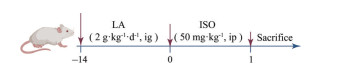
动物模型的建立及分组 根据世界卫生组织发布的膳食指南[10], 每60 kg人体, 每日所需2 000千卡热量中的50%来源于脂肪计算得出, 需摄入脂肪为2 g·kg-1。本实验在基础饲料之上, 采用2 g·kg-1 LA灌胃14天作为主要脂肪摄入来源; 采用50 mg·kg-1 ISO腹腔注射24 h以诱导急性心肌缺血[11]。基于模型建立的方案如图 1所示, 将小鼠随机分为正常对照组(Cont)、亚油酸组(LA)、异丙肾上腺素组(ISO) 和亚油酸负荷异丙肾上腺素组(LA + ISO) 组。
|
Figure 1 Experimental scheme of ischemia animal model in excessive intake linoleic acid mice. LA: Linoleic acid; ISO: Isoprenaline; ig: Intragastrical; ip: Intraperitoneal |
超声心动图检测 采用1.5%异氟烷气体麻醉机麻醉小鼠后, 给胸腔处脱毛, 仰卧位固定于鼠板上, 在脱毛处涂抹医用耦合剂, 使用MS250小鼠电子线阵探头在13~24 Mhz条件下进行超声心动图检测, 采集3个以上心动周期并求取平均值。
血清心肌酶检测 采用摘眼球取血后, 室温静置30 min, 3 500 ×g离心15 min收集上清, 采用全自动生化仪对心肌酶天门冬氨酸转移酶(aspaetate aminotransferase, AST)、肌酸激酶同工酶(creatine kinase isoenzyme, CK-MB) 和乳酸脱氢酶(lactate dehydrogenase, LDH) 进行检测。
磷脂组学检测 将心肌组织置于0.75% KCl中采用超声匀浆破碎, 随后在样品匀浆液中加入约5 mL氯仿-甲醇(2∶1) 混合液, 置于冰上涡旋萃取。静置1 h后, 采用氯仿-甲醇混合液浸润过的滤纸过滤萃取液。用氮气将萃取液吹干后, 采用200 μL甲醇复溶吹干的样品, 取适量的复溶液用于测定磷含量, 并根据标准曲线计算出样品中的总磷量。最后制备成磷量为20 nmol的40 μL样品放入液相瓶中进行LC-MS/MS分析。
磷脂过氧化相关检测 分别称取小鼠心脏组织约20 mg, 按照试剂盒说明书对小鼠心脏组织中NADPH含量、GSH含量、MDA含量进行测定。
蛋白免疫印迹检测 将约15 mg心肌组织按比例加入RIPA裂解液提取组织总蛋白, 通过BCA法测定蛋白浓度。随后加入5×上样缓冲液混匀, 置于金属浴100 ℃加热10 min使蛋白变性。吸取20 μg蛋白样品上样, 进行SDS-PAGE电泳, 湿法转膜70 min。5%脱脂牛奶封闭1.5 h, 4 ℃条件下一抗孵育过夜, 洗膜, 室温条件下二抗孵育2 h。洗膜后, ECL化学发光工作液用于显色, 全自动化学发光成像系统用于显影, 采用Image J软件对结果进行分析。
统计学分析 采用GraphPad Prism对实验数据进行绘图, 实验数据均以平均值±标准差(
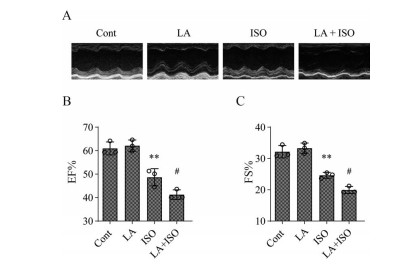
模型建立24 h后, 采集小鼠的超声心动图进行分析。图 2A是小鼠超声心动图的代表性图, 从图中可见, 与正常组相比, LA组无显著改变, ISO组与LA + ISO组的左心室腔扩大、室壁变薄、心室的运动幅度减低。与ISO组相比, LA + ISO的变化更明显。通过左心室后壁舒张末厚度(LVPW; d)、左心室后壁收缩末厚度(LVPW; s)、左心室舒张末内径(LVID; d) 和左心室收缩末期内径(LVID; s) 等参数可计算出左心室射血分数(EF%) 和左心室缩短分数(FS%)。结果如图 2B、C所示, 与正常组相比, ISO组与LA + ISO组的EF%与FS%均显著降低, 且LA + ISO组的变化相较于ISO组更为显著。
|
Figure 2 Effects of LA on echocardiography in myocardial ischemia mice. The representative echocardiography images (A), the left ventricular ejection fraction (EF%, B), and the left ventricular shortening fraction (FS%, C) for the 4 groups of mice. n = 3, |
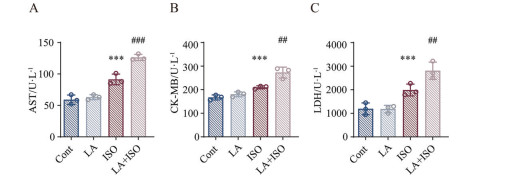
血清心肌酶检测是评价急性心肌损伤的关键指标, 主要包括AST、CK-MB和LDH等。图 3A~C中的结果显示, 与正常组相比, LA组无显著改变, ISO组与LA + ISO组的AST、CK-MB和LDH含量均有显著增加。与ISO组相比, LA + ISO组的AST、CK-MB和LDH含量的变化更为显著。结合图 2、3数据提示, 单纯LA摄入过量不会引发心肌损伤, 但当腹腔注射ISO引发心肌缺血损伤时, LA摄入过量的小鼠心肌损伤更为严重。
|
Figure 3 Effects of LA on serum myocardial enzymes in myocardial ischemia mice, the content of AST (A), CK-MB (B) and LDH (C). n = 3, |
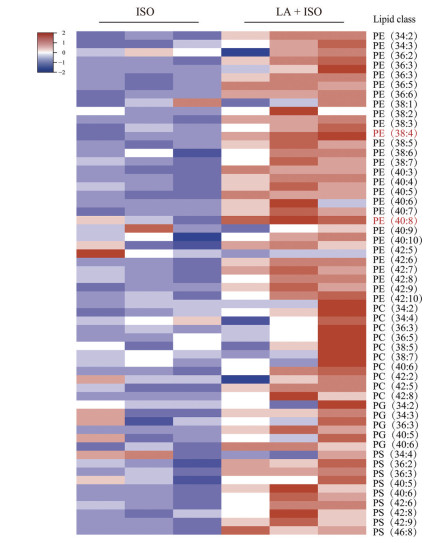
上述图 2、3的结果提示, LA摄入过量可增加对缺血损伤的“易感性”。为了探索LA摄入对心肌组织的磷脂组成影响, 采用本课题组成熟的LC-MS/MS磷脂组学进行分析, 结果显示: 与ISO组相比, LA + ISO组小鼠心肌组织中不同类型的磷脂含量均有所增加, 包括磷脂酰乙醇胺(phosphatidylethanolamine, PE) 27种、磷脂酰胆碱(phosphatidylcholine, PC) 19种、磷脂酰丝氨酸(phosphatidylserine, PS) 9种和磷脂酰甘油(phosphatidyl glycerol, PG) 5种。以PE类型的含不饱和双键的脂肪酸侧链含量最为丰富, 其中PE (38∶4) 和PE (40∶8) 增加最为显著(图 4)。
|
Figure 4 Effects of LA on ischemic myocardial lipid composition. The differential cluster analysis heatmap showed the level of lipid composition in ISO and LA + ISO groups. PC: Phosphatidylcholine; PE: Phosphatidylethanolamine; PS: Phosphatidylserine; PG: Phosphatidyl glycerol |
PE作为小鼠心脏中含量丰富的一种磷脂成分, 因其含有不饱和键的结构特点, 也是自由基和多种氧化酶的作用目标[12]。PE经酶促或非酶促反应可产生氧化型磷脂酰乙醇胺(oxidized phosphatidylethanolamine, ox-PE), 通过信号通路传导可加速细胞损伤[13]。对磷脂组学进行进一步分析发现, 与ISO组相比, LA + ISO组的心肌组织中PE (36∶3) + 1O、PE (40∶8) + 1O等ox-PE的含量显著增加(图 5)。
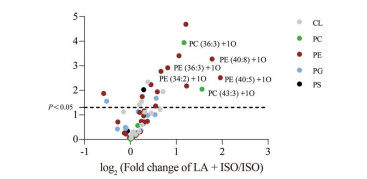
|
Figure 5 Effects of LA on ischemic myocardial oxidized phospholipids. The value of log2 (fold change) > 1 and P < 0.05 was set as the thresholds between the ISO and LA + ISO group. CL: Cardiolipin |
PE过氧化是一种包括起始、传播和终止3个阶段的复杂链式反应, 在这个过程中GSH耗竭和NADPH降低是引发PE过氧化的关键诱因, MDA是PE过氧化后的氧化产物之一[14]。由此, 本实验采用NADPH、GSH和MDA含量测定以明确PE过氧化的情况。结果如图 6A~C所示, 与正常组相比, LA组无显著改变, ISO组与LA + ISO组的NADPH和GSH显著降低, MDA含量显著增加。与ISO组相比, LA + ISO的变化更为显著。结合图 5、6的数据说明, ox-PE可能是LA摄入过量引发心肌缺血损伤“易感性”增加的关键信号。
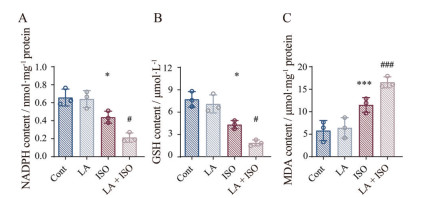
|
Figure 6 Effects of LA on the relative parameters of oxidized PE in ischemic myocardial mice, the content of NADPH (A), GSH (B) and MDA (C). n = 3, |
ALOX15是一种非血红素含铁双加氧酶, 可催化多不饱和脂肪酸双加氧生成相应的过氧化衍生物[15]。有研究表明, ALOX15通过被铆钉定于细胞膜上参与膜PE的氧化产生磷脂酰乙醇胺氢过氧化物(phosphatidylethanolamines hydroperoxides, PE-OOH), 最终产生末端产物4-HNE, 诱导细胞膜破裂损伤[16]。图 7结果表明, ISO与LA + ISO组ALOX15的蛋白表达显著增加。此外, 与ISO组相比, LA + ISO组4-HNE的蛋白表达均显著增加。综合图 5~7的结果提示, ALOX15介导的PE过氧化可能是LA摄入过多引发心肌缺损伤“易感性”增加的关键靶标。
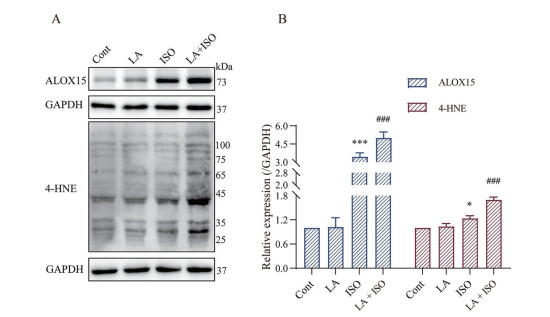
|
Figure 7 Effects of LA on the phosphatidylethanolamine peroxidation-related proteins expression. The protein expressions for ALOX15 and 4-HNE were determined by Western blot (A) and their statistical analysis (B). n = 3, |
脂质代谢异常是引发冠心病的风险因素之一[17]。早在20世纪50年代就有研究者认为, 饱和脂肪酸是影响血液脂质异常的关键[18]。因此, 采用PUFA替代SFA摄入以达到预防冠心病的观点逐渐被世人所接受[19]。但是, 近年来有临床研究发现, 额外补充omega-3型PUFA并不能降低临床心血管不良事件的发生[20]。长久以来, LA作为一种omega-6型PUFA, 被认为可以通过饮食摄入来降低冠心病的风险[21]。但是, 有临床数据表明, 通过摄取LA来降低胆固醇的干预措施并未降低冠心病的死亡率[22, 23]。有研究者认为, 随着生活水平的提高, LA摄入的比例远超人体需求, 这会使机体产生大量脂质介质衍生物, 诱导肥胖和冠心病的发病进程[24]。因此, 本实验通过建立LA摄入过量负荷急性心肌缺血的动物模型, 以此来阐明LA摄入对冠心病的作用机制。实验数据表明, 当单纯摄入LA时并不会对心脏功能产生特殊影响, 但当急性心肌缺血时, LA则会增加对心肌缺血损伤的“易感性”。因此, 综合考虑脂肪酸在人体的代谢过程, 合理膳食, 适当摄入PUFA才可以做到有效地预防冠心病发病进程。
ALOX15是脂质过氧化酶家族的一种亚型, 有研究认为ALOX15与冠心病的发病密切相关[25], 且在冠心病患者心肌组织中的表达显著增加[26]。一直以来, 炎症学说都被认为是冠心病发病的关键机制之一。有研究表明, LA经人体代谢可生成介导炎症发生的花生四烯酸(arachidonic acid, AA), 经ALOX15等生物酶的代谢过程可产生多种强效促炎介质, 包括前列腺素和白三烯[27]。虽然有研究认为, 在体内只有0.3%~0.6%的LA会转化为AA, 但是长期摄入富含LA的饮食习惯仍没有降低冠心病的患病风险[28]。有临床研究发现, 常规的广谱抗炎治疗并不能有效地缓解冠心病的发展进程[29]。这使研究者们将冠心病发病机制的研究目光, 逐渐转向了对除炎症之外的其他机制方面的探索。
最近, 有研究表明, ALOX15不仅可以催化游离的PUFA, 还可以通过分子伴侣蛋白——磷脂酰乙醇胺结合蛋白-1 (PEBP-1) 铆钉于质膜形成复合物, 促使质膜中的PE发生过氧化, 产生PE-OOH[30, 31]。花生四烯酸氢过氧化物(arachidonic acid hydroperoxide, AA-OOH) 一直以来被认为是引发炎症的前体, 而本课题组前期研究表明, ALOX15可以加速钙离子非依赖性磷脂酶A2β (calcium-independent phospholipase A2β, iPLA2β) 对膜PE-OOH代谢, 导致AA-OOH堆积, 进而产生氧化损伤[32]。以上证据提示, 质膜磷脂的氧化损伤早于炎症前体的形成, 或许这才是冠心病病理机制更重要的起始元件。
本实验研究结果表明, 过量的LA摄入增加了心肌细胞膜磷脂侧链的不饱和程度, 给磷脂氧化酶ALOX15提供了有效的氧化底物, 增加了心肌缺血损伤的“易感性”。因此, ALOX15介导磷脂过氧化损伤可能才是早期冠心病的关键机制, 并可为炎症前体的形成提供相应的物质基础。本研究可为PUFA代替疗法预防冠心病的策略是否可行提供实验依据, 也为临床长期以来通过广谱抗炎治疗策略未能达到有效治疗效果的现象提供科学依据, 更为临床早期冠心病干预靶标和药物研发提供新思路。
作者贡献: 何蓉蓉负责实验设计和指导及基金资助; 刘江涵子进行论文的整体实验、数据分析和撰写论文初稿; 马晓慧负责对实验进行具体指导和论文修改及基金资助; 袁天慧和孙万阳提供实验设计及分析方法指导; 栗原博和李怡芳对实验设计进行指导。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Hu ST, Yang YJ, Gao RL, et al. Annual report on cardiovascular health and diseases in China 2020[J]. J Cardiovasc Pulm Dis (心肺血管病杂志), 2021, 19: 582-590. |
| [2] |
Houston M. The role of noninvasive cardiovascular testing, applied clinical nutrition and nutritional supplements in the prevention and treatment of coronary heart disease[J]. Ther Adv Cardiovasc Dis, 2018, 12: 85-108. DOI:10.1177/1753944717743920 |
| [3] |
Kerr M, Dodd MS, Heather LC. The 'Goldilocks zone' of fatty acid metabolism; to ensure that the relationship with cardiac function is just right[J]. Clin Sci (Lond), 2017, 131: 2079-2094. DOI:10.1042/CS20160671 |
| [4] |
Jacobson TA, Glickstein SB, Rowe JD, et al. Effects of eicosapentaenoic acid and docosahexaenoic acid on low-density lipoprotein cholesterol and other lipids: a review[J]. J Clin Lipidol, 2012, 6: 5-18. DOI:10.1016/j.jacl.2011.10.018 |
| [5] |
Blasbalg TL, Hibbeln JR, Ramsden CE, et al. Changes in consumption of omega-3 and omega-6 fatty acids in the United States during the 20th century[J]. Am J Clin Nutr, 2011, 93: 950-962. DOI:10.3945/ajcn.110.006643 |
| [6] |
Lee YW, Park HJ, Hennig B, et al. Linoleic acid induces MCP-1 gene expression in human microvascular endothelial cells through an oxidative mechanism[J]. J Nutr Biochem, 2001, 12: 648-654. DOI:10.1016/S0955-2863(01)00186-3 |
| [7] |
Naughton SS, Mathai ML, Hryciw DH, et al. Linoleic acid and the pathogenesis of obesity[J]. Prostaglandins Other Lipid Mediat, 2016, 125: 90-99. DOI:10.1016/j.prostaglandins.2016.06.003 |
| [8] |
Froyen E, Burns-Whitmore B. The effects of linoleic acid consumption on lipid risk markers for cardiovascular disease in healthy individuals: a review of human intervention trials[J]. Nutrients, 2020, 12: 2329. DOI:10.3390/nu12082329 |
| [9] |
Woo Lee Y, Joo Park H, Hennig B, et al. Linoleic acid induces MCP-1 gene expression in human microvascular endothelial cells through an oxidative mechanism[J]. J Nutr Biochem, 2001, 12: 648-654. DOI:10.1016/S0955-2863(01)00186-3 |
| [10] |
Binns CW, Lee MK, Maycock B, et al. Climate change, food supply, and dietary guidelines[J]. Annu Rev Public Health, 2021, 42: 233-255. DOI:10.1146/annurev-publhealth-012420-105044 |
| [11] |
Zhang Y, Wang J, Guo LL. Research progress in myocardial ischemia injury model induced by isoproterenol[J]. Med Recapitul (医学综述), 2010, 16: 3527-3531. |
| [12] |
Choi J, Yin T, Shinozaki K, et al. Comprehensive analysis of phospholipids in the brain, heart, kidney, and liver: brain phospholipids are least enriched with polyunsaturated fatty acids[J]. Mol Cell Biochem, 2018, 442: 187-201. DOI:10.1007/s11010-017-3203-x |
| [13] |
Ashraf MZ, Kar NS, Podrez EA. Oxidized phospholipids: biomarker for cardiovascular diseases[J]. Int J Biochem Cell Biol, 2009, 41: 1241-1244. DOI:10.1016/j.biocel.2008.11.002 |
| [14] |
Lin XM, Sun WY, Duan WJ. Phospholipid peroxidation: a key factor in "susceptibility" to neurodegenerative diseases[J]. Acta Pharm Sin (药学学报), 2021, 56: 2154-2163. |
| [15] |
Ivanov I, Kuhn H, Heydeck D. Structural and functional biology of arachidonic acid 15-lipoxygenase-1 (ALOX15)[J]. Gene, 2015, 573: 1-32. DOI:10.1016/j.gene.2015.07.073 |
| [16] |
Ayala A, Muñoz MF, Argüelles S. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal[J]. Oxid Med Cell Longev, 2014, 2014: 360438. |
| [17] |
Ahrens EH Jr. The management of hyperlipidemia: whether, rather than how[J]. Ann Intern Med, 1976, 85: 87-93. DOI:10.7326/0003-4819-85-1-87 |
| [18] |
Keys A, Anderson JT, Grande F. Prediction of serum-cholesterol responses of man to changes in fats in the diet[J]. Lancet, 1957, 273: 959-966. |
| [19] |
Kritchevsky D. History of recommendations to the public about dietary fat[J]. J Nutr, 1998, 128: 449-452. DOI:10.1093/jn/128.2.449S |
| [20] |
Risk and Prevention Study Collaborative Group. n-3 fatty acids in patients with multiple cardiovascular risk factors[J]. N Engl J Med, 2013, 368: 1800-1808. DOI:10.1056/NEJMoa1205409 |
| [21] |
Sacks FM, Lichtenstein AH, Wu JHY, et al. Dietary fats and cardiovascular disease: a presidential advisory from the American Heart Association[J]. Circulation, 2017, 136: e1-e23. |
| [22] |
Ramsden CE, Hibbeln JR, Majchrzak SF, et al. n-6 fatty acid-specific and mixed polyunsaturate dietary interventions have different effects on CHD risk: a meta-analysis of randomised controlled trials[J]. Br J Nutr, 2010, 104: 1586-1600. DOI:10.1017/S0007114510004010 |
| [23] |
Hamley S. The effect of replacing saturated fat with mostly n-6 polyunsaturated fat on coronary heart disease: a meta-analysis of randomised controlled trials[J]. Nutr J, 2017, 16: 30. DOI:10.1186/s12937-017-0254-5 |
| [24] |
Mariamenatu AH, Abdu EM. Overconsumption of omega-6 polyunsaturated fatty acids (PUFAs) versus deficiency of omega-3 PUFAs in modern-day diets: the disturbing factor for their "balanced antagonistic metabolic functions" in the human body[J]. J Lipids, 2021, 2021: 8848161. |
| [25] |
Kaur N, Singh J, Reddy S. Interaction between ALOX15 polymorphisms and coronary artery disease in North Indian population[J]. Clin Exp Hypertens, 2018, 40: 398-405. DOI:10.1080/10641963.2017.1384485 |
| [26] |
Magnusson LU, Lundqvist A, Asp J, et al. High expression of arachidonate 15-lipoxygenase and proinflammatory markers in human ischemic heart tissue[J]. Biochem Biophys Res Commun, 2012, 424: 327-330. DOI:10.1016/j.bbrc.2012.06.117 |
| [27] |
Fritsche KL. Too much linoleic acid promotes inflammation-doesn't it?[J]. Prostaglandins Leukot Essent Fatty Acids, 2008, 79: 173-175. DOI:10.1016/j.plefa.2008.09.019 |
| [28] |
Whelan J, Fritsche K. Linoleic acid[J]. Adv Nutr, 2013, 4: 311-312. DOI:10.3945/an.113.003772 |
| [29] |
Lorenzatti AJ. Anti-inflammatory treatment and cardiovascular outcomes: results of clinical trials[J]. Eur Cardiol, 2021, 16: e15. DOI:10.15420/ecr.2020.51 |
| [30] |
Mashima R, Okuyama T. The role of lipoxygenases in pathophysiology; new insights and future perspectives[J]. Redox Biol, 2015, 6: 297-310. DOI:10.1016/j.redox.2015.08.006 |
| [31] |
Wenzel SE, Tyurina YY, Zhao J, et al. PEBP1 wardens ferroptosis by enabling lipoxygenase generation of lipid death signals[J]. Cell, 2017, 171: 628-641.e26. DOI:10.1016/j.cell.2017.09.044 |
| [32] |
Sun WY, Tyurin VA, Mikulska-Ruminska K, et al. Phospholipase iPLA2β averts ferroptosis by eliminating a redox lipid death signal[J]. Nat Chem Biol, 2021, 17: 465-476. DOI:10.1038/s41589-020-00734-x |
 2022, Vol. 57
2022, Vol. 57


