2. 暨南大学, 中药及天然药物研究所, 广东 广州 510632;
3. 暨南大学, 广东省中药药效物质基础及创新药物研究重点实验室, 广东 广州 510632;
4. 澳门科技大学中医药学院, 中药质量研究国家重点实验室, 澳门 999078
2. Institute of Traditional Chinese Medicine and Natural Products, Jinan University, Guangzhou 510632, China;
3. Guangdong Province Key Laboratory of Pharmacodynamic Constituents of TCM and New Drugs Research, Jinan University, Guangzhou 510632, China;
4. School of Pharmacy and State Key Laboratory of Quality Research in Chinese Medicine, Macau University of Science and Technology, Macau 999078, China
流感属中医温病范畴, 是一种由外感温邪引起的急性热病, 患者起病迅速, 表现为高热、畏寒、咽痛、鼻塞、流涕等症状, 严重者可发展为肺炎、哮喘, 甚至引起死亡, 流感引发的病毒性肺炎已成为全世界面临的重要公共健康问题之一。《温热论》有言: “温邪上受, 首先犯肺”, 这是因为肺连接喉管和鼻腔与外界相通, 最先受到外邪侵袭而损伤, 且肺为水上之源, 性清肃、喜润而恶燥, 易受各种阳邪的侵犯。“肝火犯肺”是情志病的一种, 长期情志不遂可以引起肝肺介导的疏泄功能障碍, 诱发“肝火”灼伤肺络, 使肺脏抵御病毒等外邪因子的能力降低, 促进流感的发生与发展。现代医学认为, “肝火犯肺”与“心理应激”关系密切, 常使用负荷拘束的方式模拟情志应激, 建立流感病毒易感的动物模型, 并探索与模型相关的药理学机制[1]。清肝泻肺方为黄芩泻白散和黛蛤散的合方, 由黄芩、地骨皮、桑白皮、甘草、青黛、蛤壳共6味药组成, 具有清肝利肺、降逆除烦的作用。因此, 本研究拟采用慢性拘束应激诱导的H1N1流感易感模型, 探讨清肝泻肺方对流感病毒性肺炎的治疗作用。同时, 利用网络药理学方法对清肝泻肺方的作用靶点进行筛选, 探讨其可能的作用机制, 为临床上清肝泻肺类中药治疗流感病毒性肺炎的应用和推广提供科学依据。
材料与方法药品与试剂 清肝泻肺方中的各味中药购自康美药业股份有限公司(青黛: 201202671; 蛤壳: 21040711; 黄芩: 210400341; 地骨皮: 202100109; 桑白皮: 20090291; 甘草: 202100371); 磷酸奥司他韦胶囊(达菲: M1069) 购自暨南大学第一附属医院; 聚合酶碱性蛋白1 (polymerase basic protein 1, PB1, GTX-125923)、流感病毒核蛋白(influenza virus nucleoprotein, NP, GTX-125989), 美国GeneTex公司; 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH, FD0068)、辣根过氧化物酶标记山羊抗兔IgG (H+L)(FDR007)、辣根过氧化物酶标记山羊抗小鼠IgG (H+L)(FDM007), 杭州弗德生物科技有限公司; 4-羟基壬烯醛(4-hydroxynonenal, 4-HNE, ab46545)、干扰素β (interferon beta, IFN-β, ab140211), 英国Abcam公司; 线粒体抗病毒信号蛋白(mitochondrial antiviral-signaling protein, MAVS, 14341-1-AP)、核因子活化B细胞κ轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells, NFκB, 10745-1-AP), 美国Proteintech公司; 磷酸化核因子活化B细胞κ轻链增强子(phospho-NFκB, p-NFκB, #3033)、干扰素调节因子3 (interferon regulatory factor 3, IRF3, 4302S)、磷酸化干扰素调节因子3 (phospho-IRF3, p-IRF3, 29047S), 美国Cell Signaling Technology公司; 反转录试剂盒(AT311-03)、SYBR Green Mix (AQ141-01), 北京全式金生物技术有限公司; 丙二醛(malondialdehyde, MDA) 检测试剂盒(S0131), 碧云天生物技术有限公司; 免疫显色试剂盒(GK500705), 上海基因科技股份有限公司。
实验仪器 全自动快速研磨仪(型号: JXFSTPRP-24), 上海净信科技公司; 高速冷冻离心机(型号: D-16C), Sartorius公司; 多功能酶标仪(型号: MK-3), Labsystem公司; 垂直电泳仪(型号: DYCZ-25E), 北京六一生物科技公司; 显影仪(型号: Tanon 5200), 上海天能科技公司; q-PCR仪(型号: 1708882AP), 美国Bio-Rad公司; 石蜡切片机(型号: RM2235), 德国Leica公司; 扫描显微成像系统(型号: Precipoint M8), 德国Precipoint公司。
实验动物 SPF级3~4周雄性C57BL/6小鼠[购自广东省医学实验动物中心, 实验动物许可证编号: SCXK (粤) 2016-0041] 适应性喂养1周后进行实验。饲养环境为12 h光照和黑暗循环交替, 温度维持在18~22 ℃, 湿度维持在40%~60%, 并以标准饲料和水喂养。动物福利和实验过程均遵循暨南大学动物伦理委员会的规定。
实验病毒 本实验使用的流感病毒株A/FM/1/47 (H1N1) 由华南农业大学陈建新教授馈赠。病毒扩增: 病毒稀释液注入SPF级鸡胚尿囊腔, 35 ℃或37 ℃恒温箱培养鸡胚2~3天, 收集鸡胚尿囊液后离心去除血液和细胞后将病毒液分装置于-80 ℃保存。病毒处理: 该批病毒前期已在SPF级C57BL/6小鼠上测定半数致死量(LD50), 动物实验所用病毒浓度为2× LD50。
给药剂量 清肝泻肺方根据人临床用量(52.5 g·d-1), 采用人与小鼠的体表面积换算系数计算出小鼠的给药剂量, 设定低剂量为21.53 g·kg-1·d-1, 即人体等效剂量的2倍; 高剂量为43.05 g·kg-1·d-1, 即人体等效剂量的4倍。磷酸奥司他韦给药剂量设定为30.75 mg·kg-1·d-1。
药物配制 清肝泻肺方总生药量为52.5 g (黄芩10 g、桑白皮10 g、青黛1.5 g、海蛤15 g、地骨皮10 g、甘草6 g), 按500 mL蒸馏水常规煎制并分别按人体用量的2倍和4倍浓缩定容, 4 ℃密封保存备用。阳性药选用磷酸奥司他韦, 用蒸馏水溶解后, 4 ℃密封保存备用。临用前置于20 ℃环境下预热。
动物实验 实验分为生存率与继发性肺炎两部分。第一批实验用于观察生存率和发病率。小鼠随机分为6组, 每组10只, 包括正常组(Control)、病毒组(Virus)、拘束+病毒组(Stress+Virus)、低剂量清肝泻肺方组(QGXF)、高剂量清肝泻肺方组(QGXF-H) 和阳性药磷酸奥司他韦组(Oseltamivir)。QGXF、QGXF-H和Oseltamivir组小鼠采用灌胃(i.g.) 的方式分别给予清肝泻肺方水煎液(21.53和43.05 g·kg-1·d-1) 和磷酸奥司他韦(30.75 mg·kg-1·d-1), 其余组小鼠灌胃等量蒸馏水, 连续给药12天。除阴性对照组与病毒组小鼠外, 其余组小鼠在给药1 h后给予4 h的拘束应激处理(即将小鼠置于50 mL通风离心管内, 使小鼠在不影响呼吸的情况下, 限制其肢体活动, 拘束期间禁食禁水。4 h后移除离心管, 结束拘束), 连续12天。第12天拘束结束恢复30 min后, 给除阴性对照组以外的所有小鼠进行滴鼻感染病毒(2× LD50, 每只约20 μL), 自此每日观察2次, 记录体重并灌胃给药, 持续21天。当小鼠出现体重减轻、驼背、毛发皱褶、呼吸改变、无反应及体重下降(超过1 g·d-1) 等典型流感症状时, 判定为发病状态。第二批实验用于检测流感病毒性肺炎相关指标。将小鼠随机分为5组, 每组6只, 包括正常组(Control)、病毒组(Virus)、拘束+病毒组(Stress+Virus)、低剂量清肝泻肺方组(QGXF) 和阳性药磷酸奥司他韦组(Oseltamivir)。造模和给药方式与第一批实验相同, 并在感染病毒后第6天取小鼠肺脏组织用于肺炎与磷脂过氧化等指标的检测。
肺脏病理学检查 统一切取小鼠右肺上叶于4%多聚甲醛溶液中固定1周, 随后采用石蜡包埋、切片、脱蜡与水化、H & E染色等技术制成病理切片, 并用扫描显微成像系统对切片进行扫描, 观察小鼠肺脏损伤情况。肺组织病理形态学观察和肺损伤评分: 每张切片按肺泡出血、肺水肿、炎性细胞浸润和免疫组织化学染色强度的等级进行分类评分, 每种分类根据病变程度又分为: 正常0分; 轻度1分; 中度2分; 重度3分; 极重度4分。总的肺部损伤评分为上述各项之和。
免疫组化检测 切取适当大小的小鼠肺脏组织于4%多聚甲醛溶液中固定1周, 随后进行石蜡包埋、切片、脱蜡与水化、抗原修复、阻断内源性过氧化物酶、封闭打孔、孵育一抗、二抗, DAB显色、苏木素染色、脱水和封片等步骤, 用扫描显微成像系统观察小鼠肺脏组织内病毒核蛋白NP和4-HNE的表达情况。免疫组化评分: 根据半定量系统对细胞染色强度进行评估并分为4级, 无阳性着色(阴性) 计0分, 淡黄色(弱阳性) 计1分, 棕黄色(阳性) 计2分, 棕褐色(强阳性) 计3分。
蛋白免疫印迹检测 取大约10 mg小鼠肺脏组织, 用蛋白裂解液提取总蛋白, 采用BCA法测定蛋白浓度。样品与蛋白上样缓冲液混合后变性, 取30 μg蛋白样品上样进行SDS-聚丙烯酰胺凝胶电泳分离蛋白, 湿法转膜80 min, 4 ℃过夜孵育一抗, 室温2 h孵育二抗, 采用ECL发光后胶片暗室曝光显影。
实时荧光定量聚合酶链式反应 取大约10 mg小鼠肺脏组织, 用Trizol Reagent提取RNA后测定浓度。将提取的RNA按照试剂盒说明书反转录成cDNA, 采用实时荧光定量PCR法分析基因的表达水平, 并以内参基因衡量目的基因的相对表达量, 引物序列见表 1。
| 表 1 The primer sequences for real-time quantitative reverse transcription. Tnf-α: Tumor necrosis factor alpha; Il-1β: Interleukin 1 beta; Il-6: Interleukin 6; NP: Influenza virus nucleoprotein; Ptgs2: Prostaglandin-endoperoxide synthase 2; Lpcat3: Lysophosphatidylcholine acyltransferase 3; Acsl4: Acyl-CoA synthetase long chain family member 4; Nox2: NADPH oxidase 2; Gapdh: Glyceraldehyde-3-phosphate dehydrogenase; 18S rRNA: 18S ribosomal RNA |
统计学分析 实验数据以平均值±标准差(
数据库 中药系统药理学数据库与分析平台(TCMSP, https://tcmsp-e.com); UniProt数据库(https://www.uniprot.org); Geneontology数据库(http://geneontology.org)。
网络药理学的构建与靶点预测 基于TCMSP数据库检索清肝泻肺方中各味药材中的化合物, 并按照口服生物利用度(oral bioavailability, OB) ≥ 30%, 类药性(drug likeness, DL) ≥ 0.18的原则进行筛选, 得到171个单体化合物; 并在TCMSP数据库中获取这些单体化合物所靶向的基因, 共计260个。随后, 使用Uniprot数据库对这些靶点基因进行Uniprot IDs转化, 并通过Geneontology数据库进行GO富集分析。
结果 1 清肝泻肺方对拘束应激小鼠体重变化的影响根据每日对小鼠体重和状态的监测发现, 未拘束的正常组和病毒组小鼠在此期间体重稳定增加, 且状态较好; 拘束+病毒组与磷酸奥司他韦组小鼠在拘束期间出现摄食量减少、生长迟缓、运动性活动减少、攻击性降低等表现, 体重变化率也显示出两组小鼠在12天内未见增长; 而给予低剂量和高剂量清肝泻肺方后均改善了拘束导致的小鼠生长迟缓现象, 表现为拘束期间体重与活动性增加(图 1)。此外, 低、高剂量清肝泻肺方和磷酸奥司他韦并未对小鼠产生明显的毒副作用。
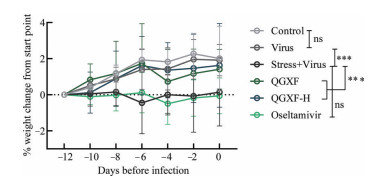
|
Figure 1 Effect of Qinggan Xiefei Fang on the weight change of mice treated with chronic restraint stress. The weight change rate of mice treated with restraint stress for 12 days. n = 10, |
拘束结束后, 对除正常组以外的所有小鼠感染H1N1病毒。21天生存率结果显示, 拘束+病毒组小鼠的生存率显著低于病毒组, 并在第6天达到最低值, 而清肝泻肺方显著提高拘束应激负荷H1N1感染小鼠的生存率(图 2A)。通过对小鼠体重与状态的持续监测中发现, 在感染病毒后的第6天, 拘束+病毒组小鼠的发病率达到最高值, 而低、高剂量清肝泻肺方均能延缓并降低小鼠的发病情况(图 2B)。以上结果说明, 清肝泻肺方有效改善拘束应激负荷H1N1感染小鼠的生存率和发病率。
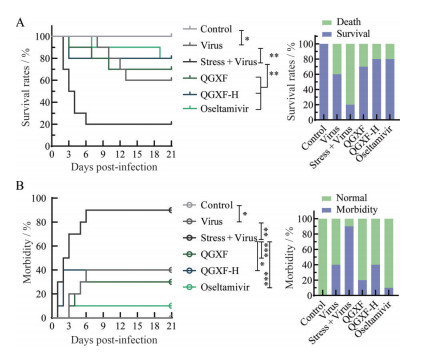
|
Figure 2 Effect of Qinggan Xiefei Fang on the survival rate and morbidity rate of influenza-infected mice loaded with emotional stress. A: The 21-day survival rate of mice; B: Morbidity of mice. n = 10, |
在评价小鼠流感病毒性肺炎相关指标的实验中, 肺形态学检查结果显示, 清肝泻肺方有效改善小鼠肺淤血的症状(图 3A); 脏器指数显示, 相比病毒组, 拘束+病毒组小鼠的肺指数大幅度升高, 肝指数下降, 说明拘束+病毒组的小鼠存在严重的肺水肿与肝脏缩小的情况, 而清肝泻肺方可有效改善这一病理症状(图 3B)。H & E染色与免疫组化的结果显示, 拘束+病毒组小鼠肺脏出现严重的肺泡出血、炎症浸润及病毒感染与复制增多的现象, 而清肝泻肺方有效改善拘束应激负荷H1N1感染小鼠肺脏的病理损伤情况, 下调肺组织中病毒核蛋白NP的表达(图 3C、D)。此外, Western blot和q-PCR结果显示, 清肝泻肺方还有效抑制病毒蛋白NP与PB1的表达, 降低肺脏炎症因子的基因表达水平(图 3E、F)。以上结果说明, 清肝泻肺方有效改善拘束应激负荷H1N1感染小鼠的病毒性肺炎症状。
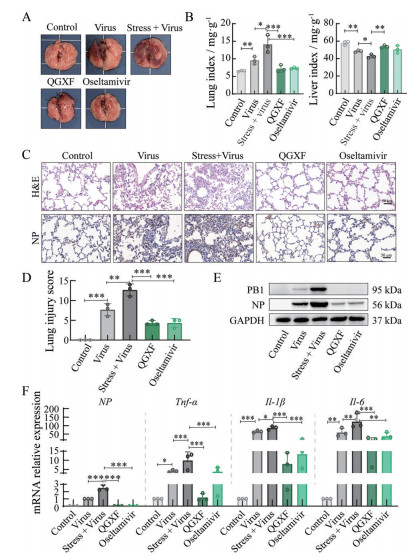
|
Figure 3 Effect of Qinggan Xiefei Fang on the H1N1 virus replication and the symptoms of viral pneumonia in mice. A: Pulmonary morphology of mice (n = 6); B: The index of lung and liver of mice (n = 3); C: Histopathology change in lung of mice analyzed by hematoxylin and eosin (H & E) staining and the expression of NP in mouse lung analyzed by immunohistochemical staining (n = 3); D: Pathological score of lungs (n = 3); E: Pulmonary protein expression of polymerase basic protein 1 (PB1) and NP detected by Western blot (n = 3); F: Pulmonary mRNA expression of NP, Tnf-α, Il-1β and Il-6 (n = 3). |
使用TCMSP数据库对清肝泻肺方中多种中药活性成分进行检索, 并通过Cytoscape软件构建清肝泻肺方活性化合物-作用靶点网络, 如图 4A所示, 以药物OB ≥ 30%, DL ≥ 0.18为条件, 共筛选出171个单体化合物, 黄芩含有36个化合物, 桑白皮含有31个化合物, 地骨皮含有13个化合物, 甘草含有92个化合物, 青黛含有9个化合物, 其中同属桑白皮与甘草的化合物有4个, 同属黄芩和地骨皮的化合物有2个, 同属甘草和黄芩的化合物有1个, 同属地骨皮、桑白皮、青黛和黄芩的化合物有1个; 并在TCMSP数据库中获得了这些单体化合物所靶向的基因, 共计260个。利用Geneontology数据库对这些靶点基因进行信号通路关联分析, 从图 4B中可知, 清肝泻肺方中活性成分的靶点基因涉及氧化应激、炎症和免疫等相关通路, 这提示清肝泻肺方可能通过调节机体的氧化应激水平, 尤其是调控脂质过氧化水平, 从而缓解流感病毒性肺炎。

|
Figure 4 Pharmacologic network analysis of Qinggan Xiefei Fang. A: The compound-target network diagram of Qinggan Xiefei Fang; B: GO terms of Qinggan Xiefei Fang against influenza viral pneumonia |
为了进一步探究清肝泻肺方改善病毒性肺炎是否与调控氧化应激有关, 本研究检测了磷脂过氧化和先天免疫抗病毒信号通路相关指标。实验结果显示, 与病毒组小鼠相比, 拘束应激不仅抑制了小鼠先天免疫MAVS抗病毒信号通路的激活, 还显著增加了H1N1流感小鼠的肺脏磷脂过氧化水平, 表现为磷脂过氧化产物4-HNE与MDA的累积增多; 而给予清肝泻肺方保护后, 小鼠的先天免疫响应功能恢复正常(图 5A), 并且降低了小鼠肺脏的磷脂过氧化水平(图 5B~D)。NADPH氧化酶2 (NADPH oxidase 2, NOX2) 是氧化应激的重要来源之一, 诱导活性氧自由基(reactive oxygen species, ROS) 的产生[2], 长链脂肪酸-CoA连接酶4 (acyl-CoA synthetase long chain family member 4, ACSL4) 和溶血磷脂酰胆碱酰基转移酶3 (lysophosphatidylcholine acyltransferase 3, LPCAT3) 调节脂质代谢, 是诱导磷脂过氧化的重要参与者[3, 4], 前列腺素内过氧化物合酶2 (prostaglandin-endoperoxide synthase 2, PTGS2) 控制前列腺素的合成, 参与炎症反应[5], 这些分子分别在氧化应激、磷脂过氧化和炎症中发挥了重要的作用。在流感病毒的作用下, Nox2、Acsl4、Lpcat3和Ptgs2的基因在患病小鼠体内上调, 并受拘束应激的刺激而增加, 而在给予清肝泻肺方的小鼠体内显示出与正常组相近的表达水平(图 5E)。以上实验结果表明, 清肝泻肺方可能通过靶向流感病毒性肺炎小鼠的先天免疫和氧化应激通路发挥治疗作用。
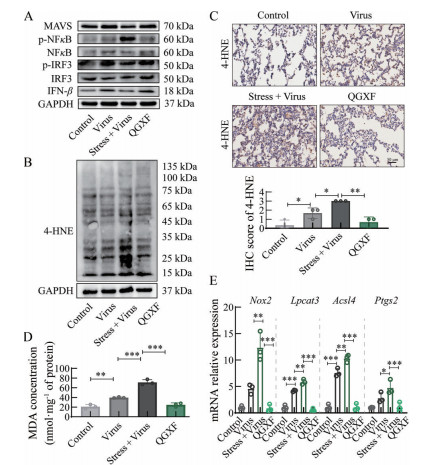
|
Figure 5 Effect of Qinggan Xiefei Fang on the regulation of innate immunity and oxidative stress in mice with influenza virus pneumonia. A: Protein expression of mitochondrial antiviral-signaling protein (MAVS), phospho-nuclear factor kappa-light-chain-enhancer of activated B cells (p-NFκB), nuclear factor kappa-light-chain-enhancer of activated B cells (NFκB), phospho-interferon regulatory factor 3 (p-IRF3), interferon regulatory factor 3 (IRF3) and interferon beta (IFN-β) in mouse lung detected by Western blot (n = 3); B: Protein expression of 4-hydroxynonenal (4-HNE) by Western blot (n = 3); C: Expression of 4-HNE in mouse lung analyzed by immunohistochemical staining (IHC) (n = 3); D: Malondialdehyde (MDA) concentration in lung tissue (n = 3); E: Lung mRNA expression of Nox2, Lpcat3, Acsl4 and Ptgs2 (n = 3). |
“情志致病”是中医理论的重要组成部分, 最早始于《黄帝内经》[6]。中医认为, 情志致病的核心在于脏腑气机紊乱, 特别是现代社会的生活节奏更快、压力聚集, 机体长期处于抑郁和焦虑的状态, 导致肝气郁结、气机运行受阻, 更易发生情志致病的情况[7]。此外, 依照五行理论, 肝属“木”, 肺属“金”, 长期的肝气郁结促使“肝火”生成, 运行到肺, 表现出“木火刑金”, 五行相侮, 使肺脏抵御外邪的能力减弱, 引起肺功能失调或肺病的加重[8]。本课题组前期也利用拘束应激成功建立情志应激增加流感病毒易感性的动物模型, 发现情志应激能够引发肝郁气滞, 侵犯肺卫, 引发流感病毒性肺炎[9]。情志应激与现代免疫学中的神经-内分泌-免疫网络的氧化应激损伤具有密切的相关性[10]。情志应激能够通过激活下丘脑-垂体-肾上腺轴, 导致机体ROS和应激激素皮质酮/皮质醇水平显著升高[11, 12]。本课题组以往的研究表明, 应激激素皮质酮通过线粒体融合蛋白2 (mitofusin-2, Mfn2) 促进MAVS发生泛素化降解, 继而损伤机体抗病毒信号反应, 促进了流感病毒复制[13]。除此之外, 皮质酮还能降低机体的抗氧化防御能力, 使机体内的ROS大量累积, 损伤细胞功能, 这不仅增加宿主上皮细胞对流感病毒的易感性, 促进细胞间病毒传播, 还能加重流感病毒感染引起的肺损伤[14, 15]。由此可知, 情志应激可通过诱导机体发生氧化应激, 抑制先天免疫抗病毒免疫, 从而增加了流感病毒的易感性。
目前, 临床常用神经氨酸酶抑制剂(如奥司他韦) 和中药复方制剂治疗流感, 由于流感病毒易发生抗原漂移与突变, 现已产生对奥司他韦耐药的H1N1流感病毒[16], 而且仅靠西药治疗流感, 并不能缓解情志应激导致肝火犯肺的病机。中药复方及其单体成分抗流感病毒的作用在近些年得到了广泛的重视及研究, 中药方剂或中西医结合疗法已成为治疗流感病毒性肺炎的更优选项[17, 18]。本研究中使用的清肝泻肺方由黄芩泻白散和黛蛤散组方而成, 黛蛤散有清肝利肺、降逆除烦之效, 其中青黛性寒, 清肝胆郁火, 泻肺经郁热, 海蛤壳清肺热, 化黏痰; 泻白散为清肺热的经典名方, 搭配黄芩清泄少阳之热, 桑白皮主入肺经, 清泻肺热止咳, 地骨皮甘寒入肺, 可助桑白皮清泻肺火, 且有养阴之功, 以复肺气之肃降, 而甘草益气补中, 以扶肺气, 且调和药性; 两方合用, 起到疏肝理气、清泄肺热的作用。现代医学解析, 方中的中药的主要成分为黄酮类化合物、有机酸类、三萜类化合物、二苯乙烯类化合物和二酰胺类等化合物, 具有广泛的药理作用。如黄芩含有多种黄酮类成分, 具有抗氧化与抗病毒的作用[19]; 桑白皮中多含以桑酮等为主的黄酮类化合物, 具有镇咳、平喘、祛痰、镇痛、抗炎等作用[20]; 地骨皮含有生物碱、苯丙素、有机酸及其酯、蒽醌等多种化学成分, 具有抑菌抗炎、解热镇痛等作用[21]; 甘草的主要成分则多为三萜皂苷类、黄酮类和香豆素类等, 可抗炎、祛痰、抗病毒和抗氧化等[22]; 青黛中的靛玉红具有抗病毒和抗炎作用[23]。目前, 两方连用已在临床上用于治疗感染后咳嗽, 并取得了较好的疗效, 但其作用机制仍不明确[24]。因此, 本研究利用情志应激放大这一效应, 用于模拟“肝火犯肺”参与的流感病毒性肺炎, 并在该模型上研究了清肝泻肺方治疗病毒性肺炎的作用。此外, 本研究还利用数据库对清肝泻肺方的成分进行解析, 绘制出单体成分与靶点的互作网络, 并对这些靶点进行富集分析。网络药理学结果显示, 清肝泻肺方中活性成分的靶点基因涉及氧化应激、炎症和免疫等相关通路, 包括一氧化氮合酶、以花生四烯酸为底物的脂氧合酶家族、白介素和肿瘤坏死因子等。这些基因通过产生ROS、促进磷脂过氧化或是诱导炎症反应发挥作用。除这些基因外, 本研究还发现清肝泻肺方能够降低NOX2、ACSL4、LPCAT3和PTGS2的表达, 从而降低磷脂过氧化水平, 并扩大和完善清肝泻肺方的靶点信息。实验结果显示, 清肝泻肺方能够缓解慢性拘束应激负荷H1N1流感病毒引起的小鼠生存率和健康率下降, 抑制小鼠肺部流感病毒的复制、炎症因子的产生, 降低拘束应激负荷H1N1流感病毒感染小鼠肺组织中的4-HNE和MDA水平, 下调氧化应激相关因子的基因水平, 恢复先天免疫抗病毒信号通路的响应, 以上结果表明, 清肝泻肺方可能通过干预磷脂过氧化过程, 缓解流感病毒性肺炎。
综上, 本研究考察清肝泻肺方治疗病毒性肺炎的疗效, 发现清肝泻肺方可能通过调控磷脂过氧化, 降低小鼠对流感病毒的易感性, 缓解小鼠流感病毒性肺炎。基于单体-靶点的网络药理学分析, 更好地了解清肝泻肺方中的天然成分与宿主之间的相互作用, 解析清肝泻肺方的物质基础与作用机制。本研究为清肝泻肺方治疗流感病毒性肺炎提供了实验参考, 但关于清肝泻肺方更深入的分子机制仍有待进一步探讨。
作者贡献: 李怡芳、何蓉蓉、栗原博负责实验设计和指导; 陆钰辉负责论文的整体实验、数据分析和撰写论文; 李怡芳、欧阳淑桦负责对实验进行具体指导和论文修改; 翁竞玉、刘佩和陈新星参与实验实施。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Buynitsky T, Mostofsky DI. Restraint stress in biobehavioral research: recent developments[J]. Neurosci Biobehav Rev, 2009, 33: 1089-1098. DOI:10.1016/j.neubiorev.2009.05.004 |
| [2] |
Fuentes E, Gibbins JM, Holbrook LM, et al. NADPH oxidase 2 (NOX2): a key target of oxidative stress-mediated platelet activation and thrombosis[J]. Trends Cardiovasc Med, 2018, 28: 429-434. DOI:10.1016/j.tcm.2018.03.001 |
| [3] |
Dixon SJ, Winter GE, Musavi LS, et al. Human haploid cell genetics reveals roles for lipid metabolism genes in nonapoptotic cell death[J]. ACS Chem Biol, 2015, 10: 1604-1609. DOI:10.1021/acschembio.5b00245 |
| [4] |
Doll S, Proneth B, Tyurina YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nat Chem Biol, 2017, 13: 91-98. DOI:10.1038/nchembio.2239 |
| [5] |
Cox D, Pontes C, Guinó E, et al. Polymorphisms in prostaglandin synthase 2/cyclooxygenase 2 (PTGS2/COX2) and risk of colorectal cancer[J]. Br J Cancer, 2004, 91: 339-343. DOI:10.1038/sj.bjc.6601906 |
| [6] |
Li ZH, Zhao ZM, Xia T, et al. Effects of psychological stress on polycystic ovary infertility based on emotional pathogenicity theory[J]. 中华中医药杂志, 2021, 36: 3706-3709. |
| [7] |
Yue GX, Huang QF, Chen JX, et al. Seven emotions generation and five Zang-organs regulation machanism[J]. 中华中医药杂志, 2007, 22: 585-588. |
| [8] |
Wang CY, Guo RJ. Research progress of liver fire caused by emotional problems[J]. 环球中医药, 2012, 5: 138-142. |
| [9] |
Chen H, Jie C, Tang LP, et al. New insights into the effects and mechanism of a classic traditional Chinese medicinal formula on influenza prevention[J]. Phytomedicine, 2017, 27: 52-62. DOI:10.1016/j.phymed.2017.02.004 |
| [10] |
Zhu SR, Luo X, Li YF, et al. Emotional "heat" increases "disease susceptibility" research[J]. 中国中药杂志, 2018, 43: 1529-1535. |
| [11] |
Marin MT, Cruz FC, Planeta CS. Chronic restraint or variable stresses differently affect the behavior, corticosterone secretion and body weight in rats[J]. Physiol Behav, 2007, 90: 29-35. DOI:10.1016/j.physbeh.2006.08.021 |
| [12] |
Lee DY, Kim E, Choi MH. Technical and clinical aspects of cortisol as a biochemical marker of chronic stress[J]. BMB Rep, 2015, 48: 209-216. DOI:10.5483/BMBRep.2015.48.4.275 |
| [13] |
Luo Z, Liu LF, Jiang YN, et al. Novel insights into stress-induced susceptibility to influenza: corticosterone impacts interferon-β responses by Mfn2-mediated ubiquitin degradation of MAVS[J]. Signal Transduct Target Ther, 2020, 5: 202. DOI:10.1038/s41392-020-00238-z |
| [14] |
Zafir A, Banu N. Modulation of in vivo oxidative status by exogenous corticosterone and restraint stress in rats[J]. Stress, 2009, 12: 167-177. DOI:10.1080/10253890802234168 |
| [15] |
Nencioni L, Sgarbanti R, De Chiara G, et al. Influenza virus and redox mediated cell signaling: a complex network of virus/host interaction[J]. New Microbiol, 2007, 30: 367-375. |
| [16] |
Sheu TG, Fry AM, Garten RJ, et al. Dual resistance to adamantanes and oseltamivir among seasonal influenza A (H1N1) viruses: 2008-2010[J]. J Infect Dis, 2011, 203: 13-17. DOI:10.1093/infdis/jiq005 |
| [17] |
Carrat F, Flahault A. Influenza vaccine: the challenge of antigenic drift[J]. Vaccine, 2007, 25: 6852-6862. DOI:10.1016/j.vaccine.2007.07.027 |
| [18] |
Wang X, Jia W, Zhao A, et al. Anti-influenza agents from plants and traditional Chinese medicine[J]. Phytother Res, 2006, 20: 335-341. DOI:10.1002/ptr.1892 |
| [19] |
Zhao T, Tang H, Xie L, et al. Scutellaria baicalensis Georgi. (Lamiaceae): a review of its traditional uses, botany, phytochemistry, pharmacology and toxicology[J]. J Pharm Pharmacol, 2019, 71: 1353-1369. DOI:10.1111/jphp.13129 |
| [20] |
Chan EW, Lye PY, Wong SK. Phytochemistry, pharmacology, and clinical trials of Morus alba[J]. Chin J Nat Med, 2016, 14: 17-30. |
| [21] |
Lu LH, Lu XP, Yuan MR, et al. Research progress on chemical constituents of Lycii Cortex[J]. 云南化工, 2021, 48: 8-14. |
| [22] |
Gao X, Wang W, Wei S, et al. Review of pharmacological effects of Glycyrrhiza radix and its bioactive compounds[J]. 中国中药杂志, 2009, 34: 2695-2700. |
| [23] |
Jie C, Luo Z, Chen H, et al. Indirubin, a bisindole alkaloid from Isatis indigotica, reduces H1N1 susceptibility in stressed mice by regulating MAVS signaling[J]. Oncotarget, 2017, 8: 105615-105629. DOI:10.18632/oncotarget.22350 |
| [24] |
Li JM, Xin DY. Observation on the curative effect of Huangqin Xiebai SAN and Daihan SAN in treating cough after infection[J]. 世界中医药, 2016, 11: 247-249. |
 2022, Vol. 57
2022, Vol. 57


