2. 暨南大学药学院中药及天然药物研究所, 广东 广州 510632;
3. 暨南大学中医学院, 广东 广州 510632;
4. 广州白云山敬修堂药业股份有限公司, 广东 广州 510130
2. Institute of Traditional Chinese Medicine and Natural Products, College of Pharmacy, Jinan University, Guangzhou 510632, China;
3. School of Traditional Chinese Medicine, Jinan University, Guangzhou 510632, China;
4. Guangzhou Baiyunshan Jingxiutang Pharmaceutical Co., Ltd., Guangzhou 510130, China
Ⅰ型单纯疱疹病毒(herpes simplex virus type 1, HSV-1) 是一种双链DNA病毒, 具有嗜神经特性。HSV-1经皮肤黏膜感染后, 可在鼻、口腔和眼睛等处引起疱疹性的病变[1]。尤为重要的是, 宿主受到原发感染后, 少量的病毒能进入神经末梢并沿轴突逆行至神经元胞体, 在宿主中枢神经系统中建立终身潜伏感染[2]。当宿主长期处于情绪压力等应激状态下时, 潜伏的病毒会重新被激活, 进而引起单纯疱疹病毒性角膜炎[3]、单纯疱疹病毒性脑炎[4]和神经退行性疾病[5-8]等严重疾病。在中医理论中, 对于HSV-1的认识, 早在宋《圣济总录》已有记载“热疮本于热盛, 风气因而乘之”, 其主要临床症状为口角、唇缘、鼻孔周围、眼、面颊等皮肤黏膜交界处出现簇集样丘疹、水疱, 红斑, 自觉灼热、疼痛, 易反复发作[9]。在前期研究中, 本课题组以“肝郁化火”证的头面部症状为研究对象, 发现其头面热疮、面红目赤、头痛耳鸣等症状与HSV-1病毒复发的头面部症状高度相似[10]。因此, 本课题组从“肝郁化火”的角度出发, 已成功建立了情志应激诱导的潜伏HSV-1激活复发的动物模型[11], 用于评价清肝泻火中药的科学内涵。
清热消炎宁(Qingre Xiaoyanning, QX) 是九节茶Sarcandra glabra (Thunb.) Nakai制成的单味制剂, 是清肝泻火类中成药, 具有清热解毒、消炎止痛、舒筋活络等功效, 并广泛用于流行性感冒、疮疡脓肿等症状。本课题组前期研究结果显示, 清热消炎宁能够降低情志应激诱导HSV-1的易感性[12], 但其对HSV-1重激活的作用仍有待深入研究。因此, 本研究在前期建立的情志应激诱导HSV-1激活复发的肝郁化火动物模型上[11], 进一步探讨清热消炎宁抑制HSV-1激活复发的作用及机制, 旨在为治疗HSV-1激活复发提供新方向, 为中医药防治HSV-1激活复发感染导致的相关疾病提供理论依据, 推动中医药的临床开发及应用。
材料与方法试剂 清热消炎宁(每0.4 g内容物中含九节茶浸膏0.33 g, 广东省广州白云山敬修堂药业股份有限公司, 批号Y12333); 阿昔洛韦片(深圳海王药业有限公司, 批号20180902); 感染细胞多肽27 (infected cell polypeptide, ICP27) 抗体、糖蛋白B (glycoprotein B, gB) 抗体、4-羟基壬烯醛(4-hydroxynonenal, 4-HNE) 抗体、花生四烯酸-15-脂加氧酶(arachidonate 15-lipoxygenase, ALOX15) 抗体、谷胱甘肽过氧化酶4 (glutathione peroxidase 4, GPX4) 抗体、GAPDH抗体和HSV-1抗体(英国Abcam公司); 铁蛋白转运受体1 (transferrin receptor 1, TFR1) 抗体和二价金属转运蛋白1 (divalent metal transporter 1, DMT1) 抗体(美国Proteintech公司); 钙非依赖磷脂酶A2β (calcium independent group VIA phospholipase A 2, iPLA2β) 抗体(美国Cayman Chemical公司); 免疫组织化学试剂盒(北京中杉金桥生物技术有限公司); 二氨基联苯胺四盐酸盐(diaminobenzidine tetrahydrochloride, DAB) 显色试剂盒(上海基因科技股份有限公司); 苏木素-伊红(hematoxylin and eosin, HE) 染色试剂盒、丙二醛(malondialdehyde, MDA) 检测试剂盒(碧云天生物技术有限公司); 羊抗兔-辣根过氧化物酶(horseradish peroxidase, HRP) 标记二抗、羊抗鼠-HRP标记二抗和显影液(杭州弗德生物公司); ICP27引物和gB引物(上海生工生物有限公司)。
仪器 石蜡切片机(德国Leica公司); 高速冷冻离心机(德国Sartorius公司); QM100型多功能组织研磨仪(上海净信科技有限公司); 化学发光成像分析系统(上海天能科技器材公司); 生物安全柜(新加坡Esco公司); 数字扫描显微成像系统(德国Precipoint公司); q-PCR仪(美国Bio-Red公司)。
动物 4周龄雄性BALB/c小鼠, 购于广东省医学实验动物中心, 实验动物许可证编号: SCXK (粤) 2018-0002。饲养温度为25 ℃, 相对湿度为55%, 12 h明暗交替环境, 标准饲料和水喂养。小鼠适应性喂养1周后进行实验。本研究涉及的动物感染实验和动物样本采集在生物安全Ⅱ级(BSL-2) 实验室进行, 动物饲养于P2实验室。动物福利和实验过程均遵循暨南大学动物伦理委员会的规定。
病毒和细胞 本研究用的HSV-1毒株(F株) 在Vero细胞上进行扩增。Vero细胞用含10%胎牛血清的DMEM培养。Vero细胞和HSV-1毒株(F株) 由暨南大学王一飞课题组馈赠。
动物分组与处理 将BALB/c小鼠随机分成正常对照组和病毒感染组。经异氟烷轻度麻醉后, 病毒感染组小鼠鼻滴感染HSV-1病毒(1×106 PFU)。对照组小鼠滴入等体积的DMEM培养基(每只20 μL)。感染4周后, 将病毒感染组存活下来的小鼠随机分为潜伏组、激活组、清热消炎宁低剂量组、清热消炎宁高剂量组和阳性药阿昔洛韦组。采用人与小鼠的体表面积换算系数计算出小鼠的给药剂量, 设定低剂量组为0.658 g·kg-1·day-1, 按人体等效剂量的2.64倍; 高剂量组为1.316 g·kg-1·day-1, 按人体等效剂量的5.28倍。阳性药物选用阿昔洛韦, 参照临床用量选用剂量0.206 g·kg-1·day-1。对清热消炎宁低、高剂量组和阿昔洛韦组小鼠每天进行灌胃给药, 连续给药1周。潜伏组和激活组小鼠给予等体积的生理盐水。除正常组和潜伏组外, 其他组小鼠在给药的第4天开始给予拘束应激处理, 即将小鼠置于50 mL通风拘束管中, 每天拘束12 h, 连续拘束4天, 在此期间, 所有小鼠禁水禁食。最后一次拘束应激结束以后, 将小鼠安乐死进行取材, 以用于后续相关指标的检测。
免疫组织化学法检测小鼠脑组织中HSV-1抗原分布 脑组织石蜡切片经常规脱蜡、水化、抗原修复后, 用rabbit anti-HSV-1 (1∶100) 孵育过夜, HRP标记二抗室温孵育30 min, DAB工作液显色, 中性树脂封片后, 在扫描显微镜下观察脑组织HSV-1感染的情况。
空斑法检测小鼠脑组织中的病毒滴度 将取出的脑组织用含2%双抗的冷PBS洗涤3遍, 往脑组织中加入含10% FBS、1%谷氨酰胺、100 u·mL-1青霉素和100 μg·mL-1链霉素的DMEM培养液中, 超声破碎。将收集到的脑组织悬浮液经过3次反复冻融后, 接种到Vero单层细胞上, 放置于37 ℃、5% CO2培养箱中吸附3 h, 弃去上清, 用PBS洗3遍, 加入含5% FBS、1%谷氨酰胺、100 u·mL-1青霉素和100 μg·mL-1链霉素的DMEM培养液, 于培养箱中孵育4天后, 收集上清, 重新接种到铺有Vero单层细胞的6孔板中, 吸附3 h加入细胞覆盖液(0.5% FBS + 0.5%羧甲基纤维素) 1 mL继续培养7天后, 加入500 μL的4%甲醛溶液固定30 min后, 吸弃甲醛固定液, 加入1%结晶紫使用液500 μL, 染色30 min。自来水冲洗后, 计算空斑数目。
RT-PCR检测小鼠脑组织中ICP27和gB基因的表达 依照试剂盒说明书提取脑组织总RNA, 定量并检测样品RNA纯度, 将提取的RNA用反转录试剂盒合成cDNA, 扩增目的基因。逆转录反应体系20 μL, 反应条件为37 ℃, 15 min; 85 ℃, 5 s; 4 ℃; PCR扩增反应体系为20 μL, 反应程序为95 ℃, 3 min; 95 ℃, 30 s; 60 ℃, 30 s; 共40个循环。实验中所用到的引物由上海生工生物有限公司合成, 引物序列见表 1。
| Table 1 The primer sequences for real-time quantitative PCR. gB: Glycoprotein B; ICP27: Infected cell polypeptide 27 |
Western blot法检测小鼠脑组织中ICP27、gB、4-HNE、ALOX15、TFR1、DMT1、GPX4和iPLA2β蛋白的表达 利用总蛋白提取试剂盒提取各组小鼠脑组织中的蛋白, 根据BCA试剂盒测定蛋白浓度。蛋白经变性后, 进行SDS-PAGE电泳, 湿法转膜60 min。一抗4 ℃孵育过夜, 一抗配制比例如下: ICP27 (1∶1 000)、gB (1∶1 000)、4-HNE (1∶1 000)、ALOX15 (1∶1 000)、TFR1 (1∶1 000)、DMT1 (1∶500)、GPX4 (1∶1 000)、iPLA2β (1∶1 000) 及GAPDH (1∶3 000); 二抗稀释液室温孵育2 h。用化学发光工作站进行成像, 用Image J软件对图像进行分析, 结果以目的蛋白与内参蛋白GAPDH的光密度比值表示。
MDA检测试剂盒检测小鼠脑中MDA的含量 具体操作步骤按试剂盒说明书进行。
统计学分析 实验数据采用GraphPad Prism6.0进行统计分析, 数据以
从小鼠给药第一天起, 每天定时记录小鼠的体质量, 计算小鼠体质量变化率。实验结果见图 1A, 与潜伏组相比, 激活组小鼠体质量显著降低; 与激活组相比, 清热消炎宁高剂量组和阳性药阿昔洛韦组小鼠体质量显著升高。眼部炎性症状的结果见图 1B, 潜伏组小鼠眼部无感染症状, 激活组小鼠眼部周围掉毛, 角膜上有一层灰白色沉积物。与激活组相比, 清热消炎宁低、高剂量组和阳性药阿昔洛韦组小鼠的眼部感染症状明显减轻。对每组小鼠的眼部炎症评分进行统计分析, 结果见图 1C, 激活组小鼠的角膜炎复发率为60%, 清热消炎宁低、高剂量组小鼠的角膜炎复发率为30%, 阿昔洛韦组小鼠的角膜炎复发率为20%, 以上结果表明, 清热消炎宁对HSV-1激活复发小鼠的体质量有保护作用, 并能降低其眼部炎症的复发率。
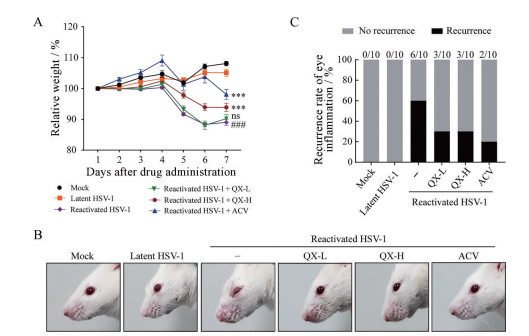
|
Figure 1 Effect of Qingre Xiaoyanning on body weight and recurrent eye infections in herpes simplex virus type 1 (HSV-1) reactivated mice. A: The relative body weight of mice was monitored for 7 consecutive days; B, C: The left eyes of mice were observed and recorded from different groups. n = 10, |
RT-PCR结果见图 2A, 与潜伏组相比, 激活组小鼠的脑中检测到大量的ICP27和gB病毒基因的表达, 而与激活组相比, 清热消炎宁给药组及阳性药阿昔洛韦组小鼠的脑组织中ICP27和gB病毒基因的表达水平明显下调。同时, Western blot结果(图 2B) 显示, 与激活组相比, 给药组ICP27和gB蛋白的表达水平明显下调。以上结果表明, 清热消炎宁能有效降低HSV-1激活复发小鼠脑组织中病毒相关基因和蛋白的表达量。
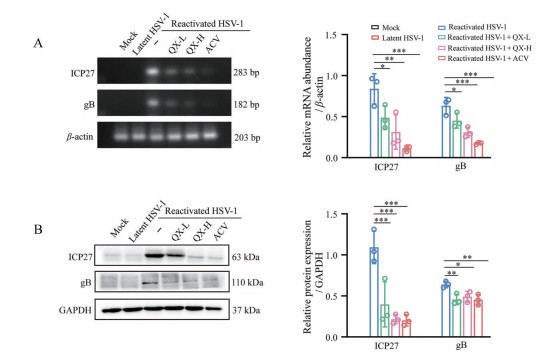
|
Figure 2 Effect of Qingre Xiaoyanning on the viral protein and gene expression in brain tissue of HSV-1 reactivated mice. A: RT-qPCR was utilized to detect the level of ICP27 and gB in brain, and β-actin was employed as the housekeeping gene; B: The expression of ICP27 and gB were detected by Western blot. n = 3, |
免疫组织化学染色结果见图 3A, 在潜伏组小鼠脑组织的海马区未检测到HSV-1抗原分布, 而在激活组小鼠脑组织的海马区中检测到HSV-1抗原的大量表达。与激活组相比, 清热消炎宁给药组及阳性药阿昔洛韦组的HSV-1抗原阳性染色相对较少。空斑法检查病毒滴度的实验结果见图 3B, 与潜伏组相比, 激活组小鼠病毒滴度显著增加, 与激活组相比, 清热消炎宁给药组及阿昔洛韦阳性药组的病毒滴度明显降低。以上结果表明, 清热消炎宁能有效降低HSV-1激活复发小鼠脑组织中HSV-1抗原的分布和病毒滴度。
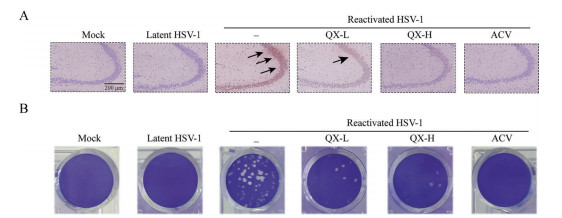
|
Figure 3 Effect of Qingre Xiaoyanning on distribution of HSV-1 antigen and titer of HSV-1 in HSV-1-reactivated mice. A: The expression of HSV-1 antigen in mouse hippocampus was observed by immunohistochemistry assay. Positive HSV-1 antigens were marked in black arrow; B: The brain was sampled and tested by PFU assay for viral particles |
为了探究清热消炎宁是否能降低HSV-1激活复发小鼠脑组织中的脂质过氧化水平, 本研究分别采用Western blot法和试剂盒检测脂质过氧化产物4-HNE水平和MDA含量。Western blot结果见图 4A, 与潜伏组相比, 激活组小鼠脑中4-HNE的表达量显著上调。与激活组相比, 给药组小鼠的脑组织中4-HNE的表达水平显著下调。MDA水平检测结果见图 4B, 与潜伏组相比, 激活组小鼠脑中MDA水平的显著增加, 与激活组相比, 清热消炎宁能显著降低MDA的水平。以上结果表明, 清热消炎宁能有效降低HSV-1激活复发小鼠脑组织中的脂质过氧化水平。
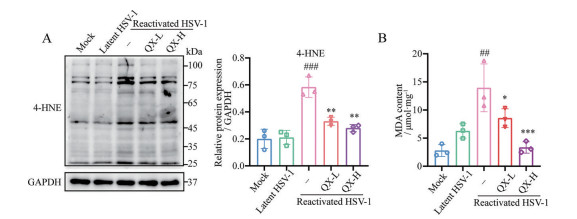
|
Figure 4 Effect of Qingre Xiaoyanning on the lipid peroxidation levels in brain tissue of HSV-1 reactivated mice. A: The levels of 4-hydroxynonenal (4-HNE) in midbrain were measured by Weatern blot; B: The levels of malondialdehyde (MDA) in midbrain were measured by lipid peroxidation MDA assay kit. n = 3, |
为了进一步探究清热消炎宁降低HSV-1激活复发小鼠脑组织中的脂质过氧化水平是否与调控铁死亡通路相关蛋白有关, 采用Western blot法检测小鼠脑组织中铁死亡通路相关蛋白的表达水平。实验结果见图 5, 与潜伏组相比, 激活组小鼠脑中ALOX15、TFR1和DMT1的蛋白表达明显上调, 清热消炎宁能显著降低这3个蛋白的表达水平, 而对GPX4和iPLA2β的蛋白表达水平无影响。结果显示, 在HSV-1激活复发小鼠的脑组织中, 铁死亡通路正调节相关蛋白表达水平显著上调, 而清热消炎宁能下调这些蛋白的表达。以上结果表明, 清热消炎宁能有效降低情志应激诱导的HSV-1激活复发小鼠脑组织中铁死亡相关蛋白的表达水平。
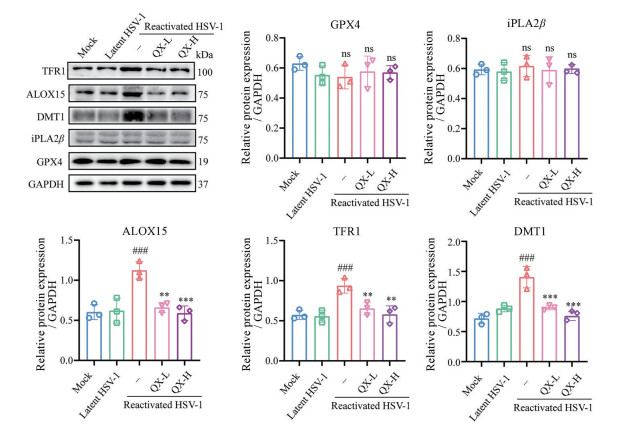
|
Figure 5 Effect of Qingre Xiaoyanning on ferroptosis pathway-related proteins in brain tissue of HSV-1 reactivated mice. The ferroptosis pathway-related proteins expressions GPX4, iPLA2β, ALOX15, TFR1, DMT1 were determined by Western blot. n = 3, |
HSV-1为较早发现的人类疱疹病毒, 是人类病毒性疾病中常见易感的病毒。HSV-1不仅可引起原发感染, 还可以造成潜伏感染和复发[13]。当机体遭受应激负荷时, 会引起潜伏HSV-1重激活。有研究表明, 大脑中潜伏的HSV-1反复重激活是导致神经退行性疾病的危险因素之一[14-16]。但遗憾的是, 在迄今为止发现的抗病毒药物中, 仍然没有一种药物能在HSV-1病毒已经建立潜伏的情况下防止其重新激活[17]。而且随着抗HSV-1药物的全面广泛使用, HSV-1病毒已产生多种耐药性毒株, 相互之间易产生交叉耐药性, 这些抗HSV-1药物现已不能全面抑制HSV-1的复制。因此, 开发抗HSV-1激活复发类药物对于疱疹病毒感染及其并发症的治疗具有重大意义。近年来, 中药及其单体成分抗病毒的作用和机制日益得到了广泛的重视及研究, 而且取得了巨大的进展, 这为开辟寻找高效低毒的抗病毒药物提供了巨大的宝藏。
清热消炎宁是一种清肝泻火类中药, 本课题组在前期研究中发现, 清热消炎宁可以通过调节HSV-1病毒易感性, 发挥抗HSV-1病毒感染的作用[12]。以上结果提示, 清热消炎宁在抑制HSV-1激活复发方面具有巨大潜力。因此, 本课题组在前期建立的情志应激诱导HSV-1激活复发的动物模型上[11], 进一步研究清热消炎宁抑制潜伏HSV-1激活的作用及机制。本研究发现, 相对于潜伏组, 激活组小鼠的体质量显著下降, 眼部感染症状明显, 并且在脑中检测到HSV-1病毒抗原的表达、病毒颗粒的存在以及病毒基因和蛋白ICP27和gB的表达, 这些结果说明情志应激诱导的HSV-1激活复发模型建立成功。随后, 本研究利用该模型探讨清热消炎宁对HSV-1激活复发的影响中发现, 清热消炎宁能够有效减缓HSV-1激活复发的小鼠的体质量下降幅度, 显著降低眼部炎症复发率, 并且能够有效降低脑部病毒抗原的分布、病毒滴度及ICP27和gB的基因和蛋白表达水平, 这表明清热消炎宁能够有效抑制情志应激诱导HSV-1的激活复发。
铁死亡是一种依赖于铁累积和脂质过氧化反应, 而表现出特定的生物学和形态学特征的新型程序性死亡途径[18]。铁死亡的诱导因子通过非酶促(芬顿反应或转运蛋白依赖途径) 或酶促反应, 直接或间接导致细胞内过氧化脂质积累, 最终导致细胞的氧化死亡[19]。铁死亡的调节机制一般涉及氨基酸代谢、铁代谢和脂质代谢等3个方面[20, 21]。铁代谢调控在铁死亡过程中发挥举足轻重的作用。肠道吸收或红细胞降解产生的Fe2+被血浆铜蓝蛋白氧化成Fe3+并与转铁蛋白(transferrin, TF) 结合形成TF-Fe3+复合物, 在TFR1的作用下, TF-Fe3+复合物被胞吞进细胞内, Fe3+通过前列腺跨膜上皮抗原3还原成Fe2+, 并通过DMT1释放到细胞质中[22], 参与芬顿反应, 产生毒性更强的羟基自由基, 促进脂质过氧化进程, 进而导致铁死亡[23, 24]。脂质代谢也与铁死亡之间存在着密切联系。研究表明, 胞质中游离多不饱和脂肪酸(polyunsaturated fatty acid, PUFA) 被酰基辅酶A合成酶长链家族成员4 (acyl-CoA synthetase long chain family member 4, ACSL4) 乙酰化后, 在溶血磷脂酰胆碱酰基转移酶3 (lysophosphatidylcholine acyltransferase 3, LPCAT3) 的作用下掺入细胞膜的磷脂中形成PUFA-PL, 后者在花生四烯酸脂氧合酶5/12/15 (arachidonate5/12/15-lipoxygenase, ALOX5/12/15) 的催化下, PUFA-PL会被氧化成PL-PUFA-OOH, 并最终导致铁死亡[25]。本研究发现, 与潜伏组小鼠相比, 激活组小鼠脑中脂质过氧化水平升高, 而清热消炎宁能显著降低脂质过氧化水平。并且结果显示, 激活组小鼠脑中铁死亡通路正调节相关蛋白DMT1、TFR1和ALOX15表达发生显著上调, 而清热消炎宁能够显著下调这些蛋白的表达。本研究结果提示, 铁死亡可能是情志应激引起HSV-1激活复发的重要病理机制, 清热消炎宁可能通过干预铁死亡相关调控因子, 降低脂质过氧化水平, 从而抑制情志应激诱导的HSV-1激活复发。
综上所述, 本研究阐明了清热消炎宁抑制情志应激诱导HSV-1激活复发的作用及机制。相关研究结果能够为开发新型抗HSV-1激活复发类药物治疗疱疹病毒感染及其并发症提供科学依据。
作者贡献: 何蓉蓉、李怡芳负责实验设计和指导; 姜珊进行论文的整体实验、数据分析和撰写论文; 牛杰、欧阳淑桦、江涛、彭红英、罗卓、李怡芳、栗原博和何蓉蓉对实验进行具体指导和论文修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Piret J, Boivzn G. Resistance of herpes simplex viruses to nucleoside analogues: mechanisms, prevalence, and management[J]. Antimicrob Agents Chemother, 2011, 55: 459-472. DOI:10.1128/AAC.00615-10 |
| [2] |
Whitley RJ. Herpes simplex virus infections of the central nervous system[J]. Continuum, 2015, 21: 1704-1713. |
| [3] |
Kovjah L, Suryawanshi RK, Shukla D. Pathological processes activated by herpes simplex virus-1 (HSV-1) infection in the cornea[J]. Cell Mol Life Sci, 2019, 76: 405-419. DOI:10.1007/s00018-018-2938-1 |
| [4] |
Rozenberg F. Herpes simplex virus and central nervous system infections: encephalitis, meningitis, myelitis[J]. Virologie, 2020, 24: 283-294. DOI:10.1684/vir.2020.0862 |
| [5] |
Duarte LF, Farias MA, Alvarez DM, et al. Herpes simplex virus type 1 infection of the central nervous system: insights into proposed interrelationships with neurodegenerative disorders[J]. Front Cell Neurosci, 2019, 13: 46. |
| [6] |
Harris SA, Harris EA. Molecular mechanisms for herpes simplex virus type 1 pathogenesis in Alzheimer's disease[J]. Front Aging Neurosci, 2018, 10: 48. DOI:10.3389/fnagi.2018.00048 |
| [7] |
Itzhaki RF, Wozniak MA. Herpes simplex virus type 1 in Alzheimer's disease: the enemy within[J]. Alzheimers Dis, 2008, 13: 393-405. DOI:10.3233/JAD-2008-13405 |
| [8] |
Mancuso R, Sicurena M, Agoseini S, et al. Herpes simplex virus type 1 and Alzheimer's disease: link and potential impact on treatment[J]. Expert Rev Anti Infect Ther, 2019, 17: 715-731. DOI:10.1080/14787210.2019.1656064 |
| [9] |
Wang QJ, Bao J, Li S, et al. Relationship between irritated and virus[J]. 中国中医急症杂志, 2015, 24: 453-456. |
| [10] |
Zhu SR, Luo X, Li YF, et al. Emotional stress-induced Shanghuo syndrome increases disease susceptibility[J]. 中国中药杂志, 2018, 43: 1529-1535. |
| [11] |
Jiang S, Luo Z, Liang L, et al. Establishing an animal model for TCM theory "liver qi stagnation forming Huo" using emotional stress activated latent HSV-1 [J/OL]. World J Tradit Chin Med (世界中医药杂志), 2022. http://kns.cnki.net/kcms/detail/11.5529.R.20220311.1646.035.html
|
| [12] |
OuYang SH, Wang XH, Li W, et al. Qingre Xiaoyanning capsules alleviate HSV-1 susceptibility induced by emotional stress[J]. 中国中药杂志, 2021, 46: 4208-4213. |
| [13] |
Kukhanova MK, Korovina AN, Kochetkov SN, et al. Human herpes simplex virus: life cycle and development of inhibitors[J]. Biochemistry (Mosc), 2014, 79: 1635-1652. DOI:10.1134/S0006297914130124 |
| [14] |
Chiara GD, Marcocci ME, Sgarbanti R, et al. Infectious agents and neurodegeneration[J]. Mol Neurobiol, 2012, 46: 614-638. DOI:10.1007/s12035-012-8320-7 |
| [15] |
Chiara GD, Piacentini R, Fabiani M, et al. Recurrent herpes simplex virus-1 infection induces hallmarks of neurodegeneration and cognitive deficits in mice[J]. PLoS Pathog, 2019, 15: e1007617. DOI:10.1371/journal.ppat.1007617 |
| [16] |
Rosa FL, Agostini S, Bianchi A, et al. Herpes simplex virus-1 (HSV-1) infection induces a potent but ineffective IFN-λ production in immune cells of AD and PD patients[J]. J Transl Med, 2019, 17: 286. DOI:10.1186/s12967-019-2034-9 |
| [17] |
Klysik K, Pietraszel A, Karewicz A, et al. Acyclovir in the treatment of herpes viruses - a review[J]. Curr Med Chem, 2020, 27: 4118-4137. DOI:10.2174/0929867325666180309105519 |
| [18] |
Stockwell BR, Jiang X, Gu W. Emerging mechanisms and disease relevance of ferroptosis[J]. Trends Cell Biol, 2020, 30: 478-490. DOI:10.1016/j.tcb.2020.02.009 |
| [19] |
Xie Y, Hou W, Song X, et al. Ferroptosis: process and function[J]. Cell Death Differ, 2016, 23: 369-379. DOI:10.1038/cdd.2015.158 |
| [20] |
Zheng J, Conrad M. The metabolic underpinnings of ferroptosis[J]. Cell Metab, 2020, 32: 920-937. DOI:10.1016/j.cmet.2020.10.011 |
| [21] |
Li J, Cao F, Yin HL, et al. Ferroptosis: past, present and future[J]. Cell Death Dis, 2020, 11: 88. DOI:10.1038/s41419-020-2298-2 |
| [22] |
Wilkinson HN, Upson SE, Banyard KL, et al. Reduced iron in diabetic wounds: an oxidative stress-dependent role for STEAP3 in extracellular matrix deposition and remodeling[J]. J Invest Dermatol, 2019, 139: 2368-2377.e7. DOI:10.1016/j.jid.2019.05.014 |
| [23] |
Doll S, Conrad M. Iron and ferroptosis: a still ill-defined liaison[J]. IUBMB Life, 2017, 69: 423-434. DOI:10.1002/iub.1616 |
| [24] |
Battaglia AM, Chirillo R, Averso I, et al. Ferroptosis and cancer: mitochondria meet the "iron maiden" cell death[J]. Cells, 2020, 9: 1505. DOI:10.3390/cells9061505 |
| [25] |
Yang WS, Stockwell BR. Ferroptosis: death by lipid peroxidation[J]. Trends Cell Biol, 2016, 26: 165-176. DOI:10.1016/j.tcb.2015.10.014 |
 2022, Vol. 57
2022, Vol. 57


