2. 中国医学科学院、北京协和医学院药物研究所, 北京 100050;
3. Department of Surgery, University of Toronto, Toronto M5S1A8, Canada
2. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
3. Department of Surgery, University of Toronto, Toronto M5S1A8, Canada
胱氨酸/谷氨酸反向转运体(cystine/glutamate antiporter), 又称为system Xc(-) (SXC), 首次于1980年在人二倍体成纤维细胞中发现[1]。自system Xc(-) 被发现后, 越来越多的研究结果表明该转运体在癌症、神经退行性疾病和眼部疾病等中发挥着重要的作用, 已成为治疗以上疾病的重要靶点。
1 System Xc(-) 的生物学 1.1 System Xc(-) 的结构System Xc(-) 是一种不依赖钠离子的氨基酸转运蛋白, 由轻链亚基xCT (SLC7A11) 和重链亚基4F2hc/CD98 (SLC3A2) 通过二硫键组成的异二聚体[2]。轻链亚基SLC7A11是SLC7家族中的成员, 该家族主要包括阳离子氨基酸转运蛋白(CAT家族, SLC7A1~SLC7A4和SLC7A14) 和糖蛋白相关氨基酸转运蛋白(gpaAT家族, SLC7A5~SLC7A11和SLC7A15) 两个亚族。其中糖蛋白相关氨基酸转运蛋白没有糖基化, 需要与SLC3家族的糖蛋白4F2hc (CD98) 或rBAT (D2、NBAT) 结合[3]。
根据已有文献可知, xCT是一种典型的螺旋束蛋白(502个氨基酸), 含有12个跨膜螺旋结构域的拓朴结构模型, N和C末端均位于细胞内, 在细胞内第2和第3环之间具有底物特异性的可折返的环状结构[2, 3]。4F2hc是II型膜糖蛋白(526个氨基酸), 由一个N端胞质内区域(75个氨基酸)、一个单一的疏水性假定跨膜结构域和C端胞外结构域(428个氨基酸) 组成[4] (图 1)。
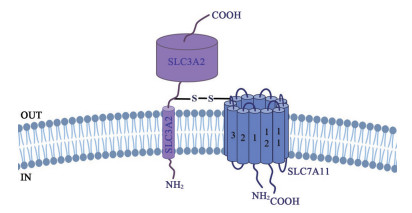
|
Figure 1 Cystine/glutamate antiporter [system Xc(-)] topology diagram |
System Xc(-) 几乎存在于所有的哺乳动物细胞系中。在人体中, system Xc(-) 主要在脑和脊髓中高表达, 但在外周血白细胞、脾脏、胸腺和淋巴结中均未检测到[5]。在小鼠中, system Xc(-) 在胸腺和脾脏中高表达, 而在心、肺、肾脏与肝脏中低表达[6]。在细胞中, system Xc(-) 主要在神经胶质细胞中表达, 特别是在小胶质细胞和星形胶质细胞中, 已在多种神经系统疾病中得到证实[7]。同时, system Xc(-) 在纤维细胞、单核细胞、巨噬细胞和视网膜细胞等细胞中也有表达[8, 9]。
2 System Xc(-) 在生理与病理中的作用 2.1 System Xc(-) 在生理条件下的作用System Xc(-) 是一种特异性、电中性、阴离子氨基酸转运蛋白, 其中重链亚基SLC3A2参与质膜的运输, 轻链亚基xCT赋予运输和底物的特异性。System Xc(-) 是依赖氯不依赖钠, 按照1∶1比率交换胞膜内外谷氨酸与胱氨酸的反向转运体, 质膜上的底物浓度梯度决定了system Xc(-) 的交换。在生理条件下, system Xc(-) 主要介导胱氨酸的摄取与谷氨酸的输出, 有助于维持细胞内外谷氨酸、胱氨酸和半胱氨酸的平衡[10]。在细胞外环境中, 半胱氨酸很容易被氧化为胱氨酸, 后者可以通过system Xc(-) 进入细胞, 立即被还原为半胱氨酸, 参与谷胱甘肽的合成。外部条件对system Xc(-) 的转运具有一定的影响, 如pH的大小等。已有文献[11]表明, 在pH 5.8~8.0内, 对培养的人二倍体细胞中的谷氨酸与胱氨酸的转运进行了研究, 发现胱氨酸的初始摄取率随着pH值的增加而增加, 谷氨酸的摄取不受pH大小的影响。
System Xc(-) 具有维持细胞外谷氨酸浓度和调节氧化应激的双重作用。一方面, system Xc(-) 介导输出的谷氨酸主要负责大脑中细胞外谷氨酸的浓度, 在维持神经系统内谷氨酸稳态方面起着关键作用(图 2)。谷氨酸稳态的破坏与大脑的许多疾病的发生有关, 可能导致突触活动的显著变化, 称为中枢神经(central nervous system, CNS) 毒性; 另一方面, 通过system Xc(-) 转运的胱氨酸在内源性抗氧化应激防御系统中发挥重要作用。研究表明, 干扰system Xc(-) 的功能可降低细胞内半胱氨酸和谷胱甘肽的含量, 从而导致抗氧化功能障碍, 伴随活性氧增加和脂质过氧化的产生, 最终导致细胞死亡和疾病的发生。
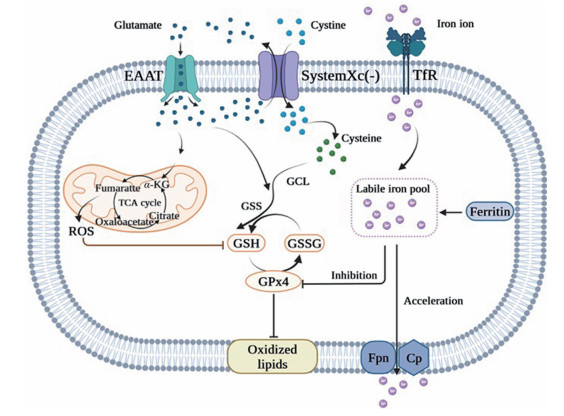
|
Figure 2 Physiological effects of system Xc(-). System Xc(-) mainly mediates the uptake of cystine and the output of glutamic acid. Cystine is immediately reduced to cysteine, which synthesizes antioxidant glutathione (GSH) with glutamic acid cysteine ligase (GCL) and glutathione synthase (GSS) to regulate the balance of intracellular oxidative stress. Extracellular glutamate can enter cells through excitatory amino acid transporter (EAAT), and part of it enters mitochondria to participate in the tricarboxylic acid cycle (TCA cycle). Transferrin receptor (TFR) transport extracellular iron ions into cells, where they are stored in iron pools, and ferroportin (Fpn) and ceruloplasmin (Cp) export intracellular iron ions. Changes in iron ions and reactive oxygen species (ROS) content can affect the oxidation balance in cells, leading to lipid peroxidations. GPX4: Glutathione peroxidase 4; GSSG: Oxidized glutathione |
System Xc(-) 的生理功能主要依赖于SLC7A11, SLC7A11的转录调控是决定system Xc(-) 活性的重要因素之一。已有文献证明, 核因子红细胞系2相关因子2 (nuclear factor erythroid 2-related factor 2, NRF2) 从Kelch样ECH相关蛋白1 (Kelch-like ECH-associated protein 1, Keap1) 中分离, 转位到细胞核中, 并与SLC7A11启动子中的抗氧化反应元件(antioxidant response element, ARE) 相互作用, 促使SLC7A11转录上调[5]。激活转录因子4 (transcription factor 4, ATF4) 与ARE相互作用, 增加SLC7A11的转录。激活转录因子3 (transcription factor 3, ATF3) 通过形成ATF3二聚体, 抑制SLC7A11的转录[12]。
肿瘤抑制因子p53可以通过调节蛋白去泛素化来抑制SLC7A11 mRNA的表达[13]。肿瘤抑制因子BRCA1相关蛋白1 (BRCA1-associated protein 1, BAP1) 可以抑制组蛋白2A的泛素化(histone 2A ubiquitination, H2Aub), 两者相互作用可以抑制SLC7A11的转录[14]。此外, 多梳抑制复合物1 (polycomb repressive complex 1, PRC1) 是H2Aub的主要泛素连接酶, 可以增加H2Aub与SLC7A11启动子的结合。BAP1和PRC1均能抑制SLC7A11的表达, 表明动态调控H2Aub对SLC7A11的抑制至关重要[5]。
2.2 System Xc(-) 在病理过程中的作用 2.2.1 氧化应激氧化应激是指细胞内氧化还原平衡被打破, 活性氧(reactive oxygen species, ROS) 的产生速率超过了体内的清除速率, 导致活性氧大量积累的病理过程。氧化应激会对细胞的信号传导、能量代谢及生长增殖产生重要的影响。谷胱甘肽(glutathione, GSH) 是细胞中普遍存在的抗氧化剂, 由谷氨酸、半胱氨酸和甘氨酸组成的含γ-酰胺键和巯基的三肽, 能够有效地降低细胞内活性氧的水平, 在细胞氧化还原稳态中起重要作用。System Xc(-) 可以将细胞外的胱氨酸转运至细胞内, 并将其还原为半胱氨酸, 参与GSH的合成。由此看出, 在氧化应激状态下, 通过促进system Xc(-) 的转运来增加胱氨酸摄取以增加GSH合成。
在视网膜色素上皮细胞中, GSH耗竭会诱导细胞死亡(凋亡、自噬、铁死亡和坏死性死亡) 和细胞过早衰老病理性过程[15]。铁死亡是一种铁依赖非凋亡形式的程序性细胞死亡, 其原因是ROS和脂质过氧化的积累[16]。在细胞形态上的表现为细胞内线粒体皱缩、膜密度增加、线粒体嵴减少或消失[17]。
System Xc(-)-GSH-GPX4途径是保护细胞的最重要的抗氧化系统之一。谷胱甘肽过氧化物酶4 (glutathione peroxidase 4, GPX4) 是机体内广泛存在的一种重要的过氧化物分解酶, 生理功能主要是催化GSH参与过氧化反应, 清除在细胞呼吸代谢过程中产生的过氧化物和羟自由基, 将脂质过氧化氢转化为无毒的脂质醇的过程, 从而减轻细胞膜多不饱和脂肪酸的过氧化作用, 是防止脂质过氧化避免细胞遭受非凋亡性铁依赖性死亡的关键物质。System Xc(-) 可以调控GSH的合成和GPX4的活性, 进而调控铁死亡的发展过程(图 2)。
根据已有文献显示, 变异性拼接外显子的CD44 (膜黏附糖蛋白) 转录子(CD44v) 与SLC7A11相互作用, 能够调节system Xc(-) 的稳定性, 促进GSH的生物合成, 降低ROS水平, 上调细胞中抗氧化剂水平[18]。ATF3以与SLC7A11启动子结合并不依赖p53的方式抑制system Xc(-) 的激活, 耗尽细胞内的GSH, 促进埃拉斯汀(erastin) 与RSL3 (GPX4的抑制剂) 诱导的脂质过氧化。ATF3促进erastin诱导的谷胱甘肽特异性γ-谷氨酰环转移酶1 (CHAC1) 表达, CHAC1被证明可以介导GSH降解, 反过来还可以加强RSL3对GPX4的抑制作用。CHAC1是真核翻译起始因子2α (eukaryotic initiation factor 2α, eIF2α)-ATF4通路的下游靶标, 实验结果表明CHAC1上调能够降低细胞内胱氨酸和半胱氨酸的水平[19]。同时ATF3还可以调节热休克蛋白5 (heat shock 70 kDa protein 5, HSPA5) 的表达, HSPA5编码的蛋白与GPX4结合, 可以防止GPX4降解[20]。ATF4也可以反式激活SLC7A11和HSPA5来抑制铁死亡[21]。P53可以抑制SLC7A11并激活转录激活因子1 (signal transducer and activator of transcription 1, STAT1) 的表达来促进氧化应激诱导的铁死亡[22]。eIF2α磷酸化诱导ATF4介导的综合应激反应, 该反应提供了蛋白质和谷胱甘肽生物合成所需的氨基酸, 并保护细胞免受氧化应激的影响[21]。
2.2.2 谷氨酸兴奋性毒性谷氨酸是人体中极性带负电的氨基酸之一, 主要来源于食物摄取和体内合成, 在蛋白质的结构、营养、新陈代谢和信号传导中发挥着关键的作用。体内的谷氨酸可以由α-酮戊二酸在谷氨酸脱氢酶或多种转氨酶的条件下合成, 还可以由其他氨基酸合成, 包括谷氨酰胺、精氨酸、脯氨酸和组氨酸等。在蛋白质合成过程中, 谷氨酸能够提供负电荷, 常常出现在蛋白质的外表面, 起到稳定蛋白结构的作用。谷氨酸与阳离子的结合能力较弱, 但它对钙的亲和力可以通过维生素K依赖性的羧化作用大大增加。该羧化作用可以将γ-羧化谷氨酰残基引入蛋白质中, 从而促进蛋白质的修饰, 增加蛋白的稳定性[23]。谷氨酸不仅是中枢神经系统中的兴奋性神经递质, 还是抑制性神经递质γ-氨基丁酸的直接前体, 能够介导快速突触传递, 活跃于大部分CNS的突触中[24]。谷氨酸是GSH的主要合成原料物质, 而后者是细胞内主要的抗氧化剂, 几乎存在于所有的细胞与组织中, 发挥抗氧化的作用。谷氨酸、胱氨酸与半胱氨酸能够调节细胞与组织的新陈代谢, 是GSH的合成前体, 对维持GSH水平很重要。
越来越多的研究表明, 哺乳动物中枢神经系统的兴奋性突触传递主要是由谷氨酸介导的, 谷氨酸能够促使几乎所有中枢神经元兴奋[22]。在正常生理状态下, 当细胞接收到刺激信号, 产生谷氨酸, 谷氨酸与相应的受体结合, 使神经元接收到兴奋信号, 从而对兴奋信号进行传导。谷氨酸兴奋性毒性是指过度或者持续性地激活谷氨酸受体, 引发神经细胞持续兴奋, 导致神经元功能障碍及退化, 最终导致细胞死亡的过程。
谷氨酸诱导的细胞毒性大小与其抑制胱氨酸摄取能力成正比[25, 26]。System Xc(-) 能够向胞内输入胱氨酸, 同时会向胞外输出谷氨酸, 当胞外谷氨酸浓度过高时, system Xc(-) 的功能被抑制, 细胞内的半胱氨酸将会被耗尽。以xCT敲除小鼠为模型, system Xc(-) 可以通过促进氧化应激、谷氨酸神经毒性介导甲基苯丙胺诱导的神经毒性[21]。
3 System Xc(-) 在不同疾病中的作用及机制System Xc(-) 是哺乳动物维持氧化还原稳态、免疫系统功能、记忆功能形成所必需的条件[14, 27], 同时与肿瘤生长存活、干细胞的生长与耐药性以及神经功能障碍有关[28]。System Xc(-) 已被证明在癌症、神经退行性疾病和眼部疾病等中发挥作用。
3.1 癌症System Xc(-) 在调节氧化应激方面发挥重要的作用, 可以通过调节氧化还原水平来调节细胞代谢, 为癌细胞的生长和死亡提供必要的条件。在研究癌症的过程中, 铁死亡已经成为了抗癌的重要策略, 通过system Xc(-) 调控铁死亡, 进而控制癌症的发展已经成为有效的抗癌途径。System Xc(-) 在胶质母细胞瘤、黑色素瘤和肺癌等各种癌症中表达水平异常升高。随着研究的深入, 已有文献[18]证明System Xc(-) 成为癌症恶化的驱动因素及预测恶性肿瘤的生物标志物。
已有文献表明, system Xc(-)与肿瘤进展密不可分。System Xc(-) 在胶质母细胞瘤患者中的表达总是处于高水平, 通过调节氧化还原反应来改变细胞代谢, 影响癌细胞的生长发育; 然而, 上调的system Xc(-) 不会促进细胞增殖。在胶质母细胞瘤中, system Xc(-) 的过表达使癌细胞具有转化为癌症干细胞的趋势[29]。System Xc(-) 还可以加速黑色素瘤细胞的增殖[30], 而敲除SLC7A11可抑制肿瘤生长, 并可能增加在小鼠模型中抗癌免疫疗法的有效性和持久性[31]。此外, 敲除SLC7A11导致癌细胞在G1或G1/S期的增殖延迟[32]。结直肠癌根治性手术后, SLC7A11阳性肿瘤的复发率是SLC7A11阴性肿瘤的3倍[33]。鉴于上述的实验结果, 进一步研究以发现更具体的调控机制是很有必要的。
在胃癌小鼠中, CD44促进xCT的表达和稳定性, 调节细胞内的GSH水平, 促进肿瘤细胞中抗氧化剂基因上调, 为肿瘤细胞提供了良好的存活条件。CD44表达降低会导致xCT减少, 促进P38的激活及细胞周期抑制剂P21 CIP/WAF1基因的表达, 最终抑制肿瘤的生长[14, 28, 34]。干扰素γ (interferon-gamma, IFNγ) 能够增加Bel7402和HepG2细胞中的活性氧水平并降低线粒体膜电位, 抑制system Xc(-) 的表达, 激活肝细胞癌细胞系中的JAK/STAT通路[5]。
3.2 中枢神经系统疾病人们在40多年前甚至更早就认识到了兴奋性神经递质谷氨酸在神经系统中的作用。System Xc(-) 是兴奋性信号传导和氧化应激之间的枢纽, 同时该系统对于维持GSH水平至关重要。由于以上的双重作用, system Xc(-) 涉及各种中枢神经系统性疾病, 包括神经退行性、成瘾性和精神类疾病。
以小胶质细胞为研究对象, 探究system Xc(-) 在神经退行性疾病中所发挥的作用。在中枢神经系统中, 小胶质细胞中的system Xc(-) 可以通过释放兴奋性神经递质谷氨酸来改变神经元对Aβ1-40的易感性[35], 也改变了小胶质细胞相关的促炎/神经毒性(M1) 和抗炎/神经保护(M2) 标志物的特征[36]。Aβ25-35能够通过促使Nrf2的激活和system Xc(-) 的上调来激活星形胶质细胞中的抗氧化反应。当受到炎症刺激时, 小胶质细胞从静息状态转变为激活状态, 发生迁移并释放大量谷氨酸。鉴于小胶质细胞是中枢神经系统生理与病理条件下的重要参与者, 推测system Xc(-) 将氧化应激转化为谷氨酸兴奋性毒性可以促进中枢神经退行性病变[37]。
帕金森病中黑质多巴胺能神经元细胞的大量损失与GSH和谷氨酸水平紊乱有关[38], 使用6-羟基多巴胺单侧损伤黑质-纹状体通路, 纹状体中xCT的表达增加, 首次表明小鼠纹状体细胞外70%的谷氨酸来自于system Xc(-) 的释放[39], system Xc(-) 参与帕金森病模型大脑纹状体中异常的谷氨酸神经传递[40]。System Xc(-) 能够通过释放大量谷氨酸, 激活代谢型谷氨酸受体5 (mGluR5), 导致脑内谷氨酸神经传递异常, 产生一系列早期帕金森病的症状, 最终诱发神经退行性疾病[41, 42]。β-N-甲基氨基-l-丙氨酸是一种非蛋白质氨基酸, 发挥抑制system Xc(-) 的作用, 导致胱氨酸摄取减少, GSH水平降低, 氧化应激水平升高, 最终导致神经元细胞的大量死亡[41]。在氧化应激反应中, CHAC1上调可作为缺乏胱氨酸或半胱氨酸细胞的帕金森病生物学指标[14, 42]。
System Xc(-) 可能成为抗癫痫治疗的新靶点, 在不同的慢性癫痫模型中, 比较xCT敲除小鼠与对照小鼠的癫痫的发病程度与易感性。xCT敲除的小鼠癫痫的发作率和严重程度的降低与α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA) 受体亚基GluA1的减少有关[43]。
System Xc(-) 能够维持谷氨酸神经递质的转运平衡, 参与氧化应激反应, 可以起到缓解谷氨酸神经毒性和预防氧化应激的作用。由此看来, system Xc(-) 可能成为治疗中枢神经系统疾病的潜在靶点。
3.3 眼部疾病氧化损伤已被确定为眼部疾病的主要致病因素。xCT已被证明在小鼠的角膜以及大鼠、小鼠和人的晶状体、晶状体上皮细胞、视网膜和各种视网膜细胞(Müller细胞) 中表达。在星形胶质细胞中, system Xc(-) 是缺血性视网膜中促红细胞生成素表达的关键调节剂。在缺氧条件下, system Xc(-) 能够增加细胞内GSH水平, 稳定低氧诱导因子2α (hypoxia-inducible factor 2α, HIF-2α), 上调星形胶质细胞中的促红细胞生成素的水平[44]。对野生型和xCT基因敲除小鼠房水中胱氨酸/半胱氨酸水平的测量显示, 与野生型小鼠相比, xCT基因敲除小鼠房水中胱氨酸水平升高, 而两者半胱氨酸水平不变, 导致氧化还原状态失衡。xCT基因的缺失可能是白内障早期发病的原因[45]。
3.4 其他在小胶质细胞中, system Xc(-) 可以将氧化应激转化为谷氨酸兴奋性毒性从而促进疾病的发展。由此推测, 如果病理过程涉及氧化应激失衡、兴奋性神经传导失调和谷氨酸代谢障碍, 均可从此入手, 探究system Xc(-) 在疾病发展过程中所扮演的角色。目前为止, 对于system Xc(-) 的研究主要集中在癌症和中枢神经系统疾病上, 对于其他疾病的研究也正在进行中。
在神经炎性脱髓鞘疾病中, 炎症反应是重要的反应机制, 免疫细胞浸润会导致中枢神经系统中的谷氨酸水平失调, 进而产生谷氨酸兴奋性毒性。System Xc(-) 能够将炎症反应与谷氨酸兴奋性毒性联系起来, 从而在免疫性脱髓鞘疾病中起重要作用。NOD样受体蛋白3 (NLRP3) 炎性体正在成为肝纤维化的治疗靶点。Auranofin (抗肝纤维剂) 通过抑制system Xc(-) 活性, 导致NLRP3炎症体活性降低[46]。
4 调控system Xc(-) 活性与药物靶点的研究 4.1 抑制system Xc(-) 活性的化合物具有抑制system Xc(-) 作用的化合物已在多种癌症中进行了药理学的研究。System Xc(-) 的抑制剂主要包括柳氮磺胺吡啶(sulfasalazine, SAS)、erastin和索拉菲尼(sorafenib)。顺铂、替莫唑胺、假月桂酸B、(S)-4-羧基苯甘氨酸和(+)-JQ1也可以发挥抑制system Xc(-) 的作用[5]。以上抑制剂大部分直接或者间接作用于SLC7A11并与其结合, 该过程一般是可逆的(erastin除外)。探究抑制剂对于system Xc(-)/SLC7A11转录和表达的影响是现阶段研究的主要内容, 在具体作用机制的研究方面, 包括结合位点、结合方式和调控机制的研究, 涉及较少。
4.1.1 SASSAS是在1940年首次由磺胺吡啶(一种抗生素) 和5-氨基水杨酸(一种抗炎剂) 通过偶氮桥连接的合成物[47], 被FDA批准为治疗溃疡性结肠炎、克罗恩病和类风湿性关节炎的药物[48], 现在广泛应用于治疗肠道、关节和视网膜的炎症。SAS是具有低效力和代谢不稳定特性的小分子化合物[49], 70%的药物在肠道中容易被结肠细菌通过偶氮还原酶裂解为磺胺吡啶与5-氨基水杨酸, 三者发挥抑制谷胱甘肽-S-转移酶的活性和慢性细菌感染的作用。SAS对system Xc(-) 具有抑制作用, 而两种代谢产物均不显示抑制活性[50]。SAS与其代谢产物在不同疾病中所发挥的作用存在一定的差异, 如在克罗恩病中, 5-氨基水杨酸和SAS似乎具有相当的活性, 均优于磺胺吡啶, 而在类风湿性关节炎中, 磺胺吡啶是活性部分[49]。
SAS是一种有效的system Xc(-) 抑制剂。在Nb2-SFJCD1细胞中, SAS能够显著抑制35S-L-胱氨酸的摄取, 该摄取过程是由system Xc(-) 所介导的, 首次证明了SAS对于system Xc(-) 具有抑制作用的特性[51, 52]。研究表明, SAS还可以干扰体细胞分泌半胱氨酸, 其中半胱氨酸的产生依赖于system Xc(-) 介导的胱氨酸的摄取。半胱氨酸的产生减少, 会降低GSH水平并增加ROS积累, 最终诱导铁死亡[50]。
临床试验结果表明, SAS的细胞毒性较小, 在癌症治疗中, 它常被用作佐剂或增敏剂。在晚期非小细胞肺癌临床试验中, SAS与顺铂和培美曲塞联合使用能够明显改善预后效果[53]。CD44v是癌症干细胞的生物标志物, 已有文献证明CD44v可以稳定xCT并加速肿瘤的发展进程, 顺铂对于肿瘤的影响不甚显著, SAS与顺铂的联合使用可能对肿瘤的发展产生显著的抑制作用, 从而克服了单药治疗的耐药性[14]。组合用药的效果已在肝细胞癌与膀胱癌中再次证实[54, 55]。
4.1.2 ErastinErastin是一种对表达RAS和猿病毒40小T [the simian virus 40 (SV40) small-T, ST] 抗原的细胞具有致死作用的小分子化合物, 同时它的致死作用是迅速且不可逆转的[56]。通过亲和纯化、代谢物分析和底物拮抗的分析表明, erastin与SLC7A5结合, 直接干扰system L (SLC7A5/SLC3A2), 间接干扰system Xc(-) (SLC7A11/SLC3A2)[49, 57]。在后续的研究中发现, erastin诱导细胞死亡(铁死亡) 是由system Xc(-) 引起的。同时, erastin的生长抑制作用可以被培养基中的L-胱氨酸逆转。
Erastin是典型的铁死亡诱导剂, 诱导铁死亡的机制主要是通过抑制system Xc(-) 的活性, 从而减少胱氨酸的摄取和半胱氨酸的产生, 抑制GPX4的活性以及GSH的合成, 导致细胞氧化还原稳态失调、脂质过氧化物和ROS积累, 最终导致铁死亡[58]。Erastin可以通过多种途径诱导铁死亡, 被广泛用于铁死亡的诱导。大量的研究结果表明, 无论是体内还是体外实验, erastin均能够通过抑制system Xc(-) 诱导铁死亡来抑制癌细胞的发展。铁死亡的小分子抑制剂已被开发用于抑制病理性细胞死亡, 包括治疗神经退行性疾病、脑卒中和缺血性损伤等疾病。Erastin是目前最常用的system Xc(-) 抑制剂, 但由于其水溶性差、代谢稳定性差和毒性强等缺点, 未应用于临床的研究。
4.1.3 Erastin类似物为了克服erastin的缺点, 可以对erastin进行结构修饰。将反应性羰基引入不具有亲电功能的支架以产生可逆共价抑制剂是增强化合物效力的潜在有效策略。与erastin形成可逆共价加合物的酮基结构, 表现出高代谢稳定性, 并具有良好的水溶性[3]。在erastin苯胺环的间位上引入哌嗪部分增强了支架的水溶性。由erastin改造后形成的erastin类似物(咪唑酮erastin、哌嗪erastin) 表现出对system Xc(-) 的抑制作用, 明显降低了毒性, 增强了效力(约为erastin的100倍) 和代谢稳定性[3, 5]。
4.1.4 SorafenibSorafenib目前已被EMA和FDA批准用于治疗肝细胞癌、晚期肾细胞癌和甲状腺癌。Sorafenib是一种多激酶抑制剂, 在细胞信号级联中具有多种靶标。Sorafenib也可以抑制system Xc(-)[49], 但在某些条件下不会通过抑制system Xc(-) 或一些尚未认识到的铁死亡相关机制引发铁死亡, 这与真正的system Xc(-) 抑制剂erastin和SAS不同。Sorafenib能够穿过血脑屏障, 因此它也是一种治疗脑肿瘤的潜在药物。
SAS对system Xc(-) 的作用强度与erastin相比较弱, 但都能引起铁死亡, 抑制谷氨酸释放。典型铁死亡抑制剂可以抑制erastin或SAS诱导的细胞死亡, 铁死亡抑制剂包括铁螯合剂环吡酮胺(CPX)、亲脂性抗氧化剂trolox和ferrostatin-1、MEK抑制剂U0126、蛋白质合成抑制剂放线菌酮(CHX) 和还原剂β-巯基乙醇(β-ME)[49]。同时, SAS和erastin对生长抑制的作用能够被培养基中的L-胱氨酸逆转[57]。Sorafenib则没有上述的反应。探究erastin与sorafenib对于神经元的形态、功能和细胞代谢的影响, 从而评价两者的毒性大小。实验结果表明, erastin与sorafenib能够有效地抑制system Xc(-) 的功能, 但是对于神经元的形态、代谢分泌组谱、突触功能和细胞代谢等方面都产生了一定的影响。
4.2 激活system Xc(-) 活性的化合物根据文献调研可知, system Xc(-) 的激活剂还处于研究阶段, 研究内容仍停留在化合物对system Xc(-)/SLC7A11表达的影响上, 发现了一些药物在某些疾病中可通过增加system Xc(-) 的表达, 起到治疗疾病的作用。脂多糖和亲电剂马来酸二乙酯能够增加小鼠巨噬细胞xCT转运蛋白的mRNA水平。N-乙酰半胱氨酸(NAC) 可以上调system Xc(-) 的活性, 增加GSH储存, 消除Aβ和促炎介质TNF-α对突触可塑性的破坏作用[59, 60]。富马酸单甲酯诱导的ARPE-19和原代小鼠RPE细胞中system Xc(-) 表达和功能活性上调, 增加了哺乳动物细胞中胱氨酸的摄入, 升高了细胞内的抗氧化水平, 降低了细胞的损伤[61]。汉方药抑肝散可以增强xCT和4F2hc基因的表达, 抑制谷氨酸诱导的PC12细胞死亡[61]。在星形胶质细胞中, system Xc(-) 输出的谷氨酸释放能够激活抑制性谷氨酸受体。美金刚胺不能改变被抑制的γ-氨基丁酸信号传导, 但美金刚胺提高了system Xc(-) 活性, 抑制了谷氨酸受体和γ-氨基丁酸能传递途径, 影响谷氨酸能的传递。美金刚胺对system Xc(-) 的激活程度高于对谷氨酸受体的抑制程度, 两者结合, 最终起到了神经保护的作用[62]。
5 讨论与展望综上所述, system Xc(-) 在摄入胱氨酸以合成GSH来调控氧化应激和影响铁死亡、稳定谷氨酸质膜间的浓度及调控细胞能量代谢方面发挥着重要的作用。在不同的疾病中, 根据system Xc(-) 在生理与病理上所发挥的作用, 以及在疾病中的应用, 对system Xc(-) 进行深入地研究, 发现大量的细胞因子与基因对system Xc(-) 发挥着不同形式的调控作用, 进而影响疾病的发展。
无论是system Xc(-) 的抑制剂还是激活剂, 对它们的研究主要停留在对system Xc(-)/SLC7A11的转录与表达的影响上, 具体作用机制的研究较少。System Xc(-) 作为一个转运体蛋白, 维持细胞内外物质的平衡。由此可以看出, 不同的组织细胞环境对于system Xc(-) 的影响较大, 激活或抑制system Xc(-) 所产生的一系列反应, 可能在某些疾病中起到治疗作用, 也可能是某些病理状态的起因。所以在system Xc(-) 作为药物靶点的研究中, 需要在具体疾病的具体病理状态中进行探索, 探究药物的作用机制与疗效。
以system Xc(-) 抑制剂为例, 毒性大、特异性低、药效作用低、代谢稳态差、水溶性差和具体作用机制不清楚等均是实行临床试验的阻碍。发现新的抑制剂和对现有抑制剂进行结构修饰和改造能够一定程度上解决上述的问题。掌握抑制剂发挥抑制作用的具体机制, 随后对相关的化合物进行改造, 从提高化合物的特异性、降低毒性和提高代谢稳定性等方面入手, 考虑到抑制剂在不同细胞和不同底物中的细微差异, 修饰出最适宜的化合物用于疾病的治疗。
System Xc(-) 已成为癌症治疗的关键性靶点, 同时也成为神经退行性疾病和癫痫治疗的潜在靶点。探究system Xc(-) 在其他疾病中发挥的作用及如何调控其他疾病的发展具有重要的科研意义, 同时还需要未来更加深入的探索。
作者贡献: 蒋楠负责大部分文章的撰写、文献资料的收集; 杜立达负责文章修改, 完善内容, 补充资料; 孔德文负责部分文献资料的收集与文章修改; 庞晓斌负责完善内容与文章修改; 通讯作者杜冠华指导综述框架的设计, 并修改文章。
利益冲突: 所有作者声明不存在利益冲突关系。
| [1] |
Bannai S, Kitamura E. Transport interaction of L-cystine and L-glutamate in human diploid fibroblasts in culture[J]. J Biol Chem, 1980, 255: 2372-2376. DOI:10.1016/S0021-9258(19)85901-X |
| [2] |
Parker JL, Deme JC, Kolokouris D, et al. Molecular basis for redox control by the human cystine/glutamate antiporter system Xc(-)[J]. Nat Commun, 2021, 12: 7147. DOI:10.1038/s41467-021-27414-1 |
| [3] |
Larraufie MH, Yang WS, Jiang E, et al. Incorporation of metabolically stable ketones into a small molecule probe to increase potency and water solubility[J]. Bioorg Med Chem Lett, 2015, 25: 4787-4792. DOI:10.1016/j.bmcl.2015.07.018 |
| [4] |
Parmacek MS, Karpinski BA, Gottesdiener KM, et al. Structure, expression and regulation of the murine 4F2 heavy chain[J]. Nucleic Acids Res, 1989, 17: 1915-1931. DOI:10.1093/nar/17.5.1915 |
| [5] |
Tu H, Tang LJ, Luo XJ, et al. Insights into the novel function of system Xc- in regulated cell death[J]. Eur Rev Med Pharmacol Sci, 2021, 25: 1650-1662. |
| [6] |
Nehser M, Dark J, Schweitzer D, et al. System X(c)(-) antiporter inhibitors: azo-linked amino-naphthyl-sulfonate analogues of sulfasalazine[J]. Neurochem Res, 2020, 45: 1375-1386. DOI:10.1007/s11064-019-02901-6 |
| [7] |
Beckers P, Lara O, Belo Do Nascimento I, et al. Validation of a system X(c) (-) functional assay in cultured astrocytes and nervous tissue samples[J]. Front Cell Neurosci, 2021, 15: 815771. |
| [8] |
Bridges RJ, Natale NR, Patel SA. System Xc⁻ cystine/glutamate antiporter: an update on molecular pharmacology and roles within the CNS[J]. Br J Pharmacol, 2012, 165: 20-34. DOI:10.1111/j.1476-5381.2011.01480.x |
| [9] |
Lo M, Wang YZ, Gout PW. The X(c)- cystine/glutamate antiporter: a potential target for therapy of cancer and other diseases[J]. J Cell Physiol, 2008, 215: 593-602. DOI:10.1002/jcp.21366 |
| [10] |
Lin W, Wang C, Liu G, et al. SLC7A11/xCT in cancer: biological functions and therapeutic implications[J]. Am J Cancer Res, 2020, 10: 3106-3126. |
| [11] |
Toohey JI. Sulfhydryl dependence in primary explant hematopoietic cells. Inhibition of growth in vitro with vitamin B12 compounds[J]. Proc Natl Acad Sci U S A, 1975, 72: 73-77. DOI:10.1073/pnas.72.1.73 |
| [12] |
Koppula P, Zhuang L, Gan B. Cystine transporter SLC7A11/xCT in cancer: ferroptosis, nutrient dependency, and cancer therapy[J]. Protein Cell, 2021, 12: 599-620. DOI:10.1007/s13238-020-00789-5 |
| [13] |
Wang X, Wang Y, Li Z, et al. Regulation of ferroptosis pathway by ubiquitination[J]. Front Cell Dev Biol, 2021, 9: 699304. DOI:10.3389/fcell.2021.699304 |
| [14] |
Liu MR, Zhu WT, Pei DS. System Xc(-): a key regulatory target of ferroptosis in cancer[J]. Invest New Drugs, 2021, 39: 1123-1131. DOI:10.1007/s10637-021-01070-0 |
| [15] |
Sun Y, Zheng Y, Wang C, et al. Glutathione depletion induces ferroptosis, autophagy, and premature cell senescence in retinal pigment epithelial cells[J]. Cell Death Dis, 2018, 9: 753. DOI:10.1038/s41419-018-0794-4 |
| [16] |
Chen H, Li XF, Wang H. Research progress on the mechanism of ferroptosis in regulating liver fibrosis[J]. 药学学报, 2021, 56: 2916-2922. |
| [17] |
Ouyang SH, Wu YP, Sun WY, et al. Research progress on the detection methods and their application in ferroptosis[J]. Acta Pharm Sin (药学学报), 2022. DOI:10.16438/j.0513-4870.2022-0276 |
| [18] |
Gallagher M. The system Xc- cystine/glutamate antiporter: an exciting target for antiepileptogenic therapy?[J]. Epilepsy Curr, 2020, 20: 39-42. DOI:10.1177/1535759719891983 |
| [19] |
Xie Y, Zhu S, Song X, et al. The tumor suppressor p53 limits ferroptosis by blocking DPP4 activity[J]. Cell Rep, 2017, 20: 1692-1704. DOI:10.1016/j.celrep.2017.07.055 |
| [20] |
Kong R, Wang N, Han W, et al. IFNγ-mediated repression of system Xc(-) drives vulnerability to induced ferroptosis in hepatocellular carcinoma cells[J]. J Leukoc Biol, 2021, 110: 301-314. DOI:10.1002/JLB.3MA1220-815RRR |
| [21] |
Harding HP, Zhang Y, Zeng H, et al. An integrated stress response regulates amino acid metabolism and resistance to oxidative stress[J]. Mol Cell, 2003, 11: 619-633. DOI:10.1016/S1097-2765(03)00105-9 |
| [22] |
Wang L, Liu Y, Du T, et al. ATF3 promotes erastin-induced ferroptosis by suppressing system Xc(-)[J]. Cell Death Differ, 2020, 27: 662-675. DOI:10.1038/s41418-019-0380-z |
| [23] |
Brosnan JT, Brosnan ME. Glutamate: a truly functional amino acid[J]. Amino Acids, 2013, 45: 413-418. DOI:10.1007/s00726-012-1280-4 |
| [24] |
Bak LK, Schousboe A, Waagepetersen HS. The glutamate/GABA-glutamine cycle: aspects of transport, neurotransmitter homeostasis and ammonia transfer[J]. J Neurochem, 2006, 98: 641-653. DOI:10.1111/j.1471-4159.2006.03913.x |
| [25] |
Verrey F, Closs EI, Wagner CA, et al. CATs and HATs: the SLC7 family of amino acid transporters[J]. Pflugers Arch, 2004, 447: 532-542. DOI:10.1007/s00424-003-1086-z |
| [26] |
Murphy TH, Miyamoto M, Sastre A, et al. Glutamate toxicity in a neuronal cell line involves inhibition of cystine transport leading to oxidative stress[J]. Neuron, 1989, 2: 1547-1558. DOI:10.1016/0896-6273(89)90043-3 |
| [27] |
Sato H, Shiiya A, Kimata M, et al. Redox imbalance in cystine/glutamate transporter-deficient mice[J]. J Biol Chem, 2005, 280: 37423-37429. DOI:10.1074/jbc.M506439200 |
| [28] |
Okuno S, Sato H, Kuriyama-Matsumura K, et al. Role of cystine transport in intracellular glutathione level and cisplatin resistance in human ovarian cancer cell lines[J]. Br J Cancer, 2003, 88: 951-956. DOI:10.1038/sj.bjc.6600786 |
| [29] |
Polewski MD, Reveron-Thornton RF, Cherryholmes GA, et al. SLC7A11 overexpression in glioblastoma is associated with increased cancer stem cell-like properties[J]. Stem Cells Dev, 2017, 26: 1236-1246. DOI:10.1089/scd.2017.0123 |
| [30] |
Shin SS, Jeong BS, Wall BA, et al. Participation of xCT in melanoma cell proliferation in vitro and tumorigenesis in vivo[J]. Oncogenesis, 2018, 7: 86. DOI:10.1038/s41389-018-0098-7 |
| [31] |
Arensman MD, Yang XS, Leahy DM, et al. Cystine-glutamate antiporter xCT deficiency suppresses tumor growth while preserving antitumor immunity[J]. Proc Natl Acad Sci U S A, 2019, 116: 9533-9542. DOI:10.1073/pnas.1814932116 |
| [32] |
Ma Z, Zhang H, Lian M, et al. SLC7A11, a component of cysteine/glutamate transporter, is a novel biomarker for the diagnosis and prognosis in laryngeal squamous cell carcinoma[J]. Oncol Rep, 2017, 38: 3019-3029. DOI:10.3892/or.2017.5976 |
| [33] |
Sugano K, Maeda K, Ohtani H, et al. Expression of xCT as a predictor of disease recurrence in patients with colorectal cancer[J]. Anticancer Res, 2015, 35: 677-682. |
| [34] |
Hasegawa M, Takahashi H, Rajabi H, et al. Functional interactions of the cystine/glutamate antiporter, CD44v and MUC1-C oncoprotein in triple-negative breast cancer cells[J]. Oncotarget, 2016, 7: 11756-11769. DOI:10.18632/oncotarget.7598 |
| [35] |
Massie A, Schallier A, Mertens B, et al. Time-dependent changes in striatal xCT protein expression in hemi-Parkinson rats[J]. Neuroreport, 2008, 19: 1589-1592. DOI:10.1097/WNR.0b013e328312181c |
| [36] |
D'ezio V, Colasanti M, Persichini T. Amyloid-β25-35 induces neurotoxicity through the up-regulation of astrocytic system X(c)(-)[J]. Antioxidants (Basel), 2021, 10: 1685. DOI:10.3390/antiox10111685 |
| [37] |
Bannai S, Kitamura E. Role of proton dissociation in the transport of cystine and glutamate in human diploid fibroblasts in culture[J]. J Biol Chem, 1981, 256: 5770-5772. DOI:10.1016/S0021-9258(19)69273-2 |
| [38] |
Dang DK, Shin EJ, Tran HQ, et al. The role of system Xc(-) in methamphetamine-induced dopaminergic neurotoxicity in mice[J]. Neurochem Int, 2017, 108: 254-265. DOI:10.1016/j.neuint.2017.04.013 |
| [39] |
Evonuk KS, Baker BJ, Doyle RE, et al. Inhibition of system Xc(-) transporter attenuates autoimmune inflammatory demyelination[J]. J Immunol, 2015, 195: 450-463. DOI:10.4049/jimmunol.1401108 |
| [40] |
Bentea E, Sconce MD, Churchill MJ, et al. MPTP-induced parkinsonism in mice alters striatal and nigral xCT expression but is unaffected by the genetic loss of xCT[J]. Neurosci Lett, 2015, 593: 1-6. DOI:10.1016/j.neulet.2015.03.013 |
| [41] |
Kim HY, Choi YJ, Kim SK, et al. Auranofin prevents liver fibrosis by system Xc-mediated inhibition of NLRP3 inflammasome[J]. Commun Biol, 2021, 4: 824. DOI:10.1038/s42003-021-02345-1 |
| [42] |
Zheng J, Sato M, Mishima E, et al. Sorafenib fails to trigger ferroptosis across a wide range of cancer cell lines[J]. Cell Death Dis, 2021, 12: 698. DOI:10.1038/s41419-021-03998-w |
| [43] |
Timmerman LA, Holton T, Yuneva M, et al. Glutamine sensitivity analysis identifies the xCT antiporter as a common triple-negative breast tumor therapeutic target[J]. Cancer Cell, 2013, 24: 450-465. DOI:10.1016/j.ccr.2013.08.020 |
| [44] |
Martis RM, Knight LJ, Donaldson PJ, et al. Identification, expression, and roles of the cystine/glutamate antiporter in ocular tissues[J]. Oxid Med Cell Longev, 2020, 2020: 4594606. |
| [45] |
Lee BJ, Jun HO, Kim JH, et al. Astrocytic cystine/glutamate antiporter is a key regulator of erythropoietin expression in the ischemic retina[J]. FASEB J, 2019, 33: 6045-6054. DOI:10.1096/fj.201802144R |
| [46] |
Jiang L, Kon N, Li T, et al. Ferroptosis as a p53-mediated activity during tumour suppression[J]. Nature, 2015, 520: 57-62. DOI:10.1038/nature14344 |
| [47] |
Wei N, Lu T, Yang L, et al. Lipoxin A4 protects primary spinal cord neurons from erastin-induced ferroptosis by activating the Akt/Nrf2/HO-1 signaling pathway[J]. FEBS Open Bio, 2021, 11: 2118-2126. DOI:10.1002/2211-5463.13203 |
| [48] |
Wahl C, Liptay S, Adler G, et al. Sulfasalazine: a potent and specific inhibitor of nuclear factor kappa B[J]. J Clin Invest, 1998, 101: 1163-1174. DOI:10.1172/JCI992 |
| [49] |
Dixon SJ, Patel DN, Welsch M, et al. Pharmacological inhibition of cystine-glutamate exchange induces endoplasmic reticulum stress and ferroptosis[J]. Elife, 2014, 3: e02523. DOI:10.7554/eLife.02523 |
| [50] |
Gout PW, Buckley AR, Simms CR, et al. Sulfasalazine, a potent suppressor of lymphoma growth by inhibition of the X(c)- cystine transporter: a new action for an old drug[J]. Leukemia, 2001, 15: 1633-1640. DOI:10.1038/sj.leu.2402238 |
| [51] |
Patel D, Kharkar PS, Gandhi NS, et al. Novel analogs of sulfasalazine as system X(c) (-) antiporter inhibitors: insights from the molecular modeling studies[J]. Drug Dev Res, 2019, 80: 758-777. DOI:10.1002/ddr.21557 |
| [52] |
Verbruggen L, Sprimont L, Bentea E, et al. Chronic sulfasalazine treatment in mice induces system X(c) (-)-independent adverse effects[J]. Front Pharmacol, 2021, 12: 625699. DOI:10.3389/fphar.2021.625699 |
| [53] |
Otsubo K, Nosaki K, Imamura CK, et al. Phase Ⅰ study of salazosulfapyridine in combination with cisplatin and pemetrexed for advanced non-small-cell lung cancer[J]. Cancer Sci, 2017, 108: 1843-1849. DOI:10.1111/cas.13309 |
| [54] |
Wada F, Koga H, Akiba J, et al. High expression of CD44v9 and xCT in chemoresistant hepatocellular carcinoma: potential targets by sulfasalazine[J]. Cancer Sci, 2018, 109: 2801-2810. DOI:10.1111/cas.13728 |
| [55] |
Ogihara K, Kikuchi E, Okazaki S, et al. Sulfasalazine could modulate the CD44v9-xCT system and enhance cisplatin-induced cytotoxic effects in metastatic bladder cancer[J]. Cancer Sci, 2019, 110: 1431-1441. DOI:10.1111/cas.13960 |
| [56] |
Dolma S, Lessnick SL, Hahn WC, et al. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells[J]. Cancer Cell, 2003, 3: 285-296. DOI:10.1016/S1535-6108(03)00050-3 |
| [57] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149: 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [58] |
Kwon OS, Kwon EJ, Kong HJ, et al. Systematic identification of a nuclear receptor-enriched predictive signature for erastin-induced ferroptosis[J]. Redox Biol, 2020, 37: 101719. DOI:10.1016/j.redox.2020.101719 |
| [59] |
Dasari S, Tchounwou PB. Cisplatin in cancer therapy: molecular mechanisms of action[J]. Eur J Pharmacol, 2014, 740: 364-378. DOI:10.1016/j.ejphar.2014.07.025 |
| [60] |
Ananth S, Babu E, Veeranan-Karmegam R, et al. Induction of the cystine/glutamate exchanger SLC7A11 in retinal pigment epithelial cells by the antipsoriatic drug monomethylfumarate[J]. Invest Ophthalmol Vis Sci, 2013, 54: 1592-1602. DOI:10.1167/iovs.12-11289 |
| [61] |
Kanno H, Kawakami Z, Mizoguchi K, et al. Yokukansan, a kampo medicine, protects PC12 cells from glutamate-induced death by augmenting gene expression of cystine/glutamate antiporter system Xc[J]. PLoS One, 2014, 9: e116275. DOI:10.1371/journal.pone.0116275 |
| [62] |
Okada M, Fukuyama K, Kawano Y, et al. Memantine protects thalamocortical hyper-glutamatergic transmission induced by NMDA receptor antagonism via activation of system Xc[J]. Pharmacol Res Perspect, 2019, 7: e00457. DOI:10.1002/prp2.457 |
 2022, Vol. 57
2022, Vol. 57


