血红素加氧酶(heme oxygenase, HO) 是血红素代谢的限速酶, 可催化血红素生成胆绿素、一氧化碳(carbon monoxide, CO) 和游离铁[1]。胆绿素在胆绿素还原酶作用下可转变为胆红素。HO存在3种不同的亚型, 包括HO-1、HO-2和HO-3。HO-1为诱导型异构酶, 又称热休克蛋白32 (heat shock protein 32, HSP32), 可在多种刺激因子作用下诱导表达; HO-2为组成型异构酶, 通常在机体稳态下表达; HO-3为非催化异构酶, 其功能尚未阐明。目前, 大多数研究主要集中于诱导型表达的HO-1。在正常生理状态下, 除肝、脾和骨髓外, HO-1在大部分组织中表达水平低或不表达, 而当细胞或组织处于紫外照射、缺血、缺氧、炎症、激素、细胞因子、氧化剂等刺激下, HO-1可被诱导表达[2]。
在应激条件下, 诱导表达的HO-1为机体提供了多种保护效应。抗氧化和抗炎作用是HO-1最常见的生物学功能, 这已被大量的HO-1的药理学激活和功能缺失研究所证实[2-7]。近年来, HO-1的生理功能还被发现与免疫调节、肿瘤发生及机体抗病毒作用相关[8-12]。目前, HO-1已被发现可抑制多种病毒复制, 如丙型肝炎病毒(hepatitis C virus, HCV)、乙型肝炎病毒(hepatitis B virus, HBV)、人类免疫缺陷病毒(human immunodeficiency virus, HIV) 等[12-14]。近期, Ma等[15, 16]首次发现HO-1具有抑制流感病毒(influenza viruses) 复制的作用, 并揭示了新的作用机制。这些发现提示, HO-1可能是具有广谱抗病毒作用的潜在宿主靶点, 包括近期大流行的新冠病毒感染。本综述主要概述HO-1在多种病毒感染过程中的保护作用, 及其抗病毒作用机制, 为从事病毒研究的科研工作者呈现靶向宿主蛋白HO-1抗病毒作用的新成果, 并为抗病毒药物开发提供潜在新思路。
1 HO-1抗病毒作用HO-1及其分解产物已被发现具有广谱抗病毒作用, 诱导或过表达HO-1显示对多种类型的病毒均有抑制作用, 包括HCV、HBV、HIV、登革热病毒(dengue virus, DENV)、埃博拉病毒(ebola virus, EBOV)、A型流感病毒(influenza A virus, IAV)、寨卡病毒(Zika virus, ZIKV)、新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)、人类呼吸道合胞病毒(human respiratory syncytial virus, hRSV)、甲型肝炎病毒(hepatitis A virus, HAV)、肠道病毒71 (enterovirus 71, EV71) 及多种动物感染类病毒。对人体来说, HO-1在病毒感染过程中的保护作用见表 1[12, 14-46]。
| Table 1 Protective effect of heme oxygenase-1 (HO-1) on various viral infections. HCV: Hepatitis C virus; HBV: Hepatitis B virus; HIV: Human immunodeficiency virus; DENV: Dengue virus; EBOV: Ebola virus; IAV: Influenza A virus; ZIKV: Zika virus; SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2; hRSV: Human respiratory syncytial virus; HAV: Hepatitis A virus; EV71: Enterovirus 71; Nrf2: Nuclear factor erythroid 2-related factor 2; IFN: Interferon; CoPP: Cobaltic protoporphyrin IX chloride; cccDNA: Covalently closed circular DNA; ISGs: IFN-stimulated genes; CORM-3: CO-releasing molecule-3; CO: Carbon monoxide |
大量研究显示, HO-1诱导表达可显著抑制HCV的复制, 并减轻HCV引起的肝脏炎症损伤。通过质粒等手段过表达HO-1或使用诱导HO-1高表达的血红素, 可显著抑制HCV在细胞中的复制, 并提高了肝细胞对氧化损伤的抵抗力[18]。在一项穿心莲内酯(andrographolide) 抗HCV研究中发现, 穿心莲内酯可激活Nrf2/HO-1通路, 诱导HO-1高表达, 从而抑制HCV复制。研究者认为, 穿心莲内酯抗HCV作用与HO-1代谢产物胆绿素的增加有关, 后者一方面促进抗病毒的I型干扰素(interferon, IFN) 反应增加; 另一方面抑制NS3/4A蛋白酶活性, 从而发挥抑制HCV的作用[21]。相似地, 咖啡酸(caffeic acid) 也被发现通过激活Nrf2/HO-1通路介导的IFN-α抗病毒反应抑制HCV复制[22]。值得注意的是, 有研究显示在HCV感染的肝活检组织中和表达HCV核心蛋白的肝细胞中, HO-1的表达水平下降, 这是因为HCV核心蛋白基因产物阻止了在应激条件下HO-1的诱导表达, 这在临床角度提示HO-1表达的下降可能增强了HCV的复制并加重了肝脏损伤, 表明HO-1对抵抗HCV感染具有重要作用[17, 47]。除小分子HO-1诱导剂外, miRNA-122、miRNA-196及miR-let-7c被发现可通过调节HO-1和BTB-CNC异体同源体1 (BTB and CNC homolog 1, Bach1) 基因表达, 抑制肝细胞中HCV复制[48-50]。这些研究表明, 小分子和miRNA类的HO-1诱导剂均可用于抑制HCV的复制, 有望成为预防或改善HCV感染及肝损伤的潜在新策略。
1.2 HO-1抗HBV研究与HCV研究体系不同, Protzer等[24]利用HO-1的另一种诱导剂钴原卟啉(cobalt protoporphyrin-IX, CoPP) 诱导HO-1表达, 发现能够显著抑制HBV复制并减轻急性HBV感染小鼠模型中的肝损伤。HO-1能够降低HBV核心蛋白的稳定性, 同时抑制核内HBV共价闭合环状DNA (covalently closed circular DNA, cccDNA) 的再形成。这表明HO-1能够对HBV感染产生直接抗病毒作用。
Shen等[23]发现肝癌细胞暴露于氯化血红素后HO-1的表达增加, 同时乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBsAg)、乙型肝炎e抗原(hepatitis B e antigen, HBeAg) 的分泌及HBV DNA的复制均受到干扰, 提示HO-1的过表达导致了HBV病毒载量的降低。此外, Hao等[25]研究结果显示, 异绿原酸A能通过诱导HO-1的表达显著提高肝细胞活力, 抑制HBsAg和HBeAg的产生, 并且显著降低HepG2.2.15细胞中HBV cccDNA含量。来源于六棱菊的3, 4-o-二咖啡酰基奎宁酸同样被证明能够激活HO-1, 阻止HBV cccDNA的形成从而在体内外发挥抗HBV活性[26]。另外, 研究显示一种端粒酶衍生肽GV1001能够通过激活HO-1介导的I型干扰素系统抑制衣壳蛋白的形成, 发挥抗HBV效应[27]。与已有功能治愈HCV的药物不同, HBV目前仍未有彻底清除病毒的药物或治疗方案。因此, 这些研究所呈现的HO-1对HBV的抑制作用在临床上可能尤为重要, 利用HO-1诱导剂与现有抗HBV治疗药物联用的策略可能为HBV的功能治疗提供一种新线索。
1.3 HO-1抗HIV研究HO-1对HIV的抑制作用可追溯到1991年Levere等[51]的开创性研究工作, 他们发现将血红素与抗HIV药物联用抑制了HIV在人类外周血淋巴细胞和H9细胞系中的复制。随后, Devadas等[29]发现血红素可诱导HO-1高表达, 能够剂量依赖地抑制HIV在单核细胞和T细胞中的复制, 而且对抗病毒药物耐药的HIV毒株同样有效。其中, 研究人员通过加入HO-1催化活性功能抑制剂锡原卟啉(Tin-protoporphyrin, SnPP) 证实了血红素对HIV的抑制依赖于HO-1表达的诱导。此后, 关于HO-1对HIV的抑制作用被进一步报道。如Zhou等[30]发现通过脂多糖(lipopolysaccharide, LPS) 诱导巨噬细胞中HO-1的表达, 不仅可阻止HIV-1对细胞的侵入, 而且抑制了HIV在细胞内的复制。此外, HO-1对HIV抑制还涉及转录反式激活因子(transactivator of transcription, Tat), Tat对于HIV在宿主细胞内的存活和复制是必不可少的。HIV-1 Tat可降低HO-1活性, 导致血红素积累, 从而使过氧化氢在细胞中积累。因此, 推测上调HO-1能够逆转Tat活性, 从而减轻HIV-1的感染[28]。
1.4 HO-1抗DENV研究I型干扰素系统相关的先天免疫在抵御DENV感染中扮演重要角色[52-55]。然而, DENV已进化出逃避先天免疫应答的策略, 其中病毒NS2B/NS3蛋白酶是DENV的逃避先天免疫的主要手段。已有研究显示HO-1可通过抑制该蛋白酶恢复先天免疫应答, 抑制DENV的复制。Tseng等[14]发现诱导或外源过表达HO-1能够有效抑制DENV的复制, 主要通过下游产物胆绿素非竞争性地抑制DENV NS2B/NS3蛋白酶, 从而恢复其抑制的抗病毒IFN反应。赤芝酮(lucidone) 可通过诱导Nrf2介导的HO-1表达, 阻断DENV NS2B/NS3蛋白酶活性, 进而激活被DENV抑制的干扰素反应, 在体内外均表现出显著的抗DENV活性[31]。Su等[56]研究表明, miRNA-155能通过抑制靶标因子Bach1, 诱导HO-1介导的抗病毒IFN反应来抑制DENV的复制。这提示可以通过调节miRNA-155的表达来控制DENV感染。因此, 靶向HO-1上下游信号通路可用于设计和开发抗DENV药物。
1.5 HO-1抗EBOV研究EBOV是一种有包膜、非分段、负链RNA病毒, 可引起人类严重出血热。与DENV一样, EBOV已进化出逃逸先天免疫的机制, 其二级膜相关蛋白VP35可抑制干扰素调节因子3 (interferon regulatory factor-3, IRF-3) 磷酸化来有效拮抗IFN通路[57]。研究显示, HO-1诱导剂和HO-1过表达可显著抑制EBOV的复制。这一研究最早由Hill-Batorski等[12]报道, 他们发现CoPP诱导的HO-1高表达和质粒介导的HO-1过表达均抑制了EBOV病毒在Vero细胞和HEK293细胞的复制。进一步研究显示, CoPP对EBOV没有直接杀伤作用, 且CoPP对EBOV的抑制依赖于HO-1的高表达。该研究还发现HO-1不影响EBOV的入侵及释放, 而是特异地针对EBOV的转录和复制环节。值得注意的是, HO-1对EBOV的抑制依赖于催化功能。
随后, Huang等[32]的研究同样证明了HO-1抗EBOV作用, 他们使用HO-1的天然诱导剂血红素诱导HO-1表达, 发现在多种细胞中血红素可剂量依赖地抑制EBOV复制, 且抑制率高于90%。此外, 有研究表明褪黑素能够增加HO-1, 从而抑制EBOV的复制[33]。考虑到EBOV感染的致死率可高达90%, 且目前仅有一款三抗鸡尾酒疗法药物inmazeb获批用于治疗扎伊尔型埃博拉病毒(Zaire ebolavirus) 引起的感染, 因此上述研究对于开发治疗EBOV广谱抗感染药物具有重要参考价值, 值得科研工作者进一步探索。
1.6 HO-1抗IAV研究尽管HO-1被发现具有抗多种病毒的作用, 然而直接抑制IAV复制的研究工作迟迟未有报道。Hashiba和Cummins两个研究团队[58, 59]在动物体内的研究均显示, HO-1对于IAV感染的小鼠具有保护作用, 但并未阐明HO-1通过直接抑制IAV复制提供保护作用, 其保护作用可能来自于HO-1的抗炎和抗氧化作用。2016年, Ma等[15]首次发现HO-1对IAV的抑制作用, 并揭示了HO-1对IAV抑制的可能的全新作用机制。他们利用HO-1小分子诱导剂和质粒过表达HO-1发现, HO-1在MDCK细胞和人上皮细胞中可显著抑制IAV的复制, 包括多种抗病毒药物耐药的IAV毒株。值得注意的是, 在HO-1抗IAV的机制中, 他们揭示了与HO-1抗其他病毒不同的机制。HO-1对IAV的抑制不依赖于其催化活性, 而是直接与IRF3结合, 促进其核转位, 诱导I型IFN系统IFN-α/β的表达, 从而启动IFN刺激基因(IFN-stimulated genes, ISGs) 的表达, 最终抑制IAV复制[15, 16]。
此后, 几个相关研究进一步证实了HO-1对IAV抑制作用。CoPP和6-去甲氧基-4'-O-甲基茵陈色原酮(6-demethoxy-4′-O-methylcapillarisin, DMO-CAP) 等能够通过激活HO-1介导的IFN-α/β反应来抑制IAV复制[16, 34]。相似地, 消退素D1 (resolving D1, RvD1) 通过Nrf2/HO-1途径保护呼吸道屏障免受H3N2流感病毒引起的损伤及炎症反应[35], 牛蒡子苷(arctiin) 也能够通过激活Nrf2/HO-1信号通路抑制H9N2禽流感病毒介导的炎症反应[36]。另外, 凋亡抑制基因Bax抑制剂1 (Bax inhibitor-1, BI-1) 能够通过抑制流感感染后ROS引起的细胞死亡, 同时激活HO-1抑制流感病毒[60]。因此, 这些研究均表明通过激活HO-1的上调来诱导IFN-α/β表达或抑制炎症氧化损伤可能是对抗IAV流行的新策略。
1.7 HO-1抗ZIKV研究ZIKV是一种蚊媒黄病毒, 由阳性单链基因组RNA组成, 于1947年首次在乌干达猴子中发现。ZIKV具有神经致病性, 可以持续感染人脑微血管内皮细胞, 导致脑炎和胎儿垂体疾病等严重损害[61]。然而, 目前尚未有任何药物批准用于治疗ZIKV感染[62]。近年来, 一些学者发现HO-1对ZIKV病毒具有显著的抑制作用, 这为ZIKV感染药物的开发提供了初步有价值的线索。Huang等[38]发现HO-1小分子诱导剂和遗传过表达HO-1可显著抑制ZIKV在LLC-MK2和MDM细胞中复制, 而HO-1遗传敲除或者上游Nrf2的敲除可逆转小分子诱导剂的抗病毒作用。相似地, 哌隆胺(piperlongumine, PL) 可显著增加HO-1的表达, 且显著抑制ZIKV在人脑血管内皮细胞中的复制, 而抑制HO-1的表达可减弱PL对寨卡病毒复制的抑制作用[39]。此外, 在ZIKV感染的细胞中, HO-1的表达水平显著降低[37]。这些发现表明, HO-1在阻止ZIKV感染中扮演重要作用。
1.8 HO-1抗SARS-CoV-2研究重症COVID-19以细胞因子风暴综合征为特征, 并发多器官衰竭和急性呼吸窘迫综合征, 导致死亡风险增加。COVID-19导致大量死亡, 需要紧急治疗策略。由于HO-1可减轻细胞因子风暴和肺损伤及肾缺血再灌注损伤, 并且能够通过激活干扰素系统抑制病毒复制, 因此推测HO-1小分子诱导剂能够在SARS-CoV-2感染后对细胞提供保护作用[63-65], 最近的体外和临床研究初步证实了这一推测。槲皮素可诱导HO-1的表达, 并抑制SARS-CoV-2刺突蛋白在细胞中的表达[40]。Kim等[41]也观察到HO-1表达诱导剂血红素或过表达HO-1可在体外抑制SARS-CoV-2的复制, HO-1的下游催化产物铁及胆绿素同样具有抗SARS-CoV-2的作用, 并证实血红素对SARS-CoV-2复制的抑制作用与HO-1上调I型干扰素诱导的ISGs的表达有关。在临床应用上, 研究人员发现5-氨基乙酰丙酸磷酸(5-aminolevulinic acid phosphate, 5-ALA) 与柠檬酸亚铁钠(sodium ferrous citrate, SFC) 结合能够通过诱导HO-1, 缩短COVID-19急性期患者康复时间[42]。这些发现表明, 为应对COVID-19的持续暴发, HO-1小分子诱导剂可能为患者提供额外的保护作用, 值得进一步探索。
1.9 HO-1抗其他病毒研究除上述研究较多的病毒外, 有部分学者也报道了HO-1对其他病毒的抑制作用, 包括hRSV、HAV和EV71。HO-1诱导剂CoPP可抑制hRSV的复制, 并在hRSV感染的小鼠肺中观察到I型干扰素IFN-α/β上调, 并减轻了炎症反应[43]。Kim等[44]研究显示, HO-1对HAV的复制有抑制作用, 多种HO-1诱导剂或过表达HO-1均可抑制细胞中的病毒RNA复制与蛋白表达, 并发现HO-1对HAV的抑制可能与其催化活性相关, HO-1酶解产物显著抑制了HAV的复制。
Tung等[46]研究表明, HO-1的过表达能够在SK-N-SH细胞中抑制EV71的复制, 并减弱EV71所诱导的NADPH氧化酶及ROS的生成, 其抗病毒效果能够被HO-1酶催化抑制剂锌原卟啉IX (zinc protoporphyrin IX, ZnPP IX) 所解除。同时, HO-1的酶催化产物CO也可抑制EV71的复制及ROS的生成。此外, EV71感染可抑制神经细胞中HO-1的产生, 从而导致ROS在神经细胞中积累, 引发自噬与凋亡[45]。
近年来, HO-1在动物感染类病毒中的作用也逐渐被揭示。牛病毒性腹泻病毒(bovine viral diarrhoea virus, BVDV) 可引起牛、羊、猪的接触性传染病。Zhang等[66]发现腺病毒介导或利用CoPP诱导的HO-1表达可有效抑制BVDV复制, 而HO-1表达降低则会增加BVDV的复制。另外, HO-1代谢产物CO和胆绿素也能抑制BVDV的复制[67]。HO-1是猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV) 感染的抗病毒因子, 过表达HO-1可抑制PRRSV病毒的体外复制[68]。研究表明, 下游产物CO介导了HO-1对PRRSV的抑制作用[69]。Zhang等[70]证明过表达HO-1或利用CoPP能够抑制感染猪的伪狂犬病病毒(pseudorabies virus, PRV) 的复制, 其下游产物CO和胆红素/胆绿素部分介导了HO-1对病毒的抑制作用。对于能够感染鲤鱼的鲤春病毒血症病毒(Spring viremia of carp virus, SVCV), HO-1通过CO介导的cGMP/PKG信号通路抑制其复制[70]。对于在鸭群中近年来新发的鸭坦布苏病毒(duck Tembusu virus, DTMUV), Wang等[71]证明过表达HO-1或利用CoPP能够体外有效抑制其复制, 且催化产物Fe3+能够介导HO-1诱导的抗DTMUV作用。这些发现表明, 诱导HO-1或应用其酶促反应产物可能是针对动物感染类病毒的有效预防和治疗策略。
2 HO-1抗病毒作用机制作为一种细胞保护酶, 研究已表明HO-1在多种病毒感染过程中能够发挥保护作用, 其作用机制也逐步被揭示, 主要涉及3个方面: HO-1及下游产物直接抑制病毒复制、增强宿主细胞I型IFN反应间接抑制病毒复制及抑制病毒感染引发的炎症损伤。
2.1 HO-1及其催化产物直接抑制病毒复制如前文所述, HO-1具有广谱抗病毒作用, 其对某些病毒可产生直接抑制作用。对于HBV来说, HO-1降低了HBV核心蛋白的稳定性, 在转录后水平直接抑制了HBV复制, 并且阻止了核HBV cccDNA的再形成[24]。
除了HO-1本身, 其催化产物也参与了对病毒的直接抑制作用。HO-1可催化生成胆红素/胆绿素、CO和游离铁。其中, 胆绿素能够抑制影响某些病毒复制的蛋白酶, 如HCV NS3/4A蛋白酶、DENV NS2B/NS3蛋白酶[14, 20]。高剂量的一氧化碳释放分子-2 (CO-releasing molecule-2, CORM-2) 可通过CO的释放在细胞外环境直接杀灭BVDV, 这是其抗BVDV的机制之一[67]。另外, CORM-2还能够通过激活cGMP/PKG信号通路或负向调节NF-κB信号通路抑制SVCV和PRRSV的复制[69, 70]。而低浓度的铁则通过抑制HCV病毒复制子的表达, 发挥抗HCV病毒作用[19]。HO-1及其催化产物直接抑制病毒复制的作用机制如图 1所示。
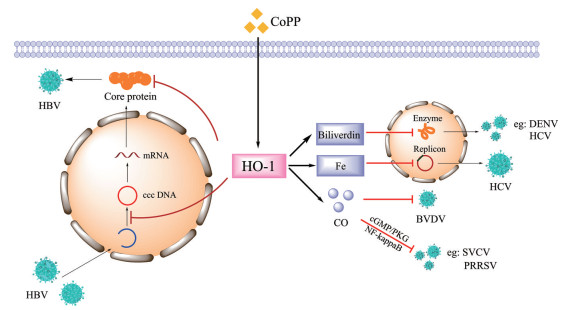
|
Figure 1 Directly antiviral mechanisms of HO-1 and its catalytic products. mRNA: Messenger RNA; BVDV: Bovine viral diarrhea virus; SVCV: Spring viremia of carp virus; PRRSV: Porcine reproductive and respiratory syndrome virus |
除直接抗病毒作用外, HO-1还可以增强宿主细胞I型IFN反应间接发挥抗病毒作用。HO-1存在与IRF3结合的结构域, 通过与IRF-3结合促进其入核, 诱导IFN-α/β的表达, 从而激活抗病毒免疫应答[16]。IFN-α/β首先与I型干扰素受体1/2 (type I IFN receptor 1/2, IFNAR 1/2) 结合, 激活JAK-STATs通路。磷酸化的信号转导转录激活因子1/2 (signal transducer and activator of transcription 1/2, STAT 1/2) 与干扰素调节因子-9 (interferon regulatory factor-9, IRF-9) 结合, 形成复合物干扰素刺激基因因子-3 (IFN-stimulated gene factor-3, ISGF-3)。进一步, ISGF-3与核内IFN刺激反应元件(IFN-stimulated response element, ISRE) 结合, 诱导一系列ISGs的表达, 如2', 5'-寡腺苷酸合成酶1 (2'-5'-oligoadenylate synthetase 1, OAS1)、双链RNA依赖的蛋白激酶(double-stranded RNA-dependent protein kinase, PKR)、IFN诱导跨膜蛋白3 (IFN-inducible transmembrane protein 3, IFITM3)、IFN诱导的三角形四肽重复蛋白1 (IFN-induced protein with tetratricopeptide repeats 1, IFIT1) 等, 这些ISGs通过多种机制在不同的阶段阻止病毒的复制[15, 72]。
对于DENV来说, HO-1诱导表达后, 可通过下游胆绿素抑制DENV NS2B/NS3蛋白酶, 解除被其抑制的抗病毒IFN反应从而发挥抗病毒作用, 并且延迟DENV诱导的死亡进程[14]。针对IAV的研究发现, 小分子化合物YZH-106、DMO-CAP等能够通过Nrf2/ARE途径诱导HO-1上调, HO-1可与IRF3结合并促进其入核, 从而诱导IFN-α/β及下游各种干扰素刺激基因的表达, 最终抑制IAV的复制[15, 34]。对于HCV、DENV、hRSV、SARS-CoV-2等, HO-1也能够经过激活IFN-α/β应答发挥抗病毒作用, 阻止病毒复制和新病毒颗粒的繁殖[27, 41, 43]。HO-1通过激活干扰素系统发挥抗病毒作用的机制如图 2所示。
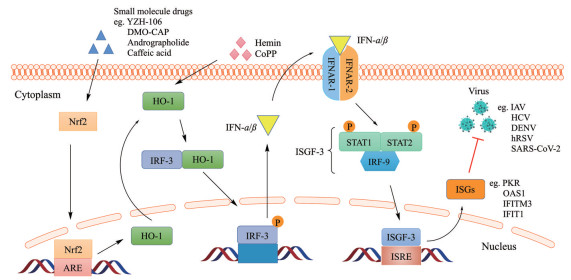
|
Figure 2 Indirectly antiviral mechanism of HO-1 through activating interferon system. ARE: Antioxidant response element; DMO-CAP: 6-Demethoxy-4'-O-methylcapillarisin; IRF-3/9: Interferon regulatory factor-3/9; IFNAR-1/2: Type I IFN receptor 1/2; STAT1/2: Signal transducer and activator of transcription 1/2; ISGF-3: IFN-stimulated gene factor-3; ISRE: IFN-stimulated response element; PKR: Double-stranded RNA-dependent protein kinase; OAS1: 2'-5'-Oligoadenylate synthetase 1; IFITM3: IFN-inducible transmembrane protein 3; IFIT1: IFN-induced protein with tetratricopeptide repeats 1 |
HO-1抗炎和抗氧化损伤作用与其催化活性及其本身有关[73, 74], 其下游催化产物的抗炎作用机制已逐步被阐明。CO可通过干扰MKK/p38/ERK/JNK MAPK、NF-κB、AP-1等信号通路抑制TNF-α、IL-β和MIP-1β等促炎症因子的产生, 同时CO可促进抗炎细胞因子IL-10的生成, 抑制dNLRP3炎症小体的活化, 从而减轻炎症引起的细胞损伤[2, 64, 73, 75]。胆绿素能够抑制细胞因子的产生, 并激活胆绿素还原酶上的酪氨酸激酶域, 从而通过PI3K-Akt信号通路促进抗炎细胞因子IL-10的生成, 减轻炎症损伤[64, 73]。胆绿素的转化产物胆红素在体内是重要的天然抗氧化剂, 不但可直接清除氧自由基, 还可通过抑制补体活化而减少炎症细胞聚集[76]。Fe2+可诱导铁蛋白的合成, 减少细胞内游离铁的蓄积, 对抗炎症因子、ROS导致的细胞损伤[74]。
在H1N1感染的动物模型中, HO-1的过表达使其催化产物CO增多, 干扰p38 MAPK信号通路, 抑制促炎因子的产生, 减少迁移至肺细胞的中性粒细胞和其他炎症细胞的数量, 同时IL-10的数量增多, 减轻了由流感病毒感染引起的急性肺损伤[67]; HO-1的过表达降低了EV71诱导的NADPH氧化酶/ROS的产生, 减轻由EV71感染导致的细胞损伤。CO也能够抑制ROS的生成和EV71的复制[46]; HO-1抗炎和抗氧化作用有可能减轻SARS-CoV-2引起的细胞炎症损伤, 同时基于HO-1诱导剂对SARS-CoV-2具有抑制作用, 因此HO-1有望成为对抗COVID-19的药物治疗靶点[64]。
3 研究展望综上所述, HO-1具有广谱抗病毒活性及细胞保护作用, 主要涉及三方面的机制。一是通过自身或下游催化产物直接与某些病毒直接相互作用, 从而抑制病毒复制; 二是激活I型干扰素系统间接抑制病毒复制; 三是可通过抗氧化的方式保护机体免遭病毒损伤。基于HO-1的广谱抗病毒活性和广泛的作用机制, HO-1作为靶标用于开发治疗各种病毒感染所致的严重疾病, 与直接抗病毒靶点相比, 其潜在优势包括不易产生耐药、在抑制病毒复制的同时有望抑制炎症反应。此外, 对于公共突发的病毒大流行, 鉴于新的直接抗病毒作用药物研发的低效率和不及时性, HO-1作为靶标开发的抗病毒分子或可快速用于治疗或预防。
尽管HO-1展现了抗病毒的潜在独特优势, 然而将HO-1作为靶标开发出抗病毒的新分子或药物推向至临床, 可能仍有一定距离或较大的挑战。目前的研究尽管多而广泛, 然而针对某一病毒的抗病毒研究缺少深度, 潜在的原因可能与直接抗病毒药物相比, 其药效仍偏弱。另一方面, 从药物开发的历史看, 通过激活某种基因而成药的药物较少, 特异性激活基因的药物开发难度仍较高, 安全性受到严重挑战。然而, 随着基础生物学的快速发展, 结合高通量基因测序和人工智能, 一些不可成药的靶标有望在未来10年获得快速突破。HO-1作为靶标开发抗病毒药物研究的突破, 不仅需要对HO-1基因激活的蛋白基础机制深入研究, 还需要结合人工智能技术、新的活性和安全性评价体系, 才有希望开发获得特异性强、安全性高的广谱抗病毒药物。另外, 鉴于与直接抗病毒药物相比, HO-1作为靶标开发的药物起效时间和中和病毒能力较弱的特性, 对于如何设计与直接抗病毒药物联合应用的研究值得重点关注, 这对于解决耐药病毒感染引起的严重疾病具有十分重要的临床意义。
作者贡献: 孙白荷进行了文章初稿撰写; 王艺婷和陆雨霏进行了机制部分撰写; 马琳琳进行了论文指导、修改及终稿准备。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Maines MD. Heme oxygenase: function, multiplicity, regulatory mechanisms, and clinical applications[J]. FASEB J, 1988, 2: 2557-2568. DOI:10.1096/fasebj.2.10.3290025 |
| [2] |
Abraham NG, Kappas A. Pharmacological and clinical aspects of heme oxygenase[J]. Pharmacol Rev, 2008, 60: 79-127. DOI:10.1124/pr.107.07104 |
| [3] |
Devey L, Ferenbach D, Mohr E, et al. Tissue-resident macrophages protect the liver from ischemia reperfusion injury via a heme oxygenase-1-dependent mechanism[J]. Mol Ther, 2009, 17: 65-72. DOI:10.1038/mt.2008.237 |
| [4] |
Gozzelino R, Jeney V, Soares MP. Mechanisms of cell protection by heme oxygenase-1[J]. Annu Rev Pharmacol Toxicol, 2010, 50: 323-354. DOI:10.1146/annurev.pharmtox.010909.105600 |
| [5] |
Pamplona A, Ferreira A, Balla J, et al. Heme oxygenase-1 and carbon monoxide suppress the pathogenesis of experimental cerebral malaria[J]. Nat Med, 2007, 13: 703-710. DOI:10.1038/nm1586 |
| [6] |
Li M, Kim DH, Tsenovoy PL, et al. Treatment of obese diabetic mice with a heme oxygenase inducer reduces visceral and subcutaneous adiposity, increases adiponectin levels, and improves insulin sensitivity and glucose tolerance[J]. Diabetes, 2008, 57: 1526-1535. DOI:10.2337/db07-1764 |
| [7] |
Soares MP, Bach FH. Heme oxygenase-1: from biology to therapeutic potential[J]. Trends Mol Med, 2009, 15: 50-58. DOI:10.1016/j.molmed.2008.12.004 |
| [8] |
Soares MP, Marguti I, Cunha A, et al. Immunoregulatory effects of HO-1: how does it work?[J]. Curr Opin Pharmacol, 2009, 9: 482-489. DOI:10.1016/j.coph.2009.05.008 |
| [9] |
Zhang Q, Cui T, Chang Y, et al. HO‐1 regulates the function of Treg: association with the immune intolerance in vitiligo[J]. J Cell Mol Med, 2018, 22: 4335-4343. DOI:10.1111/jcmm.13723 |
| [10] |
Loboda A, Jozkowicz A, Dulak J. HO-1/CO system in tumor growth, angiogenesis and metabolism—targeting HO-1 as an anti-tumor therapy[J]. Vascul Pharmacol, 2015, 74: 11-22. DOI:10.1016/j.vph.2015.09.004 |
| [11] |
Nitti M, Piras S, Marinari UM, et al. HO-1 induction in cancer progression: a matter of cell adaptation[J]. Antioxidants, 2017, 6: 29. DOI:10.3390/antiox6020029 |
| [12] |
Hill-Batorski L, Halfmann P, Neumann G, et al. The cytoprotective enzyme heme oxygenase-1 suppresses Ebola virus replication[J]. J Virol, 2013, 87: 13795-13802. DOI:10.1128/JVI.02422-13 |
| [13] |
Schmidt WN, Mathahs MM, Zhu Z. Heme and HO-1 inhibition of HCV, HBV, and HIV[J]. Front Pharmacol, 2012, 3: 129. |
| [14] |
Tseng CK, Lin CK, Wu YH, et al. Human heme oxygenase 1 is a potential host cell factor against dengue virus replication[J]. Sci Rep, 2016, 6: 32176. DOI:10.1038/srep32176 |
| [15] |
Ma LL, Wang HQ, Wu P, et al. Rupestonic acid derivative YZH-106 suppresses influenza virus replication by activation of heme oxygenase-1-mediated interferon response[J]. Free Radic Biol Med, 2016, 96: 347-361. DOI:10.1016/j.freeradbiomed.2016.04.021 |
| [16] |
Ma LL, Zhang P, Wang HQ, et al. heme oxygenase-1 agonist CoPP suppresses influenza virus replication through IRF3-mediated generation of IFN-α/β[J]. Virology, 2019, 528: 80-88. DOI:10.1016/j.virol.2018.11.016 |
| [17] |
Abdalla MY, Britigan BE, Wen F, et al. Down-regulation of heme oxygenase-1 by hepatitis C virus infection in vivo and by the in vitro expression of hepatitis C core protein[J]. J Infect Dis, 2004, 190: 1109-1118. DOI:10.1086/423488 |
| [18] |
Zhu Z, Wilson AT, Mathahs MM, et al. Heme oxygenase‐1 suppresses hepatitis C virus replication and increases resistance of hepatocytes to oxidant injury[J]. Hepatology, 2008, 48: 1430-1439. DOI:10.1002/hep.22491 |
| [19] |
Fillebeen C, Rivas-Estilla AM, Bisaillon M, et al. Iron inactivates the RNA polymerase NS5B and suppresses subgenomic replication of hepatitis C virus[J]. J Biol Chem, 2005, 280: 9049-9057. DOI:10.1074/jbc.M412687200 |
| [20] |
Zhu Z, Wilson AT, Luxon BA, et al. Biliverdin inhibits hepatitis C virus nonstructural 3/4A protease activity: mechanism for the antiviral effects of heme oxygenase?[J]. Hepatology, 2010, 52: 1897-1905. DOI:10.1002/hep.23921 |
| [21] |
Lee JC, Tseng CK, Young KC, et al. Andrographolide exerts anti‐hepatitis C virus activity by up‐regulating haeme oxygenase-1 via the p38 MAPK/Nrf2 pathway in human hepatoma cells[J]. Br J Pharmacol, 2014, 171: 237-252. DOI:10.1111/bph.12440 |
| [22] |
Shen J, Wang G, Zuo J. Caffeic acid inhibits HCV replication via induction of IFNα antiviral response through p62-mediated Keap1/Nrf2 signaling pathway[J]. Antiviral Res, 2018, 154: 166-173. DOI:10.1016/j.antiviral.2018.04.008 |
| [23] |
Shen YM, Zhang HL, Wu YH, et al. Dynamic correlation between induction of the expression of heme oxygenase-1 and hepatitis B viral replication[J]. Mol Med Rep, 2015, 11: 4706-4712. DOI:10.3892/mmr.2015.3278 |
| [24] |
Protzer U, Seyfried S, Quasdorff M, et al. Antiviral activity and hepatoprotection by heme oxygenase-1 in hepatitis B virus infection[J]. Gastroenterology, 2007, 133: 1156-1165. DOI:10.1053/j.gastro.2007.07.021 |
| [25] |
Hao BJ, Wu YH, Wang JG, et al. Hepatoprotective and antiviral properties of isochlorogenic acid A from Laggera alata against hepatitis B virus infection[J]. J Ethnopharmacol, 2012, 144: 190-194. DOI:10.1016/j.jep.2012.09.003 |
| [26] |
Wu YH, Hao BJ, Cao HC, et al. Anti-hepatitis B virus effect and possible mechanism of action of 3, 4-O-dicaffeoylquinic acid in vitro and in vivo[J]. Evid Based Complement Alternat Med, 2012, 2012: 356806. |
| [27] |
Choi YM, Kim H, Lee S, et al. A telomerase-derived peptide exerts an anti-hepatitis B virus effect via mitochondrial DNA stress-dependent type I interferon production[J]. Front Immunol, 2020, 11: 652. DOI:10.3389/fimmu.2020.00652 |
| [28] |
Cueno M, Imai K, Ochiai K. Heme oxygenase-1 reverses HIV-1 Tat activity: prospects for AIDS prevention[J]. Retrovirology, 2012, 9: 221. DOI:10.1186/1742-4690-9-S2-P221 |
| [29] |
Devadas K, Dhawan S. Hemin activation ameliorates HIV-1 infection via heme oxygenase-1 induction[J]. J Immunol, 2006, 176: 4252-4257. DOI:10.4049/jimmunol.176.7.4252 |
| [30] |
Zhou ZH, Kumari N, Nekhai S, et al. Heme oxygenase-1 induction alters chemokine regulation and ameliorates human immunodeficiency virus-type-1 infection in lipopolysaccharide-stimulated macrophages[J]. Biochem Biophys Res Commun, 2013, 435: 373-377. DOI:10.1016/j.bbrc.2013.04.095 |
| [31] |
Chen WC, Tseng CK, Lin CK, et al. Lucidone suppresses dengue viral replication through the induction of heme oxygenase-1[J]. Virulence, 2018, 9: 588-603. DOI:10.1080/21505594.2017.1421893 |
| [32] |
Huang H, Konduru K, Solovena V, et al. Therapeutic potential of the heme oxygenase-1 inducer hemin against Ebola virus infection[J]. Curr Trends Immunol, 2016, 17: 117. |
| [33] |
Anderson G, Maes M, Markus RP, et al. Ebola virus: melatonin as a readily available treatment option[J]. J Med Virol, 2015, 87: 537-543. DOI:10.1002/jmv.24130 |
| [34] |
Zhong M, Wang H, Ma L, et al. DMO-CAP inhibits influenza virus replication by activating heme oxygenase-1-mediated IFN response[J]. Virol J, 2019, 16: 21. DOI:10.1186/s12985-019-1125-9 |
| [35] |
Guo Y, Tu YH, Wu X, et al. Resolvin D1 protects the airway barrier against injury induced by influenza A virus through the Nrf2 pathway[J]. Front Cell Infect Microbiol, 2021, 10: 905. |
| [36] |
Zhou B, Wang L, Liang Y, et al. Arctiin suppresses H9N2 avian influenza virus-mediated inflammation via activation of Nrf2/HO-1 signaling[J]. BMC Complement Med Ther, 2021, 21: 289. DOI:10.1186/s12906-021-03462-4 |
| [37] |
El Kalamouni C, Frumence E, Bos S, et al. Subversion of the heme oxygenase-1 antiviral activity by Zika virus[J]. Viruses, 2019, 11: 2. |
| [38] |
Huang H, Falgout B, Takeda K, et al. Nrf2-dependent induction of innate host defense via heme oxygenase-1 inhibits Zika virus replication[J]. Virology, 2017, 503: 1-5. DOI:10.1016/j.virol.2016.12.019 |
| [39] |
Lu W, Shi L, Gao J, et al. Piperlongumine inhibits Zika virus replication in vitro and promotes up-regulation of HO-1 expression, suggesting an implication of oxidative stress[J]. Virol Sin, 2021, 36: 510-520. DOI:10.1007/s12250-020-00310-6 |
| [40] |
Singh RD, Barry MA, Croatt AJ, et al. The spike protein of SARS-CoV-2 induces heme oxygenase-1: pathophysiologic implications[J]. Biochim Biophys Acta Mol Basis Dis, 2022, 1868: 166322. DOI:10.1016/j.bbadis.2021.166322 |
| [41] |
Kim DH, Ahn HS, Go HJ, et al. Hemin as a novel candidate for treating COVID-19 via heme oxygenase-1 induction[J]. Sci Rep, 2021, 11: 21462. DOI:10.1038/s41598-021-01054-3 |
| [42] |
Kaketani K, Nakajima M. Safety, tolerability, and efficacy of 5-aminolevulinic acid phosphate, an inducer of heme oxygenase 1, in combination with sodium ferrous citrate for the treatment of COVID-19 patients[J]. Open COVID J, 2021, 1: 52-61. DOI:10.2174/2666958702101010052 |
| [43] |
Espinoza JA, León MA, Céspedes PF, et al. Heme oxygenase-1 modulates human respiratory syncytial virus replication and lung pathogenesis during infection[J]. J Immunol, 2017, 199: 212-223. DOI:10.4049/jimmunol.1601414 |
| [44] |
Kim DH, Ahn HS, Go HJ, et al. Heme oxygenase-1 exerts antiviral activity against hepatitis A virus in vitro[J]. Pharmaceutics, 2021, 13: 1229. DOI:10.3390/pharmaceutics13081229 |
| [45] |
You L, Chen J, Liu W, et al. Enterovirus 71 induces neural cell apoptosis and autophagy through promoting ACOX1 downregulation and ROS generation[J]. Virulence, 2020, 11: 537-553. DOI:10.1080/21505594.2020.1766790 |
| [46] |
Tung WH, Hsieh HL, Lee IT, et al. Enterovirus 71 induces integrin β1/EGFR‐Rac1‐dependent oxidative stress in SK‐N‐SH cells: role of HO‐1/CO in viral replication[J]. J Cell Physiol, 2011, 226: 3316-3329. DOI:10.1002/jcp.22677 |
| [47] |
Wen F, Brown KE, Britigan BE, et al. Hepatitis C core protein inhibits induction of heme oxygenase-1 and sensitizes hepatocytes to cytotoxicity[J]. Cell Biol Toxicol, 2008, 24: 175-188. DOI:10.1007/s10565-007-9027-9 |
| [48] |
Shan Y, Zheng J, Lambrecht RW, et al. Reciprocal effects of micro-RNA-122 on expression of heme oxygenase-1 and hepatitis C virus genes in human hepatocytes[J]. Gastroenterology, 2007, 133: 1166-1174. DOI:10.1053/j.gastro.2007.08.002 |
| [49] |
Hou W, Tian Q, Zheng J, et al. MicroRNA‐196 represses Bach1 protein and hepatitis C virus gene expression in human hepatoma cells expressing hepatitis C viral proteins[J]. Hepatology, 2010, 51: 1494-1504. DOI:10.1002/hep.23401 |
| [50] |
Chen WC, Wei CK, Lee JC. MicroRNA‐let‐7c suppresses hepatitis C virus replication by targeting Bach1 for induction of haem oxygenase‐1 expression[J]. J Viral Hepat, 2019, 26: 655-665. DOI:10.1111/jvh.13072 |
| [51] |
Levere RD, Gong YF, Kappas A, et al. Heme inhibits human immunodeficiency virus 1 replication in cell cultures and enhances the antiviral effect of zidovudine[J]. Proc Nat Acad Sci U S A, 1991, 88: 1756-1759. DOI:10.1073/pnas.88.5.1756 |
| [52] |
Diamond MS, Harris E. Interferon inhibits dengue virus infection by preventing translation of viral RNA through a PKR-independent mechanism[J]. Virology, 2001, 289: 297-311. DOI:10.1006/viro.2001.1114 |
| [53] |
Jones M, Davidson A, Hibbert L, et al. Dengue virus inhibits alpha interferon signaling by reducing STAT2 expression[J]. J Virol, 2005, 79: 5414-5420. DOI:10.1128/JVI.79.9.5414-5420.2005 |
| [54] |
Simon-Loriere E, Lin RJ, Kalayanarooj SM, et al. High anti-Dengue virus activity of the OAS gene family is associated with increased severity of dengue[J]. J Infect Dis, 2015, 212: 2011-2020. DOI:10.1093/infdis/jiv321 |
| [55] |
Lin RJ, Yu HP, Chang BL, et al. Distinct antiviral roles for human 2', 5'-oligoadenylate synthetase family members against Dengue virus infection[J]. J Immunol, 2009, 183: 8035-8043. DOI:10.4049/jimmunol.0902728 |
| [56] |
Su YC, Huang YF, Wu YW, et al. MicroRNA‐155 inhibits Dengue virus replication by inducing heme oxygenase‐1‐mediated antiviral interferon responses[J]. FASEB J, 2020, 34: 7283-7294. DOI:10.1096/fj.201902878R |
| [57] |
Schümann M, Gantke T, Mühlberger E. Ebola virus VP35 antagonizes PKR activity through its C-terminal interferon inhibitory domain[J]. J Virol, 2009, 83: 8993-8997. DOI:10.1128/JVI.00523-09 |
| [58] |
Hashiba T, Suzuki M, Nagashima Y, et al. Adenovirus-mediated transfer of heme oxygenase-1 cDNA attenuates severe lung injury induced by the influenza virus in mice[J]. Gene Ther, 2001, 8: 1499-1507. DOI:10.1038/sj.gt.3301540 |
| [59] |
Cummins NW, Weaver EA, May SM, et al. Heme oxygenase-1 regulates the immune response to influenza virus infection and vaccination in aged mice[J]. FASEB J, 2012, 26: 2911-2918. DOI:10.1096/fj.11-190017 |
| [60] |
Hossain MK, Saha SK, Abdal Dayem A, et al. Bax inhibitor-1 acts as an anti-influenza factor by inhibiting ROS mediated cell death and augmenting heme-oxygenase 1 expression in influenza virus infected cells[J]. Int J Mol Sci, 2018, 19: 712. DOI:10.3390/ijms19030712 |
| [61] |
Acosta-Ampudia Y, Monsalve DM, Castillo-Medina LF, et al. Autoimmune neurological conditions associated with Zika virus infection[J]. Front Mol Neurosci, 2018, 11: 116. DOI:10.3389/fnmol.2018.00116 |
| [62] |
Shelton S. Effects of Zika Virus on Neural Precursor Cell Types and Microencephaly in a Model of Direct Embryonic Murine Brain Infection [D]. Boston: Boston University, 2021.
|
| [63] |
Su WL, Lin CP, Hang HC, et al. Desaturation and heme elevation during COVID-19 infection: a potential prognostic factor of heme oxygenase-1[J]. J Microbiol Immunol Infect, 2021, 54: 113-116. DOI:10.1016/j.jmii.2020.10.001 |
| [64] |
Singh D, Wasan H, Reeta K. Heme oxygenase-1 modulation: a potential therapeutic target for COVID-19 and associated complications[J]. Free Radic Biol Med, 2020, 161: 263-271. DOI:10.1016/j.freeradbiomed.2020.10.016 |
| [65] |
Toro A, Ruiz MS, Lage-Vickers S, et al. A journey into the clinical relevance of heme oxygenase 1 for human inflammatory disease and viral clearance: why does it matter on the COVID-19 scene?[J]. Antioxidants, 2022, 11: 276. DOI:10.3390/antiox11020276 |
| [66] |
Zhang C, Pu F, Zhang A, et al. Heme oxygenase-1 suppresses bovine viral diarrhoea virus replication in vitro[J]. Sci Rep, 2015, 5: 15575. DOI:10.1038/srep15575 |
| [67] |
Ma Z, Pu F, Zhang X, et al. Carbon monoxide and biliverdin suppress bovine viral diarrhoea virus replication[J]. J Gen Virol, 2017, 98: 2982-2992. DOI:10.1099/jgv.0.000955 |
| [68] |
Xiao S, Zhang A, Zhang C, et al. Heme oxygenase-1 acts as an antiviral factor for porcine reproductive and respiratory syndrome virus infection and over-expression inhibits virus replication in vitro[J]. Antiviral Res, 2014, 110: 60-69. DOI:10.1016/j.antiviral.2014.07.011 |
| [69] |
Zhang A, Zhao L, Li N, et al. Carbon monoxide inhibits porcine reproductive and respiratory syndrome virus replication by the cyclic GMP/protein kinase G and NF-κB signaling pathway[J]. J Virol, 2017, 91: e01866-16. |
| [70] |
Zhang A, Wan B, Jiang D, et al. The cytoprotective enzyme heme oxygenase-1 suppresses pseudorabies virus replication in vitro[J]. Front Microbiol, 2020, 11: 412. DOI:10.3389/fmicb.2020.00412 |
| [71] |
Wang Y, Du YY, Cao FY, et al. Heme Oxygenase-1 suppresses duck Tembusu virus replication in vitro[J]. Vet Microbiol, 2020, 251: 108885. DOI:10.1016/j.vetmic.2020.108885 |
| [72] |
Schoggins JW. Interferon-stimulated genes: roles in viral pathogenesis[J]. Curr Opin Virol, 2014, 6: 40-46. DOI:10.1016/j.coviro.2014.03.006 |
| [73] |
Costa DL, Amaral EP, Andrade BB, et al. Modulation of inflammation and immune responses by heme oxygenase-1: implications for infection with intracellular pathogens[J]. Antioxidants, 2020, 9: 1205. DOI:10.3390/antiox9121205 |
| [74] |
Koliaraki V, Kollias G. A new role for myeloid HO-1 in the innate to adaptive crosstalk and immune homeostasis[J]. Adv Exp Med Biol, 2011, 780: 101-111. |
| [75] |
Waza AA, Hamid Z, Ali S, et al. A review on heme oxygenase-1 induction: is it a necessary evil[J]. Inflamm Res, 2018, 67: 579-588. DOI:10.1007/s00011-018-1151-x |
| [76] |
Basiglio CL, Arriaga SM, Pelusa HF, et al. Protective role of unconjugated bilirubin on complement-mediated hepatocytolysis[J]. Biochim Biophys Acta Gen Subj, 2007, 1770: 1003-1010. DOI:10.1016/j.bbagen.2007.03.005 |
 2022, Vol. 57
2022, Vol. 57


