茜草科钩藤Uncaria rhynchophylla (Miq.) Miq. ex Havil.是传统地道中药材, 收录于中国药典[1], 多以干燥带钩茎枝入药, 其主要活性成分以钩藤碱(rhynchophylline, RIN) 和异钩藤碱(isorhynchophylline, IRN) 等单萜吲哚类生物碱(monoterpene indole alkaloid, MIA) 为主, 具有镇静催眠、降血压、抗菌和抗癌等重要的药理作用[1-4]。单萜吲哚类生物碱的合成涉及复杂的多步酶促反应, 上游由环烯醚萜途径(iridoid pathway) 和吲哚途径(indole pathway) 分别生成一分子的裂环马钱子苷和色胺, 然后在异胡豆苷合成酶(strictosidine synthase, STR) 的作用下经皮克特-施彭格勒反应(Pictet-Spengler reaction) 耦合形成异胡豆苷, 它是超过2 000多种MIA的前体中心产物[5-7]。以异胡豆苷为下游途径的起始位点, 在夹竹桃科、茜草科和马钱科等MIA资源植物中产生众多MIA的衍生物。大量的研究表明, STR基因作为单萜吲哚类生物碱合成途径中关键的限速酶基因, 在植物的次生代谢途径中发挥了重要的作用。STR基因最早从萝芙木(Rauvolfia serpentina)[8]和长春花[9](Catharanthus roseus) 中克隆到并通过原核表达确定了其酶活性; 随后从短小蛇根草[10](Ophiorrhiza pumila)、日本蛇根草[11](Ophiorrhiza japonica)、臭味假柴龙树[12](Nothapodytes foetida) 和铁皮石斛[13](Dendrobium officinale) 中相继克隆到。在长春花中超表达STR基因显著促进了阿吗碱、长春碱和水草甘碱等MIA的积累[14, 15]; 在短小蛇根草中超表达STR基因显著促进喜树碱的积累[16]; Singh等[12]基于同源克隆的方法, 从假柴龙树中克隆到NfSTR基因, 在匍地蛇根草中异源表达后提高了喜树碱含量。MIA家族成员广泛, 较为典型的有抗感染的喹啉、具有抗肿瘤活性的喜树碱和抗心律失常的阿吗灵等。而钩藤中主要活性成分RIN和IRN在抗抑郁、癫痫等中枢神经系统、糖尿病、心律不齐等心血管疾病以及消炎等各个方面都有重要的疗效作用[4, 17]。现阶段对于钩藤的研究仍主要集中于有效成分分离、药理学研究和规模化种植等方面, 对钩藤属植物主要活性成分RIN和IRN的生物合成途径基因研究鲜有报道。本研究基于遮阴处理下第3代转录组数据, 通过同源基因比对分析, 利用RACE和染色体步移技术成功扩增得到UrSTR基因和上游启动子序列, 并对其进行生物信息学分析、亚细胞定位分析和原核表达分析。为下一步解析RIN和IRN合成机制和通过转基因技术定向调控钩藤属植物次生代谢合成提供理论依据。
材料与方法植物材料 选取生长良好、长势基本一致的3株贵州大学实验基地种植的4年生钩藤, 分别对其根、茎、叶、花、果和钩等部位分别取样, 用于组织表达分析; 选取高度约10 cm的钩藤幼苗[18]用于光照处理和发育表达分析实验, 所用材料均液氮速冻后置于-80 ℃冰箱保存备用。
仪器与试剂 激光共聚焦显微镜(Nikon C2-ER); 凝胶成像系统(上海培清科技有限公司, JS2012); PCR仪(BIO-RAD T100TMThermal Cycler); 实时荧光定量PCR仪(BIO-RAD)。总RNA提取试剂盒(TSP412) 和胶回收试剂盒(GE0101-200) 均购于重庆擎科生物科技有限公司; GUS染色试剂盒(SL7160) 购于北京酷来搏科技有限公司; 质粒提取试剂盒购于天根生化科技有限公司; 各种限制性内切酶、RNA反转录试剂盒(RR019A)、荧光定量PCR反转录(RR037A) 试剂盒、荧光定量染料SYBR® Premix Ex TaqTM II (Perfect Real Time) 和T载体pMD19-T Vector均购于TaKaRa公司; HiFi酶购于全式金公司。本研究所使用的引物及测序工作均由重庆擎科生物科技有限公司提供。实验所用质粒为pBWA (V) HS-GLosgfp和pET-28a, 感受态细胞为DH5α和Rosseta (DE3), EHA105A根癌农杆菌感受态细胞均由本实验室制备保存。
总RNA、DNA的提取和反转录cDNA第一链合成 根据总RNA提取试剂盒说明书分别提取钩藤主根、茎、叶、花、果和钩等6个组织的总RNA, 0.1%琼脂糖凝胶电泳检验其完整性, 微量核酸蛋白测定仪检验其浓度和纯度, 根据反转录试剂盒说明书合成相应组织的cDNA第一链; 按照DNA提取试剂盒说明书提取钩藤幼嫩叶片DNA, 进行琼脂糖凝胶电泳检测和浓度的测定。
UrSTR基因的克隆 由钩藤转录组数据分析得到关于UrSTR基因的核心片段, 使用Premier6软件设计5'RACE和3'RACE特异性扩增引物, PCR扩增产物胶回收纯化后与pMD19-T Vector连接, 转化克隆感受态细胞DH5α后涂板, 菌液PCR验证正确的送擎科生物公司测序。将这3段测序序列使用Vector NTI 11.5软件进行序列重叠分析, 最终得到UrSTR基因的cDNA全长。根据预测的UrSTR基因的ORF区序列设计一对特异性引物进行扩增, HiFi酶反应体系(25 μL): HiFi buffer II 2.5 μL, dNTPs 2 μL, 引物各0.5 μL, HiFi 0.25 μL, cDNA模板2 μL, ddH2O 17.25 μL。PCR扩增反应程序: 95 ℃ 2 min; 94 ℃ 30 s, 56.4 ℃ 30 s, 72 ℃ 60 s, 30个循环; 72 ℃ 2 min, 25 ℃ 10 s。用1.0%琼脂糖凝胶电泳检测PCR扩增产物, 用擎科生物公司的DNA胶回收试剂盒纯化回收。
UrSTR基因的生物信息学分析 使用Vector NTI 11.5软件推导UrSTR基因编码的氨基酸序列。在线软件ExPASy对UrSTR基因编码蛋白的理化性质预测分析; 基于NCBI的BlastP检索, NCBI-CDD预测其保守结构域, 利用DNAMAN对UrSTR蛋白和其他已报道的STR蛋白进行多序列比对分析; SignalP 5.0和Target P预测其信号肽; NetPhos 3.1软件预测其磷酸位点。使用SOPMA软件对UrSTR蛋白的二级结构进行预测分析; 进一步基于同源建模的方法, 使用Swiss-model软件进行三级结构建模分析。基于Neighbor-Joining统计学方法使用MEGA X软件构建系统进化树, 检测方法为Bootstrap, 重复1 000次检验置信度。
UrSTR基因的亚细胞定位分析 将UrSTR基因序列终止密码子去除并进行克隆, 将纯化回收的克隆片段与Bsa I单酶切后的线性化载体pBWA (V) HS-GLosgfp连接。转农杆菌GV3101后, 将pBWA (V) HS-GLosgfp和pBWA (V) HS-UrSTR-GLosgfp分别侵染烟草幼苗, 使用激光共聚焦显微镜观察荧光信号, 叶绿体通道的激发光640 nm, 发射光675 nm, GFP荧光蛋白的激发光488 nm, 发射光510 nm。
UrSTR基因的原核表达分析 根据UrSTR基因的生物信息学分析结果表明, UrSTR基因编码的氨基酸存在一段信号肽, 结合原核表达载体PET-28a限制性酶切位点BamH I和Sal I序列设计引物, 去除信号肽序列进行克隆, HiFi酶反应体系(25 μL): HiFi buffer II 2.5 μL, dNTPs 2 μL, 引物各0.5 μL, HiFi 0.25 μL, cDNA模板2 μL, ddH2O 17.25 μL。PCR扩增反应程序: 95 ℃ 2 min; 94 ℃ 30 s, 56.4 ℃ 30 s, 72 ℃ 60 s, 30个循环; 72 ℃ 2 min, 25 ℃ 10 s。重组连接后的质粒热激法转化到DH5α克隆感受态细胞中, 涂板后挑取单克隆。37 ℃、200 r·min-1振荡培养, 进行菌液PCR验证, 送重庆擎科生物科技有限公司测序。将测序正确的pET-28a-UrSTR原核表达载体扩大培养, 提取质粒导入至Rosetta (DE3) 表达感受态细胞中, 挑取部分单克隆到10 mL LB (含kan) 的液体培养基中, 37 ℃、220 r·min-1进行一活; 按照1∶50将一活菌液吸取到新鲜的LB (含kan) 的液体培养基中, 37 ℃、200 r·min-1进行二活, 约3 h后菌液吸光值OD600值约达到0.6时, 加入终浓度为1 mmol·L-1的IPTG。37 ℃、180 r·min-1条件下分别诱导1~5 h提取蛋白, 使用煮沸法破碎样品10 min, 4 ℃、12 000 r·min-1离心10 min后各取10 μL经SDS-PAGE蛋白电泳和考马斯亮蓝染色, 检测UrSTR重组蛋白表达情况。
UrSTR基因的启动子克隆及生物信息学分析 根据已知的UrSTR基因开放阅读框区域, 设计引物R-STR-W1、R-STR-W2采用热不对称PCR (Thermal asymmetric interlaced PCR, TAIL-PCR) 进行第1次克隆[19]; 设计引物R-STR-W3、R-STR-W4、R-STR-W5采用融合引物巢式PCR (fusion primer and nested integrated PCR, FPNI-PCR) 进行第2次克隆[20]。以CTAB法提取钩藤幼嫩叶DNA为模板, 将经过1次TAIL-PCR及1次FPNI-PCR扩得的启动子序列在Vector NTI 11.5上重叠拼接分析, 共得到启动子长度1 179 bp, 高保真酶扩增测序验证后, 在plant-CARE在线分析工具中分析UrSTR基因启动子区顺式作用元件。
UrSTR基因的启动子活性分析 植物表达载体pBI121用Hind III和Xba I酶进行双酶切得到线性化片段, 与PCR扩增纯化得到的STR基因启动子片段重组连接, 得到目标表达载体pBI121-STRpro: : GUS。转化农杆菌EHA105后, 采用农杆菌叶片渗透法, 注射本式烟草叶片背面, 暗培养2天后, 进行GUS染色, 用作STRpro启动子的活性验证。
UrSTR基因的表达分析 采用实时荧光定量PCR法(qRT-PCR) 检测UrSTR基因在4年生钩藤根、茎、叶、花、果和钩等6个组织, 幼苗中不同轮生叶和黑暗处理3天后连续光照下叶中的相对表达情况。按照PrimeScriptTMRT reagent Kit (Perfect Real Time) (TaKaRa, 大连) 试剂盒说明书将各组织部位的500 ng RNA反转录为cDNA, 以各组织部位的cDNA为模板, 按照荧光染料试剂盒TB Green Ex TaqTM Ⅱ (TaKaRa, 大连) 说明书配置PCR反应体系, 反应体系详见文献[18]; 内参基因GAPDH参考文献[21], 本研究所用引物序列详见表 1。
| Table 1 Premier sequences |
用长春花的CrSTR基因序列(X53602.1) 在钩藤三代转录组数据库中进行Blastn检索, 筛选到1条序列相似性大于90%的unigene, Pfam和Swiss-prot均注释为异胡豆苷合成酶基因家族。设计核心片段引物、5'/3'RACE引物分别进行扩增, 测序拼接后得到片段长度为1 541 bp的全长cDNA序列(GeneBank: OL310251)。以钩藤的cDNA为模板, 使用高保真酶对UrSTR基因的CDS区进行克隆后琼脂糖凝胶电泳检测, 条带大小与分析相符(图 1); 使用Vector NTI 11.5软件分析工具Find ORF对UrSTR基因的cDNA开放阅读框进行分析预测, 钩藤UrSTR基因的ORF区1 038 bp, 编码345个氨基酸(图 2)。
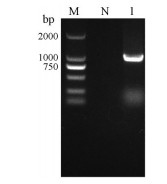
|
Figure 1 PCR product of UrSTR ORF. M: 2 000 DNA Marker; N: Negative control; 1: Amplified PCR product of UrSTR ORF |
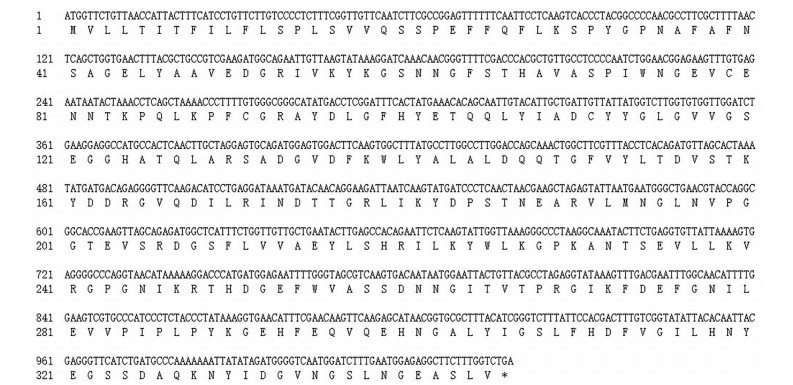
|
Figure 2 ORF of UrSTR gene and the deduced amino acid sequence |
使用ExPASy对其基本理化性质分析结果表明, 钩藤的UrSTR蛋白质分子质量为38.05 kDa, 理论等电位为5.38, 不稳定系数为25.96, 脂肪系数为86.14, 总平均亲水性为-0.198, 蛋白分子式为C1723H2616N452O514S5, 为酸性蛋白质。
将钩藤的UrSTR蛋白的氨基酸序列在NCBI中进行BlastP, 结果表明: UrSTR蛋白与茜草科的短小蛇根草(OpSTR)、帽柱木(MsSTR) 和日本蛇根木(OjSTR) 的同源性都大于90%, 说明钩藤UrSTR蛋白属于植物STR蛋白家族。氨基酸比对结果表明(图 3): 不同物种的STR蛋白氨基酸序列结构域位置有较高的保守性, 物种间STR蛋白氨基酸序列同源性差异主要来自N端和C端, 而有催化作用的底物结合位置多处在中间。NCBI-CDD保守结构域分析表明(图 3): 钩藤的UrSTR蛋白含有2个结构域, 第141~229位氨基酸残基(Domin I) 组成Str_synth super family, 这是MIA合成途径中异胡豆苷合成酶的关键结构域, 催化裂环马钱子苷和色胺结合生成异胡豆苷; 176~289位氨基酸残基(Domin II) 组成糖内酯蛋白的YvrE super family结构域, 参与细胞内碳水化合物的运输和代谢, 但目前相关的研究较少。

|
Figure 3 Multiple amino acid sequence alignments of STR between Uncaria rhynchophylla and other plants. Ms: Mitragyna speciosa; Op: Ophiorrhiza pumila; Cr: Catharanthus roseus; Oj: Ophiorrhiza japonica; Gs: Gelsemium sempervirens; Rm: Rauvofia mannii |
SignalP 5.0和Target P预测其信号肽表明, UrSTR蛋白存在信号肽的可能性为0.998 7, 在N端有一段20个氨基酸的信号肽, 这表明UrSTR蛋白属于分泌性蛋白, 构建原核表达载体时可去除N端信号肽增加蛋白的表达量和可溶性。
NetPhos3.1 server分析表明, UrSTR蛋白含有19个丝氨酸(Ser)、8个苏氨酸(Thr) 和4个络氨酸(Tyr), 磷酸位点丰富且磷酸化修饰位点两端谷氨酸(Glu) 数量较少。这说明UrSTR蛋白会有丰富的磷酸化修饰类型, 同时UrSTR蛋白表达的稳定性较低。
SOPMA软件对UrSTR蛋白的二级结构分析结果表明(图 4A): 钩藤UrSTR蛋白由α螺旋(alpha helix, Hh)、延伸链(extended strand, Ee)、β转角(beta turn, Tt) 和无规则卷曲(random coil, Cc) 等4种构象组成, 其中Cc占比最高为43.19%, Ee占比次之为32.17%, Hh占比为15.07%, Tt占比最低为9.57%。SWISS-MODEL进行UrSTR蛋白的同源建模图 4B所示, UrSTR蛋白主要由无规则卷曲和延伸链所组成。
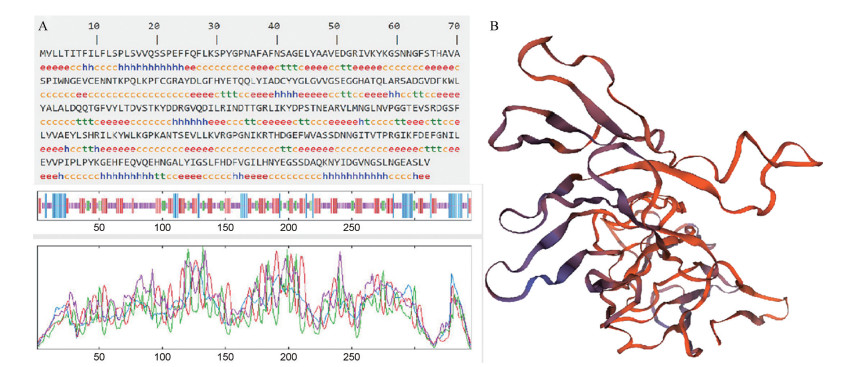
|
Figure 4 Secondary structure (A) and tertiary structure analysis of UrSTR protein (B) |
采用MEGA X软件对UrSTR蛋白氨基酸序列和其他有较高同源性的STR氨基酸序列使用Neighbor-Joining法进行系统进化分析, 结果(图 5) 表明钩藤UrSTR蛋白与日本蛇根草、短小蛇根草和美丽帽柱木聚为一支, 亲缘关系最近, 这3个物种的STR均已报道分别参与合成MIA类的喜树碱和帽柱木碱, 都属于茜草科植物, 而与喜树、臭味假柴龙树、长春花、小蔓长春花、曼氏萝芙木和蟾蜍树的亲缘关系较远。
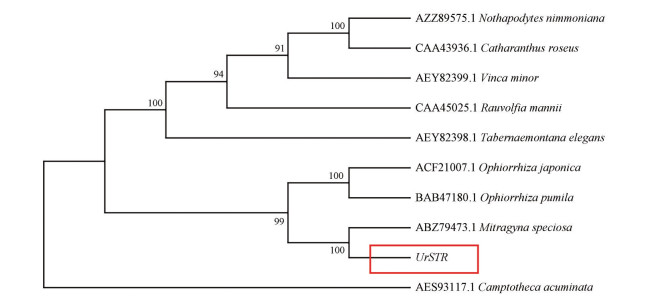
|
Figure 5 Phylogenic tree analysis of UrSTR |
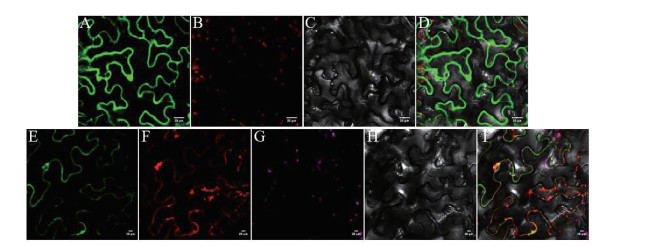
将pBWA (V) HS-GLosgfp (对照) 和构建的融合表达载体pBWA (V) HS-UrSTR-GLosgfp和液泡膜Marker分别采用叶片渗透法侵染烟草叶片, 激光共聚焦显微镜下观察UrSTR蛋白在细胞中的定位情况, 结果(图 6) 表明pBWA (V) HS-UrSTR-GLosgfp融合蛋白绿色荧光信号和液泡膜Marker的红色荧光相一致, 但UrSTR荧光信号较弱。表明UrSTR蛋白与液泡膜Marker存在共定位, UrSTR蛋白定位于液泡膜上。
|
Figure 6 Subcellular localization of UrSTR-GLosgfp. A: GFP of 35s-GLosgfp (control check) in bright field; B: Chlorophyll autofluorescence; C: Bright field; D: Merged images; E: GFP of UrSTR-GLosgfp; F: Vacuole marker; G: Chlorophyll autofluorescence; H: Bright field; I: Merged images |
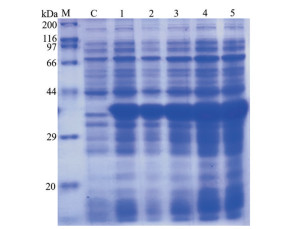
生物信息学分析发现UrSTR蛋白5'端有一段20个氨基酸的信号肽, 设计引物去除信号肽, 构建原核蛋白融合表达载体pET-28a-UrSTR, 将质粒pET-28a-UrSTR转化Rosseta (DE3) 感受态细胞, 得到UrSTR蛋白表达工程菌。IPTG诱导表达, 菌体煮沸破碎, 离心后取上清液经SDS-PAGE电泳和考马斯亮蓝染色, 结果(图 7) 表明对照组C中未加IPTG的菌液未能诱导出pET-28a-UrSTR重组蛋白; pET-28a-UrSTR重组蛋白在1~5 h内能被IPTG成功诱导表达, 在4 h时pET-28a-UrSTR重组蛋白的表达量就能达到最高, 蛋白条带在29~44 kDa之间, 与生物信息学预测的38 kDa一致。
|
Figure 7 Effect of different inductive time on expression of pET-28a-UrSTR recombinant protein. M: Protein marker; C: Control group; 1-5 h: Total protein of bacteria with 1 mmol·L-1 IPTG in 1, 2, 3, 4 and 5 h |
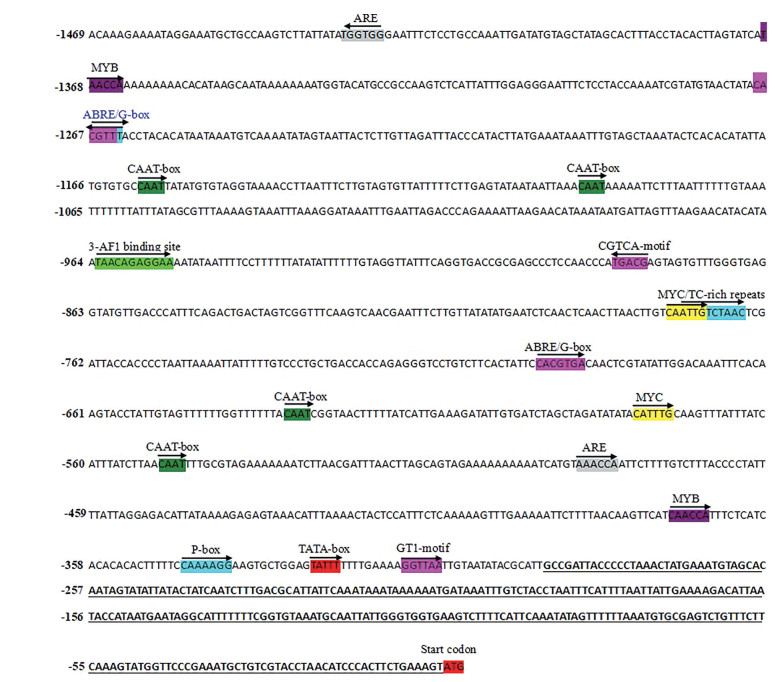
在UrSTR基因的CDS区设计2条特异性引物, 采用热不对称PCR进行第1次扩增得到413 bp启动子序列; 在此基础上再设计3条特异性引物采用融合引物巢式PCR进行扩增。共计克隆到UrSTR基因编码区上游序列1 455 bp, 去除5'UTR区287 bp, 共计得到UrSTR基因启动子(GeneBank: OL310252) 共计1 179 bp。在线软件Plant-CARE分析UrSTR基因启动子区域的顺式作用元件, 结果(图 8) 表明UrSTR基因启动子含有基本转录元件TATA-box和CAAT-box; 植物激素响应元件ABRE、CGTCA-motif、TCA-element和P-box; 光响应元件G-box、3-AF1 binding site和GT1-motif; 转录因子结合位点元件MYB、MYB-like和MYC; 厌氧诱导顺式作用元件ARE和逆境响应元件TC-rich repeats。启动子区域元件丰富, 说明钩藤UrSTR基因启动子能够响应植物激素胁迫、光调控和逆境等外界环境的变化, 从而调控UrSTR基因的表达。
|
Figure 8 The sequence of upstream promoter element of UrSTR |
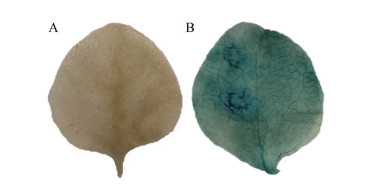
将pBI121:: GUS (对照) 和构建好的pBI121-STRpro: : GUS采用叶片渗透法侵染烟草, 验证UrSTR基因启动子活性, GUS染色结果显示: 阴性对照未能染上蓝色(图 9A), pBI121-STRpro: : GUS烟草具有较深的蓝色(图 9B), 说明克隆到的UrSTR基因启动子具有驱动下游基因转录的活性。
|
Figure 9 UrSTR gene promoter transient expression tobacco. A: Negative control; B: pBI121-STRpro: : GUS transient expression tobacco GUS staining map |
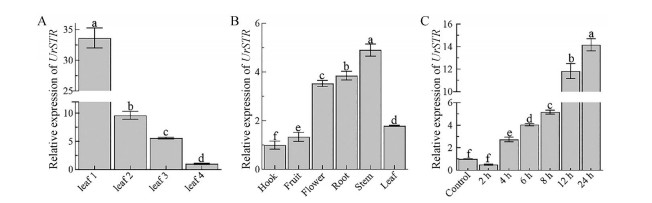
实时荧光定量PCR检测UrSTR基因的相对表达量, 结果(图 10) 表明在幼苗叶片的发育过程中, UrSTR表达量由顶端往下急剧降低, 顶端叶1的UrSTR表达量最高, 是底端叶4的34倍, 叶2中UrSTR基因表达是叶4的10倍, 叶3中UrSTR基因表达是叶4的5倍(图 10A); UrSTR基因在茎中的表达量最高, 约为钩的5倍; 根中次之, 约为钩的4倍, 钩和果中的表达量最低(图 10B)。黑暗处理3天, 在连续光照处理下, UrSTR基因在24 h内能持续地诱导表达, 在24 h提高至14倍, 说明UrSTR是光响应基因(图 10C)。
|
Figure 10 Relative expression of UrSTR. Different letters represent significant differences among the expression levels using Duncan's multiple range test at P < 0.05 in SPSS. A: Developmental ages were labeled from young (L1) to old (L4) leaf; B: Different tissues from Uncaria rhynchophylla; C: Induction of light after dark treatment |
利用底盘细胞合成天然活性成分具有周期短、占据空间少和降低外在影响等优点, 为药源问题的获取提供新的思路, 具有广阔的应用场景。现阶段已成功在酿酒酵母中完成了莨菪碱和东莨菪碱[22]、青蒿素[23]、灯盏花素[24]和甘草酸[25]的全合成, 为解决土壤紧缺、快速获得天然活性成分和解决药源问题做出了巨大贡献。而解析合成途径基因是代谢工程的基础, 在之前的报道中发现双超表达STR和TDC显著促进了长春花中TIAs的积累, 而单超表达TDC时对MIA的积累无显著影响[14]; 在短小蛇根草中双超表达STR和G10H显著促进喜树碱的积累[16]。由此可见, STR基因可作为解析MIA合成途径的突破口和TIAs代谢工程中的重要靶基因。
STR压缩色胺和裂环马钱子苷合成异胡豆苷, 为包括钩藤碱在内的众多萜类吲哚生物碱的合成提供关键的前体物质。本研究克隆到的UrSTR基因ORF框有1 038 bp, 与植物中其他物种所报道STR基因的ORF框长度接近[7, 10, 11]。UrSTR蛋白与其他植物中STR蛋白结构域高度相似, 只有部分位点发生了变化, 这可能是因为它们都是催化色胺和裂环马钱子苷生成异胡豆苷。除此之外, UrSTR蛋白还存在YvrE super family结构域, 可能与碳水化合物的转运和代谢相关[26], 然而目前有关于YvrE蛋白的研究还较少, 具体的功能还需要更深入的研究。系统进化树中钩藤、短小蛇根草、日本蛇根木和美丽帽柱木在同一支上, 同源关系较近且氨基酸相似度很高, 这可能是因为它们都属于茜草科, 同时暗示着他们具有相似的生物学功能。而喜树自成一支, 可能是因为在喜树中异胡豆苷合成酶是催化裂环马钱子酸与色胺缩合成异胡豆苷酸[27], 进化过程中酶催化位点发生了变异或者进化。同时, 异胡豆苷合成酶广泛存在于动物和植物中[27, 28], 在系统进化过程中逐渐分化成不同的功能, 在植物中合成MIA的前体异胡豆苷, 与水稻花药发育和花粉壁的形成有关[29]; 在动物中与肌纤维的整合有关[30], 本研究中UrSTR蛋白还具有YvrE结构域, 可针对其在钩藤中是否具有其他功能展开更深入的研究。
亚细胞结构的分区为蛋白质的生物学功能发挥提供合适的场所, 使不同功能蛋白间互不干扰。在MIA的合成途径中需要5种亚细胞结构(叶绿体、细胞质、细胞核、液泡和内质网) 的参与[15]。色氨酸通过吲哚途径在细胞质中生成色胺[31]; 香叶醇通过环烯醚萜途径在内质网中生成裂环马钱子苷[32]。色胺和裂环马钱子苷被转运到液泡膜, 异胡豆苷合成酶结合色胺和裂环马钱子苷生成众多MIA的前体异胡豆苷。由于STR蛋白是一个功能保守性蛋白[33], 在MIA合成途径中于液泡膜上发挥着功能, 本研究中UrSTR蛋白定位于液泡膜上, 与Thomas等[33]报道的长春花CrSTR蛋白定位结果一致。进一步说明UrSTR蛋白属于植物中STR蛋白家族。
植物基因启动子在基因的表达调控和功能发挥起着重要的作用。本研究克隆到UrSTR基因启动子含有激素、光调控和转录因子等顺式作用元件, 这暗示UrSTR基因能及时响应外界环境的变化, 可能还参与钩藤植物的发育调控。本课题组前期使用MeJA和ABA处理钩藤幼苗[18, 34], UrSTR基因能被显著诱导表达, 结合克隆到启动子域含有MeJA和ABA等响应元件, 进一步揭示UrSTR基因受到显著诱导表达原因所在。同时, UrSTR基因启动子区域含有G-box、3-AF1 binding site和GT1-motif等光响应元件为解释光照处理下UrSTR基因持续表达提供了理论依据。构建UrSTR基因启动子表达载体瞬时表达本式烟草验证其具有转录活性, 但并未进一步构建缺失片段启动子来验证启动活性的变化, 还需进一步构建不同缺失长度的启动子来研究。此外应利用拟南芥为材料构建UrSTR基因启动子稳定遗传体系, 研究UrSTR基因启动子在不同组织部位的表达情况, 同时对该启动子的关键调控区域进行酵母单杂实验, 筛选出能与UrSTR基因启动子结合的转录因子, 为揭示钩藤中MIA生物合成机制提供理论依据。
发育表达分析结果表明UrSTR基因随着叶片的成熟表达量逐渐降低, 这与Yasuyo等[35]在短小蛇根草中检测到OpSTR基因的表达结果一致。在喜树中同样检测到CaTDC1、CaG8O和Ca7DLS等途径基因及部分转录因子的基因表达量随着叶片成熟而逐渐降低[36]。这是因为植物的幼嫩枝叶易受到食草动物和病原微生物的侵害, 而植物的次生代谢产物可抵御逆境胁迫, 例如在长春花中机械损伤处发现次生代谢产物异胡豆苷的大量积累[37]。因此, UrSTR基因随着叶片成熟表达量降低, 是因为叶片的木质化和蜡质化程度加深, 提高了叶片防御病原微生物的能力。组织表达结果表明钩藤UrSTR基因在钩藤的根、茎、叶、花、果和钩6个组织部位都有表达, 其中在茎中的表达量最高。然而Yasuyo等[35]在喜树和匍地蛇根草根茎叶中检测不到STR酶活性。这暗示在植物中STR合成位置具有差异性, 在钩藤中的合成位置还需更深入的研究, 为后续在钩藤中途径基因的鉴定提供更多的线索。研究发现萜类物质的合成具有昼夜节律性, 如青蒿的β-pinene合成酶在光照下转录水平高于黑暗条件下[38]。本研究在黑暗处理后在持续光照处理下钩藤UrSTR基因达到对照的14倍。而在喜树中CaSTR基因变化不显著[26], 这可能是CaSTR基因启动子区不含有光响应顺式作用元件, 而本研究中钩藤UrSTR基因启动子富含多种光响应顺式作用元件。
综上, 本研究首次从钩藤中克隆到MIA途径基因UrSTR及其启动子, 并验证了其功能定位情况, 启动子具有转录活性。在Rosetta (DE3) 细胞中成功表达了UrSTR重组蛋白, 煮沸破碎后重组蛋白成功在上清液中检测到, 为后续的蛋白纯化和研究其结构和功能奠定基础。对进一步阐明钩藤MIA的合成调控机制, 分子育种具有重要的意义。
作者贡献: 周浩完成本实验主要工作; 敖雯雯和路星星构建了植物表达载体; 周浩完成了数据分析和论文初稿的写作; 强玮、廖海民和张明生共同指导论文的写作与修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol 1. Beijing: China Medical Science Press, 2015: 257.
|
| [2] |
Wei GY, Xu CY. Research progress on antihypertensive effects of rhynchophylline and isorynchophylline[J]. China Med Pharm (中国医药科学), 2020, 10: 32-36. |
| [3] |
Yu X, Zhu LL, Liu J, et al. Research progress on monoterpenoid indole alkaloids in Uncariae Ramulus Cum Uncis and their pharmacological activities[J]. Chin Tradit Herb Drugs (中草药), 2021, 52: 6052-6065. |
| [4] |
Qin N, Lu X, Liu YJ, et al. Recent research progress of Uncaria spp. based on alkaloids: phytochemistry, pharmacology and structural chemistry[J]. Eur J Med Chem, 2021, 210: 112960. DOI:10.1016/j.ejmech.2020.112960 |
| [5] |
Stöckigt J, Antonchick AP, Wu F, et al. The pictet-spengler reaction in nature and in organic chemistry[J]. Angew Chem Int Ed, 2011, 50: 8538-8564. DOI:10.1002/anie.201008071 |
| [6] |
Wu SW, Yang MQ, Xiao YL. Synthetic biology studies of monoterpene indole alkaloids[J]. Chin J Org Chem (有机化学), 2018, 38: 2243-2258. DOI:10.6023/cjoc201806001 |
| [7] |
O'Connor SE, Maresh JJ. Chemistry and biology of monoterpene indole alkaloid biosynthesis[J]. Nat Prod Rep, 2006, 23: 532-547. DOI:10.1039/b512615k |
| [8] |
Kutchan TM. Expression of enzymatically active cloned strictosidine synthase from the higher plant Rauvolfia serpentina in Escherichia coli[J]. FEBS Lett, 1989, 257: 127-130. DOI:10.1016/0014-5793(89)81802-2 |
| [9] |
Treimer J, Zenk M. Purification and properties of strictosidine synthase, the key enzyme in indole alkaloid formation[J]. Eur J Biochem, 1979, 101: 225-233. DOI:10.1111/j.1432-1033.1979.tb04235.x |
| [10] |
Yasuyo Y, Hiroshi S, Mami Y, et al. Camptothecin biosynthetic genes in hairy roots of Ophiorrhiza pumila: cloning, characterization and differential expression in tissues and by stress compounds[J]. Plant Cell Physiol, 2003, 44: 395-403. DOI:10.1093/pcp/pcg051 |
| [11] |
Lu Y, Wang HS, Wang W, et al. Molecular characterization and expression analysis of a new cDNA encoding strictosidine synthase from Ophiorrhiza japonica[J]. Mol Biol Rep, 2009, 36: 1845-1852. DOI:10.1007/s11033-008-9389-y |
| [12] |
Singh S, Kamble SN, Satdive RK, et al. Heterologous overexpression of Nothapodytes foetida strictosidine synthase enhances levels of anti-cancer compound camptothecin in Ophiorrhiza rugosa[J]. Plant Cell Tissue Organ Cult, 2020, 141: 67-76. DOI:10.1007/s11240-020-01767-9 |
| [13] |
Zhu YZ, Fan HH, Li DH, et al. Molecular cloning, bioinformation analysis and expression of the strictosidine synthase in Dendrobium officinale[J]. Acta Sci Pol Hort Cult, 2020, 19: 111-124. DOI:10.24326/asphc.2020.3.10 |
| [14] |
Canel C, LopesCardoso MI, Whitmer S, et al. Effects of over-expression of strictosidine synthase and tryptophan decarboxylase on alkaloid production by cell cultures of Catharanthus roseus[J]. Planta, 1998, 205: 414-419. DOI:10.1007/s004250050338 |
| [15] |
Sharma A, Verma P, Mathur A, et al. Overexpression of tryptophan decarboxylase and strictosidine synthase enhanced terpenoid indole alkaloid pathway activity and antineoplastic vinblastine biosynthesis in Catharanthus roseus[J]. Protoplasma, 2018, 255: 1281-1294. DOI:10.1007/s00709-018-1233-1 |
| [16] |
Cui LJ, Ni XL, Ji Q, et al. Co-overexpression of geraniol-10-hydroxylase and strictosidine synthase improves anti-cancer drug camptothecin accumulation in Ophiorrhiza pumila[J]. Sci Rep, 2015, 5: 8227. DOI:10.1038/srep08227 |
| [17] |
Zhang JG, Chen JJ, Geng CA. Advances in indole alkaloids from traditional Chinese medicine of Uncariae Ramulus Cum Uncis documented in Chinese Pharmacopoeia[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 685-695. |
| [18] |
Zhou H, Qiang W, Ao WW, et al. Effect of exogenous abscisic acid on biosynthesis of alkaloids in Uncaria[J]. Mol Plant Breeding (分子植物育种), 2021. |
| [19] |
Wang Z, Ye SF, Li JJ, et al. Fusion primer and nested integrated PCR (FPNI-PCR): a new high-efficiency strategy for rapid chromosome walking or flanking sequence cloning[J]. BMC Biotechnol, 2011, 11: 109. DOI:10.1186/1472-6750-11-109 |
| [20] |
Liu YG, Chen YL. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J]. Biotechniques, 2007, 43: 651-656. |
| [21] |
Yu XS, Li X, Wang XH, et al. Screening and stability evaluation of reference genes in Uncaria rhynchophylla qRT-PCR analysis[J]. J Agric Biotechnol (农业生物技术学报), 2021, 29: 587-597. |
| [22] |
Prashanth S, Christina DS. Engineering a microbial biosynthesis platform for de novo production of tropane alkaloids[J]. Nat Commun, 2020, 585: 614-639. |
| [23] |
Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin[J]. Nature, 2013, 496: 528-532. DOI:10.1038/nature12051 |
| [24] |
Liu XN, Cheng J, Zhang GH, et al. Engineering yeast for the production of breviscapine by genomic analysis and synthetic biology approaches[J]. Nat Commun, 2018, 9: 448. DOI:10.1038/s41467-018-02883-z |
| [25] |
Xu K, Zhao YJ, Nadeem A, et al. O-Glycosyltransferases from Homo sapiens contributes to the biosynthesis of glycyrrhetic acid 3-O-mono-β-D-glucuronide and glycyrrhizin in Saccharomyces cerevisiae[J]. Synth Syst Biotechnol, 2021, 6: 173-179. DOI:10.1016/j.synbio.2021.07.001 |
| [26] |
Reshma SV, Nitish S, Nagendra HG. Characterization of a hypothetical protein YVRE from Bacillus subtilis indicates its key role as glucono-lactonase in pentose phosphate pathway and glucose metabolism[J]. Bioinformation, 2017, 13: 430-438. DOI:10.6026/97320630013430 |
| [27] |
Cao N, Wang CH. Strictosidine synthase, an indispensable enzyme involved in the biosynthesis of terpenoid indole and β-carboline alkaloids[J]. China J Nat Med, 2021, 19: 591-607. |
| [28] |
McCoy E, Galan MC, O'Connor SE. Substrate specificity of strictosidine synthase[J]. Bioorg Med Chem Lett, 2006, 16: 2475-2478. DOI:10.1016/j.bmcl.2006.01.098 |
| [29] |
Zou T, Li SC, Li MX, et al. An atypical strictosidine synthase, OsSTRL2, plays key roles in anther development and pollen wall formation in rice[J]. Sci Rep, 2017, 7: 6863. DOI:10.1038/s41598-017-07064-4 |
| [30] |
Gray CH, McGarry LC, Spence HJ, et al. Novel beta-propeller of the BTB-Kelch protein Krp1 provides a binding site for Lasp-1 that is necessary for pseudopodial extension[J]. J Biol Chem, 2009, 284: 30498-30507. DOI:10.1074/jbc.M109.023259 |
| [31] |
Luca DV, Cutler AJ. Subcellular localization of enzymes involved in indole alkaloid biosynthesis in Catharanthus roseus[J]. Plant Physiol, 1987, 85: 1099-1102. DOI:10.1104/pp.85.4.1099 |
| [32] |
Miettinen K, Dong L, Navrot N, et al. The seco-iridoid pathway from Catharanthus roseus[J]. Nat Commun, 2014, 5: 3606. DOI:10.1038/ncomms4606 |
| [33] |
Thomas DM, Dnaiel RB, Ronald JB, et al. Expression of enzymatically active and correctly targeted strictosidine synthase in transgenic tobacco plants[J]. Planta, 1991, 185: 148-152. |
| [34] |
Lu XX, Qiang W, Fu W, et al. Effects of methyl jasmonate on alkaloids biosynthesis in Uncaria rhynchophylla[J]. Mol Plant Breeding (分子植物育种), 2021. https://kns.cnki.net/kcms/detail/46.1068.s.20210603.1049.004.html
|
| [35] |
Yasuyo Y, Akiko U, Hiroshi S, et al. Metabolite profiling of alkaloids and strictosidine synthase activity in camptothecin producing plants[J]. Phytochemistry, 2003, 62: 461-470. DOI:10.1016/S0031-9422(02)00543-5 |
| [36] |
Chang CH, Liu ZW, Wang YY, et al. A bZIP transcription factor, CaLMF, mediated light-regulated camptothecin biosynthesis in Camptotheca acuminata[J]. Tree Physiol, 2019, 39: 372-380. |
| [37] |
Bernonville TD, Carqueijeiro I, Lanoue A, et al. Flivory elicits a strong defense reaction in Catharanthus roseus: metabolomic and transcriptomic analyses reveal distinct local and systemic responses[J]. Sci Rep, 2017, 7: 40453. DOI:10.1038/srep40453 |
| [38] |
Lu S, Xu R, Jia JW, et al. Cloning and functional characterization of a β-pinene synthase from Artemisia annua that shows a circadian pattern of expression[J]. Plant Physiol, 2002, 130: 477-486. DOI:10.1104/pp.006544 |
 2022, Vol. 57
2022, Vol. 57


